Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Экстракция и очистка белка FAHD1 из печени свиной почки и мыши
В этой статье
Резюме
Этот протокол описывает, как извлечь фумарилацетоацетат гидролазу, содержащий домен белка 1 (FAHD1), из почек свиней и печени мыши. Перечисленные способы могут быть адаптированы к другим белкам, представляющим интерес, и модифицированы для других тканей.
Аннотация
Фумарилацетоацетат гидролаза, содержащий домен белка 1 (FAHD1), является первым идентифицированным членом надсемейства FAH у эукариот, действующим как оксалоацетатдекарбоксилаза в митохондриях. В данной статье представлен ряд методов экстракции и очистки FAHD1 из почек свиней и печени мышей. Охватываемыми методами являются ионообменная хроматография с быстрой белковой жидкостной хроматографией (FPLC), препаративная и аналитическая гелевая фильтрация с FPLC и протеомные подходы. После полной экстракции белка были исследованы осаждение сульфата аммония и хроматография ионного обмена, а FAHD1 экстрагировали с помощью последовательной стратегии с использованием ионного обмена и размерно-эксклюзионной хроматографии. Этот репрезентативный подход может быть адаптирован к другим белкам, представляющим интерес (выраженным на значительных уровнях) и модифицирован для других тканей. Очищенный белок из ткани может поддерживать выработку высококачественных антител и/или мощных и специфических фармакологических ингибиторов.
Введение
Эукариотический домен FAH-содержащий белок 1 (FAHD1) действует как бифункциональная оксалоацетат (OAA), декарбоксилаза (ODx)1 и ацилпируватгидролаза (ApH)2. Он локализован в митохондриях2 и принадлежит к широкому надсемейству ферментовFAH 1,2,3,4,5,6. В то время как его активность ApH имеет лишь незначительное значение, активность ODx FAHD1 участвует в регулировании потока цикла TCA 1,7,8,9. OAA не только необходим для реакции центральной цитратсинтазы в цикле трикарбоновой кислоты, но также действует как конкурентный ингибитор сукцинатдегидрогеназы как часть системы переноса электронов и как катаплеротический метаболит. Снижение регуляции экспрессии гена FAHD1 в эндотелиальных клетках пупочных вен человека (HUVEC) привело к значительному снижению скорости пролиферации клеток10 и значительному ингибированию потенциала митохондриальной мембраны, связанного с сопутствующим переходом на гликолиз. Рабочая модель относится к митохондриальной дисфункции, связанной со старением (MiDAS)11-подобным фенотипом8, где уровни митохондриального OAA жестко регулируются активностью FAHD1 1,8,9.
Рекомбинантный белок легче получить путем экспрессии и очистки от бактерий12 , а не от ткани. Однако белок, экспрессируемый в бактериях, может быть смещен из-за возможного отсутствия посттрансляционных модификаций или может быть просто проблематичным (т. Е. Из-за потери плазмид, реакций бактериального стресса, искаженных / несформированных дисульфидных связей, отсутствия или плохой секреции, агрегации белка, протеолитического расщепления и т. Д.). Для определенных применений белок должен быть получен из клеточного лизата или ткани, чтобы включить такие модификации и/или исключить возможные артефакты. Очищенный белок из ткани поддерживает выработку высококачественных антител и/или мощных и специфических фармакологических ингибиторов для выбранных ферментов, таких как FAHD113.
В данной рукописи представлен ряд методов извлечения и очистки FAHD1 из печени свиной почки и мыши. Описанные методы требуют быстрой белковой жидкостной хроматографии (ФПЛК), но в остальном используют общее лабораторное оборудование. Альтернативные методы можно найти в других местах 14,15,16,17. После полной экстракции белка предлагаемый протокол включает в себя фазу тестирования, на которой обсуждаются подпротоколы для осаждения сульфата аммония и хроматографии ионного обмена (рисунок 1). После определения этих подпротоколов интересующий белок извлекается с помощью последовательной стратегии с использованием ионного обмена и размерно-эксклюзионной хроматографии с FPLC. Основываясь на этих руководящих принципах, окончательный протокол может быть адаптирован индивидуально для других белков, представляющих интерес.
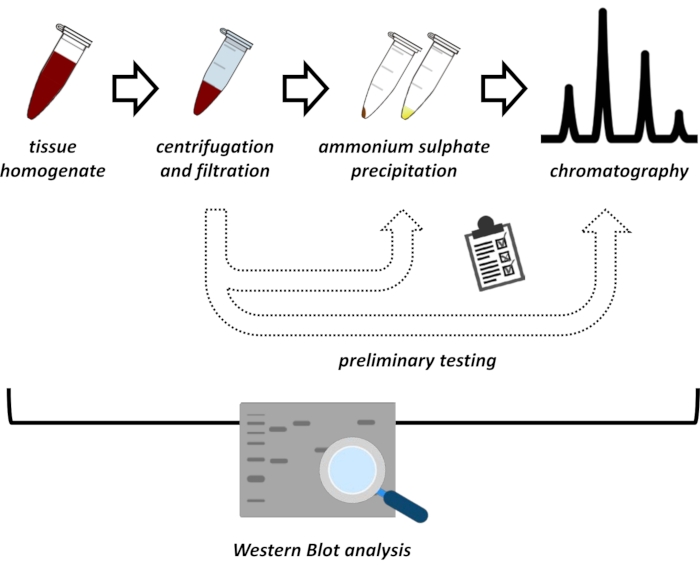
Рисунок 1: Общая стратегия этого протокола. Сверху донизу: Белок извлекается из тканей. Тканевый гомогенат готовят, центрифугируют и фильтруют. Для каждой пары образцов, полученных из супернатанта и гранул, необходимо провести испытания на осаждение сульфата аммония и ионно-обменную хроматографию (FPLC) для определения оптимальных условий. После установления этих подпротоколов белок может быть извлечен с помощью последовательной процедуры осаждения сульфата аммония, хроматографии ионнообменной хроматографии и повторяющейся хроматографии с исключением размера (FPLC) при различных концентрациях рН и солей. Все шаги должны контролироваться западным пятном. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
протокол
Все эксперименты проводились в соответствии с институциональными руководящими принципами. Почки свиней были получены свежими из местного супермаркета. Ткани печени были собраны у мышей дикого типа C57BL6, поддерживаемых в Институте биомедицинских исследований старения при Университете Инсбрука, Rennweg 10, 6020 Инсбрук, Австрия под наблюдением Univ.-Doz. Д-р Пиддер Янсен-Дюрр, на которого распространяется этическое разрешение в качестве руководителя проекта, выданное в 2013 году (BMWF-66.008/0007-II/3b/2013). Обслуживание и использование мышей для проекта охватываются этическим разрешением No 2020-0.242.978 от 5 мая 2020 года, выданным Министерством образования, науки и исследований Австрии (BMBWF).
1. Препараты
ПРИМЕЧАНИЕ: Перед началом протокола необходимо подготовить несколько вещей, например, буфер лизиса белка, образец сырой ткани и специфическое антитело, помимо общих химических веществ и материалов.
- Готовят 250 мл буфера лизиса белка на 100 г чистой массы ткани: 250 мл 1x PBS с 50 мМ NaF, 1 мМ PMSF, 2 мкг/мл апротинина и 1 мМ активированного ортованадата (см. Таблицу 1). Отфильтруйте раствор с помощью шприцевого фильтра 0,22 мкм.
ПРИМЕЧАНИЕ: Активация ортованадата требуется перед использованием для превращения его в более мощный ингибитор белка тирозинфосфатаз18. Активированный ортованадат может быть получен от коммерческих поставщиков, но также приготовлен следующим образом.- Готовят 200 мМ запасного раствора (натрия) ортованадата в ddH2O. Для приготовления 10 мл раствора добавляют 368 мг Na3VO4 - 9 мл воды и растворяют путем перемешивания. После растворения восполняют объем до 10 мл с ddH2O.
ПРИМЕЧАНИЕ: Начальный рН раствора ортованадата натрия может изменяться в зависимости от источника материала, и рН необходимо скорректировать до 10 при повторяющемся подходе следующим образом. - В зависимости от исходного рН раствора отрегулируйте рН до 10 с NaOH или HCl. При рН > 10 раствор будет иметь желтый цвет. Вскипятите раствор, пока он не станет бесцветным, охладите его до комнатной температуры и проверьте pH. Если pH составляет >10, добавьте небольшой объем HCl, чтобы отрегулировать pH до 10. В этот момент раствор может снова пожелтеть.
- Повторяют кипячение и охлаждение до тех пор, пока раствор не останется бесцветным и рН не стабилизируется на уровне 10 (примерно в 5-7 раз). На этом этапе добавление HCl приводит к слабому появлению желтого цвета в растворе. Хранить активированный ортованадат в 1 мл аликвоты при -20 °C.
- Готовят 200 мМ запасного раствора (натрия) ортованадата в ddH2O. Для приготовления 10 мл раствора добавляют 368 мг Na3VO4 - 9 мл воды и растворяют путем перемешивания. После растворения восполняют объем до 10 мл с ddH2O.
- Подготовьте пробирки с 2 мл лизисного буфера на грамм ткани и поместите их на лед.
ПРИМЕЧАНИЕ: В этом протоколе использовались восемь пробирок по 50 мл, каждая из которых заполнена 30 мл лизисного буфера в общей сложности для одной почки свиньи (около 100-150 г), и две трубки, каждая из которых заполнена 40 мл лизисного буфера для 20 печени мышей (каждая 1-2 г) в общей сложности. - Подготовьте ткань: рассекните ткань на предварительно очищенной стеклянной пластине, помещенной на лед в коробке из пенополистирола. Разрезанные кусочки ткани по 100 мг каждый должны быть легко перенесены в соответствующие трубки для последующего лизиса. Переложите кусочки ткани в подготовленные пробирки (этап 1.2).
- Готовят насыщенный раствор сульфата аммония: нагревают 500 мл ddH2Oдо 70 °C и при перемешивании постепенно добавляют порошок сульфата аммония (см. Таблицу материалов) до тех пор, пока не растворится сульфат аммония. Охладите этот (пере)насыщенный раствор до комнатной температуры и храните его при 4 °C в течение ночи.
2. Общая экстракция белка
ПРИМЕЧАНИЕ После подготовки образца в буфере лизиса холодного белка (см. этап 1.3) гомогенизируйте ткань как можно лучше с помощью ультразвукового зонда или с использованием электрического гомогенизатора следующим образом.
- Гомогенизация тканей
- В случае свиной почки обжарьте суспензию ультразвуком, предпочтительно с помощью ультразвукового зонда, сохраняя образец на льду (10 циклов импульса 15 с, с интервалами 30 с между импульсами для охлаждения образца на льду, на средней амплитуде с 50% рабочим циклом).
- В случае органов мыши гомогенизируйте суспензию с помощью электрического гомогенизатора (начиная с низкой силы и медленно ускоряясь до средней силы), сохраняя образец на льду. Регулярно мойте электрический гомогенизатор в PBS, чтобы удалить любой органический материал, засоряющий устройство.
- Возьмите 20 мкл из образцов и проверьте под микроскопом, правильно ли разрушены клетки гомогенизированной ткани; в противном случае повторите гомогенизацию.
- Центрифугируйте трубки в настольной центрифуге при 10 000 х г в течение 30 мин при 4 °C.
ПРИМЕЧАНИЕ: Необязательно центрифугировать супернатант во второй раз при 20 000 х г в течение 30 мин при 4 °C для устранения небольших фракций исходной гранулы, которые могли быть перенесены. Это упростит последующую фильтрацию на этапе 2.3. - Соберите супернатант в свежую трубку и поместите его на лед. Последовательно фильтруйте супернатант с помощью шприцевых фильтрующих блоков 0,45 мкм и 0,22 мкм. Aliquot супернатант в партии по 10 мл и заморозьте их при -20 °C для краткосрочного хранения или при -80 °C для более длительного хранения.
ПРИМЕЧАНИЕ: Предварительная фильтрация с 0,45 мкм удаляет большинство частиц, прежде чем вторая стадия фильтрации с 0,22 мкм удаляет более мелкие частицы. Использование фильтра 0,22 мкм напрямую может вызвать риск засорения фильтров. - Подготовьте образец объемом 50 мкл для анализа SDS-PAGE/western blot путем добавления 10 мкл буфера образца 5x SDS (см. Таблицу 1) к 40 мкл надводного вещества, а затем кипячения при 95 °C в течение 10 мин.
- Необязательно повторно суспендируют около 100 мкл гранул, полученных на стадии 2.2 в 900 мкл ddH2O, и готовят образец для анализа SDS-PAGE/western blot, как описано выше.
ПРИМЕЧАНИЕ: Включение образцов, полученных из гранул, в анализ вестерн-блоттинга, в дополнение к положительному контролю, укажет, является ли экспрессия белка низкой, или антитело проблематично.
- Необязательно повторно суспендируют около 100 мкл гранул, полученных на стадии 2.2 в 900 мкл ddH2O, и готовят образец для анализа SDS-PAGE/western blot, как описано выше.
3. SDS-PAGE и вестерн-блот анализ
ПРИМЕЧАНИЕ: Анализ вестерн-блоттинга необходим для проверки растворимости белка. Ниже описан протокол для электроблоттинга с использованием системы мокрого и резервуарного блоттинга (см. Таблицу материалов). Альтернативный протокол для SDS-PAGE можно найти в другом месте19.
- Приготовьте прерывистый 12,5% полиакриламидный гель SDS-PAGE в соответствии с инструкциями производителя (т.е. гель для укладки поверх разрешающего геля; см. таблицу 1). Запустите образцы, ранее подготовленные на шаге 2 (аналогично шагам 4, 5 и 6; см. ниже).
- Загрузите белковую маркерную лестницу в первую лунку (см. Таблицу материалов). Нагрузка 5 нг рекомбинантного белка hFAHD1 (полученного избактерий 12; см. табл. 1) в качестве положительного контроля во вторую лунку.
- Затем загрузите 20 мкл анализируемого образца и заполните все оставшиеся скважины 20 мкл подготовленного буфера проб SDS-PAGE 1x (т.е. 5x буфера образцов, разбавленного ddH2O). Запускайте гели SDS-PAGE при напряжении 125 В с помощью буфера, работающего под управлением SDS (см. таблицу 1).
- После того, как SDS-PAGE будет завершен, выполните анализ вестерн-блоттинга и исследуйте мембраны, используя доступное антитело, поднятое против FAHD1 (см. Таблицу 1).
ПРИМЕЧАНИЕ: Поскольку образцы берутся из сырого гомогената ткани, обычно качество SDS-PAGE и анализа вестерн-блот на этом этапе ставится под угрозу; однако важно проверить, является ли белок для извлечения растворимым в надосадочном веществе. Следующий протокол был протестирован для свиной почки и различных органов мыши, включая печень, сердце, мозг и почки.- Подготовьте 10-кратный буфер переноса вестерн-блотов (см. таблицу 1). Подготовьте 1-кратный буфер переноса вестерн-блоттинга (см. таблицу 1) и охладите его до 4 °C.
- Активируйте мембрану PVDF в течение 2 мин в метаноле. Промыть мембрану в ddH2Oв течение 2 мин. Уравновешивайте мембрану в течение 15 мин в 1x западном буфере переноса блоттинга.
- Вымойте SDS-гель с 1x PBS в течение 10 минут во время встряхивания, чтобы удалить буфер, работающий под SDS, а затем инкубируйте гель в 1x западном буфере переноса пятен в течение 10 минут для уравновешивания. Смонтируйте электроблоттинговую кассету (т.е. комбинируя активированную PVDF-мембрану и гели) в соответствии с инструкциями производителя.
- Запустите пятно с помощью электроблоттинга при 300 мА в течение 1 ч в пенополистирольной коробке, заполненной льдом, или в холодном помещении (4 °C). Переложите мембрану PVDF в трубку объемом 50 мл с открытой стороной, обращенной к внутренней стороне трубки. Инкубируют мембрану в 20 мл буфера блокировки вестерн-блоттинга (см. Таблицу 1) в течение ночи при 4 °C при катании на трубчатом ролике (см. Таблицу материалов).
- На следующий день промывайте мембрану в течение 5 мин 20 мл вестерн-блот-промывочного буфера (PBS с 0,1% (v/v) Tween 20) в той же трубке во время прокатки. Инкубируют мембрану в той же пробирке с первичным антителом2 (нацеливающимся на FAHD1; см. Таблицу 1), разбавленным 1:500 в западном блокирующем буфере в течение 1 ч при комнатной температуре во время прокатки.
- Промывайте мембрану в одной и той же трубке три раза в течение 10 мин каждая с 20 мл буфера для промывки вестерн-блот во время прокатки. Инкубируют мембрану в течение 30 мин при комнатной температуре с HRP-конъюгированным вторичным антителом (см. Таблицу материалов), разбавленным 1:3000 в 5 мл буфера блокировки вестерн-блоттинга.
- Промывайте мембрану в одной и той же трубке три раза в течение 10 мин каждая с 20 мл вестерн-блот-промывочного буфера и дважды в течение 5 минут каждый с 1x PBS. Высушите мембрану, осторожно удерживая ее пинцетом на одном краю, и касаясь куска целлюлозы или куска бумаги Whatman противоположным (нижним) краем мембраны. Поместите мембрану (открытой стороной вверх) на очищенную стеклянную пластину.
- Тщательно накройте всю мембрану 1 мл подготовленного ECL вестерн-блот-субстрата с помощью пипетки, следя за тем, чтобы не создавать пузырьков воздуха. Дайте раствору ECL инкубироваться в течение 3 минут и сразу же развивайте мембрану с помощью рентгеновской пленки или с помощью системы визуализации.
ПРИМЕЧАНИЕ: Если белок не был обнаружен ни в одном из образцов, а только в положительном контроле, это может указывать на то, что белок нерастворим или не присутствует в достаточных количествах, которые могут быть обнаружены антителом. Если были загружены только нанограммы положительного контроля, то более вероятен первый сценарий. Если белка вообще не было обнаружено, проверьте качество антитела и, возможно, переключитесь на поликлональное антитело, а не на моноклональное антитело. В редких случаях, т.е. для некоторых гидрофобных белков, белок может быть обнаружен после центрифугирования, но не после фильтрации. В таком случае рекомендуется использовать специальные фильтрующие устройства для гидрофобных белков.
- Необязательно окрашивать мембраны PVDF после вестерн-блоттинга, чтобы контролировать успешную передачу белка из геля SDS-PAGE в мембрану PVDF.
ПРИМЕЧАНИЕ: Окрашивание Coomassie рекомендуется для поиска и устранения неисправностей, разработки метода и документации, но имейте в виду, что после применения этого протокола мембраны теряются для дальнейшего анализа вестерн-блоттинга. Окрашивание Ponceau S дает более слабое окрашивание, но может быть использовано, если мембраны должны быть повторно исследованы.- Подготовьте небольшие лотки, содержащие окрашивание (Coomassie или Ponceau S) и растворы для окрашивания.
- С помощью пинцета поместите мембрану в окрашивающий раствор и аккуратно встряхните до тех пор, пока мембрана не будет хорошо окрашена (5-10 мин).
- Переложите мембрану в очищающий раствор и встряхните до тех пор, пока раствор не насытится (5-10 мин). Повторяйте стадию обезболивания до тех пор, пока на мембране не будут наблюдаться белковые полосы; если полос не наблюдается вообще, повторите окрашивание с более длительным временем инкубации. Высушите мембрану, поместив ее на стеклянную пластину с помощью пинцета.
4. Тестирование: осаждение сульфата аммония
ПРИМЕЧАНИЕ: Осаждение сульфата аммония представляет собой метод очистки белка путем изменения растворимости белка. В предварительном эксперименте концентрацию сульфата аммония последовательно увеличивают до значения, которое выпадает в осадок максимального количества белковых загрязнителей, оставляя ПРИ этом FAHD1 в растворе. Растворимость белка снова исследуется с помощью анализа вестерн-блоттинга.
- Исходя из шага 2.3: либо разморозить аликвоту образца, либо приступить непосредственно после экстракции белка (т.е. без замораживания образца). Отфильтруйте образец с помощью фильтрующего блока 0,22 мкм, чтобы исключить возможные осадки после оттаивания. Подготовьте шесть пробирок по 1,5 мл на льду и переложите 250 мкл образца в каждую пробирку.
- Готовят серию разбавления 5%, 10%, 15%, 20%, 25% и 30% сульфата аммония в подготовленных выше пробирках и составляют конечный объем до 1000 мкл с буфером лизиса белка. Инкубируйте образцы при 4 °C в течение ночи на трубчатом ротаторе (см. Таблицу материалов).
- Используя настольную центрифугу, центрифугу при 10 000 х г в течение 30 мин при 4 °C и осторожно переложите все супернатанты в отдельные трубки. Высушите полученные гранулы на воздухе и повторно суспендируйте каждую из них в 1000 мкл ddH2O.
- Для каждой пары повторно суспендированных гранул и супернатанта с предыдущей стадии смешайте 40 мкл с 10 мкл 5x SDS буфера образца и кипятите при 95 °C с открытыми крышками до тех пор, пока большая часть жидкости не испарится. Затем повторно суспендируют гранулу в смеси 50% ДМСО в ddH2O.
- Выполните SDS-PAGE (шаг 3), но запустите гели при 80 В в течение 3 часов. Для каждой концентрации сульфата аммония загрузите образцы, полученные из повторно суспендированных гранул и супернатанта (стадия 4.3), парами. Выполните анализ вестерн-блоттинга (шаг 3).
- Проверьте самую высокую концентрацию сульфата аммония, при которой очищаемый белок (т.е. FAHD1) остается в образце, полученном из супернатанта. Основываясь на результатах, определите протокол осаждения сульфата аммония для интересующего белка, который будет использоваться в будущих экспериментах.
ПРИМЕЧАНИЕ: Известно, что сульфат аммония искажает SDS-PAGE и вестерн-блоттинг. По мере увеличения концентрации сульфата аммония качество анализа вестерн-блот будет поставлено под угрозу. Однако, как и на этапе 3 ранее, этот анализ используется для проверки растворимости интересующего белка при заданных концентрациях сульфата аммония. Этот протокол направлен на осаждение других белков, в то время как очищаемый белок должен оставаться растворимым.
5. Тестирование: ионообменная хроматография с ФПЛК
ПРИМЕЧАНИЕ: Молекулы с заряженными функциональными группами связаны с колонкой частиц кремнезема для FPLC, что позволяет дифференцировать белки в соответствии с их поверхностным зарядом. Выполните этот шаг дважды, используя катионно-обменную колонну и анионную обменную колонну (см. Таблицу материалов). Этапы протокола одинаковы для катионной или анионной обменной хроматографии, но используемые буферы различны (см. таблицу 1); как с «низким содержанием соли» 15 мМ NaCl, так и с «высоким содержанием соли» 1 М NaCl. Для используемых колонок рекомендуется расход 1 мл/мин.
- Настройте систему FPLC с анионной или катионной обменной колонкой. Промывайте колонну с 5 объемами колонн (CV) 20% EtOH (вH2O), затем 5 CV ddH2O. Поочередно промывайте колонну с 1 CV низкосолевого буфера, высокого солевого буфера и снова низкосолевого буфера в порядке, пока в хроматограмме больше не наблюдаются пики, но промывайте хотя бы один раз.
- После определения оптимального протокола осаждения сульфата аммония в малых масштабах (этап 4) применяют протокол осаждения к 10 мл исходного гомогената ткани (этап 2). При желании диализуйте образец по буферу с низким содержанием соли.
- Нанесите образец на колонну (например, путем впрыска или с помощью насоса для отбора проб) и соберите сквозной поток. Вымойте колонну с 1 CV буфера с низким содержанием соли.
- Установите линейное градиентное элюирование от 100% низкосолевого буфера / 0% буфера с высоким содержанием соли до 0% буфера с низким содержанием соли / 100% буфера с высоким содержанием соли в пределах 3 CV. Непрерывно собирайте фракции 1 мл. После того, как градиент закончился, продолжайте работать с буфером с высоким содержанием соли до тех пор, пока в хроматограмме не будут обнаружены больше связанные с белком пики (поглощение ультрафиолета при 280/255 нм) в диапазоне 1 CV.
- Применяют 1 мл 25% SDS, растворенного в 0,5 М NaOH (в ddH2O) для очистки колонки. Последовательно промываем колонну с 3 CV ddH2O и 3 CV 20% EtOH (в ddH2O).
- Соберите образцы SDS-PAGE всех пиковых фракций и проточных фракций и исследуйте их с помощью вестерн-блоттинга на наличие интересующего белка (этап 3). Заморозьте собранные фракции в жидком азоте и храните их при -80 °C.
- После того, как анализ вестерн-блот завершен, разморозьте и объедините фракции, содержащие интересующий белок, и отбросьте другие. Повторите шаги 5.1-5.5 с альтернативной колонкой (т.е. катионной или анионной обменной колонкой).
- После того, как обе колонки будут исследованы, определите протокол FPLC для интересующего белка, который будет использоваться в будущих экспериментах. Уменьшить объем белкового раствора с помощью ультрацентрифугирующих фильтрующих установок (10 кДа, см. Таблицу материалов) до 2 мл.
ПРИМЕЧАНИЕ: Есть два ожидаемых результата этой серии экспериментов. Либо интересующий белок прикрепился к одной из колонок, а белковый раствор уже достаточно чист после элюирования, либо белок остался в протекании в обоих случаях. В последнем сценарии, хотя белок находится в потоке, очищающий эффект этого шага все еще может быть значительным. В таком случае, как и для FAHD1 в печени свиней и мышей, этот этап ионного обмена все равно будет выполнен. Если ни катионный, ни анионный обменный столб не может обеспечить надлежащий эффект очистки, можно попытаться изменить рН лизата и буфера и диализовать образец по отношению к работающему буферу перед применением к FPLC.
6. Экстракция белка с использованием определенных подпротоколов для осаждения сульфата аммония и FPLC
ПРИМЕЧАНИЕ: Пористые частицы в колонке силикагеля для FPLC (см. Таблицу материалов) позволяют дифференцировать белки в соответствии с их гидродинамическим радиусом. Описанные этапы должны быть выполнены с помощью системы FPLC с использованием хроматографии исключения размеров (SEC). Для используемой колонки SEC (см. Таблицу материалов) рекомендуется расход 0,3 мл/мин.
- Подготовьте все необходимые материалы (см. этап 1) и извлеките общий белок из ткани (см. шаг 2). Выполняют осаждение сульфата аммония со всем гомогенатом ткани, который не использовался для тестирования (см. этап 4). Для больших объемов концентрируйте лизат с помощью ультрацентрифугирующих фильтрующих установок (10 кДа; см. Таблицу материалов) до меньшего объема 50 мл или менее.
- Выполните первый этап очистки с помощью ионной обменной хроматографии (см. шаг 5).
- Подготовьте образцы для вестерн-блоттинга, как описано в предыдущих шагах. Выполните анализ вестерн-блоттинга и объедините все фракции, содержащие FAHD1, из ионной обменной хроматографии.
- Уменьшить объем белкового раствора до 2 мл с помощью ультрацентрифугирующих фильтрующих установок (10 кДа). Последовательно фильтруйте раствор с помощью 0,45 мкм и 0,22 мкм шприцевых фильтрующих устройств для удаления любых микроосаждений.
- Уравновешивайте столбец SEC 1 CV рабочего буфера SEC (см. Таблицу 1), содержащего 1 мМ DTT. Загрузите образец на колонку и выполняйте хроматографию до тех пор, пока все белки не будут элюированы (1-2 CV).
- Соберите фракции 1 мл сквозного потока, что соответствует значительным пикам в хроматограмме (поглощение ультрафиолета при 280/255 нм) и подготовьте образцы 50 мкл каждой собранной фракции для анализа SDS-PAGE и вестерн-блоттинга, как описано на предыдущих этапах. Заморозьте все фракции, используя жидкий азот, и храните их при -80 °C.
- Последовательно промывайте колонну SEC с 1 CV ddH2O и 1 CV 20% EtOH (в ddH2O). Выполните анализ вестерн-Блот и объедините все фракции, содержащие FAHD1. Уменьшить объем белкового раствора до 2 мл с помощью ультрацентрифугирующих фильтрующих установок (10 кДа, см. Таблицу материалов).
- Оцените концентрацию белка с помощью коммерческого набора для анализа BCA (см. Таблицу материалов).
ПРИМЕЧАНИЕ: рН и содержание соли в подвижной фазе могут влиять на профиль элюирования шаровидных белков20. Кислотные или основные условия могут привести к тому, что пики будут менее определенными, а увеличение белково-матричных взаимодействий приведет к частичному удержанию белка на колонке20. Этот эффект может быть использован для дальнейшей очистки белка. Повторение шага 6 с различными скоростями потока, рН и концентрациями соли может повысить чистоту белка20.
7. Серебряное окрашивание
ПРИМЕЧАНИЕ: Анализ серебряного окрашивания гелей SDS-PAGE необходим для проверки белковых загрязнений, которые могут не быть замечены при окрашивании Coomassie. Следующий протокол является одной из многих версий, которые можно найти в литературе21. Выполните все этапы инкубации, встряхнув в чистом стеклянном лотке. Соберите все серебряные и формальдегидсодержащие жидкости в специальный контейнер для отходов и правильно выбрасывайте их.
- Инкубируйте гели SDS-PAGE в серебряном фиксирующем растворе для окрашивания (см. Таблицу 1) в холодном помещении. Инкубировать гели в серебряном окрашивающем инкубационном растворе (см. табл. 1) в течение 3 ч при комнатной температуре. Необязательно добавляют глутаральдегид (см. таблицу 1) для улучшения обнаружения слабых полос. Промыть гели четыре раза в ddH2Oв течение 10 мин каждый.
- Инкубировать гели в серебряном окрашивающем растворе серебра (см. табл. 1) в течение 1 ч.
ПРИМЕЧАНИЕ: Имейте в виду, что отныне все жидкости и сам гель содержат серебро и формальдегид, которые являются токсичными. - Инкубируйте гели в растворе для окрашивания серебром (см. таблицу 1) с сильным встряхиванием до тех пор, пока полосы не станут хорошо видны. Чтобы остановить реакцию, отбросьте раствор разработчика и немедленно инкубируйте гели в растворе для окрашивания серебром (см. таблицу 1) в течение минимум 10 мин.
ПРИМЕЧАНИЕ: Полосы, окрашенные на шагах 7.2 и 7.3, будут постоянно становиться все более развитыми. Добавление большего количества формальдегида в раствор, чем указано, может потребоваться, если окрашивание слабое.
Access restricted. Please log in or start a trial to view this content.
Результаты
Белок FAHD1 экстрагировали из почек свиней и печени мыши с использованием представленного протокола. Для тканей мышей требуется несколько органов, чтобы получить несколько мкг после окончательной стадии очистки. По этой причине в данной статье основное внимание уделяется извлечению FAHD1...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Критические шаги в протоколе
Соблюдение общих рекомендаций по обращению с белками имеет важное значение, например, работа на льду и в умеренных условиях pH и соли. Применение ингибиторов протеазы выгодно для метода, в то время как использование ингибиторов протеасом настояте...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конкурирующих финансовых интересов.
Благодарности
Авторы очень благодарны за техническую помощь Айсе Озтюрк и Еве Альбертини. Мыши, используемые для генерации ткани печени, содержались под наблюдением Univ.-Doz. Д-р Пиддер Янсен-Дюрр (Институт биомедицинских исследований старения при Инсбрукском университете, Реннвег 10, 6020 Инсбрук, Австрия).
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | - | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | - | - | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | - | - | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
Ссылки
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), London, England. 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 - a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily - A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284(2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729(2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009(2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), Seoul, Korea. 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802(2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- Ahmed, U., Saunders, G. Effect of pH on Protein Size Exclusion Chromatography. , Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011).
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- Cytiva Life Fundamentals of size exclusion chromatography. , Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022).
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172(2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены