Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
FAHD1 Proteininin Domuz Böbreği ve Fare Karaciğerinden Ekstraksiyonu ve Saflaştırılması
Bu Makalede
Özet
Bu protokol, domuz böbreği ve fare karaciğerinden fumarilasetotat hidrolaz alan içeren protein 1'in (FAHD1) nasıl çıkarılacağını açıklar. Listelenen yöntemler ilgilenilen diğer proteinlere uyarlanabilir ve diğer dokular için modifiye edilebilir.
Özet
Fumarilasetotat hidrolaz alan içeren protein 1 (FAHD1), ökaryotlarda FAH süper ailesinin ilk tanımlanmış üyesidir ve mitokondride oksaloasetat dekarboksilaz olarak işlev görür. Bu makalede, FAHD1'in domuz böbreği ve fare karaciğerinden ekstraksiyonu ve saflaştırılması için bir dizi yöntem sunulmaktadır. Kapsanan yöntemler hızlı protein sıvı kromatografisi (FPLC) ile iyonik değişim kromatografisi, FPLC ile preparatif ve analitik jel filtrasyonu ve proteomik yaklaşımlardır. Toplam protein ekstraksiyonundan sonra, amonyum sülfat çökeltmesi ve iyonik değişim kromatografisi araştırıldı ve FAHD1, iyonik değişim ve boyut dışlama kromatografisi kullanılarak sıralı bir strateji ile ekstrakte edildi. Bu temsili yaklaşım, ilgilenilen diğer proteinlere (önemli seviyelerde ifade edilir) uyarlanabilir ve diğer dokular için modifiye edilebilir. Dokudan saflaştırılmış protein, yüksek kaliteli antikorların ve / veya güçlü ve spesifik farmakolojik inhibitörlerin gelişimini destekleyebilir.
Giriş
Ökaryotik FAH etki alanı içeren protein 1 (FAHD1), iki fonksiyonlu oksaloasetat (OAA) dekarboksilaz (ODx)1 ve asilpiruvat hidrolaz (ApH)2 olarak işlev görür. Mitokondri2'de lokalizedir ve 1,2,3,4,5,6 enzimlerinin geniş FAH süper ailesine aittir. ApH aktivitesi sadece küçük bir öneme sahip olsa da, FAHD1'in ODx aktivitesi, TCA döngü akısı1,7,8,9'un düzenlenmesinde rol oynar. OAA sadece trikarboksilik asit döngüsündeki merkezi sitrat sentaz reaksiyonu için gerekli değildir, aynı zamanda elektron taşıma sisteminin bir parçası olarak ve bir kataplerotik metabolit olarak süksinat dehidrogenazın rekabetçi bir inhibitörü olarak da işlev görür. İnsan göbek damarı endotel hücrelerinde (HUVEC) FAHD1 gen ekspresyonunun aşağı regülasyonu, hücre proliferasyon hızında10 önemli bir azalmaya ve glikolize eşzamanlı bir geçişle ilişkili mitokondriyal membran potansiyelinin önemli ölçüde inhibisyona neden olmuştur. Çalışma modeli, mitokondriyal OAA seviyelerinin FAHD1 aktivitesi 1,8,9 tarafından sıkı bir şekilde düzenlendiği mitokondriyal disfonksiyon ile ilişkili yaşlanma (MiDAS)11 benzeri fenotip 8'i ifade eder.
Rekombinant proteinin dokudan ziyade bakteri12'den ekspresyon ve saflaştırma yoluyla elde edilmesi daha kolaydır. Bununla birlikte, bakterilerde eksprese edilen bir protein, post-translasyonel modifikasyonların olası eksikliği nedeniyle önyargılı olabilir veya basitçe sorunlu olabilir (yani, plazmid kaybı, bakteriyel stres tepkileri, çarpık / şekilsiz disülfit bağları, hiç veya zayıf sekresyon, protein agregasyonu, proteolitik bölünme, vb. Nedeniyle). Bazı uygulamalar için, bu tür modifikasyonları dahil etmek ve / veya olası eserleri dışlamak için hücre lizatından veya dokudan protein elde edilmesi gerekir. Dokudan saflaştırılmış protein, FAHD113 gibi seçilmiş enzimler için yüksek kaliteli antikorların ve / veya güçlü ve spesifik farmakolojik inhibitörlerin gelişimini destekler.
Bu el yazması, FAHD1'in domuz böbreği ve fare karaciğerinden ekstraksiyonu ve saflaştırılması için bir dizi yöntem sunmaktadır. Tarif edilen yöntemler hızlı protein sıvı kromatografisi (FPLC) gerektirir, ancak aksi takdirde ortak laboratuvar ekipmanı kullanır. Alternatif yöntemler başka yerlerde bulunabilir14,15,16,17. Toplam protein ekstraksiyonundan sonra, önerilen protokol, amonyum sülfat çökeltmesi ve iyonik değişim kromatografisi için alt protokollerin tartışıldığı bir test aşamasını içerir (Şekil 1). Bu alt protokolleri tanımladıktan sonra, ilgilenilen protein, FPLC ile iyonik değişim ve boyut dışlama kromatografisi kullanılarak sıralı bir strateji ile çıkarılır. Bu kılavuzlara dayanarak, nihai protokol diğer ilgili proteinler için ayrı ayrı uyarlanabilir.
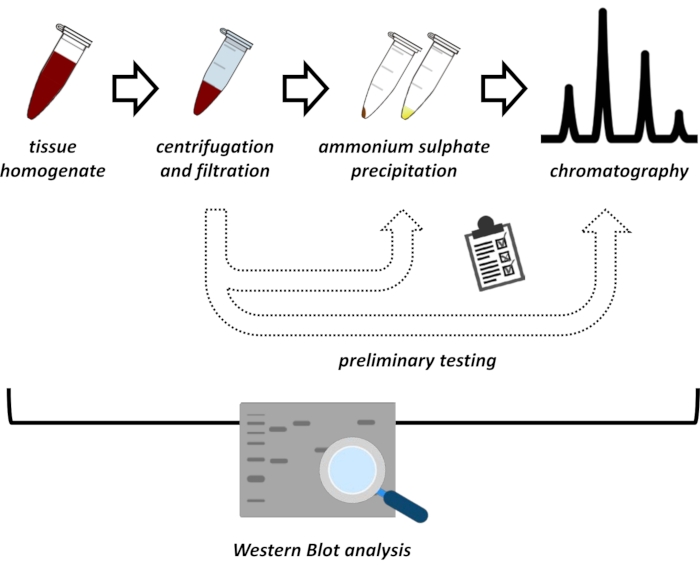
Şekil 1: Bu protokolün genel stratejisi. Yukarıdan aşağıya: Protein dokulardan çıkarılır. Doku homojenatı hazırlanır, santrifüj edilir ve filtrelenir. Her bir süpernatant ve pelet türevi numune çifti için, optimum koşullar için prob yapmak üzere amonyum sülfat çökeltme ve iyonik değişim kromatografisi (FPLC) testleri yapılmalıdır. Bu alt protokolleri oluşturduktan sonra, protein, değişen pH ve tuz konsantrasyonlarında sıralı bir amonyum sülfat çökeltme, iyonik değişim kromatografisi ve tekrarlayan boyut dışlama kromatografisi (FPLC) prosedürü ile ekstrakte edilebilir. Tüm adımların batı lekesi tarafından kontrol edilmesi gerekir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Protokol
Tüm deneyler kurumsal yönergelere uygun olarak gerçekleştirilmiştir. Domuz böbreği yerel süpermarketten taze olarak elde edildi. Karaciğer dokuları, Univ.-Doz gözetiminde Innsbruck Üniversitesi, Rennweg 10, 6020 Innsbruck, Avusturya'daki Biyomedikal Yaşlanma Araştırmaları Enstitüsü'nde tutulan C57BL6 vahşi tip farelerden toplandı. Dr. Pidder Jansen-Dürr, 2013 yılında verilen proje lideri olarak etik izin kapsamındadır (BMWF-66.008/0007-II/3b/2013). Proje için farelerin bakımı ve kullanımı, Avusturya Eğitim, Bilim ve Araştırma Bakanlığı (BMBWF) tarafından verilen 5 Mayıs 2020 tarihinden itibaren 2020-0.242.978 sayılı etik izin kapsamındadır.
1. Hazırlıklar
NOT: Protokol başlamadan önce, genel kimyasallar ve malzemelerin yanı sıra protein lizis tamponu, ham doku örneği ve spesifik bir antikor gibi birkaç şeyin hazırlanması gerekir.
- 100 g net doku ağırlığı başına 250 mL protein lizis tamponu hazırlayın: 50 mM NaF, 1 mM PMSF, 2 μg / mL aprotinin ve 1 mM aktive edilmiş ortovanadat ile 250 mL 1x PBS (bkz. Tablo 1). 0,22 μm şırınga filtre ünitesi kullanarak çözeltiyi filtreleyin.
NOT: Ortovanadatın aktivasyonu, protein tirozin fosfatazların daha güçlü bir inhibitörüne dönüştürülmesi için kullanılmadan önce gereklidir18. Aktif ortovanadat ticari tedarikçilerden elde edilebilir, ancak aşağıdaki gibi de hazırlanabilir.- ddH2O'da 200 mM'lik bir (sodyum) ortovanadat stok çözeltisi hazırlayın. 10 mL çözelti hazırlamak için, 368 mg Na3VO4 ila 9 mL su ekleyin ve karıştırarak çözün. Çözüldükten sonra, ddH2O ile hacmi 10 mL'ye kadar yükseltin.
NOT: Sodyum ortovanadat çözeltisinin başlangıç pH'ı, malzemenin kaynağına göre değişebilir ve pH'ın aşağıdaki gibi tekrarlayan bir yaklaşımla 10'a ayarlanması gerekir. - Çözeltinin başlangıç pH'ına bağlı olarak, pH'ı NaOH veya HCl ile 10'a ayarlayın. pH > 10'da, çözelti sarı bir renge sahip olacaktır. Çözeltiyi renksiz hale gelene kadar kaynatın, oda sıcaklığına soğutun ve pH'ı kontrol edin. pH >10 ise, pH'ı 10'a ayarlamak için küçük bir HCl hacmi ekleyin. Bu noktada, çözelti tekrar sararabilir.
- Çözelti renksiz kalana ve pH 10'da (yaklaşık 5-7 kez) stabilize olana kadar kaynatma ve soğutmayı tekrarlayın. Bu noktada, HCl eklenmesi, çözeltide sarı rengin soluk bir görünümüne neden olur. Aktif ortovanadadı -20 °C'de 1 mL alikotta saklayın.
- ddH2O'da 200 mM'lik bir (sodyum) ortovanadat stok çözeltisi hazırlayın. 10 mL çözelti hazırlamak için, 368 mg Na3VO4 ila 9 mL su ekleyin ve karıştırarak çözün. Çözüldükten sonra, ddH2O ile hacmi 10 mL'ye kadar yükseltin.
- Tüpleri gram doku başına 2 mL lizis tamponu ile hazırlayın ve buzun üzerine yerleştirin.
NOT: Bu protokol, her biri bir domuz böbreği (yaklaşık 100-150 g) için toplamda 30 mL lizis tamponu ile doldurulmuş sekiz adet 50 mL tüp ve toplamda 20 fare karaciğeri (her biri 1-2 g) için her biri 40 mL lizis tamponu ile doldurulmuş iki tüp kullanmıştır. - Dokuyu hazırlayın: dokuyu bir polistiren köpük kutuda buz üzerine yerleştirilmiş önceden temizlenmiş bir cam plaka üzerinde disseke edin. Sonraki lizis için ilgili tüplere kolayca aktarılmak üzere her biri yaklaşık 100 mg'lık doku parçalarını kesin. Doku parçalarını hazırlanan tüplere aktarın (adım 1.2).
- Doymuş bir amonyum sülfat çözeltisi hazırlayın: 500 mL ddH2O ila 70 ° C ısıtın ve karıştırırken, daha fazla amonyum sülfat çözülmeyene kadar yavaş yavaş amonyum sülfat tozu ekleyin ( Malzemeler Tablosuna bakınız). Bu (aşırı) doymuş çözeltiyi oda sıcaklığına soğutun ve gece boyunca 4 ° C'de saklayın.
2. Toplam protein ekstraksiyonu
NOT Numuneyi soğuk protein lizis tamponunda hazırladıktan sonra (bkz. adım 1.3), dokuyu ultrasonik bir prob ile sonikasyon yoluyla veya aşağıdaki gibi bir elektrikli homojenizatör kullanarak mümkün olan en iyi şekilde homojenize edin.
- Dokuların homojenizasyonu
- Bir domuz böbreği durumunda, numuneyi buz üzerinde tutarken süspansiyonu tercihen ultrasonik bir prob ile sonikleştirin (numuneyi buz üzerinde soğutmak için darbeler arasında 30 s aralıklı,% 50 görev döngüsü ile orta genlikte, 15 s darbenin 10 döngüsü).
- Fare organları söz konusu olduğunda, numuneyi buz üzerinde tutarken bir elektrikli homojenizatör (düşük kuvvetle başlayıp yavaşça orta kuvvete hızlanan) kullanarak süspansiyonu homojenize edin. Cihazı tıkayan organik maddeleri temizlemek için elektrikli homojenizatörü PBS'de düzenli olarak yıkayın.
- Numunelerden 20 μL alın ve homojenize edilmiş dokunun hücrelerinin uygun şekilde tahrip edilip edilmediğini mikroskop altında kontrol edin; aksi takdirde, homojenizasyonu tekrarlayın.
- Tüpleri 4 °C'de 30 dakika boyunca 10.000 x g'de bir masa üstü santrifüjde santrifüj yapın.
NOT: İsteğe bağlı olarak, aktarılmış olabilecek ilk peletin küçük fraksiyonlarını ortadan kaldırmak için süpernatantı 4 ° C'de 30 dakika boyunca 20.000 x g'de ikinci kez santrifüj edin. Bu, adım 2.3'te sonraki filtrelemeyi basitleştirecektir. - Süpernatantı taze bir tüpte toplayın ve buzun üzerine yerleştirin. Süpernatantı 0,45 μm ve 0,22 μm şırınga filtre üniteleri kullanarak sırayla filtreleyin. Süpernatantı 10 mL partilere ayırın ve kısa süreli depolama için -20 ° C'de veya daha uzun depolama için -80 ° C'de dondurun.
NOT: 0,45 μm ile ön filtreleme, 0,22 μm ile ikinci bir filtreleme adımı daha ince parçacıkları kaldırmadan önce parçacıkların çoğunu uzaklaştırır. 0,22 μm filtrenin doğrudan kullanılması, filtrelerin tıkanması riskine neden olabilir. - SDS-PAGE/batı leke analizi için süpernatanın 40 μL'sine 10 μL 5x SDS numune tamponu (bkz. Tablo 1) ekleyerek ve ardından 10 dakika boyunca 95 °C'de kaynatarak 50 μL'lik bir numune hazırlayın.
- İsteğe bağlı olarak, 900 μLddH 2O'da adım 2.2'de elde edilen yaklaşık 100 μL peleti yeniden askıya alın ve yukarıda açıklandığı gibi SDS-PAGE/batı leke analizi için bir örnek hazırlayın.
NOT: Pelet türevi örneklerin batı leke analizine dahil edilmesi, pozitif kontrole ek olarak, proteinin ekspresyonunun düşük olup olmadığını veya antikorun sorunlu olup olmadığını gösterecektir.
- İsteğe bağlı olarak, 900 μLddH 2O'da adım 2.2'de elde edilen yaklaşık 100 μL peleti yeniden askıya alın ve yukarıda açıklandığı gibi SDS-PAGE/batı leke analizi için bir örnek hazırlayın.
3. SDS-PAGE ve batı leke analizi
NOT: Protein çözünürlüğünü kontrol etmek için Western blot analizi gereklidir. Aşağıda, Islak/Tank lekeleme sistemi kullanılarak elektro-lekeleme için bir protokol açıklanmaktadır (bkz. SDS-PAGE için alternatif bir protokol19 başka bir yerde bulunabilir.
- Üreticinin talimatlarına göre süreksiz% 12,5'lik bir poliakrilamid SDS-PAGE jeli hazırlayın (yani, bir çözücü jelin üzerine bir istifleme jeli; bakınız Tablo 1). Adım 2 sırasında daha önce hazırlanmış örnekleri çalıştırın (adım 4, 5 ve 6'ya benzer; aşağıya bakın).
- İlk kuyucuğa bir protein işaretleyici merdiven yükleyin (bkz. İkinci kuyucuğa pozitif kontrol olarak 5 ng hFAHD1 rekombinant proteini (bakteri12'den elde edilir; bakınız Tablo 1) yükleyin.
- Daha sonra, analiz edilecek numunenin 20 μL'sini yükleyin ve kalan tüm kuyucukları 20 μL hazırlanmış SDS-PAGE 1x numune tamponu ile doldurun (yani, ddH2O ile seyreltilmiş 5x numune tamponu). SDS çalışan arabelleği kullanarak SDS-PAGE jellerini 125 V'ta çalıştırın (bkz. Tablo 1).
- SDS-PAGE tamamlandıktan sonra, bir batı lekesi analizi yapın ve FAHD1'e karşı yükseltilmiş mevcut antikoru kullanarak membranları araştırın (bakınız Tablo 1).
NOT: Numuneler ham doku homojenatından alındığından, genellikle SDS-PAGE ve batı leke analizinin kalitesi bu noktada tehlikeye girer; Bununla birlikte, ekstrakte edilecek proteinin süpernatant içinde çözünür olup olmadığını kontrol etmek önemlidir. Aşağıdaki protokol domuz böbreği ve karaciğer, kalp, beyin ve böbrek dahil olmak üzere farklı fare organları için test edilmiştir.- 10x batı lekesi transfer arabelleğini hazırlayın (bkz. Tablo 1). 1x batı lekesi transfer tamponunu hazırlayın (bakınız Tablo 1) ve 4 °C'ye soğutun.
- Metanol içinde 2 dakika boyunca bir PVDF membranını etkinleştirin. Membranı ddH 2 O'da2dakika yıkayın. Membranı 15 dakika boyunca 1x batı lekesi transfer tamponunda dengeleyin.
- SDS çalışan tamponu çıkarmak için sallarken SDS-jeli 10 dakika boyunca 1x PBS ile yıkayın ve ardından denge için jeli 10 dakika boyunca 1x batı lekesi transfer tamponunda inkübe edin. Elektro-lekeleme kasetini (yani, aktif PVDF membranını ve jelleri birleştirerek) üreticinin talimatlarına göre monte edin.
- Lekeyi, buzla dolu bir polistiren köpük kutuda veya soğuk odada (4 ° C) 1 saat boyunca 300 mA'da elektro-lekeleme yoluyla çalıştırın. PVDF membranını, açıkta kalan tarafı tüpün iç tarafına bakacak şekilde 50 mL'lik bir tüpe aktarın. Membranı, bir tüp silindiri üzerinde yuvarlanırken gece boyunca 4 °C'de 20 mL batı leke bloke edici tamponda (bakınız Tablo 1) inkübe edin (bkz.
- Ertesi gün, membranı yuvarlanırken aynı tüpte 20 mL batı lekesi yıkama tamponu (% 0.1 (v / v) Ara 20 ile PBS) 5 dakika boyunca yıkayın. Membranı aynı tüpte primer antikor2 (FAHD1'i hedefleme; bakınız Tablo 1) ile inkübe edin 1:500 batı leke bloke edici tamponda yuvarlanırken oda sıcaklığında 1 saat seyreltin.
- Membranı aynı tüpte her biri 10 dakika boyunca üç kez yıkayın, haddeleme sırasında 20 mL batı lekesi yıkama tamponu ile. Membranı oda sıcaklığında 30 dakika boyunca HRP konjuge sekonder antikor ile inkübe edin ( bakınız Malzeme Tablosu) 5 mL batı leke bloke edici tamponda 1:3000 seyreltin.
- Membranı aynı tüpte her biri 10 dakika boyunca üç kez 20 mL batı lekesi yıkama tamponu ile ve her biri 1x PBS ile 5 dakika boyunca iki kez yıkayın. Membranı bir kenarındaki cımbızla dikkatlice tutarak ve zarın zıt (alt) kenarı olan bir parça selüloz veya bir parça Whatman kağıdına dokunarak kurulayın. Membranı (açıkta kalan tarafı yukarı) temizlenmiş bir cam plakaya koyun.
- Tüm membranı 1 mL hazırlanmış ECL batı lekesi substratı ile pipet kullanarak dikkatlice örtün, hava kabarcığı oluşturmamaya özen gösterin. ECL çözeltisinin 3 dakika boyunca inkübe olmasına izin verin ve hemen X-ışını filmi kullanarak veya bir görüntüleme sistemi kullanarak membranı geliştirin.
NOT: Protein, örneklerin hiçbirinde değil, sadece pozitif kontrolde tespit edilmişse, bu, proteinin çözünmez olduğunu veya antikor tarafından tespit edilecek yeterli miktarda bulunmadığını gösterebilir. Pozitif kontrolün sadece nanogramları yüklendiyse, ilk senaryo daha olasıdır. Hiç protein tespit edilmediyse, antikorun kalitesini kontrol edin ve belki de monoklonal bir antikor yerine bir poliklonal antikora geçin. Nadir durumlarda, yani bazı hidrofobik proteinler için, protein santrifüjlemeden sonra tespit edilebilir, ancak filtrasyondan sonra tespit edilemez. Böyle bir durumda, hidrofobik proteinler için özel filtre ünitelerinin kullanılması önerilir.
- İsteğe bağlı olarak, proteinin SDS-PAGE jelden PVDF membranına başarılı bir şekilde aktarılmasını kontrol etmek için PVDF membranlarını batı lekesinden sonra boyayın.
NOT: Sorun giderme, yöntem geliştirme ve dokümantasyon için Coomassie boyama önerilir, ancak bu protokolü uyguladıktan sonra membranların daha fazla batı leke analizinde kaybolduğunu unutmayın. Ponceau S boyaması daha zayıf boyama verir, ancak membranlar yeniden incelenecekse kullanılabilir.- Boyama (Coomassie veya Ponceau S) ve leke giderme solüsyonlarını içeren küçük tepsiler hazırlayın.
- Cımbız kullanarak, zarı boyama çözeltisine koyun ve membran iyice lekelenene kadar hafifçe çalkalayın (5-10 dakika).
- Membranı leke çözücü çözeltiye aktarın ve çözelti doyana kadar çalkalayın (5-10 dakika). Membran üzerinde protein bantları gözlenene kadar destaining adımını tekrarlayın; hiç bant gözlenmezse, boyamayı daha uzun bir kuluçka süresiyle tekrarlayın. Membranı cımbız kullanarak bir cam plakaya yerleştirerek kurutun.
4. Test: Amonyum sülfat çökeltme
NOT: Amonyum sülfat çökeltmesi, proteinin çözünürlüğünü değiştirerek bir protein saflaştırma yöntemidir. Bir ön deneyde, amonyum sülfat konsantrasyonu, FAHD1'i çözelti içinde bırakırken, maksimum miktarda protein kirleticisini çökelten bir değere sıralı olarak arttırılır. Proteinin çözünürlüğü yine batı leke analizi ile incelenir.
- Adım 2.3'ten devam edin: ya numunenin bir alikotunu çözün ya da protein ekstraksiyonundan hemen sonra (yani, numuneyi dondurmadan) devam edin. Çözülmeden sonra olası çökelmeleri dışlamak için numuneyi 0,22 μm'lik bir filtre ünitesi kullanarak filtreleyin. Buz üzerinde altı adet 1,5 mL tüp hazırlayın ve her tüpe 250 μL numune aktarın.
- Yukarıda hazırlanan tüplerde% 5,% 10,% 15,% 20,% 25,% 25 ve% 30'luk bir seyreltme serisi hazırlayın ve protein lizis tamponu ile son hacmi 1000 μL'ye kadar yapın. Numuneleri bir tüp rotatörde gece boyunca 4 °C'de inkübe edin (bkz.
- Bir masa üstü santrifüj kullanarak, 4 ° C'de 30 dakika boyunca 10.000 x g'de santrifüj yapın ve tüm süpernatantları dikkatlice ayrı tüplere aktarın. Elde edilen peletleri hava ile kurutun ve her birini 1000 μL ddH2O içinde yeniden askıya alın.
- Önceki adımdaki her bir yeniden askıya alınmış pelet ve süpernatant çifti için, 40 μL'yi 10 μL 5x SDS numune tamponu ile karıştırın ve sıvının çoğu buharlaşana kadar açık kapaklarla 95 ° C'de kaynatın. Daha sonra, peleti ddH2O'da% 50 DMSO karışımında yeniden askıya alın.
- SDS-PAGE (adım 3) gerçekleştirin, ancak jelleri 3 saat boyunca 80 V'ta çalıştırın. Her bir amonyum sülfat konsantrasyonu için, yeniden askıya alınmış pelet ve süpernatanttan (adım 4.3) elde edilen numuneleri çiftler halinde yükleyin. Batı lekesi analizi yapın (adım 3).
- Saflaştırılacak proteinin (yani, FAHD1) süpernatandan türetilen numunede kaldığı en yüksek amonyum sülfat konsantrasyonunu kontrol edin. Sonuçlara dayanarak, gelecekteki deneylerde kullanılmak üzere ilgilenilen protein için bir amonyum sülfat çökeltme protokolü tanımlayın.
NOT: Amonyum sülfatın SDS-PAGE ve batı lekesini bozduğu iyi bilinmektedir. Amonyum sülfat konsantrasyonu arttıkça, batı leke analizinin kalitesi tehlikeye girecektir. Bununla birlikte, daha önce adım 3'te olduğu gibi, bu analiz, verilen amonyum sülfat konsantrasyonlarında ilgili proteinin çözünürlüğünü kontrol etmek için kullanılır. Bu protokol, diğer proteinleri çökeltmeyi amaçlarken, saflaştırılacak proteinin çözünür kalması gerekir.
5. Test: FPLC ile iyonik değişim kromatografisi
NOT: Yüklü fonksiyonel gruplara sahip moleküller, FPLC için bir silika parçacık sütununa bağlanır ve proteinlerin yüzey yüklerine göre farklılaşmasını sağlar. Katyonik değişim sütununu ve anyonik değişim sütununu kullanarak bu adımı iki kez gerçekleştirin (bkz. Protokol adımları katyonik veya anyonik değişim kromatografisi için aynıdır, ancak kullanılacak tamponlar farklıdır (bkz . Tablo 1); hem "düşük tuzlu" 15 mM NaCl hem de "yüksek tuzlu" 1 M NaCl koşullarıyla. Kullanılan kolonlar için 1 mL/dak debi önerilir.
- FPLC sistemini anyonik veya katyonik değişim sütunu ile kurun. Kolonu % 20 EtOH'luk (H2O'da) 5 sütun hacmi (CV) ile yıkayın, ardından 5 CV ddH2O Alternatif olarak, kolonu, kromatogramda daha fazla pik gözlenmeyene kadar sırayla 1 CV düşük tuz tamponu, yüksek tuz tamponu ve tekrar düşük tuz tamponu ile yıkayın, ancak en az bir kez yıkayın.
- Küçük ölçekte amonyum sülfat çökeltmesi için en uygun protokolü belirledikten sonra (adım 4), çökeltme protokolünü 10 mL orijinal doku homojenatına uygulayın (adım 2). İsteğe bağlı olarak, numuneyi düşük tuz tamponuna karşı çevirin.
- Numuneyi kolona uygulayın (örneğin, enjeksiyonla veya bir numune pompası kullanarak) ve akışı toplayın. Kolonu düşük tuz tamponunun 1 CV'si ile yıkayın.
- 3 CV içinde %100 düşük tuz tamponu / %0 yüksek tuz tamponundan %0 düşük tuz tamponu/%100 yüksek tuz tamponuna doğrusal gradyan elüsyonu ayarlayın. Gradyan bittikten sonra, kromatogramda 1 CV aralığında proteinle ilişkili pikler (280/255 nm'de UV emilimi) tespit edilmeyene kadar yüksek tuz tamponu ile çalışmaya devam edin.
- Kolonu temizlemek için 0,5 M NaOH (ddH 2 O'da) içinde çözünmüş 1mL% 25SDS uygulayın. Ardışık olarak, sütunu 3 CV ddH 2 O ve 3 CV ile% 20 EtOH (ddH2O olarak) ile yıkayın.
- Tüm pik fraksiyonların ve akışların SDS-PAGE örneklerini toplayın ve ilgilenilen proteinin varlığı için batı lekesi yoluyla araştırın (adım 3). Toplanan fraksiyonları sıvı azotta çıtçıtla dondurun ve -80 °C'de saklayın.
- Batı leke analizi tamamlandıktan sonra, ilgilenilen proteini içeren fraksiyonları çözün ve bir araya getirin ve diğerlerini atın. 5.1-5.5 arasındaki adımları alternatif sütunla (ör. katyonik veya anyonik değişim sütunu) tekrarlayın.
- Her iki sütun da incelendikten sonra, gelecekteki deneylerde kullanılmak üzere ilgilenilen protein için bir FPLC protokolü tanımlayın. Ultra santrifüjleme filtre üniteleri kullanarak protein çözeltisinin hacmini (10 kDa, Malzeme Tablosuna bakınız) 2 mL'ye düşürün.
NOT: Bu deney serisinin beklenen iki sonucu vardır. Ya ilgilenilen protein sütunlardan birine bağlanmıştır ve protein çözeltisi elüsyondan sonra zaten oldukça saftır ya da protein her iki durumda da akışta kalmıştır. İkinci senaryoda, protein akışta olmasına rağmen, bu adımın temizleme etkisi hala önemli olabilir. Böyle bir durumda, domuz böbreği ve fare karaciğerindeki FAHD1'de olduğu gibi, iyonik değişimin bu adımı hala gerçekleştirilecektir. Katyonik veya anyonik değişim kolonunun hiçbiri uygun bir temizleme etkisi sağlayamıyorsa, lizat ve tamponun pH'ını değiştirmeye ve FPLC'ye uygulamadan önce numuneyi çalışan tampona karşı çevirmeye çalışılabilir.
6. Amonyum sülfat çökeltme ve FPLC için tanımlanmış alt protokolleri kullanarak protein ekstraksiyonu
NOT: FPLC için bir silika jel kolondaki gözenekli parçacıklar ( Malzeme Tablosuna bakınız), proteinlerin hidrodinamik yarıçaplarına göre farklılaşmasını sağlar. Açıklanan adımlar, boyut dışlama kromatografisi (SEC) kullanılarak bir FPLC sistemi ile gerçekleştirilmelidir. Kullanılan SEC sütunu için (bkz . Malzeme Tablosu), 0,3 mL/dak akış hızı önerilir.
- Gerekli tüm malzemeleri hazırlayın (bkz. adım 1) ve toplam proteini dokudan çıkarın (bkz. adım 2). Test için kullanılmayan tüm doku homojenatı ile bir amonyum sülfat çökeltmesi gerçekleştirin (bkz. adım 4). Daha büyük hacimler için, lizatı ultra santrifüjleme filtre üniteleri (10 kDa; bakınız Malzeme Tablosu) kullanarak 50 mL veya daha küçük bir hacme kadar yoğunlaştırın.
- İyonik değişim kromatografisini kullanarak ilk saflaştırma adımını gerçekleştirin (bkz. adım 5).
- Önceki adımlarda açıklandığı gibi batı lekesi için numuneler hazırlayın. Batı leke analizi yapın ve iyonik değişim kromatografisinden fraksiyonlar içeren tüm FAHD1'leri bir araya getirin.
- Ultra santrifüjleme filtre üniteleri (10 kDa) kullanarak protein çözeltisinin hacmini 2 mL'ye düşürün. Herhangi bir mikro çökeltiyi gidermek için çözeltiyi 0,45 μm ve 0,22 μm şırınga filtre üniteleriyle sırayla filtreleyin.
- SEC sütununu, 1 mM DTT içeren 1 CV çalışan arabellek ile dengeleyin (bkz. Tablo 1). Numuneyi kolona yükleyin ve tüm proteinler salınana kadar kromatografiyi çalıştırın (1-2 CV).
- Kromatogramdaki önemli zirvelere karşılık gelen akışın 1 mL'lik fraksiyonlarını toplayın (280/255 nm'de UV absorpsiyonu) ve önceki adımlarda açıklandığı gibi SDS-PAGE ve batı leke analizi için toplanan her fraksiyonun 50 μL numunesini hazırlayın. Sıvı azot kullanarak tüm fraksiyonları çıtçıtla dondurun ve -80 °C'de saklayın.
- SEC sütununu art arda 1 CV ddH 2 O ve 1 CV %20 EtOH (ddH2O cinsinden) ile yıkayın. Batı-Leke analizi yapın ve fraksiyonları içeren tüm FAHD1'leri bir araya getirin. Ultra santrifüjleme filtre üniteleri kullanarak protein çözeltisinin hacmini 2 mL'ye düşürün (10 kDa, bkz.
- Ticari bir BCA tahlil kiti kullanarak protein konsantrasyonunu değerlendirin (bakınız Malzeme Tablosu).
NOT: Mobil fazın pH ve tuz içeriği, küresel proteinlerin elüsyon profilini etkileyebilir20. Asidik veya bazik koşullar, piklerin daha az tanımlanmış olmasına ve protein-matriks etkileşimlerinin artmasına ve proteinin sütun20'de kısmi tutulmasına neden olabilir. Bu etki, daha fazla protein saflaştırması için kullanılabilir. Adım 6'nın farklı akış hızları, pH ve tuz konsantrasyonları ile tekrarlanması, protein20'nin saflığını artırabilir.
7. Gümüş boyama
NOT: SDS-PAGE jellerinin gümüş boyama analizi, Coomassie boyamasında görülemeyen protein kontaminasyonlarını kontrol etmek için gereklidir. Aşağıdaki protokol, literatür21'de bulunabilecek birçok versiyondan biridir. Tüm inkübasyon adımlarını temiz bir cam tepside sallayarak gerçekleştirin. Tüm gümüş ve formaldehit içeren sıvıları özel bir atık kabında toplayın ve uygun şekilde atın.
- SDS-PAGE jellerini soğuk odada gece boyunca gümüş boyama sabitleme çözeltisinde (bakınız Tablo 1) inkübe edin. Jelleri gümüş boyama inkübasyon çözeltisinde (bakınız Tablo 1) oda sıcaklığında 3 saat boyunca inkübe edin. İsteğe bağlı olarak, soluk bantların algılanmasını iyileştirmek için glutaraldehit ekleyin (bkz. Tablo 1). Jelleri her biri 10 dakika boyunca ddH2O'da dört kez yıkayın.
- Jelleri gümüş boyama gümüş çözeltisinde (bakınız Tablo 1) 1 saat boyunca inkübe edin.
NOT: Şu andan itibaren tüm sıvıların ve jelin kendisinin toksik olan gümüş ve formaldehit içerdiğini unutmayın. - Jelleri gümüş boyama geliştirici çözümünde (bakınız Tablo 1) bantlar açıkça görünene kadar kuvvetli bir şekilde çalkalayarak inkübe edin. Reaksiyonu durdurmak için, geliştirici solüsyonu atın ve jelleri derhal gümüş boyama durdurma çözeltisinde (bakınız Tablo 1) en az 10 dakika boyunca inkübe edin.
NOT: Adım 7.2 ve 7.3'te lekelenen bantlar sürekli olarak daha gelişmiş hale gelecektir. Çözeltiye belirtilenden daha fazla formaldehit eklenmesi, boyama zayıfsa gerekli olabilir.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
FAHD1 proteini, sunulan protokol kullanılarak domuz böbreği ve fare karaciğerinden ekstrakte edildi. Fare dokusu için, son saflaştırma adımından sonra birkaç μg elde etmek için birden fazla organ gereklidir. Bu nedenle, bu makale FAHD1'in domuz böbreklerinden ekstraksiyonuna odaklanmaktadır, bu da çok daha örnek bir deneydir. FAHD1'in fare karaciğerinden çıkarılması, bu protokolün zorluklarını ve olası tuzaklarını sunmak için gerçekleştirilir. Genellikle arındırmak istediği proteinin yük...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Protokoldeki kritik adımlar
Proteinlerin işlenmesi için ortak yönergeleri izlemek, buz üzerinde ve ılımlı pH ve tuz koşullarında çalışmak gibi esastır. Proteaz inhibitörlerinin kullanımı yöntem için faydalıdır, proteazom inhibitörlerinin kullanımı şiddetle tavsiye edilir. Numunenin dondurulması ve çözülmesi her zaman protein çökelmesine (en azından kısmen) neden olabilir, bu nedenle ilk protein lizatının çözülmüş herhangi bir alikotu (adım 2) ara vermeden süre...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların rekabet eden finansal çıkarları yoktur.
Teşekkürler
Yazarlar, Ayşe Öztürk ve Eva Albertini'nin teknik yardımları için çok müteşekkirdir. Karaciğer dokusunun oluşumu için kullanılan fareler, Univ.-Doz gözetiminde tutuldu. Dr. Pidder Jansen-Dürr (Innsbruck Üniversitesi Biyomedikal Yaşlanma Araştırmaları Enstitüsü, Rennweg 10, 6020 Innsbruck, Avusturya).
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm filter units | MERCK | SLGP033RS | Millex-HP, 0.22 µm, PES 33 mm, not steril |
| 0.45 µm filter units | MERCK | SLHP033NS | Millex-HP, 0.45 µm, PES 33 mm, not steril |
| 15 mL Falcon tubes | VWR | 734-0451 | centrifugal tubes |
| 50 mL Falcon tubes | VWR | 734-0448 | centrifugal tubes |
| 96-Well UV Microplate | Thermo-Fischer | 8404 | UV/VIS transparent flat-bottom 96 well plates |
| Acrylamide/Bis Solution (40%, 29:1 ratio) | BIO-RAD | #1610147 | 40% acrylamide/bis-acrylamide, 29:1 (3.3% crosslinker) solution for casting polyacrylamide gels |
| ÄKTA FPLC system | GE Healthcare Life Sciences / Cytiva | - | using the FPLC system by GE Healthcare; different custom versions exist; this work used the "ÄKTA pure" system |
| Amicon Ultra-15, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC901024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 15 mL |
| Amicon Ultra-4, PLGC Ultracel-PL Membran, 10 kDa | MERCK | UFC801024 | centrifigal filters for protein enrichment; 10 kDa molecular mass filter; 4 mL |
| Ammonium sulfate powder | MERCK | A4418 | ammonium sulphate for molecular biology, ≥99.0% |
| Ammoniumpersulfat reagent grade, 98% | MERCK | 215589 | Catalyst for acrylamide gel polymerization. |
| Coomassie Brilliant blue R 250 | MERCK | 1125530025 | Coomassie Brilliant blue R 250 (C.I. 42660) for electrophoresis Trademark of Imperial Chemical Industries PLC. CAS 6104-59-2, pH 6.2 (10 g/l, H2O, 25 °C) |
| Dialysis tubing cellulose membrane | MERCK | D9277 | Cellulose membranes for the exchange of buffers via dialysis. |
| Eppendof tubes 1.5 mL | VWR | 525-1042 | microcentrifugal tubes; autoclaved |
| HiLoad 26/600 Superdex 75 pg | GE Healthcare Life Sciences / Cytiva | 28989334 | HiLoad Superdex 75 pg prepacked columns are for high-resolution size exclusion chromatography of recombinant proteins |
| Immun-Blot PVDF Membrane | BIO-RAD | #1620177 | PVDF membranes are protein blotting membranes optimized for fluorescent and multiplex fluorescent applications. |
| Mini Trans-Blot Electrophoretic Transfer Cell | BIO-RAD | #1703930 | Use the Mini Trans-Blot Cell for rapid blotting of Mini-PROTEAN precast and handcast gels. |
| Mini-PROTEAN Tetra Vertical Electrophoresis Cell for Mini Precast Gels | BIO-RAD | #1658004 | 4-gel vertical electrophoresis system, includes electrode assembly, companion running module, tank, lid with power cables, mini cell buffer dam. |
| Mono Q 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516701 | Mono Q columns are strong anion exchange chromatography columns for protein analysis or small scale, high resolution polishing of proteins. |
| Mono S 10/100 GL | GE Healthcare Life Sciences / Cytiva | 17516901 | Mono S columns are strong cation exchange chromatography columns for protein analysis or small scale high resolution polishing of proteins. |
| PageRuler Prestained Protein Ladder, 10 to 180 kDa | Thermo-Fischer | 26616 | A mixture of 10 blue-, orange-, and green-stained proteins (10 to 180 kDa) for use as size standards in protein electrophoresis (SDS-PAGE) and western blotting. |
| Pierce BCA Protein Assay Kit | Thermo-Fischer | 23225 | A two-component, high-precision, detergent-compatible protein assay for determination of protein concentration. |
| Sonifier 250; Ultrasonic Cell Disruptor w/ Converter | Branson | - | New models at https://www.emerson.com/documents/automation/brochure-sonifier-sfx250-sfx550-cell-disruptors-homogenizers-branson-en-us-168180.pdf |
| Swine Anti-Rabbit Immunoglobulins/HRP (affinity isolated) | Agilent Dako | P0399 | The antibody used for horseradish peroxidase conjugation reacts with rabbit immunoglobulins of all classes. |
| TEMED, 1,2-Bis(dimethylamino)ethane, TMEDA | MERCK | T9281 | TEMED (N,N,N′,N′-Tetramethylethylenediamine) is molecule which allows rapid polymerization of polyacrylamide gels. |
| Tube Roller | - | - | A general tube rotator roller; e.g. a new model at https://labstac.com/de/Mixer/Roller/c/71 |
| Tube Rotator | - | - | A general tube rotator wheel; e.g. a new model at https://labstac.com/de/Tube-Roller/p/MT123 |
| ULTRA-TURRAX; T 25 digital | IKA | 0003725000 | New models at https://www.ika.com/de/Produkte-Lab-Eq/Dispergierer-Dipergiergeraet-Homogenisierer-Homogenisator-csp-177/T-25-digital-ULTRA-TURRAX-cpdt-3725000/ |
Referanslar
- Pircher, H., et al. Identification of FAH domain-containing protein 1 (FAHD1) as oxaloacetate decarboxylase. Journal of Biological Chemistry. 290 (11), 6755-6762 (2015).
- Pircher, H., et al. Identification of human Fumarylacetoacetate Hydrolase Domain-containing Protein 1 (FAHD1) as a novel mitochondrial acylpyruvase. Journal of Biological Chemistry. 286 (42), 36500-36508 (2011).
- Kang, T. -W., et al. Senescence surveillance of pre-malignant hepatocytes limits liver cancer development. Nature. 479 (7374), 547-551 (2011).
- Hong, H., Seo, H., Park, W., Kim, K. K. -J. Sequence, structure and function-based classification of the broadly conserved FAH superfamily reveals two distinct fumarylpyruvate hydrolase subfamilies. Environmental Microbiology. 22 (1), 270-285 (2020).
- Timm, D. E., Mueller, H. A., Bhanumoorthy, P., Harp, J. M., Bunick, G. J. Crystal structure and mechanism of a carbon-carbon bond hydrolase. Structure. 7 (9), London, England. 1023-1033 (1999).
- Bateman, R. L., et al. Mechanistic inferences from the crystal structure of Fumarylacetoacetate Hydrolase with a bound phosphorus-based inhibitor. Journal of Biological Chemistry. 276 (18), 15284-15291 (2001).
- Weiss, A. K. H., et al. Structural basis for the bi-functionality of human oxaloacetate decarboxylase FAHD1. Biochemical Journal. 475 (22), 3561-3576 (2018).
- Etemad, S., et al. Oxaloacetate decarboxylase FAHD1 - a new regulator of mitochondrial function and senescence. Mechanisms of Ageing and Development. 177, 22-29 (2019).
- Weiss, A. K. H., et al. Regulation of cellular senescence by eukaryotic members of the FAH superfamily - A role in calcium homeostasis. Mechanisms of Ageing and Development. 190, 111284(2020).
- Petit, M., Koziel, R., Etemad, S., Pircher, H., Jansen-Dürr, P. Depletion of oxaloacetate decarboxylase FAHD1 inhibits mitochondrial electron transport and induces cellular senescence in human endothelial cells. Experimental Gerontology. 92, 7-12 (2017).
- Wiley, C. D., et al. Mitochondrial dysfunction induces senescence with a distinct secretory phenotype. Cell Metabolism. 23 (2), 303-314 (2016).
- Weiss, A. K. H., et al. Expression, purification, crystallization, and enzyme assays of Fumarylacetoacetate Hydrolase Domain-containing proteins. Journal of Visualized Experiments: JoVE. (148), e59729(2019).
- Weiss, A. K. H., et al. Inhibitors of Fumarylacetoacetate Hydrolase Domain Containing Protein 1 (FAHD1). Molcules. 26 (16), 5009(2021).
- Mizutani, H., Kunishima, N. Purification, crystallization and preliminary X-ray analysis of the fumarylacetoacetase family member TTHA0809 from Thermus thermophilus HB8. Acta Crystallographica Section F Structural Biology and Crystallization Communications. 63 (9), 792-794 (2007).
- Lee, C. H. A simple outline of methods for protein isolation and purification. Endocrinology and Metabolism. 32 (1), Seoul, Korea. 18-22 (2017).
- Amer, H. E. A. Purification of proteins: Between meaning and different methods). Proteomics Technologies and Applications. , (2019).
- Niu, L., Yuan, H., Gong, F., Wu, X., Wang, W. Protein extraction methods shape much of the extracted proteomes. Frontiers in Plant Science. 9, 802(2018).
- Gordon, J. A. Use of vanadate as protein-phosphotyrosine phosphatase inhibitor. Methods in Enzymology. 201, 477-482 (1991).
- Gallagher, S. R. SDS-polyacrylamide gel electrophoresis (SDS-PAGE). Current Protocols in Essential Laboratory Techniques. , (2012).
- Ahmed, U., Saunders, G. Effect of pH on Protein Size Exclusion Chromatography. , Available from: https://www.agilent.com/cs/library/applications/5990-8138EN.pdf (2011).
- Sørensen, B. K., et al. Silver staining of proteins on electroblotting membranes and intensification of silver staining of proteins separated by polyacrylamide gel electrophoresis. Analytical Biochemistry. 304 (1), 33-41 (2002).
- Fagerberg, L., et al. Analysis of the human tissue-specific expression by genome-wide integration of transcriptomics and antibody-based proteomics. Molecular & Cellular Proteomics. 13 (2), 397-406 (2014).
- Cytiva Life Fundamentals of size exclusion chromatography. , Available from: https://www.cytivalifesciences.com/en/us/solutions/protein-research/knowledge-center/protein-purification-methods/size-exclusion-chromatography (2022).
- Rosano, G. L., Ceccarelli, E. A. Recombinant protein expression in Escherichia coli: advances and challenges. Frontiers in Microbiology. 5, 172(2014).
- Rosano, G. L., Morales, E. S., Ceccarelli, E. A. New tools for recombinant protein production in Escherichia coli: A 5-year update. Protein Science: A Publication of the Protein Society. 28 (8), 1412-1422 (2019).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır