このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
酸化鉄ナノ粒子投与後の腫瘍T2*緩和時間の測定
要約
外部ソフトウェアを使用して腫瘍のT2*緩和時間を定量化するための標準化されたプロトコルを提示します。マルチエコー勾配エコー画像を取得してソフトウェアに入力し、腫瘍T2*マップを作成し、腫瘍T2*緩和時間を測定します。
要約
T2*弛緩測定法は、磁気共鳴画像法(MRI)を用いて腫瘍組織に対する超常磁性酸化鉄ナノ粒子の効果を測定するために確立された方法の1つです。酸化鉄ナノ粒子は、腫瘍のT1、T2、およびT2*緩和時間を短縮します。T1効果はナノ粒子のサイズと組成に基づいて変化しますが、T2およびT2*効果は通常優勢であり、T2*測定は臨床状況で最も時間効率が良いです。ここでは、マルチエコー勾配エコーシーケンス、外部ソフトウェア、およびスキャナーに依存しないソフトウェアでT2*マップを作成するための標準化されたプロトコルを使用して、腫瘍T2*緩和時間を測定するアプローチを紹介します。これにより、異なる臨床スキャナー、異なるベンダー、および共同臨床研究作業からの画像データ(すなわち、マウスモデルおよび患者で得られた腫瘍T2*データ)の比較が容易になります。ソフトウェアをインストールしたら、プラグインマネージャーからT2 Fit Mapプラグインをインストールする必要があります。このプロトコルは、マルチエコー勾配エコーシーケンスのソフトウェアへのインポートから、色分けされたT2*マップの作成、腫瘍T2*緩和時間の測定まで、段階的な手順の詳細を提供します。このプロトコルは、あらゆる身体部分の固形腫瘍に適用でき、患者の前臨床画像データと臨床データに基づいて検証されています。これにより、多施設臨床試験における腫瘍T2*測定が容易になり、共臨床および多施設データ解析における腫瘍T2*測定の標準化と再現性が向上する可能性があります。
概要
磁気共鳴画像法(MRI)を用いた体の様々な組織における腫瘍T2*緩和時間の非侵襲的定量化は広く確立されています1。この記事の理論的根拠は、Osirix2のようなスキャナーソフトウェアに依存しない腫瘍T2*緩和時間の測定のためのプロトコルを提供することです。これにより、さまざまなセンター、さまざまなスキャナー、さまざまなベンダーからの画像データを統一して分析できます。実際、何千人ものユーザーが同じアプローチを使用する可能性があり、それによって腫瘍T2*測定の標準化が促進されます。T2*測定は、神経放射線科医、心臓画像の専門家、腹部画像の専門家などによってさまざまな目的で使用されます。組織T2 *緩和時間を測定するためのMRIパルスシーケンスは、頭蓋内出血3、肝鉄含有量1,4、および心臓鉄含有量5,6などの評価に適用および最適化されています。他の研究者は、T2 *測定値を使用して、悪性腫瘍における酸化鉄ナノ粒子蓄積の定量的推定値を生成しました7,8。ただし、これらの以前のアプローチの多くは、特定の機関での使用または特定のスキャナーで取得したデータの処理に限定されていた機関向けソフトウェアまたは特定のスキャナーソフトウェアを使用していました。ここでは、マルチエコー勾配エコー画像を生成できるスキャナーからの前臨床または臨床MRIデータに基づいて、腫瘍T2*マップと腫瘍T2*緩和時間を生成するための普遍的に適用可能なアプローチについて説明します。必要な勾配エコーシーケンスは、最初のエコー時間が非常に短く、エコー間間隔が近い必要があります9,10。次に、マルチエコー勾配エコー画像を外部ソフトウェアに供給し、腫瘍T2*マップを計算し、腫瘍T2*緩和時間を測定します。外部モデルのT2*減衰曲線のT2 Fit Mapプラグインは、S(t) = So e-t/T2* 11への単指数適合として、S(t)は特定の時間tにおける信号またはプロセス値を表します。S 0は、t =0における信号またはプロセスの初期値であり、tは時間を表します。見かけの横緩和時間としても知られるT2*は、信号またはプロセスの減衰速度を特徴付ける。eは自然対数の底です(約2.71828に等しい)。この式は指数関数的減衰を表し、信号またはプロセスは減衰率T2 *の関数として時間とともに減少します。T2*の値が大きいほど減衰速度は遅くなり、その逆も同様です。同じソフトウェアを使用して、マルチエコースピンエコー画像を入力し、T2減衰曲線をS(t)= So e-t/T2にフィッティングすることで腫瘍T2値を生成することもできます。カーブフィットは、一定のオフセットを組み込むことなく、外部ソフトウェアを使用して実行されました。両方の減衰曲線は単一の指数関数的挙動を示し、T2*はT2と比較して短い持続時間を示します。
ヘモジデローシスおよびヘモクロマトーシスの患者では、組織生検による肝臓鉄含有量の定量化がゴールドスタンダードであるのに対し、非侵襲的MRイメージングは、ベースライン値を確立し、経時的な変化を非侵襲的に監視するためのポイントオブケアです12,13。肝臓鉄定量のためのT2*マップの生成は十分に確立されていますが4、腫瘍T2*緩和時間を測定するための標準化されたプロトコルはありません。T2*マップはスキャナーソフトウェアでも生成できますが、特定のスキャナーとベンダーに限定されます。腫瘍学の分野では、特定の患者の連続画像検査が異なるスキャナーで行われることが多く、多施設MRIデータは、さまざまなスキャナーおよびさまざまなベンダーからの画像研究に基づいて取得されます。さらに、コクリニカルイメージング研究はますます実施されており、患者のMRIデータと腫瘍をシミュレートするマウスモデルの比較が必要です。このプロトコルの目的は、スキャナーソフトウェアに依存しない腫瘍T2*緩和時間を測定するためのプロトコルを提供することです。これにより、異なるセンターや異なるスキャナからの画像データを均一に分析することができます。実際、何千人ものユーザーが同じアプローチを使用する可能性があり、それによって腫瘍T2*測定の標準化と再現性が向上します。当社のプロトコルは、インターネットからダウンロードできる外部ソフトウェアを利用しています。マルチエコー勾配エコー画像がソフトウェアに供給され、単指数減衰の式に適合してT2*マップが生成され、オペレーターが定義した関心領域(ROI)5を使用して腫瘍T2*緩和時間を測定できます。酸化鉄ナノ粒子は異なる用量で注入することができます14、私たちの研究では、患者はフェルモキシトール注射を受けました (30 mg / mL)17 mLの容量に510 mgの元素鉄を含む、体重1kgあたり5 mgの元素鉄の投与量で。続いて、データ取得のための設定されたシーケンスパラメータを使用して、マルチエコー勾配エコーシーケンス15を取得しました。
プロトコル
このプロトコルは、前向き臨床試験および共同臨床研究のために生成されました。この研究は、医療保険の相互運用性と説明責任に関する法律(HIPAA)に準拠しており、スタンフォード大学の治験審査委員会(IRB)によって承認されました。すべての患者またはその法的に認可された代理人は書面によるインフォームドコンセントに署名し、7歳から18歳までのすべての子供は同意書に署名しました。
1. T2フィットマッププラグインのインストールと起動
- Osirixソフトウェアを起動します。プラグインマネージャーからT2 Fit Mapプラグインをインストールし、ソフトウェアを再起動します。
- メニュー バーで、[プラグイン] ボタンをクリックします。ドロップダウンメニューをクリックし、[ プラグインパッケージのインストール ]を選択します(図1)。
- プラグインマネージャーがロードされたら、ドロップダウンメニューから使用可能なプラグインを選択し、 T2 Fit Map を選択します(図2)。
- [ダウンロードとインストール]をクリックします。プラグインマネージャーを閉じて、ソフトウェアを再起動します。
- マルチエコー勾配エコーシーケンス画像をDICOMファイルとしてソフトウェアにロードします。
- マウスボタンの機能を変更して、 関心領域 (ROI)を描画します(図3)。
- このマウスボタン機能を使用して、必要なROIの形状を定義します: 楕円形 または 閉じたポリゴン、またはドロップダウンメニューから目的の形状を選択します(図4)。
- 異なるエコー時間(TE)で必要な画像にROIを描画します。
- T2* マップが必要な TE が異なるすべての画像で ROI を選択します。
- [ プラグイン] ボタンをクリックし、ドロップダウン メニューから [ 画像フィルター ] を選択して、[ T2 Fit Map] を選択します。
- T2フィットマップをクリックします。ダイアログボックスが開きます。[マップの生成](ダイアログボックスの下部にあります)をクリックします(図5)。
注: フィット曲線は、さまざまな TE (ms) で選択した ROI の最小、平均、および最大 T2* 値を使用して生成されます。平均T2*値が計算され、曲線の下に表示されます(図6)。
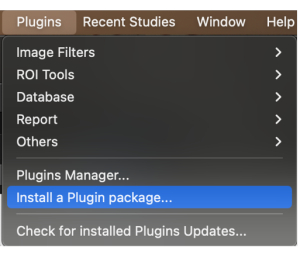
図1:ドロップダウンメニューから[プラグインパッケージのインストール]を選択します。 この図の拡大版を表示するには、ここをクリックしてください。
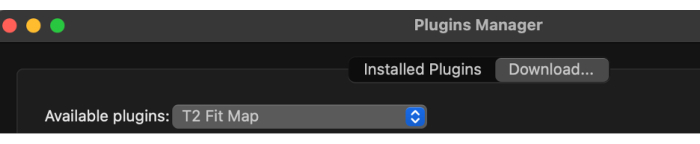
図2:利用可能なプラグインから「T2フィットマップ」を選択する。 この図の拡大版を表示するには、ここをクリックしてください。
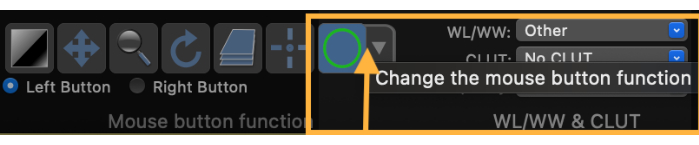
図3:マウスボタン機能を変更して関心領域(ROI)を描画する方法を示すスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
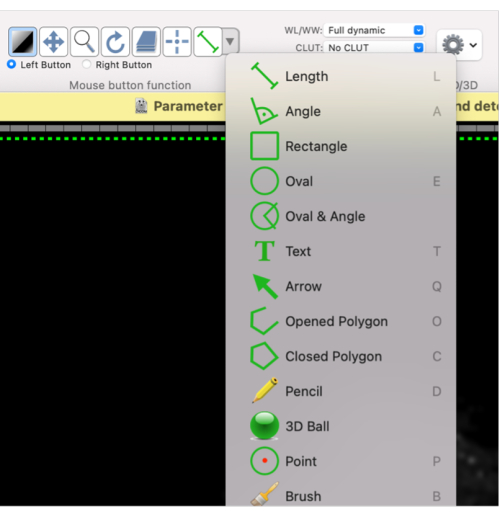
図4:ROIにさまざまな形状を選択する方法を示すスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
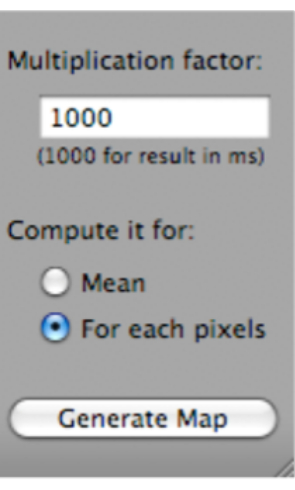
図5:「T2フィットマップ」を選択した後に「マップの生成」を選択する方法を示すスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
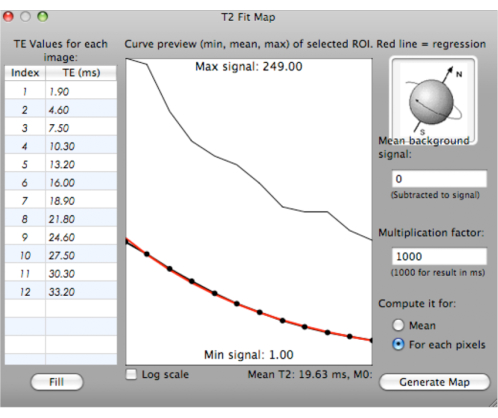
図6:T2*値のフィット曲線の生成を示すスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
2. マスクの定義を用いたノイズの排除
注:パラメトリックマップの計算に使用されるT2map_MSMEデータの最初のエコーにマスクを定義するには、T2*値の計算の最初のエコー信号のしきい値を低く設定します(T2*マップボリュームは、最初のマルチスピンマルチエコー(MSME)エコーで正確な計算には信号が低すぎるピクセルを除外するようになりました。しきい値を大きくしてより多くのピクセルを除外したり、小さくしてより多くのピクセルを除外したりできます)。
- パラメトリックデータ外の画像系列でマスクROIを定義するには、目的の系列(TE = 15のT2map_MSMEの最初のエコーなど)を開き、スライスを選択します。
- ROI ドロップダウン メニューの下部にある [ 地域の拡大...] を選択します。
- [ 3D成長領域] ラジオボタンを選択します(図7)。
- [アルゴリズム] ドロップダウン メニューで、[ しきい値 (下限/上限)] を選択します。
- 下限閾値と上限閾値をそれぞれ対側のふくらはぎの筋肉信号の0とX%に設定します(たとえば、腫瘍ROIの最もスペックルをマスクし、最も評価可能な腫瘍T2(*)を残す値にしきい値を設定します)。
- 必要に応じて ROI 名を設定します。
- 画像をクリックして、ROI成長の種を配置します。
- [ コンピューティング] ボタンをクリックします。
- ROIメニューで、[ このシリーズのすべてのROIを保存] を選択します(図8)。
注:これで、パラメトリックマップからマスクする領域を定義するROIが保存され、パラメトリックデータに適用できるようになりました。 - 4Dビューアでパラメトリックデータセットを開きます。
- ROI メニューで、 ROI のインポート を選択します。
注:マスクROIは、最初のパラメトリックシリーズになりました。 - ROIが4Dではなく最初の3Dボリュームにあることを確認します。
- マスクを適用してデータをマップします。これを行うには、[ROI] ドロップダウン メニューの下部にある [ ピクセル値の設定] を選択します。次に、 [ 適用先: 同じ名前の ROI] を選択します (図 9)。
- 4Dシリーズに伝播チェックボックスにチェックを入れます。
- ROIの内側にあるピクセルを設定します。
- この新しい値に設定します: 0 として。
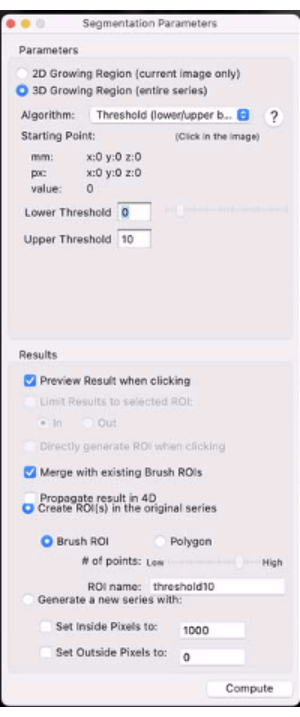
図7:セグメンテーションパラメータを示すスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
図8:「このシリーズのすべてのROIを保存...」を選択する方法を示すスクリーンショット。この図の拡大版を表示するには、ここをクリックしてください。
図9:「ピクセル値の設定」に入力する値を示すスクリーンショット。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
私たちのプロトコルにより、マルチエコー勾配エコーシーケンス、外部ソフトウェア、およびT2*マップを作成するためのプラグインに基づいて、腫瘍のT2*緩和時間を測定することができます。プロトコル内の重要なステップは、非常に短いTEを持つマルチエコー勾配エコーシーケンスをスキャンプロトコルに含めることと、外部ソフトウェアを使用したマルチエコー勾配エコー画像の単指数?...
開示事項
著者は開示するものは何もありません。
謝辞
この作業の一部は、国立がん研究所からの助成金、助成金番号U24CA264298によってサポートされました。スタンフォード大学のルーカス研究センターでのPET / MRIスキャンの取得を支援してくれたPET / MRI代謝サービスセンターのDawn Holley、Kim Halbert、およびMehdi Khalighiに感謝します。このプロジェクトに関する貴重なインプットと議論をしてくれたDaldrup-Linkラボのメンバーに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| OsiriX | Pixmeo SARL | https://www.osirix-viewer.com/ | |
| 3T GE MR 750 | GE Healthcare, Chicago, IL | ||
| FERAHEME (ferumoxytol injection) | AMAG Pharmaceuticals, Inc. 1100 Winter Street Waltham, MA 02451 |
参考文献
- Garbowski, M. W., et al. Biopsy-based calibration of T2* magnetic resonance for estimation of liver iron concentration and comparison with R2 Ferriscan. Journal of Cardiovascular Magnetic Resonance. 16 (1), 40 (2014).
- . OsiriXDICOM Viewer Available from: https://www.osirix-viewer.com/ (2023)
- Linfante, I., Llinas, R. H., Caplan, L. R., Warach, S. MRI features of intracerebral hemorrhage within 2 hours from symptom onset. Stroke. 30 (11), 2263-2267 (1999).
- Labranche, R., et al. Liver iron quantification with MR imaging: a primer for radiologists. Radiographics. 38 (2), 392-412 (2018).
- Triadyaksa, P., Oudkerk, M., Sijens, P. E. Cardiac T2* mapping: Techniques and clinical applications. Journal of Magnetic Resonance Imaging. 52 (5), 1340-1351 (2020).
- Anderson, L. J., et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. European Heart Journal. 22 (23), 2171-2179 (2001).
- Seo, M., et al. Estimation of T2* relaxation time of breast cancer: correlation with clinical, imaging and pathological features. Korean Journal of Radiology. 18 (1), 238-248 (2017).
- Serkova, N. J. Nanoparticle-based magnetic resonance imaging on tumor-associated macrophages and inflammation. Frontiers in Immunology. 8, 590 (2017).
- Chen, X., Qiu, B. A pilot study of short T2* measurements with ultrashort echo time imaging at 0.35 T. BioMedical Engineering OnLine. 17 (1), 70 (2018).
- Yi, J., Lee, Y. H., Song, H. -. T., Suh, J. -. S. Comparison of T2* between regular echo time and ultrashort echo time with 3D cones at 3 tesla for knee meniscus. Medicine. 97 (48), e13443 (2018).
- Weishaupt, D., et al. . How Does MRI Work?: An Introduction to the Physics and Function of Magnetic Resonance Imaging. , (2006).
- Wood, J. C. Guidelines for quantifying iron overload. Hematology. American Society of Hematology. 2014 (1), 210-215 (2014).
- Branisso, P. P. F., et al. Non-invasive methods for iron overload evaluation in dysmetabolic patients. Annals of Hepatology. 27 (4), 100707 (2022).
- Schaefer, B., Meindl, E., Wagner, S., Tilg, H., Zoller, H. Intravenous iron supplementation therapy. Molecular Aspects of Medicine. 75, 100862 (2020).
- Haacke, E. M., Mittal, S., Wu, Z., Neelavalli, J., Cheng, Y. -. C. N. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1. AJNR: American Journal of Neuroradiology. 30 (1), 19-30 (2009).
- . T2 Mapping Slicer Extension Available from: https://github.com/gattia/Slicer-T2mapping (2021)
- 3D Slicer image computing platform. 3D Slicer Available from: https://slicer.org/ (2023)
- Messroghli, D. R., et al. An open-source software tool for the generation of relaxation time maps in magnetic resonance imaging. BMC Medical Imaging. 10, 16 (2010).
- . GNU Octave Available from: https://octave.org/ (2023)
- Chavhan, G. B., Babyn, P., Thomas, B., Shroff, M., Haacke, E. M. Principles, techniques, and applications of T2*-based MR imaging and its special applications. Radiographics. 29 (5), 1433-1449 (2009).
- Aghighi, M., et al. Magnetic resonance imaging of tumor associated macrophages: clinical translation. Clinical Cancer Research. 24 (17), 4110-4118 (2018).
- Trujillo-Alonso, V., et al. FDA-approved ferumoxytol displays anti-leukaemia efficacy against cells with low ferroportin levels. Nature Nanotechnology. 14 (6), 616-622 (2019).
- Ishiyama, K., et al. Tumor-liver contrast and subjective tumor conspicuity of respiratory-triggered T2-weighted fast spin-echo sequence compared with T2*-weighted gradient recalled-echo sequence for ferucarbotran-enhanced magnetic resonance imaging of hepatic malignant tumors. Journal of Magnetic Resonance Imaging. 27 (6), 1322-1326 (2008).
- Hirokawa, Y., et al. Hepatic lesions: improved image quality and detection with the periodically rotated overlapping parallel lines with enhanced reconstruction technique-evaluation of SPIO-enhanced T2-weighted MR images. Radiology. 251 (2), 388-397 (2009).
- Tonan, T., et al. Evaluation of small (≤2cm) dysplastic nodules and well-differentiated hepatocellular carcinomas with ferucarbotran-enhanced MRI in a 1.0-T MRI unit: Utility of T2*-weighted gradient echo sequences with an intermediate-echo time. European Journal of Radiology. 64 (1), 133-139 (2007).
- Rief, M., et al. Detection of focal liver lesions in unenhanced and ferucarbotran-enhanced magnetic resonance imaging: a comparison of T2-weighted breath-hold and respiratory-triggered sequences. Magnetic Resonance Imaging. 27 (9), 1223-1229 (2009).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved
