Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Измерение времени релаксации опухоли T2* после введения наночастиц оксида железа
В этой статье
Резюме
Мы представляем стандартизированный протокол для количественной оценки времени релаксации T2* опухолей с использованием внешнего программного обеспечения. Эхо-изображения с мультиэхо-градиентом собираются и передаются в программное обеспечение для создания карт опухоли T2 * и измерения времени релаксации опухоли T2 *.
Аннотация
Релаксометрия T2* является одним из установленных методов измерения влияния суперпарамагнитных наночастиц оксида железа на опухолевые ткани с помощью магнитно-резонансной томографии (МРТ). Наночастицы оксида железа сокращают время релаксации опухолей T1, T2 и T2*. В то время как эффект Т1 варьируется в зависимости от размера и состава наночастиц, эффекты Т2 и Т2* обычно преобладают, а измерения Т2 * являются наиболее эффективными по времени в клиническом контексте. Здесь мы представляем наш подход к измерению времени релаксации опухоли T2* с использованием эхо-последовательностей с мультиэхо-градиентом, внешнего программного обеспечения и стандартизированного протокола для создания карты T2* с помощью программного обеспечения, независимого от сканера. Это облегчает сравнение данных визуализации с разных клинических сканеров, разных поставщиков и совместных клинических исследований (т. е. данных об опухоли T2 *, полученных на мышиных моделях и у пациентов). После установки программного обеспечения необходимо установить плагин T2 Fit Map из менеджера плагинов. Этот протокол предоставляет пошаговые процедурные детали, от импорта эхо-последовательностей градиента с несколькими эхо-сигналами в программное обеспечение до создания карт T2* с цветовой кодировкой и измерения времени релаксации опухоли T2*. Протокол может быть применен к солидным опухолям в любой части тела и был проверен на основе данных доклинической визуализации и клинических данных у пациентов. Это может облегчить измерения опухоли T2* для многоцентровых клинических испытаний и улучшить стандартизацию и воспроизводимость измерений опухоли T2* при совместном клиническом и многоцентровом анализе данных.
Введение
Широко распространена неинвазивная количественная оценка времени релаксации опухоли T2* в различных тканях организма с помощью магнитно-резонансной томографии (МРТ)1. Обоснование этой статьи состоит в том, чтобы предоставить протокол для измерения времени релаксации опухоли T2*, который не зависит от программного обеспечения сканера, такого как Osirix2. Это позволит проводить единообразный анализ данных визуализации из разных центров, разных сканеров и разных поставщиков. Действительно, тысячи пользователей потенциально могут использовать тот же подход, тем самым увеличивая стандартизацию измерений опухоли T2 *. Измерения T2* используются, в частности, для различных целей нейрорадиологами, специалистами по визуализации сердца и специалистами по визуализации брюшной полости. Последовательности импульсов МРТ для измерения времени релаксации T2* тканей были применены и оптимизированы для оценки внутричерепных кровотечений3, содержания железа в печени1,4 и содержанияжелеза в сердце 5,6, среди прочего. Другие исследователи использовали измерения T2* для получения количественных оценок накопления наночастиц оксида железа в злокачественных опухолях 7,8. Однако во многих из этих предыдущих подходов использовалось институциональное программное обеспечение или специальное программное обеспечение для сканирования, которое было бы ограничено использованием в конкретном учреждении или для обработки данных, полученных на конкретном сканере. Здесь мы описываем универсально применимый подход к созданию карт опухоли T2 * и времени релаксации опухоли T2 * на основе доклинических или клинических данных МРТ с любого сканера, который может генерировать эхо-изображения с мультиэхо-градиентом. Требуемая градиентная эхо-последовательность должна иметь очень короткое время первого эха и близкий интервал между эхо-сигналами 9,10. Затем эхо-изображения градиентного эхо-сигнала с несколькими эхо-градиентами передаются во внешнее программное обеспечение, рассчитываются карты опухоли T2* и измеряется время релаксации опухоли T2*. Плагин T2 Fit Map в кривых затухания T2* внешних моделей как моноэкспоненциальная подгонка к S(t) = So e-t/T2* 11, где S(t) представляет собой значение сигнала или процесса в данный момент времени t; S 0 – начальное значение сигнала или процесса при t =0; t обозначает время; T2*, также известное как кажущееся время поперечной релаксации, характеризует скорость затухания сигнала или процесса; а e — основание натурального логарифма (приблизительно равное 2,71828). Уравнение описывает экспоненциальный затухание, при котором сигнал или процесс уменьшается с течением времени в зависимости от скорости распада T2 *. Чем больше значениеT2*, тем медленнее скорость распада, и наоборот. Это же программное обеспечение также может быть использовано для ввода изображений спинового эха с несколькими эхо-сигналами и генерации значений Т2 опухоли путем подгонки кривой распада Т2 к S (t) = So e-t / T2. Подгонка кривой была выполнена с помощью внешнего программного обеспечения, без учета постоянного смещения. Обе кривые распада демонстрируют одинарное экспоненциальное поведение, при этом T2* демонстрирует более короткую продолжительность по сравнению с T2.
У пациентов с гемосидерозом и гемохроматозом количественная оценка содержания железа в печени с помощью биопсии тканей является золотым стандартом, тогда как неинвазивная МРТ является точкой оказания помощи для установления исходных значений и неинвазивного мониторинга изменений с течением времени12,13. В то время как создание карт T2* для количественного определения железа печени хорошо известно4, не существует стандартизированного протокола для измерения времени релаксации опухоли T2 *. Хотя карты T2* также могут быть сгенерированы программным обеспечением сканера, оно ограничено конкретным сканером и поставщиком. В области онкологии серийные визуализирующие исследования данного пациента часто происходят на разных сканерах, а данные многоцентровой МРТ собираются на основе визуализирующих исследований от разных сканеров и разных поставщиков. Кроме того, все чаще внедряются совместные клинические исследования визуализации, которые требуют сравнения данных МРТ пациентов и мышиных моделей, которые имитируют их опухоль. Целью этого протокола является предоставление протокола для измерения времени релаксации опухоли T2*, которое не зависит от программного обеспечения сканера. Это позволит единообразно анализировать данные визуализации из разных центров и разных сканеров. Действительно, тысячи пользователей потенциально могут использовать тот же подход, тем самым повышая стандартизацию и воспроизводимость измерений опухоли T2*. Наш протокол использует внешнее программное обеспечение, которое можно загрузить из Интернета. Эхо-изображения градиента с мультиэхо-градиентом вводятся в программное обеспечение и подгоняются под формулу моноэкспоненциального распада для создания карты T2*, на которой можно измерить время релаксации опухоли T2*, используя определяемые оператором области интереса (ROI)5. Наночастицы оксида железа можно вводить в разных дозах14, В нашем исследовании пациент получил инъекцию ферумокситола (30 мг / мл), содержащую 510 мг элементарного железа в объеме 17 мл, в дозировке 5 мг элементарного железа на кг массы тела. Впоследствии были получены эхо-последовательности с мультиэхо-градиентом,15 с использованием заданных параметров последовательности для сбора данных.
протокол
Этот протокол был разработан для проспективного клинического испытания и совместных клинических исследований. Исследование соответствовало Закону о переносимости и подотчетности медицинского страхования (HIPAA) и было одобрено институциональным наблюдательным советом Стэнфордского университета (IRB). Все пациенты или их законные представители подписали письменное информированное согласие, а все дети в возрасте от 7 до 18 лет подписали форму согласия.
1. Установка и запуск плагина T2 Fit Map
- Запустите программное обеспечение Osirix. Установите плагин T2 Fit Map из менеджера плагинов и перезапустите программное обеспечение.
- В строке меню нажмите кнопку Плагины. Нажмите на выпадающее меню и выберите Установить пакет плагина (рисунок 1).
- После загрузки менеджера плагинов выберите доступные плагины из выпадающего меню, а затем T2 Fit Map (рисунок 2).
- Нажмите «Загрузить и установить». Закройте менеджер плагинов и перезапустите программное обеспечение.
- Загрузите изображения эхо-последовательности градиента с несколькими эхо-сигналами в виде файлов DICOM в программное обеспечение.
- Измените функцию кнопки мыши, чтобы нарисовать область интереса (ROI) (рис. 3).
- Используя эту функцию мыши, определите фигуру для требуемой рентабельности инвестиций: выберите « Овал » или «Замкнутый многоугольник» или желаемую фигуру из выпадающего меню (рис. 4).
- Рисуйте рентабельность инвестиций в требуемых изображениях с разным временем эха (TE).
- Выберите ROI на всех изображениях с различными TE, для которых требуется карта T2*.
- Нажмите кнопку « Подключаемые модули », выберите « Фильтры изображений » в раскрывающемся меню, а затем выберите «T2 Fit Map».
- Нажмите на T2 Fit Map. Откроется диалоговое окно; нажмите на кнопку Generate Map (которая находится в нижней части диалогового окна) (рисунок 5).
ПРИМЕЧАНИЕ: Кривая подгонки генерируется с минимальными, средними и максимальными значениями T2* для выбранных ROI с различными TE (мс). Среднее значение T2* вычисляется и отображается под кривой (рис. 6).
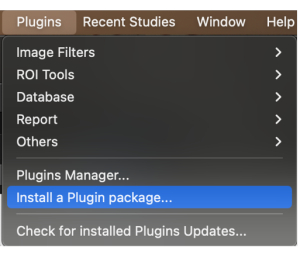
Рисунок 1: Выбор 'Install a plugin package' из выпадающего меню. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
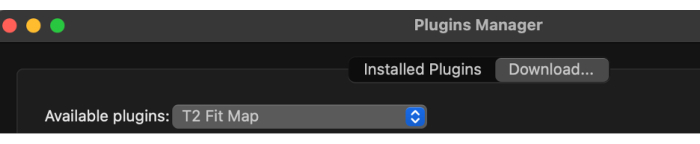
Рисунок 2: Выбор 'T2 Fit Map' из доступных плагинов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
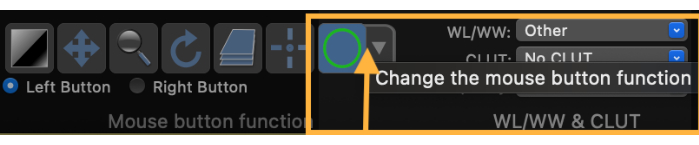
Рисунок 3: Скриншот, демонстрирующий, как изменить функцию кнопки мыши, чтобы нарисовать интересующую область (ROI). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
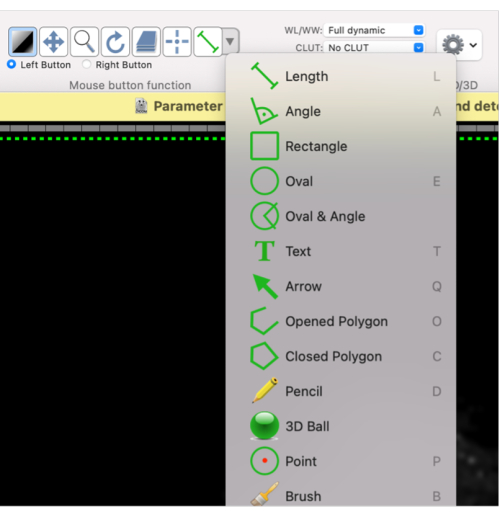
Рисунок 4: Скриншот, показывающий, как выбрать различные формы для ROI. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
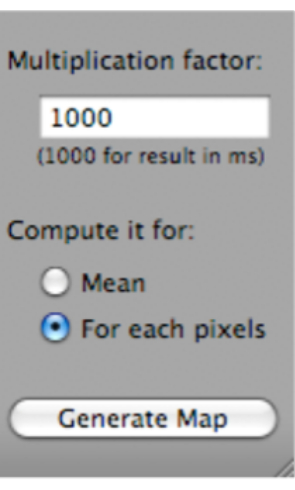
Рисунок 5: Скриншот, показывающий, как выбрать «Создать карту» после выбора «T2 Fit Map». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
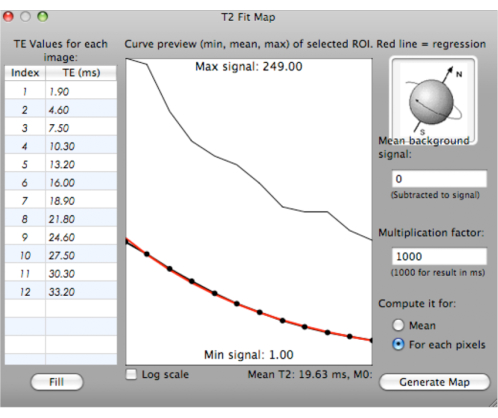
Рисунок 6: Скриншот, показывающий генерацию кривой подгонки для значений T2*. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
2. Исключение шума с помощью определения маски
ПРИМЕЧАНИЕ: Чтобы определить маску на первом эхо-сигнале T2map_MSME данных, используемых для вычисления параметрических карт, установите более низкий порог сигнала первого эха для вычисления значения T2* (объем карты T2* теперь будет исключать пиксели со слишком низкими сигналами для точного расчета при первом многоспиновом эхо-эхо (MSME). Пороговое значение может быть увеличено, чтобы исключить больше пикселей, или уменьшено, чтобы включить больше пикселей).
- Чтобы определить ROI маски для ряда изображений за пределами параметрических данных, откройте нужный ряд (например, первое эхо T2map_MSME с TE = 15) и выберите срез.
- В нижней части раскрывающегося меню ROI выберите Регион роста....
- Выберите переключатель 3D Growing Region... (рис. 7).
- В раскрывающемся меню Алгоритм выберите Порог (нижняя/верхняя границы).
- Установите нижний и верхний пороги на 0 и X% сигнала контралатеральной икроножной мышцы соответственно (например, установите порог на значение, которое замаскирует наибольшее количество пятен в ROI опухоли и оставит наиболее оцениваемые T2 (*) опухоли).
- Установите желаемое имя ROI.
- Нажмите на изображение, чтобы разместить семя для выращивания ROI.
- Нажмите кнопку Вычисление .
- В меню ROI выберите Save All ROI of this Series... (рисунок 8).
ПРИМЕЧАНИЕ: Теперь ROI, определяющий область для маскировки из параметрических карт, сохранен и может быть применен к параметрическим данным. - Откройте параметрический набор данных в средстве просмотра 4D.
- В меню ROI выберите Import ROI(s)....
ПРИМЕЧАНИЕ: ROI маски теперь находится в первой параметрической серии. - Убедитесь, что рентабельность инвестиций находится в первом 3D-объеме, а не в 4D.
- Примените маску для сопоставления данных. Для этого в нижней части раскрывающегося меню ROI выберите Set Pixel Values To. Затем выберите «Применить к: ROI с тем же именем...» (рис. 9).
- Установите флажок « Распространить на серию 4D ».
- Установите пиксели, которые находятся внутри ROI.
- Задайте для параметра To this new value: as 0.
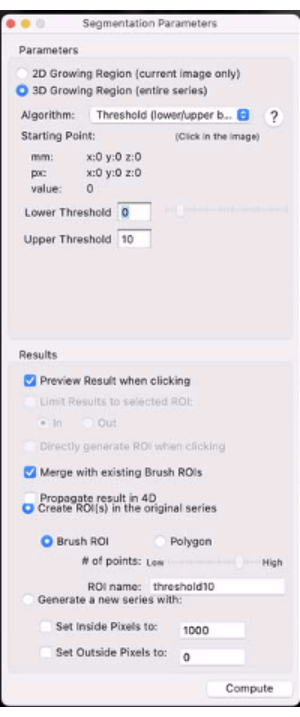
Рисунок 7: Скриншот с параметрами сегментации. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Рисунок 8: Скриншот, показывающий, как выбрать «Сохранить все ROI этой серии...». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
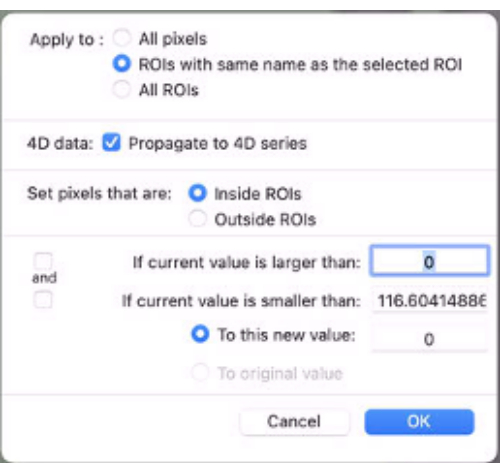
Рисунок 9: Снимок экрана, показывающий значения, которые должны быть введены в «Set Pixel Values To». Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты

Рисунок 10: Карта T2* с ROI, наложенная на метастатическое поражение остеосаркомы, которая показывает среднее значение и стандартное отклонение T2 *.
Обсуждение
Наш протокол позволяет нам измерять время релаксации опухоли T2* на основе последовательностей градиента и эха с несколькими эхо-сигналами, внешнего программного обеспечения и плагина для создания карт T2*. Важнейшими шагами в рамках протокола являются включение в протокол сканировани?...
Раскрытие информации
Авторам раскрывать нечего.
Благодарности
Эта работа была частично поддержана грантом Национального института рака, грант No U24CA264298. Мы благодарим Дон Холли, Кима Хэлберта и Мехди Халиги из Центра метаболического обслуживания ПЭТ/МРТ за их помощь в приобретении ПЭТ/МРТ-сканирования в Исследовательском центре Лукаса в Стэнфорде. Мы благодарим сотрудников лаборатории Daldrup-Link за ценный вклад и обсуждение этого проекта.
Материалы
| Name | Company | Catalog Number | Comments |
| OsiriX | Pixmeo SARL | https://www.osirix-viewer.com/ | |
| 3T GE MR 750 | GE Healthcare, Chicago, IL | ||
| FERAHEME (ferumoxytol injection) | AMAG Pharmaceuticals, Inc. 1100 Winter Street Waltham, MA 02451 |
Ссылки
- Garbowski, M. W., et al. Biopsy-based calibration of T2* magnetic resonance for estimation of liver iron concentration and comparison with R2 Ferriscan. Journal of Cardiovascular Magnetic Resonance. 16 (1), 40 (2014).
- . OsiriXDICOM Viewer Available from: https://www.osirix-viewer.com/ (2023)
- Linfante, I., Llinas, R. H., Caplan, L. R., Warach, S. MRI features of intracerebral hemorrhage within 2 hours from symptom onset. Stroke. 30 (11), 2263-2267 (1999).
- Labranche, R., et al. Liver iron quantification with MR imaging: a primer for radiologists. Radiographics. 38 (2), 392-412 (2018).
- Triadyaksa, P., Oudkerk, M., Sijens, P. E. Cardiac T2* mapping: Techniques and clinical applications. Journal of Magnetic Resonance Imaging. 52 (5), 1340-1351 (2020).
- Anderson, L. J., et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. European Heart Journal. 22 (23), 2171-2179 (2001).
- Seo, M., et al. Estimation of T2* relaxation time of breast cancer: correlation with clinical, imaging and pathological features. Korean Journal of Radiology. 18 (1), 238-248 (2017).
- Serkova, N. J. Nanoparticle-based magnetic resonance imaging on tumor-associated macrophages and inflammation. Frontiers in Immunology. 8, 590 (2017).
- Chen, X., Qiu, B. A pilot study of short T2* measurements with ultrashort echo time imaging at 0.35 T. BioMedical Engineering OnLine. 17 (1), 70 (2018).
- Yi, J., Lee, Y. H., Song, H. -. T., Suh, J. -. S. Comparison of T2* between regular echo time and ultrashort echo time with 3D cones at 3 tesla for knee meniscus. Medicine. 97 (48), e13443 (2018).
- Weishaupt, D., et al. . How Does MRI Work?: An Introduction to the Physics and Function of Magnetic Resonance Imaging. , (2006).
- Wood, J. C. Guidelines for quantifying iron overload. Hematology. American Society of Hematology. 2014 (1), 210-215 (2014).
- Branisso, P. P. F., et al. Non-invasive methods for iron overload evaluation in dysmetabolic patients. Annals of Hepatology. 27 (4), 100707 (2022).
- Schaefer, B., Meindl, E., Wagner, S., Tilg, H., Zoller, H. Intravenous iron supplementation therapy. Molecular Aspects of Medicine. 75, 100862 (2020).
- Haacke, E. M., Mittal, S., Wu, Z., Neelavalli, J., Cheng, Y. -. C. N. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1. AJNR: American Journal of Neuroradiology. 30 (1), 19-30 (2009).
- . T2 Mapping Slicer Extension Available from: https://github.com/gattia/Slicer-T2mapping (2021)
- 3D Slicer image computing platform. 3D Slicer Available from: https://slicer.org/ (2023)
- Messroghli, D. R., et al. An open-source software tool for the generation of relaxation time maps in magnetic resonance imaging. BMC Medical Imaging. 10, 16 (2010).
- . GNU Octave Available from: https://octave.org/ (2023)
- Chavhan, G. B., Babyn, P., Thomas, B., Shroff, M., Haacke, E. M. Principles, techniques, and applications of T2*-based MR imaging and its special applications. Radiographics. 29 (5), 1433-1449 (2009).
- Aghighi, M., et al. Magnetic resonance imaging of tumor associated macrophages: clinical translation. Clinical Cancer Research. 24 (17), 4110-4118 (2018).
- Trujillo-Alonso, V., et al. FDA-approved ferumoxytol displays anti-leukaemia efficacy against cells with low ferroportin levels. Nature Nanotechnology. 14 (6), 616-622 (2019).
- Ishiyama, K., et al. Tumor-liver contrast and subjective tumor conspicuity of respiratory-triggered T2-weighted fast spin-echo sequence compared with T2*-weighted gradient recalled-echo sequence for ferucarbotran-enhanced magnetic resonance imaging of hepatic malignant tumors. Journal of Magnetic Resonance Imaging. 27 (6), 1322-1326 (2008).
- Hirokawa, Y., et al. Hepatic lesions: improved image quality and detection with the periodically rotated overlapping parallel lines with enhanced reconstruction technique-evaluation of SPIO-enhanced T2-weighted MR images. Radiology. 251 (2), 388-397 (2009).
- Tonan, T., et al. Evaluation of small (≤2cm) dysplastic nodules and well-differentiated hepatocellular carcinomas with ferucarbotran-enhanced MRI in a 1.0-T MRI unit: Utility of T2*-weighted gradient echo sequences with an intermediate-echo time. European Journal of Radiology. 64 (1), 133-139 (2007).
- Rief, M., et al. Detection of focal liver lesions in unenhanced and ferucarbotran-enhanced magnetic resonance imaging: a comparison of T2-weighted breath-hold and respiratory-triggered sequences. Magnetic Resonance Imaging. 27 (9), 1223-1229 (2009).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены