Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure des temps de relaxation de la tumeur T2* après l’administration de nanoparticules d’oxyde de fer
Dans cet article
Résumé
Nous présentons un protocole standardisé pour la quantification des temps de relaxation T2* des tumeurs à l’aide d’un logiciel externe. Des images d’écho à gradient multi-écho sont acquises et introduites dans le logiciel pour créer des cartes de tumeur T2* et mesurer les temps de relaxation de la tumeur T2*.
Résumé
La relaxométrie T2* est l’une des méthodes établies pour mesurer l’effet des nanoparticules d’oxyde de fer superparamagnétiques sur les tissus tumoraux avec l’imagerie par résonance magnétique (IRM). Les nanoparticules d’oxyde de fer raccourcissent les temps de relaxation T1, T2 et T2* des tumeurs. Alors que l’effet T1 est variable en fonction de la taille et de la composition des nanoparticules, les effets T2 et T2* sont généralement prédominants, et les mesures T2* sont les plus rapides dans un contexte clinique. Ici, nous présentons notre approche pour mesurer les temps de relaxation T2* tumoraux, en utilisant des séquences d’écho à gradient multi-écho, un logiciel externe et un protocole standardisé pour créer une carte T2* avec un logiciel indépendant du scanner. Cela facilite la comparaison des données d’imagerie de différents scanners cliniques, de différents fournisseurs et de travaux de recherche cocliniques (c’est-à-dire les données tumorales T2* obtenues dans des modèles murins et des patients). Une fois le logiciel installé, le plugin T2 Fit Map doit être installé à partir du gestionnaire de plugins. Ce protocole fournit des détails de procédure étape par étape, de l’importation des séquences d’écho à gradient multi-écho dans le logiciel, à la création de cartes T2* codées par couleur et à la mesure des temps de relaxation T2* tumoraux. Le protocole peut être appliqué aux tumeurs solides dans n’importe quelle partie du corps et a été validé sur la base de données d’imagerie précliniques et de données cliniques chez les patients. Cela pourrait faciliter les mesures de la tumeur T2* pour les essais cliniques multicentriques et améliorer la normalisation et la reproductibilité des mesures de la tumeur T2* dans les analyses de données cocliniques et multicentriques.
Introduction
La quantification non invasive des temps de relaxation tumorale T2* dans divers tissus du corps avec l’imagerie par résonance magnétique (IRM) est largement établie1. La raison d’être de cet article est de fournir un protocole pour la mesure des temps de relaxation de la tumeur T2* qui est indépendant du logiciel de scanner comme Osirix2. Cela permettra des analyses uniformes des données d’imagerie provenant de différents centres, de différents scanners et de différents fournisseurs. En effet, des milliers d’utilisateurs pourraient potentiellement utiliser la même approche, augmentant ainsi la standardisation des mesures de la tumeur T2*. Les mesures T2* sont utilisées à différentes fins par les neuroradiologues, les experts en imagerie cardiaque et les experts en imagerie abdominale, entre autres. Des séquences d’impulsions IRM pour mesurer les temps de relaxation tissulaire T2* ont été appliquées et optimisées pour l’évaluation des saignements intracrâniens3, de la teneur en fer hépatique1,4 et de la teneur en fer cardiaque 5,6, entre autres. D’autres chercheurs ont utilisé des mesures T2* pour générer des estimations quantitatives des accumulations de nanoparticules d’oxyde de fer dans les tumeurs malignes 7,8. Toutefois, bon nombre de ces approches antérieures utilisaient un logiciel institutionnel ou un logiciel de numérisation spécifique, qui serait limité à une utilisation dans un établissement particulier ou pour le traitement des données obtenues sur un scanner spécifique. Ici, nous décrivons une approche universellement applicable pour générer des cartes T2* tumorales et des temps de relaxation T2* tumoraux basés sur des données IRM précliniques ou cliniques de n’importe quel scanner capable de générer des images d’écho à gradient multi-écho. La séquence d’écho de gradient requise doit avoir des temps de premier écho très courts et un espacement inter-écho étroit 9,10. Les images d’écho à gradient multi-écho sont ensuite introduites dans le logiciel externe, les cartes T2* tumorales sont calculées et les temps de relaxation de la tumeur T2* sont mesurés. Le plug-in T2 Fit Map dans les courbes de désintégration T2* des modèles externes en tant qu’ajustement monoexponentiel à S(t) = So e-t/T2* 11 où S(t) représente la valeur du signal ou du processus à un instant t donné ; S 0 est la valeur initiale du signal ou du processus à t =0; t indique le temps; T2*, également connu sous le nom de temps de relaxation transversale apparente, caractérise le taux de désintégration du signal ou du processus; et e est la base du logarithme népérien (approximativement égal à 2,71828). L’équation décrit une décroissance exponentielle, où le signal ou le processus diminue avec le temps en fonction du taux de désintégration T2*. Plus la valeur de T2 est grande, plus le taux de décroissance est lent, et vice versa. Le même logiciel peut également être utilisé pour saisir des images d’écho de spin multi-écho et générer des valeurs de tumeur T2 en ajustant la courbe de désintégration T2 à S (t) = So e-t / T2. L’ajustement de la courbe a été effectué à l’aide d’un logiciel externe, sans incorporer de décalage constant. Les deux courbes de décroissance présentent un comportement exponentiel unique, T2* démontrant une durée plus courte que T2.
Chez les patients atteints d’hémosidérose et d’hémochromatose, la quantification de la teneur en fer du foie par biopsie tissulaire est l’étalon-or, tandis que l’imagerie IRM non invasive est le point de soins pour établir les valeurs de base et surveiller les changements au fil du temps de manière non invasive12,13. Bien que la génération de cartes T2* pour la quantification du fer dans le foie soit bien établie4, il n’existe pas de protocole standardisé pour mesurer les temps de relaxation T2* tumoraux. Bien que les cartes T2* puissent également être générées par un logiciel de numérisation, elles sont limitées à un scanner et à un fournisseur spécifiques. Dans le domaine de l’oncologie, les études d’imagerie en série d’un patient donné se produisent souvent sur différents scanners, et les données d’IRM multicentriques sont acquises sur la base d’études d’imagerie de différents scanners et de différents fournisseurs. En outre, la recherche en imagerie coclinique est de plus en plus mise en œuvre et nécessite la comparaison des données IRM des patients et des modèles murins qui simulent leur tumeur. Le but de ce protocole est de fournir un protocole pour la mesure des temps de relaxation de la tumeur T2* qui sont indépendants du logiciel du scanner. Cela permettra une analyse uniforme des données d’imagerie provenant de différents centres et de différents scanners. En effet, des milliers d’utilisateurs pourraient potentiellement utiliser la même approche, augmentant ainsi la standardisation et la reproductibilité des mesures T2* tumorales. Notre protocole utilise un logiciel externe, qui peut être téléchargé à partir d’Internet. Les images d’écho à gradient multi-écho sont introduites dans le logiciel et adaptées à une formule de désintégration monoexponentielle pour générer une carte T2*, sur laquelle les temps de relaxation T2* de la tumeur peuvent être mesurés à l’aide de régions d’intérêt (ROI) définies par l’opérateur5. Les nanoparticules d’oxyde de fer peuvent être perfusées à différentes doses 14, Dans notre étude, le patient a reçu une injection de Ferumoxytol (30 mg / mL) contenant 510 mg de fer élémentaire dans un volume de17 mL, à une dose de 5 mg de fer élémentaire par kg de poids corporel. Par la suite, des séquences d’échos à gradient multi-écho ont été obtenues15 en utilisant des paramètres de séquence définis pour l’acquisition de données.
Protocole
Ce protocole a été généré pour un essai clinique prospectif et une recherche co-clinique. L’étude était conforme à la loi HIPAA (Health Insurance Portability and Accountability Act) et approuvée par le comité d’examen institutionnel (IRB) de l’Université de Stanford. Tous les patients ou leur représentant légal ont signé un consentement éclairé écrit, et tous les enfants âgés de 7 à 18 ans ont signé un formulaire d’assentiment.
1. Installation et démarrage du plugin T2 Fit Map
- Démarrez le logiciel Osirix. Installez le plug-in T2 Fit Map à partir du gestionnaire de plugins et redémarrez le logiciel.
- Dans la barre de menus, cliquez sur le bouton Plugins. Cliquez sur le menu déroulant et sélectionnez Installer un package de plug-in (Figure 1).
- Une fois le gestionnaire de plug-ins chargé, sélectionnez les plug-ins disponibles dans le menu déroulant, puis T2 Fit Map (Figure 2).
- Cliquez sur télécharger et installer. Fermez le gestionnaire de plugins et redémarrez le logiciel.
- Chargez les images de séquence d’écho à gradient multi-écho sous forme de fichiers DICOM dans le logiciel.
- Modifiez la fonction du bouton de la souris pour dessiner une région d’intérêt (ROI) (Figure 3).
- À l’aide de cette fonction de bouton de souris, définissez une forme pour le retour sur investissement requis : sélectionnez Polygone ovale ou fermé, ou la forme souhaitée dans le menu déroulant (Figure 4).
- Dessinez des ROI dans les images requises avec différents temps d’écho (TE).
- Sélectionnez les ROI dans toutes les images avec différents TE pour lesquels la carte T2* est requise.
- Cliquez sur le bouton Plug-ins , sélectionnez Filtres d’image dans le menu déroulant, puis sélectionnez T2 Fit Map.
- Cliquez sur T2 Fit Map. Une boîte de dialogue s’ouvre ; cliquez sur Générer la carte (qui se trouve au bas de la boîte de dialogue) (Figure 5).
REMARQUE: Une courbe d’ajustement est générée avec les valeurs T2* minimales, moyennes et maximales pour les ROI sélectionnés avec différents TE (ms). La valeur moyenne T2* est calculée et affichée sous la courbe (Figure 6).
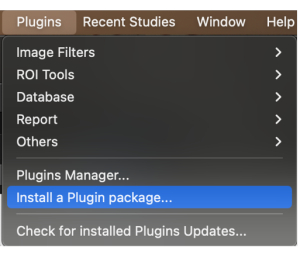
Figure 1: Sélectionnez « Installer un package de plug-in » dans le menu déroulant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
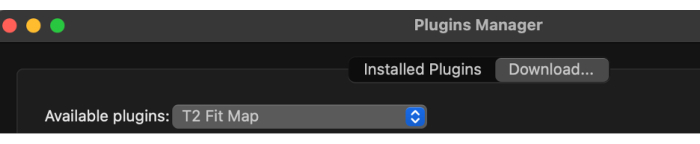
Figure 2: Sélectionnez 'T2 Fit Map' parmi les plugins disponibles. Veuillez cliquer ici pour voir une version agrandie de cette figure.
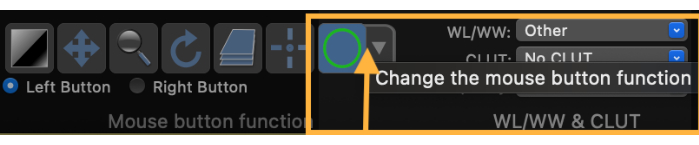
Figure 3: Capture d’écran montrant comment modifier la fonction du bouton de la souris pour dessiner une région d’intérêt (ROI). Veuillez cliquer ici pour voir une version agrandie de cette figure.
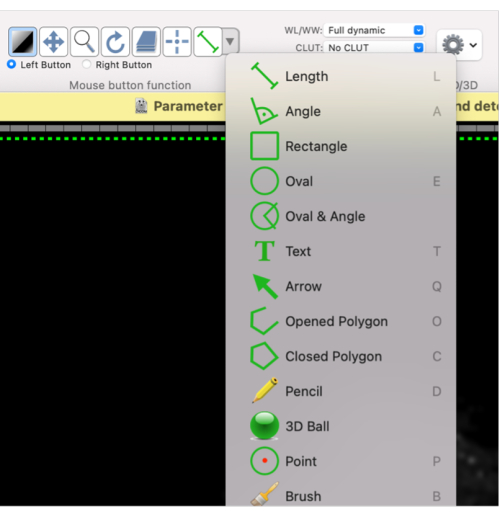
Figure 4: Capture d’écran montrant comment sélectionner différentes formes pour le retour sur investissement. Veuillez cliquer ici pour voir une version agrandie de cette figure.
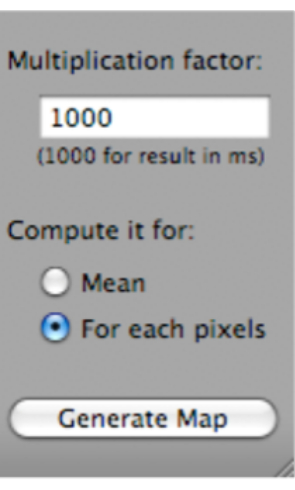
Figure 5: Capture d’écran montrant comment sélectionner « Générer une carte » après avoir sélectionné « T2 Fit Map ». Veuillez cliquer ici pour voir une version agrandie de cette figure.
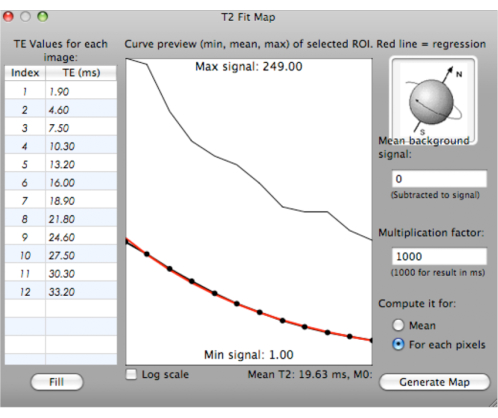
Figure 6 : Capture d’écran montrant la génération d’une courbe d’ajustement pour les valeurs T2*. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Exclusion du bruit selon la définition de masque
REMARQUE : Pour définir un masque sur le premier écho des données T2map_MSME utilisées pour calculer les cartes paramétriques, définissez un seuil inférieur de premier écho pour le calcul de la valeur T2* (le volume de carte T2* exclura désormais les pixels dont les signaux sont trop faibles pour un calcul précis au premier écho multi-spin multi-echo (MSME). Le seuil peut être augmenté pour exclure plus de pixels, ou diminué pour inclure plus de pixels).
- Pour définir le retour sur investissement du masque sur une série d’images en dehors des données paramétriques, ouvrez la série souhaitée (par exemple, premier écho de la T2map_MSME avec TE = 15) et sélectionnez une tranche.
- En bas du menu déroulant ROI, sélectionnez Région de culture....
- Sélectionnez la case d’option 3D Growing Region... (Figure 7).
- Dans le menu déroulant Algorithme, sélectionnez Seuil (limites inférieure/supérieure).
- Réglez les seuils inférieur et supérieur à 0 et X% du signal du muscle controlatéral du mollet, respectivement (par exemple, définissez le seuil sur la valeur qui masquera le plus de mouchetures dans le retour sur investissement de la tumeur et laissera les T2(*) de tumeur les plus évaluables).
- Définissez le nom du retour sur investissement comme vous le souhaitez.
- Cliquez sur l’image pour placer une graine pour la croissance du retour sur investissement.
- Cliquez sur le bouton Calculer .
- Dans le menu ROI, sélectionnez Save All ROIs of this Series... (Figure 8).
REMARQUE: Maintenant, le retour sur investissement définissant la zone à masquer des cartes paramétriques a été enregistré et peut être appliqué aux données paramétriques. - Ouvrez le jeu de données Parametric dans la visionneuse 4D.
- Dans le menu ROI, sélectionnez Importer le(s) ROI(s)....
REMARQUE: Le ROI du masque est maintenant dans la première série paramétrique. - Vérifiez que les ROI sont dans le premier volume 3D et non dans la 4D.
- Appliquez un masque pour mapper les données. Pour ce faire, au bas du menu déroulant ROI, sélectionnez Définir les valeurs de pixels sur. Sélectionnez ensuite appliquer aux : ROI portant le même nom... (Figure 9).
- Cochez la case Propager à la série 4D .
- Définissez les pixels qui sont à l’intérieur des ROI.
- Définissez sur cette nouvelle valeur : comme 0.
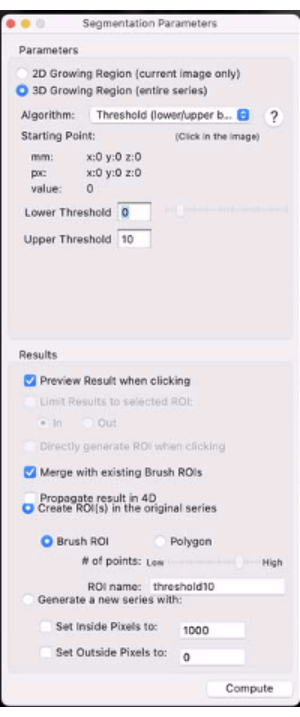
Figure 7: Capture d’écran montrant les paramètres de segmentation. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Figure 8: Capture d’écran montrant comment sélectionner « Enregistrer tous les retours sur investissement de cette série... ». Veuillez cliquer ici pour voir une version agrandie de cette figure.
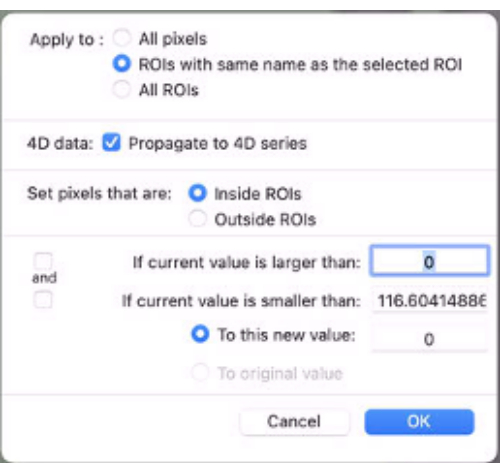
Figure 9: Capture d’écran montrant les valeurs à saisir dans « Définir les valeurs de pixel sur ». Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats

Figure 10 : La carte T2* avec un retour sur investissement superposé à la lésion d’ostéosarcome métastatique qui montre la valeur moyenne et l’écart-type T2*. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Notre protocole nous permet de mesurer les temps de relaxation T2* de la tumeur sur la base de séquences d’écho à gradient-écho multi-écho, d’un logiciel externe et d’un plugin pour créer des cartes T2*. Les étapes critiques du protocole sont l’inclusion de la séquence gradient-écho multi-écho avec des TE très courts dans le protocole de balayage, et l’ajustement monoexponentiel des images d’écho de gradient multi-écho à l’aide d’un logiciel externe. Il est important d’organiser les images...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été en partie soutenu par une subvention de l’Institut national du cancer, numéro de subvention U24CA264298. Nous remercions Dawn Holley, Kim Halbert et Mehdi Khalighi du Centre de services métaboliques TEP/IRM pour leur aide dans l’acquisition de TEP/IRM au Lucas Research Center de Stanford. Nous remercions les membres du laboratoire Daldrup-Link pour leurs précieux commentaires et discussions concernant ce projet.
matériels
| Name | Company | Catalog Number | Comments |
| OsiriX | Pixmeo SARL | https://www.osirix-viewer.com/ | |
| 3T GE MR 750 | GE Healthcare, Chicago, IL | ||
| FERAHEME (ferumoxytol injection) | AMAG Pharmaceuticals, Inc. 1100 Winter Street Waltham, MA 02451 |
Références
- Garbowski, M. W., et al. Biopsy-based calibration of T2* magnetic resonance for estimation of liver iron concentration and comparison with R2 Ferriscan. Journal of Cardiovascular Magnetic Resonance. 16 (1), 40 (2014).
- . OsiriXDICOM Viewer Available from: https://www.osirix-viewer.com/ (2023)
- Linfante, I., Llinas, R. H., Caplan, L. R., Warach, S. MRI features of intracerebral hemorrhage within 2 hours from symptom onset. Stroke. 30 (11), 2263-2267 (1999).
- Labranche, R., et al. Liver iron quantification with MR imaging: a primer for radiologists. Radiographics. 38 (2), 392-412 (2018).
- Triadyaksa, P., Oudkerk, M., Sijens, P. E. Cardiac T2* mapping: Techniques and clinical applications. Journal of Magnetic Resonance Imaging. 52 (5), 1340-1351 (2020).
- Anderson, L. J., et al. Cardiovascular T2-star (T2*) magnetic resonance for the early diagnosis of myocardial iron overload. European Heart Journal. 22 (23), 2171-2179 (2001).
- Seo, M., et al. Estimation of T2* relaxation time of breast cancer: correlation with clinical, imaging and pathological features. Korean Journal of Radiology. 18 (1), 238-248 (2017).
- Serkova, N. J. Nanoparticle-based magnetic resonance imaging on tumor-associated macrophages and inflammation. Frontiers in Immunology. 8, 590 (2017).
- Chen, X., Qiu, B. A pilot study of short T2* measurements with ultrashort echo time imaging at 0.35 T. BioMedical Engineering OnLine. 17 (1), 70 (2018).
- Yi, J., Lee, Y. H., Song, H. -. T., Suh, J. -. S. Comparison of T2* between regular echo time and ultrashort echo time with 3D cones at 3 tesla for knee meniscus. Medicine. 97 (48), e13443 (2018).
- Weishaupt, D., et al. . How Does MRI Work?: An Introduction to the Physics and Function of Magnetic Resonance Imaging. , (2006).
- Wood, J. C. Guidelines for quantifying iron overload. Hematology. American Society of Hematology. 2014 (1), 210-215 (2014).
- Branisso, P. P. F., et al. Non-invasive methods for iron overload evaluation in dysmetabolic patients. Annals of Hepatology. 27 (4), 100707 (2022).
- Schaefer, B., Meindl, E., Wagner, S., Tilg, H., Zoller, H. Intravenous iron supplementation therapy. Molecular Aspects of Medicine. 75, 100862 (2020).
- Haacke, E. M., Mittal, S., Wu, Z., Neelavalli, J., Cheng, Y. -. C. N. Susceptibility-weighted imaging: technical aspects and clinical applications, part 1. AJNR: American Journal of Neuroradiology. 30 (1), 19-30 (2009).
- . T2 Mapping Slicer Extension Available from: https://github.com/gattia/Slicer-T2mapping (2021)
- 3D Slicer image computing platform. 3D Slicer Available from: https://slicer.org/ (2023)
- Messroghli, D. R., et al. An open-source software tool for the generation of relaxation time maps in magnetic resonance imaging. BMC Medical Imaging. 10, 16 (2010).
- . GNU Octave Available from: https://octave.org/ (2023)
- Chavhan, G. B., Babyn, P., Thomas, B., Shroff, M., Haacke, E. M. Principles, techniques, and applications of T2*-based MR imaging and its special applications. Radiographics. 29 (5), 1433-1449 (2009).
- Aghighi, M., et al. Magnetic resonance imaging of tumor associated macrophages: clinical translation. Clinical Cancer Research. 24 (17), 4110-4118 (2018).
- Trujillo-Alonso, V., et al. FDA-approved ferumoxytol displays anti-leukaemia efficacy against cells with low ferroportin levels. Nature Nanotechnology. 14 (6), 616-622 (2019).
- Ishiyama, K., et al. Tumor-liver contrast and subjective tumor conspicuity of respiratory-triggered T2-weighted fast spin-echo sequence compared with T2*-weighted gradient recalled-echo sequence for ferucarbotran-enhanced magnetic resonance imaging of hepatic malignant tumors. Journal of Magnetic Resonance Imaging. 27 (6), 1322-1326 (2008).
- Hirokawa, Y., et al. Hepatic lesions: improved image quality and detection with the periodically rotated overlapping parallel lines with enhanced reconstruction technique-evaluation of SPIO-enhanced T2-weighted MR images. Radiology. 251 (2), 388-397 (2009).
- Tonan, T., et al. Evaluation of small (≤2cm) dysplastic nodules and well-differentiated hepatocellular carcinomas with ferucarbotran-enhanced MRI in a 1.0-T MRI unit: Utility of T2*-weighted gradient echo sequences with an intermediate-echo time. European Journal of Radiology. 64 (1), 133-139 (2007).
- Rief, M., et al. Detection of focal liver lesions in unenhanced and ferucarbotran-enhanced magnetic resonance imaging: a comparison of T2-weighted breath-hold and respiratory-triggered sequences. Magnetic Resonance Imaging. 27 (9), 1223-1229 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon