Method Article
共焦点顕微鏡によるラット生体骨格筋線維のミトコンドリア密度と縦方向分布の解析
要約
ここでは、ミトコンドリアネットワークスキャン用の共焦点顕微鏡を使用した生きた骨格筋イメージングにより、ミトコンドリア密度と縦方向分布の変化を解析するプロトコルを紹介します。
要約
ミトコンドリアは、細胞の代謝要件に応じて伸長、断片化、および再生できる細胞小器官です。ミトコンドリアネットワークのリモデリングにより、健康なミトコンドリアは細胞の要求を満たすことができます。しかしながら、この能力の喪失は、異なる病状の発症または進行に関連している。骨格筋では、運動、加齢、肥満などの生理的・病理学的条件において、ミトコンドリア密度や分布の変化が観察されます。したがって、ミトコンドリアネットワークの研究は、これらの状態に関連するメカニズムのより良い理解を提供する可能性があります。
ここでは、ラット由来の生きた骨格筋線維のミトコンドリアイメージングのプロトコルについて説明します。繊維をリラックス溶液中で手動で解剖し、ミトコンドリアの蛍光生細胞イメージングインジケーター(テトラメチルローダミンエチルエステル、TMRE)とインキュベートします。ミトコンドリアシグナルは、XYZスキャンモードを使用して共焦点顕微鏡によって記録され、筋原線維間ミトコンドリア(IMF)ネットワークの共焦点画像を取得します。その後、共焦点画像は閾値化と二値化によって処理されます。二値化された共焦点画像は、ミトコンドリアの正のピクセルを占め、ミトコンドリア密度を得るためにカウントされます。骨格筋のミトコンドリアネットワークは、T尿細管(TT)と同様の周期的な縦方向分布を持つIMF集団の高密度によって特徴付けられます。高速フーリエ変換 (FFT) は、TT の分布を評価するために実行される標準的な分析手法であり、分布頻度と組織のレベルを見つけることができます。このプロトコルでは、FFTアルゴリズムの実装は骨格筋の縦方向のミトコンドリア分布の分析のために記述されている。
概要
ミトコンドリアは、ミトフシン1、2(Mfn1、Mfn2)、ミトコンドリア外膜と内膜の融合を調節する視タンパク質萎縮1(Opa1)などのタンパク質の発現と活性によって調節される伸長(融合)と断片化(分裂)のバランスによって制御される、非常にダイナミックなネットワークを形成しています。 それぞれ 1,2.ダイナミン関連タンパク質(Drp1)は、Ser6163でリン酸化されると、主にミトコンドリア分裂を調節します。
骨格筋では、ミトコンドリアネットワークが、異なる細胞領域(筋原線維、筋膜、核)への近接性に基づいて、構造的に明確に定義された亜集団に配置されていることが十分に確立されています4,5。筋膜の真下に位置するミトコンドリアを筋膜下ミトコンドリア(SSM)と呼び、収縮フィラメントの間に位置するミトコンドリアを筋原線維間ミトコンドリア(IMF)と呼び、核の周りのミトコンドリア亜集団を核周囲ミトコンドリアネットワーク(PMN)と呼びます。さらに、これらのミトコンドリア亜集団は領域特異的な機能を持ち、代謝的に特殊化していることが示唆されている4,5。
代謝機能や収縮機能を可能にする細胞のエネルギー恒常性の維持は、ミトコンドリアネットワークを介した特定の部位での相互作用やコミュニケーション(IMFやSSMの相互作用など)に大きく依存しています4,6。ミトコンドリアネットワークの相互作用に加えて、ミトコンドリアは他の細胞小器官と相互作用し、構造的および機能的な複合体を形成することもできます。この点に関して、IMFは、筋小胞体(SR)に隣接し、横尿細管(TT)によって形成されるCa2+放出単位(CRU)に近接して配置できることが示されている7。この事実は、ATP合成とアポトーシスの調節におけるミトコンドリアCa 2+取り込みの役割に関連しています。最近では、細胞質のCa2+トランジェントの調節における潜在的な役割も示唆されています8。
TTは、心筋細胞と骨格筋線維の縦軸に沿って周期的に分布する筋腫の陥入であり、IMF分布5と同様に9,10。TTの分布の変化は、収縮機能における役割を考えると、重要な生理学的意味合いを持っています。しかし、これらの変化は主に心筋細胞で評価されています。高速フーリエ変換(FFT)解析を使用すると、距離領域から周波数領域への周期信号の変換が可能になり、信号の周波数と規則性を示すFFTスペクトルが得られます11、12、13。骨格筋線維におけるミトコンドリアネットワークの組織化は、筋肉損傷後の再生中のように、さまざまな代謝条件への適応に不可欠であるという証拠があるが14,15、ほとんどの分析は定性的に行われる。
さらに、ミトコンドリアの機能不全は、いくつかの骨格筋関連(例えば、廃用性萎縮)2 および非筋肉疾患、特に代謝性疾患、および関連する筋肉量の減少(すなわち、萎縮)と関連していることを考えると、骨格筋におけるミトコンドリアネットワークと分布の定量的評価は関連性があります。最近、肥満群(Ob;Zucker fa/fa rats)、およびリーングループ(Lean;Zucker +/+ rats)はFFT17によって同定された。本研究は、ミトコンドリア分布の解析におけるFFTの有用性を実証した。従って、このプロトコルは蛍光性の共焦点顕微鏡検査によって得られるイメージからの生きている骨格筋線維のミトコンドリアを調査する方法論を示す。バックグラウンド閾値化によりミトコンドリア密度を定量化し、FFT解析によるミトコンドリア縦分布の解析についても記載する。ワークフロー スキームを 図 1 に示します。
プロトコル
すべての動物実験手順は、モンテレイ工科大学の動物使用およびケア委員会(CICUAL)によって評価および承認されました(プロトコル2019-007)。この研究には、12〜13週齢の雄のZucker(+/+およびfa/fa)ラットが使用されました。.動物は標準的な飼育条件(12時間/12時間の明暗サイクル、湿度40〜60%)で飼育され、餌(標準的なラットチャウ)と水を自由に利用することができました。
1. 溶液組成
- 表1に示す成分を混合して、新鮮なリラックス液を調製します。水酸化ナトリウム(NaOH)を使用してpHを7.3に調整します。
- 遊離金属濃度を決定するためのシミュレーションプログラムを使用して、リラックス溶液中の遊離カルシウム濃度を計算します。
- ジメチルスルホキシド(DMSO)中の5 mMテトラメチルローダミンメチルエステル(TMRE)ストックを調製し、続いてDMSOで0.1 mMの希釈液を調製します。
2.腓腹筋線維束の解剖
- 動物を誘導チャンバーに入れ、蓋を閉めます。酸素源をオンにし、ガス流量を0.5 L / minに設定し、気化器を4%セボフルランに設定して麻酔を誘発します。
- ラットが眠ったら、麻酔を維持しながら仰臥位でチャンバーの外に置きます。つま先や尻尾をつまんで、反射神経がないことを確認します。
- ハサミで腹部の皮膚と筋肉を切り裂きます。次に、胸郭を切断して心臓にアクセスできるようにします。
- 心臓切除術を行うには、鉗子で最上部の静脈と動脈から心臓をつかみ、ハサミで血管を切断します。ハートを取り除きます。
- 安楽死直後は後肢をエタノールで消毒し、シェービングマシンで剃る。
- 後ろ足を持ち、アキレス腱の高さで皮膚をハサミで切開します。
- 後肢をハサミで近位脛骨の高さで切ります。背中の位置で3 mLの氷冷リラックス溶液を含む60 mmペトリ皿に移します。筋肉が乾燥するのを防ぐために、十分な溶液で覆います。
- アキレス腱を特定し、鉗子で慎重に持ち上げ、虹彩ハサミで筋肉を骨から離して解剖します。解剖のこのステップ以降は実体顕微鏡を使用します。
- 後肢の後ろにある主なバルクである腓腹筋全体を特定して分離します。
- 筋肉を取り巻く結合組織と脂肪組織を細い先端の鉗子で解剖して廃棄します。筋肉の外側の頭を、氷冷リラックス液を入れた新しいペトリ皿に移します( 図2Aを参照)。
- 片方の端から鉗子で筋肉をそっと持ち、マイクロハサミで慎重に束に分けます。常に鉗子で一端をそっと保持して束を操作してください。
注意: バンドルの長さは約10mm、幅は2mmです。 - 繊維束を2 mLの氷冷リラックス溶液を入れた新しいペトリ皿に移します。滑らかな外観を持ち、端から端まで完全で、短くなっていないもののみを選択してください(図2B)。
3. 共焦点顕微鏡による骨格筋ミトコンドリアの生細胞イメージング取得
- 繊維を2.5 × 10-4 mM TMRE中のリラックス液中で室温で20分間インキュベートします。
注:TMREの推奨使用濃度では、非急冷モードになることが期待されます。この時点から光にさらされないように保護してください。 - 潜伏期間中:
- 共焦点顕微鏡標準ソフトウェアを開き、構成フレームワークを選択し、ハードウェア構成ダイアログボックスでレーザーを選択し、HeNe 543オプションをオンにします。
- 取得フレームワークで、取得ダイアログボックスを選択し、取得モードで[XYZ]パネルを選択します。
- XY ダイアログボックスで、512 x 512 フォーマット、400 Hz 速度を選択し、ピンホールパネルにチェックを入れます。表示されたピンホールダイアログボックスで、単位にAUを選択し、ピンホールに値3 Airyを追加します。
注:適切な蛍光シグナルが保存されている場合は、1 Airyの最適基準に最も近いピンホールサイズを小さくすることを検討してください。 - ビームパス設定ダイアログボックスで、20倍の水浸対物レンズと0.7(20x/0.7 IMM)の開口数(NA)を選択し、576-700nmの発光波長ウィンドウを選択します。DD488/543 と 543 レーザーのレーザー出力の 15% を選択します。
注意: ライブイメージングスキャン用の水浸対物レンズを強くお勧めします(利用可能な場合)。浸漬培地とインキュベーション培地の屈折率は同等であるため、達成される。
- 20分間のインキュベーション後、インキュベーション培地を2回交換します。インキュベーション後20〜30分以内に共焦点画像を取得するようにしてください。
- ホウケイ酸ガラスの0.15mmカバーガラスで記録チャンバーを準備します。
注意: 最適なパフォーマンスを得るには、厚さが通常0.15〜0.22mmの範囲であることを考慮して、使用可能な記録チャンバーに応じてカバーガラスの厚さを選択してください。 - 200 μL の Relax 溶液を記録チャンバーに加え、ファイバー束を転写します。
- 共焦点顕微鏡では、明視野モードを使用して、ミトコンドリアの蛍光記録に有効な繊維を同定します。生存可能な繊維は完全で、収縮しておらず、無傷の縞模様を持っています。
- 繊維束を互いに分離し、鉗子で位置合わせします。カバーガラスに最も近いものを選択します。
- ライブボタンを使用して蛍光をスキャンし、コントロールパネルコンソールでゲインとオフセットを調整し、次の点を考慮します。
- ほぼ0の任意単位(A.U.)の背景に対して低い蛍光強度値を選択します。
- 100〜200A.U.のゲインレベルを選択します。録音システムの飽和を避けるため。したがって、最高の蛍光レベルを記録しないでください。
- 150-190 nm のピクセルサイズを選択してファイバーの全幅を取得し、 XY ダイアログボックスでズーム倍率を調整します。
注:ナイキスト基準(90 nm)に近いピクセルサイズを使用して、ファイバーの全幅をスキャンすることを検討してください。
- Zスタックダイアログボックスで、Z距離を調整して、ファイバー深度15 μm(開始ボタン)から最大22 μm(終了ボタン)までの蛍光シグナルを取得します。Zステップサイズとして3μmを選択します。
- [開始]ボタンをクリックして、共焦点画像を取得します。深さ15、18、21μmで取得した3つの共焦点画像で構成されるZスタックを取得します。
4. ミトコンドリア密度の解析
- 生物学的画像解析のためのオープンソースプラットフォーム18で、 図3Bに示すように、Zスタックファイルを開き、画像を回転させてファイバーを水平に配置する。
- ミトコンドリアが占める領域(ROIミト)を含む長方形の関心領域(ROI)をランダムに選択します。Xには65〜90μmの範囲のROIミトサイズを選択します。Yの場合、サイズは繊維幅に依存し、その周辺部は避けられます。
- 選択したROImitoでZスタックを複製し、新しいZスタック(Mito-stack )としてTIFF形式で保存します。ROI マネージャーツールを使用して、元のスタックで選択した ROImito 位置を保存します。
- バックグラウンド減算のしきい値は、次のように計算します。
- ショートカット command+shift+t を使用して、[ しきい値 ] ダイアログ ボックスを開きます。
- 閾値アルゴリズムを選択 Otsu |白黒&W |暗い背景 オプション。イメージがバイナリ化されていることを確認します。
- [しきい値] ダイアログ ボックスで、蛍光強度分布のヒストグラムと表示されるしきい値を確認します。
注:ミトコンドリア陽性ピクセルは、蛍光強度値がしきい値よりも大きく、バイナリ画像では白いピクセルとして表示されます。 - [ 適用] を選択して、バイナリ イメージ スタックにしきい値を適用します。表示された「スタックを バイナリに変換 」ダイアログボックスで、「 各画像のしきい値を計算」、「黒い背景」、「新しいスタックを作成」オプションを選択し、「 OK」をクリックします。
- 3 つのバイナリ イメージを含むスタックが生成されることを確認します (BinDMito-stack)。 TIFF形式で保存します。
- BinDMitoスタックのミトコンドリア密度を次のように計算します。
- [ 分析 ] メニューを選択します。次に、[ ヒストグラム] をクリックします。表示されたヒストグラムダイアログボックスで、[ はい ]をクリックして、スタックのすべての画像を解析対象に含めます。
- 「スタックのヒストグラム」ダイアログ・ボックスで、「リスト」をクリックしてヒストグラム・データを取得します。ヒストグラム データをスプレッドシートに転送します。
- スプレッドシートで、値が 255 の水戸ピクセルを特定します。式(1)を使用してミトコンドリア密度を計算します。
ミトコンドリア密度 =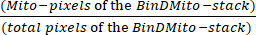 × 100 (1)
× 100 (1)
合計ピクセル数は、ヒストグラムダイアログボックスで N として識別されるか、ヒストグラムのピクセル数をスプレッドシートで合計して計算されます。 - ミトコンドリアが占める面積(μm2)を計算するには、BinDMitoスタックの水戸ピクセルにピクセルサイズを掛けます。
5. 高速フーリエ変換によるミトコンドリア分布の解析
- 生体画像解析用のオープンソースプラットフォームで、BinDMitoスタックを開き、幅256ピクセル、高さ5μmの長方形のROIを描画します。ROIを中央の位置に、別のROIを横の位置に配置します(図4A、Bを参照)。
- ROI マネージャー ツールを使用して、FFT 解析の ROI を構成し、保存します。
注:分析の必要に応じて、他のROIをさまざまな位置で選択し、それらのサイズを変更することができます。ただし、FFTを実行するには、幅が2n ピクセル(128、256、512ピクセルなど)に等しくなければなりません。 - ショートカット command + k を使用して ROI のプロット プロファイルを取得し、データをスプレッドシートに転送します。
- スプレッドシートで、 B 列と C 列にプロットプロファイルから取得したデータを入力します。 B カラムには μm単位の距離が含まれ、 C カラムには対応する蛍光強度(A.U.)のグレー値が含まれます。
- D列はFFT周波数(イベント/μm)に対応し、次のように入力されます。
- サンプリング周波数 (Fs) を計算します: Fs = 1/Δ d (ここで、Δd は距離ステップ (B の 2 番目の値) です)。
- Δfs: Δ Fs= Fs/N (N は B のデータ点数) (256) を計算します。
- FFT周波数(S)の終止値を計算します: S = (N/2) ×ΔFs。
- D列を次のように入力します。
- D 列の最初の値は 0 です。
- D 列の 2 番目のセルを選択し、ホーム メニューに移動して [塗りつぶし] を選択し、[系列] をクリックします。列を選択します。ステップ値には、計算された Δ Fs を使用します。ストップ値には、計算されたSを使用します。
- 次に、 次のように E 列に FFT 複素数値を入力します。
- FFTの計算には距離0が信号0と一致する必要があるため、C列の最初のセルに0を挿入します。
- 次に、[データ]メニュー に移動し、[ データ分析]をクリックして、[ フーリエ解析]を選択します。
- 新しいウィンドウで、入力範囲として列 C に記述されている蛍光シグナルのデータポイントの範囲を選択します。
注:データポイントの数は2n である必要があります(たとえば、蛍光シグナルの256または128データポイント)。 - 出力範囲の E の対応する範囲を選択します。
- [OK] を選択し、FFT 複素数を自動的に入力します。
- 次のように、F列にFFTの大きさを入力します。
- IMABS 関数を使用して、E の複素数から F の絶対値を返し、2/N を掛けて正規化します (式 (2))。
FFT振幅=(IM.ABS(E1...En) × (2/N) (2)
- IMABS 関数を使用して、E の複素数から F の絶対値を返し、2/N を掛けて正規化します (式 (2))。
- F の FFT 振幅を D の FFT 周波数の関数として使用して S まで FFT スペクトルをプロットします。
- 最大ピークのFFT周波数を式(3)で距離に変換します。この計算された距離は、ミトコンドリア分布の縦方向の距離を表します。
距離 (μm) = 1/FFT 周波数 (3)
注:FFT対称性のため、FFTスペクトルの重複を避けるために、データポイントの半分に対応する S 値を超えてFFT周波数をプロットしないでください。
6.画像解析前の画像ノイズを低減するためのオプションの前処理ステップ
- メディアンフィルターまたは 2D デコンボリューションを次のように適用します。
- メディアンフィルターの場合:
- [プロセス] |フィルターを選択し、[中央値]オプションをクリックします。
- 表示された[中央値]ダイアログ ボックスで、[半径]に 2.0 を選択し、[OK]をクリックします。[はい]を選択すると、Mitoスタック内のすべての画像にプロセスが適用されます。
- 画像のノイズの低減を観察します。
- 2Dデコンボリューションの場合:
- 理論上の点像分布関数 (PSF) を生成します。
- プラグインPSF_Generator.jarをダウンロードし、ファイルを「Plugins」フォルダに配置します。
- PSFジェネレータダイアログボックスで、Born & Wolf 3D光学モデルオプションをクリックし、共焦点スキャン中に使用される屈折率浸漬値1.33を入力し、精度計算オプションにBestを選択します。
- 発光波長は576nm、対物レンズのNAは0.7、Zステップは3,000nmで撮影します。
- デコンボリューションする共焦点像の画素サイズXYと、XとYの画素数とZステップ数を示すサイズXYZ(このプロトコルでは3)をキャプチャします。
- PSF ジェネレーターの [表示] メニューで、[linear] オプションをクリックし、[8 ビット解像度] を選択してから、ルックアップ テーブル (LUT) の [grays] オプションを選択します。
- PSF ジェネレーターを実行し、TIFF 形式で作成された理論上の PSF を保存します。
- [イメージ] メニューにある [スタック] オプションの [Z プロジェクト] ツールを開いて、作成された PSF のスライスの合計を作成します。
- 表示された ZProjection ダイアログ ボックスで、[投影タイプ] で [スライスの合計] を選択し、[OK] をクリックします。新しい PSF を TIFF 形式で保存します。
注:理論上のPSFの代わりに、直径が既知の共焦点走査型蛍光マイクロビーズによって実験的に得られたPSFを使用できます。 - プラグイン「DeconvolutionLab_2.jar」19 をダウンロードし、プラグインフォルダに配置します。
- メニュー の [Plugins] をクリックします。次に、[ DeconvolutionLab2] をクリックします。
- [画像]メニューの[スタック]オプションから[スタックする画像]ツールを使用して、水戸スタックから共焦点画像を分離し、TIFF形式で保存します。
- DeconvolutionLab2ダイアログボックスで、Mitoスタックから取得した画像の1つを選択します。作成した理論上の PSF を選択し、15 回の反復でアルゴリズム Richardson-Lucy を選択します。
- DeconvolutionLab2を実行し、画像の信号改善とノイズ低減を検証し、TIFF形式で保存します。
- メディアンフィルターの場合:
- ステップ 4.4 に進み、画像解析を行います。
- デコンボリューションされたイメージの閾値処理では、閾値処理中に 8 ビット マスクに変換します。[イメージ] メニューの [スタック] ツールで [スタックするイメージ] を選択して、バイナリ イメージとデコンボリューション イメージでスタックを作成します。
- デコンボリューションされたイメージの FFT 解析では、プロット プロファイルにはピクセル単位の距離が含まれます。ピクセル単位を 次のように μm に変換します。
- スプレッドシートで、手順 5.4 を完了した後、B から A にデータを転送します。次に、A の各ピクセル番号にピクセル サイズを掛けて、B に μm 単位の距離を入力します。
結果
本プロトコルに従って、ミトコンドリアの密度および分布の分析は生きている骨格筋で達成することができる。プロトコルは3つの主要な段階に分けられる:骨格筋束の解剖、共焦点顕微鏡検査のスキャンおよびイメージ分析。ワークフローの概要を 図 1 に示します。 図2A は、ペトリ皿内のラット腓腹筋全体を示し、繊維が得られる側頭部に印を付け、 図2B はリラックス液中の繊維束を示しています。共焦点顕微鏡では、蛍光インジケーターTMREを使用して、生きた骨格筋線維の深さに沿ってミトコンドリアを記録することができます。TMREは、ミトコンドリア膜電位20に従ってミトコンドリア内に選択的に蓄積される親油性カチオン性蛍光色素です。
IMFの最適な共焦点画像は、ファイバー内の深さ15 μmを超えるZ距離を選択することで得られます(図3A)。 図3B は、腓腹筋線維のZ距離(15〜21μm)に沿って取得したTMREをロードしたミトコンドリアの代表的なXY共焦点画像を示しています。共焦点画像を閾値処理してバイナリ画像に変換し、ミトコンドリア解析を可能にしました。 図3B (左パネル)は、運動させたリーンラットの繊維を示しています。これは、骨格筋線維ミトコンドリアの線維に沿って一貫したパターンを有するため、予想される共焦点記録を表しています。対照的に、ミトコンドリアの含有量と分布に大きな変化を示すObラット(図3B、右パネル)から繊維を選択しました。 図3C は、ミトコンドリアが占める繊維面積をミトコンドリア密度として表したもので、各二値化画像(パネル B)から得られたものです。予想通り、Ob線維はミトコンドリア密度が低かった。ミトコンドリア密度を15、18、21 μmで取得した3つの共焦点画像に適合させたスタックごとに計算した場合にも、 図3D で観察される分析したZ距離に沿って一貫して定量化しました。
ミトコンドリア密度分析と同様に、TMREなどの生細胞イメージング用の蛍光インジケーターの共焦点スキャンにより、生きた骨格筋におけるミトコンドリアの縦方向の組織を研究することができます。IMFは、TT7に近いIバンドの周期的な組織を提示し、FFTによって分析して、ミトコンドリアシグナルの周波数と組織のレベルを定量化することができる17。図4は、痩せたラットとObラットに由来する腓腹筋に見られるIMFの組織の違いと、FFTによってミトコンドリアシグナルの分布の変化を見つける方法を示しています。図4A、Bは、FFT分析のためにファイバーの中央位置と横方向の位置で選択された縦方向のROIを示しています。FFTを実行する前に、バックグラウンド減算の閾値が計算されます。次に、画像は2値化されます。これらの手順により、ミトコンドリアシグナルの蛍光強度レベルの変動が排除されます。バイナリ画像は、FFTの実行に必要な蛍光分布のプロットプロファイルを提供します。
図4C、D は、パネル A と B で選択したROIをプロットプロファイルとともに示しています(上部パネル)。プロットプロファイルから、リーンラットとオビットラットに由来する繊維間の蛍光分布の違い、および同じファイバー内のROI間の変動を観察できます。各プロットプロファイルについて、それぞれのFFTスペクトルが表示されます(下のパネル)。最大FFTスペクトルのピークは、長手方向の軸に沿ったミトコンドリアシグナル分布のFFT周波数(X軸)を示す。これは、リーンラットの外側および中央のROIで2μmに近い距離値に変換できます。特に、ピークのFFTの大きさはミトコンドリアシグナルの規則性の指標であり、この振幅の変化はミトコンドリア分布の変化を明らかにします。
図4E、Fは、側方ROIと中央ROIをそれぞれ分析したリーンファイバーとObファイバーのFFTスペクトルの違いを示しています。横方向のROI(図4E)では、ミトコンドリアの縦方向分布の頻度は、細い繊維とOb由来の繊維で類似していました。それにもかかわらず、Ob由来ファイバーの最大FFTピークの振幅は高く、これは図4Bの画像で観察された信号のより高い規則性と一致しています。それにもかかわらず、Obの中央ROI(図4F)は、ミトコンドリア分布の重要な変化が存在する場合、リーンと比較してFFTピークが有意に減少する例として観察されます。
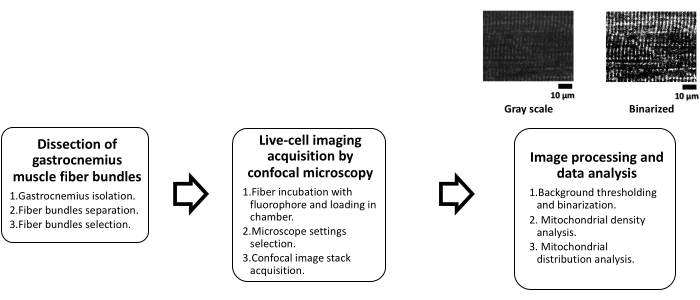
図1:共焦点顕微鏡による骨格筋のミトコンドリア分析のスキーム。 このスキームは、プロトコルの主なステップを3つのフェーズにまとめたものです。第1段階である腓腹筋線維束の解剖は、腓腹筋の分離という3つのステップに細分化され、続いて筋肉の機械的解剖を束に分解して、最終的に実行可能なものを視覚的に選択します。第2段階では、共焦点顕微鏡による生細胞イメージングの取得を行い、蛍光色素(TMRE)と室温で20分間インキュベートしてファイバーをチャンバーに入れます。その後、顕微鏡で適切な設定を行い、共焦点画像の取得を行います。第3段階では、共焦点画像処理とデータ解析を行います。まず、画像処理では、ミトコンドリア密度の計算やFFTによるミトコンドリア分布を行うバイナリ画像を生成するための閾値が必要です。略語:TMRE =テトラメチルローダミンエチルエステル;FFT = 高速フーリエ変換。 この図の拡大版をご覧になるには、ここをクリックしてください。
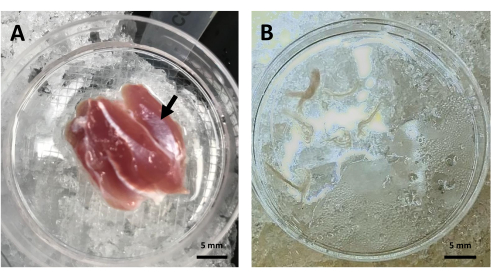
図2:骨格筋束の解剖。(A) ラットの腓腹筋外側頭部(黒矢印)をリラックス液入りペトリ皿で解剖した。 (B) TMREローディング前のリラックス液中の腓腹筋線維束の代表画像。略語:TMRE =テトラメチルローダミンエチルエステル。 この図の拡大版をご覧になるには、ここをクリックしてください。
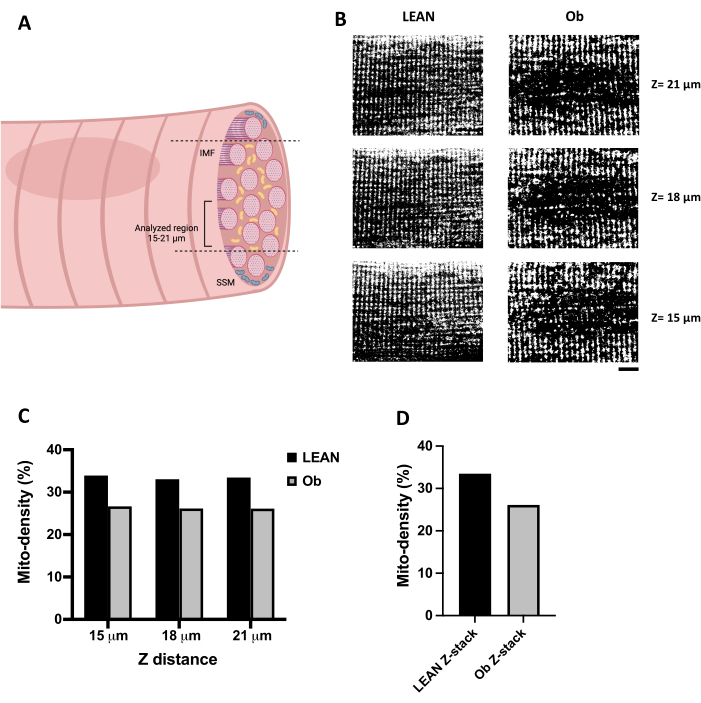
図3:ミトコンドリア密度分析。 (A)骨格筋線維中のIMFミトコンドリアの共焦点スキャンに推奨されるZ距離を表す図。(B)運動したZucker +/+ラット(Lean)および肥満のZucker fa/fa ラット(Ob)からZ距離(深さ15〜21μm)で記録された、骨格筋線維にTMREをロードしたミトコンドリアの一連の共焦点画像。画像は閾値処理によって処理され、バイナリ画像に変換されました。(C)パネル Bで観察された異なるZ距離で得られた共焦点スライスの計算されたマイト密度。(D)パネル Bで観察された画像によって構成されたスタックから得られたマイト密度。パネル Bの画像は65 x 50 μmです。スケールバー = 10 μm。 略語: 有糸分裂密度 = ミトコンドリア密度;IMF = 筋原線維間ミトコンドリア;ob =肥満;SSM = 筋骨下ミトコンドリア。 この図の拡大版をご覧になるには、ここをクリックしてください。
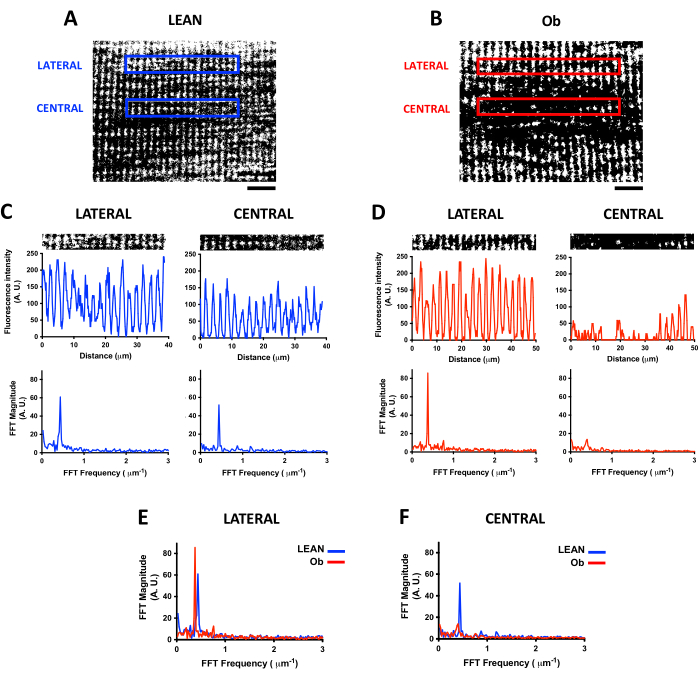
図4:FFTによるミトコンドリア分布解析 運動したZucker +/+ラット(Lean、パネル A)および肥満のZucker fa/fa ラット(Ob、パネル B)から得られた骨格筋線維の深さ21 μmで取得した蛍光指示薬TMREを装填したミトコンドリアの代表的な共焦点画像。画像は閾値処理によって処理され、バイナリ画像に変換されました。パネル A (パネル C)とパネル B (パネル D)の横方向および中央のROIと、蛍光強度(上のプロット)とFFTスペクトル(下のプロット)のそれぞれのプロットプロファイル。FFTは、パネル A の39 x 5 μmのROIサイズとパネル Bの50 x 5 μmのROIサイズに対応する幅256ピクセルのROIから計算されました。パネル E は、側方ROIにおけるリーンラット由来のミトコンドリアとObラット由来のFFTスペクトルの違いを示し、パネル F は、中央ROIのFFTスペクトルの違いを示しています。スケールバー = 10 μm。 略語: A.U. = 任意の単位;FFT = 高速フーリエ変換。ROI = 関心領域;ob = 肥満。 この図の拡大版をご覧になるには、ここをクリックしてください。
| 試薬 | 最終濃度:100 mL | 株式 |
| K-アスパラギン酸 | 100ミリメートル | |
| KClの | 20ミリメートル | |
| ヘペス | 20ミリメートル | |
| L-グルタミン酸 | 3ミリメートル | |
| リンゴ酸 | 3ミリメートル | |
| EGTAの | 0.1ミリメートル | 10ミリメートル |
| MgClの2 | 1 mM 遊離 Mg2+ | |
| CaCl 2 (カリウム2) | 0.00002 mM 遊離 Ca2+ | |
| クレアチンリン酸ジ-Na | 5ミリメートル | 500ミリメートル |
| クレアチンホスホキナーゼ | 5 U/mL | 200 U/mLの |
| MgATPの | 5ミリメートル | |
| pH 7.3(NaOHを含む) |
表1:リラックス溶液試薬と濃度。
補足図S1:画像前処理方法の効果。 (A)運動したZucker +/+ラット(痩せた、上段)および肥満のZucker fa /fa ラット(下段)から得られた骨格筋線維中の深さ18μmで取得した蛍光指示薬TMREを装填したミトコンドリアの代表的な共焦点画像と、Otsu'閾値、メディアンフィルターおよびOtsu'閾値を用いた前処理後に得られたそれぞれの画像、 2DデコンボリューションとOtsuの閾値化。(B)異なる方法で前処理を行った後の共焦点画像(パネル A)から得られたマイト密度のプロファイルをプロットします。パネル A の画像は65 x 50 μmです。スケールバー = 10 μm。略語:2D-Decon = 2Dデコンボリューション。有糸分裂密度=ミトコンドリア密度。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ミトコンドリアは、高いリモデリング能力を持つ細胞小器官です。ミトコンドリアの動態1として知られるミトコンドリアの融合と分裂のメカニズムの活性化と、ミトコンドリアの代謝回転メカニズムであるミトコンドリアの生合成と特殊なミトコンドリア分解経路(マイトファジー21,22)のバランスによって、その含有量、密度、分布を急速に変化させることができます.ミトコンドリアの含有量と形態は、細胞の種類と発生段階に応じて変化し得、異なる生理学的および病理学的刺激の下でリモデリングすることができる17,22,23,24。したがって、ミトコンドリア形態の研究は半世紀以上にわたって関連してきました25。特に、電子顕微鏡によるミトコンドリアの分析は、複数の研究で適用されている標準的な手法です26。
共焦点顕微鏡による蛍光研究は、異なる繊維深さでのミトコンドリアの生細胞イメージングの能力により、過去数年間で関連性を増しており、さまざまな適応条件および不適応条件における骨格筋におけるミトコンドリアの役割をよりよく理解するのに役立つ可能性があります27。本研究では、共焦点顕微鏡による生きた骨格筋線維中のミトコンドリア密度と分布の解析方法について述べる。生きた骨格筋線維を扱う際の主な課題の1つは、単離プロセスからミトコンドリア共焦点記録までの収縮を回避することです。この目標を達成するために、高MgおよびATPリラックス溶液17を使用して、ファイバーを少なくとも2時間弛緩させ、ファイバー単離プロセス、蛍光色素負荷、および共焦点顕微鏡によるミトコンドリアシグナルの獲得を実行するのに十分な時間を与える。プロトコルの重要なポイントは、高精度で新鮮な組織を必要とするため、繊維を機械的に入手することです。しかしながら、この以前に使用され報告された技術28を用いてラットの筋肉から生存可能な繊維束を得ることは可能である。無傷の繊維を得ることで、筋膜と細胞内環境を保存し、細胞構造間の代謝的および機能的クロストークを維持することができます28,29。
組織や固定細胞での作業とは異なり、共焦点顕微鏡による生細胞イメージング蛍光画像の取得により、さまざまな実験条件の影響をリアルタイムでモニタリングできます。本プロトコルは、ミトコンドリアの密度と分布の変化をリアルタイムで調査し、ここで紹介した細い繊維とOb由来の繊維(図3 および 図4)の例など、実験グループ間の違いを調べるために使用できます。生細胞イメージングは、細胞損傷を軽微な状態で最適な作業条件を標準化することを意味することを常に考慮する必要があります。作業時間、使用する溶液の品質、取得パラメータ、およびレーザーの露光を細かく制御する必要があります。したがって、重要な考慮事項を以下に示します。
筋線維のミトコンドリアは、線維のサイズと長時間のレーザー照射によって引き起こされる可能性のある線維の損傷のために、共焦点顕微鏡で完全に縦方向に記録することはできません。それにもかかわらず、繊維の代表的なサンプルは、この技術の下で記録される。共焦点顕微鏡ではラットの骨格筋線維の全厚さを記録することは可能ですが、これは記録時間が長くなり、レーザー光線への曝露が長くなることを意味します。対照ラットの場合、これらの記録に関する問題は発生していません。ただし、病理学的状態からの繊維は、Obラットからの繊維に見られるように、損傷を受けやすい可能性があります。したがって、異なるZ距離で得られた代表的な共焦点画像のスタックを取得することが好ましい。繊維の厚さの一部のみが記録されている場合、ミトコンドリアの分布と密度は繊維内の位置によって異なる可能性があるため、テストしたすべての繊維で同じ深さでスタックを取ることをお勧めします。IMFの代表的な共焦点画像を得るためには、15 μmを超える深さでシグナルを取得することが推奨され、周辺部に近いSSM集団は避けてください。
共焦点取得の際には、いくつかの重要な考慮事項を考慮する必要があります。まず、倍率、高NA、および液浸媒質を考慮した液浸対物レンズの選択。細胞は親水性のインキュベーション培地で維持されるため、良好なシグナルを得て組織の奥深くまでスキャンするには、インキュベーション培地と浸漬培地の屈折率が類似している必要があります。通常、水浸対物レンズを使用して達成されます。図 3 と 図 4 の共焦点画像は、20 倍、0.7 NA の水浸対物レンズで取得しました。この対物レンズでは、ファイバーの深さをすべて記録することができますが、IMFの代表的な共焦点画像は、高い蛍光強度シグナルと軽微なファイバー損傷で取得できるため、15、18、および21 μmでのスキャンを決定しました。40倍や油浸媒質など、他の倍率も検討できますが、評価する必要があります。
第2に、画像取得のための画素サイズはナイキスト定理に従って計算され、オーバーサンプル(より高いレーザー露光)およびアンダーサンプル(解像度の低下につながる)を回避する適切な画素サイズの選択を可能にする30。計算は、選択した対物レンズの特性と波長(~90 nm)によって異なります。ズームで調整できます。したがって、ズーム設定は 1 つだけで、最適なピクセル サイズ30 が得られます。それにもかかわらず、実際には、ズームは分析する標本の面積にも依存します。したがって、バランスを見つけることで、ナイキスト基準に最も近く、分析する領域にも適合するピクセルサイズで作業できます。図 3 と 図4 は、150nmと190nmのピクセルサイズで取得され、50~80μmのファイバーの全幅の分析が可能になりました。
第3に、ピンボケの光が検出器に入らないように適切なピンホール径を使用する必要があります。典型的には、1エアリーは、焦点30の平面から発信される光子の~80%の検出を可能にするので、最適なピンホールサイズと考えられる。それにもかかわらず、低い蛍光レベルを示すいくつかの染色された生物学的サンプルは、ピンホールの増加を必要とします30。図 3 と 図4 の共焦点画像は、低エアリーで低信号が撮影されたため、ピンホールサイズ3エアリーで取得されました。ピンホールサイズを大きくすることによる信号強度の上昇は、ピントの合っていない捕捉光の増加による分解能の低下につながることを考慮することが重要です。このため、できるだけ1エアリーに近いピンホールサイズを使用することをお勧めします。
適切に取得されると、共焦点画像を処理して、ミトコンドリアの密度と分布に関する定量的な情報を得ることができます。いずれにせよ、信号の定量化を改善するために、解析の前に閾値処理の重要な画像処理ステップを実行する必要があります。この重要なステップでは、ミトコンドリアの正のピクセルと背景の正のピクセルを分離する蛍光強度値が定義されます。閾値は、画像のヒストグラムが背景とミトコンドリアに対応する2つのピークを表示する場合、ミトコンドリアを表すピークのガウス近似によって定義することができる。ただし、各画像でバイモーダル分布が常に達成されるとは限らないため、他の閾値処理方法を適用する必要があります。
このプロトコルでは、2つのピークが分離されていないか、または他のピークが存在する場合に閾値を見つけるように設計されたノンパラメトリックで教師なしの方法であるOtsuの閾値化の実装が説明されています31。Otsuは、生体画像解析のためのオープンソースプラットフォームを使用して簡単に適用できます。ただし、他のしきい値処理方法をテストできます。すべての共焦点画像に同じ閾値法を適用する必要があり、共焦点画像ごとに個別に計算する必要があります。しきい値をスタック全体に適用すると、誤った結果になります。閾値処理後にバイナリ画像が得られると、ミトコンドリア密度とFFTの分析は、このプロトコルに記載されている指示に従うことで簡単に実行できます。ただし、両方の分析を行う場合は、定量誤差につながるため、核と毛細血管を含めないように注意する必要があります。密度に関しては、分析するピクセルまたは総面積からピクセル、または核または毛細血管が占める面積を差し引くだけで十分です。また、FFT解析を行う際には、ミトコンドリアのシグナルがまっすぐであることを確認する必要があります。逆に、ミトコンドリア信号が傾いていると、ミトコンドリアの縦方向分布を表さないプロファイルが生成され、誤ったFFTスペクトルデータが生成される可能性があります。さらに、前処理ステップを適用して、画像のノイズを低減することができます。このプロトコルでは、メディアンフィルタと2Dデコンボリューションを使用した2つのオプションの前処理ステップについて説明します。これらの前処理方法が画像およびミトコンドリア密度含有量に及ぼす影響を補足 図S1に示す。これらの前処理は画質を向上させることができますが、特定の画像の詳細が失われる可能性があることを考慮することが重要です。したがって、これらは注意して使用し、分析されるすべての画像に一貫して適用する必要があります。
その利点にもかかわらず、共焦点顕微鏡は、取得のための最適な条件が実装されている場合、180〜250nmの横方向の分解能(XY)によって制限されます32。ミトコンドリアの直径は~200-700 nmで、共焦点顕微鏡の回折限界に近い。したがって、サブミトコンドリア構造は適切に検出できず33 、このプロトコルに示されている密度およびFFT分析によって評価することはできません。確率的光学再構成顕微鏡法(STORM)、誘導放出枯渇法(STED)ナノスコピー法、または構造化照明顕微鏡法(SIM)などの顕微鏡の他の超解像技術を、サブミトコンドリア構造を分解するために検討することができる32。このプロトコルでは、ミトコンドリアの共焦点イメージはミトコンドリアの膜の潜在性によって決まるfluorophore TMREを使用して得られる。したがって、ミトコンドリアの蛍光強度は、膜電位に応じて変化する可能性があります。この問題を克服するために、データ分析の前にしきい値処理が実行されます。定義された閾値を超えるすべてのピクセルは、蛍光値とは無関係にミトコンドリアシグナルに対して陽性と見なされます。それにもかかわらず、膜電位が非常に低いミトコンドリアは、この技術では解決できないことに注意する必要があります。したがって、ミトコンドリアタンパク質含量の定量に関する補完的な研究が推奨されます。TMREを用いる利点は、共焦点画像をミトコンドリア膜電位解析にも使用できることですが、カルボニルシアニド-p-トリフルオロメトキシフェニルヒドラゾン(FCCP)などの脱共役剤による適切な制御を行う必要があります。また、ミトコンドリアの密度や分布の解析は、膜電位に関係なくミトコンドリアに負荷をかけるミトコンドリア用の緑色蛍光インジケーターを用いて行うことができますが、インキュベーション戦略や共焦点取得設定の標準化が必要です。
ミトコンドリアの構造が必須のミトコンドリアおよび細胞機能に関連していることを考えると、ここに記述されているプロトコルは病気の間にまたは特定の圧力の侮辱によって改造についての貴重な情報を提供できる。この研究は、ミトコンドリアが支配する骨格筋のエネルギー産生などの重要な機能や、ミトコンドリアが他の細胞小器官との相互作用において重要な役割を果たす(収縮と代謝の結合など)の理解を深めることに寄与する可能性がある。プロトコルの指示に従うことで、生きている骨格筋のミトコンドリア密度と分布を推定することができます。プロトコールのステップは、骨格筋束の解剖、共焦点顕微鏡スキャン、画像解析に焦点を当てた3つの主要な段階に分かれており、詳細な手順と重要な考慮事項が含まれています。特に、このプロトコルをさらに最適化して、ユーザーのニーズに応じてファイバー内の完全なミトコンドリア再構成のための追加のZステップを探索することができます。例えば、共焦点画像と解析のステップをテストして、ライブサンプルと固定サンプルのTTなど、同様の分布を持つ細胞構造を研究することができます。
開示事項
著者らは、利益相反がないことを宣言します。
謝辞
この研究は、モンテレイ工科大学の医学部と肥満研究所の支援を受けました。 図3A は、Scientific Image and Illustrationソフトウェアで作成しました。
資料
| Name | Company | Catalog Number | Comments |
| Adenosine 5’-triphosphate disodium salt hydrate | Sigma-Aldrich | A6419 | |
| Borosilicate glass coverslip | Warner Instruments | 64-0709 | |
| Calcium chloride | Sigma-Aldrich | C5670 | |
| Confocal microscope | Leica | TCS SP5 | |
| Confocal microscope software Leica Application Suite | Leica | 2.7.3.9723 | |
| Creatine Phosphokinase | Sigma-Aldrich | C3755 | |
| DeconvolutionLab2 (DeconvolutionLab_2.jar) | Biomedical Imaging Group, EPFL | http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/ | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D2650 | |
| DL-Aspartic acid potassium sat hemihydrate | Sigma-Aldrich | 11240 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N´N´-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Forceps | Miltex | MH-18 | |
| HC PL APO 20x/ 0.7 IMM objective | Leica | 506517 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Iris scissors | Miltex | 5-304 | |
| L-(-)-Malic acid | Sigma-Aldrich | M7397 | |
| L-glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2393 | |
| Maxchelator | UC Davis Health | https://somapp.ucdmc.ucdavis.edu/pharmacology/bers/maxchelator/downloads.htm | |
| Micro scissors | Miltex | 18-1633 | |
| Open-source platform for biological-image analysis Fiji | Public, maintained by Eliceiri/LOCI group, Jug group, and Tomancak lab.Fiji | https://fiji.sc/ | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium chloride | Sigma-Aldrich | P9333 | |
| PSF Generator (PSF_Generator.jar) | Biomedical Imaging Group, EPFL | http://bigwww.epfl.ch/algorithms/psfgenerator/ | |
| Recording chamber | Warner Instruments | RC-27N | |
| Sodium hydroxide | Sigma-Aldrich | S5881 | |
| Spreadsheet Microsoft Excel | Microsoft | ||
| Stereo microscope | Zeiss | Stemi 508 | |
| Tetramethylrhodamine, ethyl ester | Invitrogen | T669 |
参考文献
- Lackner, L. L. Shaping the dynamic mitochondrial network. BMC Biology. 12, 35(2014).
- De Mario, A., Gherardi, G., Rizzuto, R., Mammucari, C. Skeletal muscle mitochondria in health and disease. Cell Calcium. 94, 102357(2021).
- Chang, C. R., Blackstone, C. Dynamic regulation of mitochondrial fission through modification of the dynamin-related protein Drp1. Annals of the New York Academy of Sciences. 1201, 34-39 (2010).
- Willingham, T. B., Ajayi, P. T., Glancy, B. Subcellular specialization of mitochondrial form and function in skeletal muscle cells. Frontiers in Cell and Developmental Biology. 9, 757305(2021).
- Kuznetsov, A. V., et al. Mitochondrial subpopulations and heterogeneity revealed by confocal imaging: possible physiological role. Biochimica et Biophysica Acta. 1757 (5-6), 686-691 (2006).
- Díaz-Vegas, A. R., et al. Mitochondrial calcium increase induced by RyR1 and IP3R channel activation after membrane depolarization regulates skeletal muscle metabolism. Frontiers in Physiology. 9, 791(2018).
- Boncompagni, S., et al. Mitochondria are linked to calcium stores in striated muscle by developmentally regulated tethering structures. Molecular Biology of the Cell. 20 (3), 1058-1067 (2009).
- Reggiani, C., Marcucci, L. A controversial issue: Can mitochondria modulate cytosolic calcium and contraction of skeletal muscle fibers. The Journal of General Physiology. 154 (9), e202213167(2022).
- Heinzel, F. R., et al. Remodeling of T-tubules and reduced synchrony of Ca2+ release in myocytes from chronically ischemic myocardium. Circulation Research. 102 (3), 338-346 (2008).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skeletal Muscle. 1 (1), 26(2011).
- Pérez-Treviño, P., Pérez-Treviño, J., Borja-Villa, C., García, N., Altamirano, J. Changes in T-tubules and sarcoplasmic reticulum in ventricular myocytes in early cardiac hypertrophy in a pressure overload rat model. Cellular Physiology and Biochemistry. 37 (4), 1329-1344 (2015).
- Celestino-Montes, A., Pérez-Treviño, P., Sandoval-Herrera, M. D., Gómez-Víquez, N. L., Altamirano, J. Relative role of T-tubules disruption and decreased SERCA2 on contractile dynamics of isolated rat ventricular myocytes. Life Sciences. 264, 118700(2021).
- Song, L. S., et al. Orphaned ryanodine receptors in the failing heart. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4305-4310 (2006).
- Houzelle, A., et al. Human skeletal muscle mitochondrial dynamics in relation to oxidative capacity and insulin sensitivity. Diabetologia. 64 (2), 424-436 (2021).
- Call, J. A., et al. Ulk1-mediated autophagy plays an essential role in mitochondrial remodeling and functional regeneration of skeletal muscle. American Journal of Physiology. Cell Physiology. 312 (6), C724-C732 (2017).
- Fealy, C. E., Grevendonk, L., Hoeks, J., Hesselink, M. K. C. Skeletal muscle mitochondrial network dynamics in metabolic disorders and aging. Trends in Molecular Medicine. 27 (11), 1033-1044 (2021).
- Rivera-Alvarez, I., et al. A single session of physical activity restores the mitochondrial organization disrupted by obesity in skeletal muscle fibers. Life Sciences. 256, 117965(2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2022).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes, and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Ma, K., et al. Mitophagy, mitochondrial homeostasis, and cell fate. Frontiers in Cell and Developmental Biology. 8, 467(2020).
- Meinild, L. A. -K., et al. Exercise training increases skeletal muscle mitochondrial volume density by enlargement of existing mitochondria and not de novo biogenesis. Acta Physiologica. 222 (1), (2018).
- Memme, J. M., Erlich, A. T., Phukan, G., Hood, D. A. Exercise and mitochondrial health. Journal of Physiology. 599 (3), 803-817 (2021).
- Gan, Z., Fu, T., Kelly, D. P., Vega, R. B. Skeletal muscle mitochondrial remodeling in exercise and diseases. Cell Research. 28 (10), 969-980 (2018).
- Schiaffino, S., Hanzlíková, V., Pierobon, S. Relations between structure and function in rat skeletal muscle fibers. Journal of Cell Biology. 47 (1), 107-119 (1970).
- Vincent, A. E., et al. The spectrum of mitochondrial ultrastructural defects in mitochondria myopathy. Scientific Reports. 6, 30610(2016).
- Mishra, P., Varuzhanyan, G., Pham, A. H., Chan, D. C. Mitochondrial dynamics is a distinguishing feature of skeletal muscle fiber types and regulates organellar compartmentalization. Cell Metabolism. 22 (6), 1033-1044 (2015).
- Cheng, A. J., Westerblad, H. Mechanical isolation, and measurement of force and myoplasmic free [Ca2+] in fully intact single skeletal muscle fibers. Nature Protocols. 12 (9), 1763-1776 (2017).
- Kuznetsov, A. V., Javadov, S., Margreiter, R., Hagenbuchner, J., Ausserlechner, M. J. Analysis of mitochondrial function, structure, and intracellular organization in situ in cardiomyocytes and skeletal Muscles. International Journal of Molecular Sciences. 23 (4), 2252(2022).
- Pawley, J. B. Fundamental limits in confocal microscopy. In: Pawley, J. (eds) Handbook of Biological Confocal Microscopy. , Springer, Boston, MA. (2006).
- Otsu, N. A. Threshold selection method from gray-level histogram. IEEE Transactions on System Man Cybernetics. 9, 62-66 (1979).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Jakobs, S., Stephan, T., Ilgen, P., Brüser, C. Light microscopy of mitochondria at the nanoscale. Annual Review of Biophysics. 49, 289-308 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved