Method Article
Analyse de la densité mitochondriale et de la distribution longitudinale dans les fibres musculaires squelettiques vivantes du rat par microscopie confocale
Dans cet article
Résumé
Nous présentons ici un protocole permettant d’analyser les changements de densité mitochondriale et de distribution longitudinale par imagerie des muscles squelettiques vivants à l’aide de la microscopie confocale pour le balayage du réseau mitochondrial.
Résumé
La mitochondrie est un organite qui peut être allongé, fragmenté et renouvelé en fonction des besoins métaboliques des cellules. Le remodelage du réseau mitochondrial permet à des mitochondries saines de répondre aux demandes cellulaires ; Cependant, la perte de cette capacité a été liée au développement ou à la progression de différentes pathologies. Dans le muscle squelettique, des changements de densité et de distribution mitochondriales sont observés dans des conditions physiologiques et pathologiques telles que l’exercice, le vieillissement et l’obésité, entre autres. Par conséquent, l’étude du réseau mitochondrial peut permettre de mieux comprendre les mécanismes liés à ces conditions.
Ici, un protocole pour l’imagerie mitochondriale des fibres musculaires squelettiques vivantes de rats est décrit. Les fibres sont disséquées manuellement dans une solution relaxante et incubées à l’aide d’un indicateur fluorescent d’imagerie de cellules vivantes des mitochondries (ester éthylique de tétraméthylrhodamine, TMRE). Le signal mitochondrial est enregistré par microscopie confocale en utilisant le mode de balayage XYZ pour obtenir des images confocaux du réseau mitochondrial intermyofibrillaire (FMI). Après cela, les images confocaux sont traitées par seuillage et binarisation. L’image confocale binarisée tient compte des pixels positifs pour les mitochondries, qui sont ensuite comptés pour obtenir la densité mitochondriale. Le réseau mitochondrial dans le muscle squelettique est caractérisé par une forte densité de population IMF, qui a une distribution longitudinale périodique similaire à celle des tubules T (TT). La transformée de Fourier rapide (FFT) est une technique d’analyse standard réalisée pour évaluer la distribution des TT qui permet de trouver la fréquence de distribution et le niveau de leur organisation. Dans ce protocole, l’implémentation de l’algorithme FFT est décrite pour l’analyse de la distribution mitochondriale longitudinale dans le muscle squelettique.
Introduction
Les mitochondries forment des réseaux hautement dynamiques qui sont principalement régulés par l’équilibre entre son élongation (fusion) et sa fragmentation (fission)1,2, qui sont modulés par l’expression et l’activité de protéines telles que la mitofusine 1 et 2 (Mfn1 et Mfn2), et l’atrophie optique des protéines 1 (Opa1), qui régulent la fusion de la membrane mitochondriale externe et de la membrane interne, respectivement 1,2. La protéine liée à la dynamine (Drp1) régule principalement la fission mitochondriale lorsqu’elle est phosphorylée dans le Ser6163.
Dans le muscle squelettique, il a été bien établi que le réseau mitochondrial est organisé en sous-populations structurellement bien définies en fonction de leur proximité avec différentes régions cellulaires (myofibrilles, sarcolemme et noyaux)4,5. Les mitochondries situées juste en dessous du sarcolemme sont appelées mitochondries sous-sarcolemmales (SSM), celles situées entre les filaments contractiles sont appelées mitochondries intermyofibrillaires (IMF) et la sous-population mitochondriale autour des noyaux est appelée réseau de mitochondries périnucléaires (PMN). De plus, il a été suggéré que ces sous-populations mitochondriales ont des fonctions spécifiques à la région et sont métaboliquement spécialisées 4,5.
Le maintien de l’homéostasie énergétique cellulaire, qui permet la fonction métabolique et contractile, dépend dans une large mesure de l’interaction et de la communication sur des sites spécifiques à travers le réseau mitochondrial (par exemple, l’interaction IMF et SSM)4,6. En plus des interactions du réseau mitochondrial, la mitochondrie peut également interagir avec d’autres organites, formant des complexes structurels et fonctionnels. À cet égard, il a été démontré que l’IMF peut être situé à côté du réticulum sarcoplasmique (SR) et à proximité des unités de libération de Ca2+ (CRU), formées par les tubules transverses (TT)7. Ce fait est pertinent en raison du rôle de l’absorption mitochondriale de Ca2+ dans la régulation de la synthèse de l’ATP et de l’apoptose. Récemment, un rôle potentiel dans la régulation des transitoires cytosoliques Ca2+ a également été suggéré8.
Les TT sont des invaginations du sarcolemme qui ont une distribution périodique le long de l’axe longitudinal des cardiomyocytes et des fibres musculaires squelettiques 9,10, similaire à la distribution IMF 5. Les changements dans la distribution de TT ont des implications physiologiques importantes, étant donné leur rôle dans la fonction contractile. Cependant, ces changements ont été principalement évalués dans les cardiomyocytes. L’utilisation de l’analyse par transformée de Fourier rapide (FFT) permet la conversion de signaux périodiques du domaine des distances au domaine fréquentiel, ce qui donne un spectre FFT qui indique la fréquence et la régularité du signal11,12,13. Bien qu’il existe des preuves que l’organisation du réseau mitochondrial dans les fibres musculaires squelettiques est essentielle pour l’adaptation à différentes conditions métaboliques, comme lors de la régénération après une lésion musculaire14,15, la plupart des analyses sont effectuées qualitativement.
De plus, étant donné que le dysfonctionnement mitochondrial a été associé à plusieurs maladies liées aux muscles squelettiques (par exemple, l’atrophie de la désuétude)2 et non musculaires, en particulier les maladies métaboliques, et à la perte de masse musculaire associée (c’est-à-dire l’atrophie)16, l’évaluation quantitative du réseau mitochondrial et de la distribution dans le muscle squelettique est pertinente. Récemment, une différence significative dans la distribution longitudinale des mitochondries des fibres musculaires gastrocnémiennes entre un groupe obèse (Ob ; Zucker fa/fa rats), et un groupe lean (Lean ; Zucker +/+ rats) a été identifié par FFT17. Cette étude a démontré l’utilité de la FFT dans l’analyse de la distribution mitochondriale. Par conséquent, ce protocole présente une méthodologie pour étudier les mitochondries dans les fibres musculaires squelettiques vivantes à partir d’images obtenues par microscopie confocale à fluorescence. La densité mitochondriale est quantifiée par seuillage de fond, et l’analyse de la distribution mitochondriale longitudinale par analyse FFT est également décrite. Un schéma de flux de travail est présenté à la figure 1.
Protocole
Toutes les procédures d’expérimentation animale ont été évaluées et approuvées par le Comité d’utilisation et de soins aux animaux (CICUAL) de Tecnologico de Monterrey (Protocole 2019-007). Des rats Zucker mâles (+/+ et fa/fa) âgés de 12 à 13 semaines ont été utilisés pour cette étude. Les animaux ont été gardés dans des conditions d’élevage standard (cycle lumière/obscurité de 12 h/12 h, 40 à 60 % d’humidité) et ont eu accès à de la nourriture (nourriture standard pour rats) et à de l’eau ad libitum.
1. Composition de la solution
- Préparez une solution fraîche de Relax en mélangeant les composants indiqués dans le tableau 1. Ajustez le pH à 7,3 à l’aide d’hydroxyde de sodium (NaOH).
- Calculez la concentration de calcium libre dans la solution Relax à l’aide d’un programme de simulation pour déterminer la concentration en métaux libres.
- Préparer un ester méthylique de tétraméthylrhodamine (TMRE) de 5 mM dans du diméthylsulfoxyde (DMSO) et une dilution subséquente de 0,1 mM dans du DMSO.
2. Dissection des faisceaux de fibres musculaires gastrocnémiennes
- Placez l’animal à l’intérieur de la chambre d’induction et fermez le couvercle. Allumez la source d’oxygène, réglez le débit de gaz à 0,5 L/min et réglez le vaporisateur à 4 % de sévoflurane pour induire l’anesthésie.
- Une fois que le rat est endormi, placez-le à l’extérieur de la chambre en position couchée sur le dos tout en maintenant l’anesthésie. Pincez l’orteil ou la queue pour vérifier l’absence de réflexes.
- À l’aide de ciseaux, coupez la peau et les muscles de l’abdomen. Ensuite, coupez la cage thoracique pour accéder au cœur.
- Pour effectuer une cardectomie, saisissez le cœur à partir des veines et des artères les plus hautes avec des pinces et coupez les vaisseaux sanguins avec des ciseaux. Retirez le cœur.
- Immédiatement après l’euthanasie, désinfectez le membre postérieur avec de l’éthanol et rasez-le à l’aide d’une machine à raser.
- Tenez l’arrière-pied et faites une incision avec des ciseaux à travers la peau au niveau du tendon d’Achille.
- Coupez le membre postérieur avec des ciseaux au niveau du tibia proximal. Transférez-le dans une boîte de Pétri de 60 mm contenant 3 mL de solution glacée Relax en position dorsale. Couvrez-le d’une solution suffisante pour éviter que les muscles ne se dessèchent.
- Identifiez le tendon d’Achille, soulevez-le soigneusement avec des pinces et disséquez les muscles de l’os avec des ciseaux à iris. Utilisez un stéréomicroscope à partir de cette étape de la dissection.
- Identifiez et séparez l’ensemble du muscle gastrocnémien, la masse principale à l’arrière du membre postérieur.
- Disséquer et jeter le tissu conjonctif et adipeux entourant le muscle à l’aide d’une pince à pointe fine. Transférez la tête latérale du muscle dans une nouvelle boîte de Pétri avec une solution glacée Relax (voir Figure 2A).
- Tenez doucement le muscle avec une pince à partir d’une extrémité et séparez-le soigneusement en faisceaux avec des microciseaux. Manipulez toujours les paquets en les tenant doucement à une extrémité avec une pince.
REMARQUE : Les faisceaux mesurent environ 10 mm de long et 2 mm de large. - Transférez les faisceaux de fibres dans une nouvelle boîte de Pétri avec 2 mL de solution Relax glacée. Ne sélectionnez que ceux qui ont un aspect lisse, qui sont complets d’un bout à l’autre et qui ne sont pas raccourcis (Figure 2B).
3. Acquisition par imagerie de cellules vivantes de mitochondries dans le muscle squelettique par microscopie confocale
- Incuber les fibres dans 2,5 × 10-4 mM de TMRE dans une solution Relax pendant 20 min à température ambiante.
REMARQUE : Avec les concentrations de travail recommandées de TMRE, on s’attend à ce qu’il soit en mode non trempe. Protéger de l’exposition à la lumière à partir de ce point. - Pendant la période d’incubation :
- Ouvrez le logiciel standard du microscope confocal, sélectionnez le cadre de configuration, puis dans la boîte de dialogue de configuration matérielle , sélectionnez laser et cochez l’option HeNe 543 .
- Dans l’infrastructure d’acquisition, sélectionnez la boîte de dialogue d’acquisition, puis en mode d’acquisition, sélectionnez le groupe de fonctions XYZ.
- Dans la boîte de dialogue XY, sélectionnez le format 512 x 512, la vitesse de 400 Hz et vérifiez le panneau sténopé. Dans la boîte de dialogue sténopé affichée, sélectionnez AU pour l’unité et ajoutez une valeur de 3 Airy pour le sténopé.
REMARQUE : Envisagez de réduire la taille du trou d’épingle le plus proche du critère optimal 1 Airy, si un signal de fluorescence adéquat est conservé. - Dans la boîte de dialogue Paramètres de la trajectoire du faisceau , sélectionnez un objectif d’immersion dans l’eau de 20x et une ouverture numérique (NA) de 0,7 (20x/0,7 IMM), puis sélectionnez la fenêtre de longueur d’onde d’émission de 576 à 700 nm. Sélectionnez DD488/543 et 15 % de la puissance laser pour le laser 543.
REMARQUE : Un objectif à immersion dans l’eau pour la numérisation par imagerie en direct est fortement recommandé (si disponible). Étant donné qu’un indice de réfraction similaire du milieu d’immersion et du milieu d’incubation est atteint.
- Après 20 min d’incubation, changez deux fois le milieu d’incubation. S’assurer que les images confocaux sont acquises dans les 20 à 30 minutes suivant l’incubation.
- Préparez la chambre d’enregistrement avec une lamelle de 0,15 mm en verre borosilicaté.
REMARQUE : Sélectionnez l’épaisseur de la lamelle en fonction de la chambre d’enregistrement disponible, en tenant compte du fait que l’épaisseur varie généralement de 0,15 à 0,22 mm pour des performances optimales. - Ajoutez 200 μL de solution Relax dans la chambre d’enregistrement et transférez les faisceaux de fibres.
- Dans le microscope confocal, utilisez le mode fond clair pour identifier les fibres viables pour l’enregistrement fluorescent des mitochondries. Les fibres viables sont complètes, non contractées et ont un motif de striation intact.
- Séparez les faisceaux de fibres les uns des autres et alignez-les avec des pinces. Sélectionnez ceux qui sont les plus proches de la lamelle.
- Analysez la fluorescence à l’aide du bouton Live pour régler le gain et le décalage dans la console du Panneau de configuration, en tenant compte des éléments suivants :
- Sélectionnez des valeurs d’intensité fluorescente faibles pour un arrière-plan proche de 0 unité arbitraire (UA).
- Sélectionnez un niveau de gain compris entre 100 et 200 A.U. pour éviter la saturation du système d’enregistrement. Par conséquent, n’enregistrez pas les niveaux de fluorescence les plus élevés.
- Sélectionnez une taille de pixel comprise entre 150 et 190 nm pour acquérir toute la largeur de la fibre, en ajustant le facteur de zoom dans la boîte de dialogue XY .
REMARQUE : Envisagez d’utiliser la taille de pixel plus proche des critères de Nyquist (90 nm), ce qui permet de scanner toute la largeur de la fibre.
- Dans la boîte de dialogue Pile Z, ajustez la distance Z pour acquérir le signal de fluorescence à partir d’une profondeur de fibre de 15 μm (bouton de début) jusqu’à 22 μm (bouton de fin). Sélectionnez 3 μm comme taille de pas en Z.
- Cliquez sur le bouton Démarrer pour acquérir les images confocaux. Obtenir une pile Z composée de trois images confococaux acquises à 15, 18 et 21 μm de profondeur.
4. Analyse de la densité mitochondriale
- Dans la plate-forme open source pour l’analyse d’images biologiques18, ouvrez le fichier Z-stack et faites pivoter les images pour placer la fibre horizontalement, comme illustré à la figure 3B.
- Sélectionnez au hasard une région d’intérêt rectangulaire (ROI) qui inclut la zone occupée par les mitochondries (ROImito). Sélectionnez des tailles de mito ROI allant de 65 à 90 μm pour X. Pour Y, la taille dépendra de la largeur de la fibre, en évitant sa périphérie.
- Dupliquez la pile Z avec le mitoROI sélectionné et enregistrez-la en tant que nouvelle pile Z (pile Mito) au format TIFF. Enregistrez la position ROI mito sélectionnée sur la pile d’origine à l’aide de l’outil ROI Manager.
- Calculez le seuil de soustraction de l’arrière-plan comme suit :
- Utilisez le raccourci Commande+Maj+T pour ouvrir la boîte de dialogue Seuil .
- Sélectionnez l’algorithme de seuil Otsu |N&B | Option d’arrière-plan sombre . Observez que l’image est maintenant binarisée.
- Dans la boîte de dialogue Seuil , observez l’histogramme de la distribution de l’intensité de fluorescence et la valeur de seuil affichée.
REMARQUE : Les pixels positifs pour les mitochondries ont des valeurs d’intensité de fluorescence supérieures au seuil et apparaissent sous forme de pixels blancs dans l’image binaire. - Appliquez le seuil à la pile d’images binaires en sélectionnant Appliquer. Dans la boîte de dialogue Convertir la pile en binaire qui s’affiche, sélectionnez les options Calculer le seuil pour chaque image, Arrière-plan noir, Créer une nouvelle pile, puis cliquez sur OK.
- Observez qu’une pile avec les trois images binaires est générée (BinDMito-stack). Enregistrez-le au format TIFF.
- Calculez la densité mitochondriale dans la pile BinDMito comme suit :
- Sélectionnez le menu Analyser . Ensuite, cliquez sur Histogramme. Dans la boîte de dialogue Histogramme affichée, cliquez sur Oui pour inclure toutes les images de la pile à analyser.
- Dans la boîte de dialogue Histogramme de la pile , cliquez sur Liste pour obtenir les données de l’histogramme. Transférez les données de l’histogramme dans une feuille de calcul.
- Dans une feuille de calcul, identifiez les pixels Mito qui sont ceux qui ont la valeur 255 . Calculer la densité mitochondriale à l’aide de l’équation (1) :
Densité mitochondriale =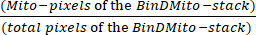 × 100 (1)
× 100 (1)
Le nombre total de pixels est identifié par N dans la boîte de dialogue Histogramme ou calculé en additionnant dans la feuille de calcul le nombre de pixels de l’histogramme. - Pour calculer la surface occupée par les mitochondries (μm2), multipliez les Mito-pixels de la pile BinDMito par la taille des pixels.
5. Analyse de la distribution mitochondriale par transformée de Fourier rapide
- Dans la plate-forme open-source pour l’analyse d’images biologiques, ouvrez la pile BinDMito et dessinez un retour sur investissement rectangulaire de 256 pixels de largeur et 5 μm de hauteur. Localisez un ROI en position centrale et un autre en position latérale, comme illustré à la Figure 4A,B.
- Utilisez l’outil ROI Manager pour configurer les ROI pour l’analyse FFT et enregistrez-les.
REMARQUE : Selon les nécessités de l’analyse, d’autres ROI peuvent être sélectionnés dans différentes positions et leurs tailles peuvent être modifiées. Néanmoins, la largeur doit être égale à 2n pixels pour effectuer la FFT (par exemple, 128, 256, 512 pixels). - Obtenez le profil de tracé des ROI à l’aide de la commande de raccourci + k et transférez les données dans une feuille de calcul.
- Dans la feuille de calcul, remplissez les colonnes B et C avec les données obtenues à partir du profil de tracé. La colonne B contient la distance en μm et la colonne C la valeur de gris correspondante de l’intensité de fluorescence (U.A.).
- La colonne D correspond à la fréquence FFT (événement/μm), qui sera remplie comme suit :
- Calculer la fréquence d’échantillonnage (Fs) : Fs = 1/Δ d, où Δd est le pas de distance (la deuxième valeur de B).
- Calculer le Δ Fs : ΔFs = Fs/N, où N est le nombre de points de données de B (256).
- Calculer la valeur d’arrêt de la fréquence FFT (S ) : S = (N/2) ×ΔF.
- Remplissez la colonne D comme suit :
- La première valeur de la colonne D est égale à 0.
- Sélectionnez la deuxième cellule de la colonne D, accédez au menu principal, sélectionnez Remplir, puis cliquez sur Série. Sélectionnez des colonnes. Pour la valeur de pas, utilisez le Δ F calculé. Pour la valeur d’arrêt, utilisez le S calculé.
- Ensuite, remplissez la colonne E avec les valeurs complexes de la FFT comme suit :
- Insérez 0 dans la première cellule de la colonne C , car la distance 0 doit coïncider avec un signal 0 pour le calcul de la FFT.
- Ensuite, allez dans le menu Données , cliquez sur Analyse des données, puis sélectionnez Analyse de Fourier.
- Dans la nouvelle fenêtre, sélectionnez la plage de points de données du signal fluorescent décrite dans la colonne C pour la plage d’entrée.
REMARQUE : Le nombre de points de données doit être de 2n (par exemple, 256 ou 128 points de données de signal fluorescent). - Sélectionnez la plage correspondante du E pour la plage de sortie.
- Sélectionnez Ok et laissez les valeurs complexes FFT être remplies automatiquement.
- Remplissez la colonne F avec la magnitude FFT comme suit :
- Utilisez la fonction IMABS pour renvoyer la valeur absolue en F à partir du nombre complexe en E et multipliez par 2/N pour normaliser (équation (2)) :
Magnitude FFT = (IM.ABS (E1... En) × (2/N) (2)
- Utilisez la fonction IMABS pour renvoyer la valeur absolue en F à partir du nombre complexe en E et multipliez par 2/N pour normaliser (équation (2)) :
- Tracez le spectre FFT en utilisant l’amplitude FFT en F, en fonction de la fréquence FFT en D, jusqu’à S. Trouvez le point du pic maximal et sa fréquence FFT correspondante.
- Convertissez la fréquence FFT du pic maximal en distance à l’aide de l’équation (3). Cette distance calculée représente la distance longitudinale de la distribution mitochondriale.
Distance (μm) = fréquence 1/FFT (3)
REMARQUE : En raison de la symétrie de la FFT, ne tracez pas la fréquence de la FFT au-delà de la valeur S , qui correspond à la moitié des points de données, afin d’éviter la duplication du spectre de la FFT.
6. Étapes de prétraitement facultatives pour réduire le bruit de l’image avant l’analyse de l’image
- Appliquez un filtre médian ou une déconvolution 2D comme suit :
- Pour le filtre médian :
- Sélectionnez Traiter | Filtres et cliquez sur l’option Médiane .
- Dans la boîte de dialogue Médiane qui s’affiche, sélectionnez 2.0 pour Rayon et cliquez sur OK. Choisissez Oui pour appliquer le processus à toutes les images de la pile Mito.
- Observez la réduction du bruit dans les images.
- Pour la déconvolution 2D :
- Générez une fonction d’étalement de points (PSF) théorique.
- Téléchargez le plugin PSF_Generator.jar et placez le fichier dans le dossier « Plugins ».
- Dans la boîte de dialogue Générateur PSF , cliquez sur l’option Modèle optique 3D Born & Wolf, entrez la valeur d’immersion de l’indice de réfraction de 1,33 utilisée lors du balayage confocal, puis sélectionnez Optimal pour l’option de calcul de précision .
- Capturez 576 nm pour la longueur d’onde d’émission, l’ouverture numérique de l’objectif utilisée est de 0,7 et le pas en Z de 3 000 nm.
- Capturez la taille de pixel XY de l’image confocale à déconvoluer, ainsi que la taille XYZ indiquant le nombre de pixels de X et Y et le nombre de pas Z (3 pour ce protocole).
- Dans le menu Affichage du générateur PSF, cliquez sur l’option linéaire, sélectionnez Résolution 8 bits, puis sélectionnez l’option gris pour la table de correspondance (LUT).
- Exécutez le générateur PSF et enregistrez le PSF théorique créé au format TIFF.
- Faites une somme de tranches du PSF créé en ouvrant l’outil Projet Z de l’option Piles qui se trouve dans le menu Image .
- Dans la boîte de dialogue ZProjection qui s’affiche, sélectionnez Somme des tranches pour le type de projection, puis cliquez sur OK. Enregistrez le nouveau fichier PSF au format TIFF.
NOTE : Une PSF obtenue expérimentalement par microbilles fluorescentes à balayage confocal d’un diamètre connu peut être utilisée à la place de la PSF théorique. - Téléchargez le plugin « DeconvolutionLab_2.jar"19 et placez-le dans le dossier du plugin.
- Cliquez sur le menu Plugins. Ensuite, cliquez sur DeconvolutionLab2.
- Séparez les images confocaux de la pile Mito à l’aide de l’outil Images à empiler à partir de l’option Piles située dans le menu Image et enregistrez-la au format TIFF.
- Dans la boîte de dialogue DeconvolutionLab2 , sélectionnez l’une des images obtenues à partir de la pile Mito. Sélectionnez la PSF théorique créée, puis sélectionnez l’algorithme Richardson-Lucy avec 15 itérations.
- Exécutez DeconvolutionLab2, vérifiez l’amélioration du signal et la réduction du bruit dans l’image, puis enregistrez-la au format TIFF.
- Pour le filtre médian :
- Passez à l’étape 4.4 pour l’analyse de l’image.
- Pour le seuillage des images déconvolutées, convertissez-les en un masque 8 bits pendant le processus de seuillage. Créez une pile avec les images binaires et déconvolutées en sélectionnant Images à empiler dans l’outil Piles du menu Image .
- Pour l’analyse FFT d’images déconvoluées, le profil de tracé contient la distance en pixels. Transformez les unités de pixel en μm comme suit :
- Dans la feuille de calcul, après avoir terminé l’étape 5.4, transférez les données de B à A. Ensuite, remplissez B avec la distance en μm en multipliant chaque nombre de pixels à partir de A par la taille des pixels.
Résultats
En suivant le présent protocole, l’analyse de la densité et de la distribution des mitochondries peut être réalisée dans le muscle squelettique vivant. Le protocole est divisé en trois étapes principales : la dissection du faisceau de muscles squelettiques, la microscopie confocale et l’analyse d’images. La vue d’ensemble du flux de travail est présentée à la figure 1. La figure 2A montre un muscle gastrocnémien entier de rat dans une boîte de Pétri, marquant la tête latérale à partir de laquelle les fibres sont obtenues, tandis que la figure 2B montre les faisceaux de fibres dans la solution Relax. Par microscopie confocale, les mitochondries peuvent être enregistrées le long de la profondeur de la fibre musculaire squelettique vivante à l’aide de l’indicateur fluorescent TMRE. Le TMRE est un fluorophore cationique lipophile qui s’accumule sélectivement dans les mitochondries en fonction du potentiel membranaire mitochondrial20.
Une image confocale optimale de l’IMF peut être obtenue en sélectionnant une distance Z supérieure à 15 μm de profondeur à l’intérieur de la fibre (Figure 3A). La figure 3B montre des images confocales XY représentatives de mitochondries chargées de TMRE acquises le long de la distance Z des fibres musculaires gastrocnémiennes (15 à 21 μm). Les images confocales ont été traitées par seuillage pour les transformer en images binaires afin de permettre l’analyse mitochondriale. La figure 3B (panneau de gauche) montre une fibre provenant d’un rat maigre qui fait de l’exercice. Il représente un enregistrement confocal attendu des mitochondries des fibres musculaires squelettiques car il a un motif cohérent le long de la fibre. En revanche, nous avons sélectionné une fibre provenant d’un rat Ob (Figure 3B, panneau de droite) qui montre des altérations substantielles du contenu et de la distribution mitochondriales. La figure 3C montre la quantification de la surface fibreuse occupée par les mitochondries, exprimée en densité mitochondriale, obtenue à partir de chaque image binarisée (illustrée dans le panneau B). Comme on pouvait s’y attendre, la fibre Ob présentait une densité mitochondriale plus faible. Il a été quantifié de manière cohérente le long de la distance Z analysée, ce qui est également observé dans la figure 3D lorsque la densité mitochondriale est calculée par pile conforme par les trois images confocaux acquises à 15, 18 et 21 μm.
Semblable à l’analyse de la densité mitochondriale, le balayage confocal d’un indicateur fluorescent pour l’imagerie de cellules vivantes, tel que TMRE, permet d’étudier l’organisation longitudinale des mitochondries dans le muscle squelettique vivant. L’IMF présente une organisation périodique dans la bande I proche de TT7, qui peut être analysée par FFT pour quantifier la fréquence du signal mitochondrial et le niveau d’organisation17. La figure 4 montre les différences dans l’organisation de l’IMF observées chez les gastrocnémiens dérivés de rats Lean et Ob et comment la FFT permet de trouver les changements dans la distribution du signal mitochondrial. Les figures 4A et B montrent les ROI longitudinaux sélectionnés en position centrale et latérale dans la fibre pour l’analyse FFT. Avant d’effectuer la FFT, le seuil de la soustraction de l’arrière-plan est calculé. Ensuite, l’image est binarisée ; Ces procédures éliminent les variations des niveaux d’intensité de fluorescence du signal mitochondrial. L’image binaire fournit le profil de tracé de la distribution de fluorescence nécessaire à la réalisation de la FFT.
Les figures 4C et D montrent les ROI sélectionnés dans les panneaux A et B avec leurs profils de tracé (panneaux supérieurs). À partir des profils de tracés, des différences dans la distribution de la fluorescence entre les fibres dérivées de rats maigres et ob peuvent être observées, ainsi que les variations entre les retours sur investissement au sein d’une même fibre. Pour chaque profil de parcelle, leur spectre FFT respectif est présenté (panneaux inférieurs). Le pic du spectre FFT maximal indique la fréquence FFT (axe X) de la distribution du signal mitochondrial le long de l’axe longitudinal. Il peut être transformé en une valeur de distance proche de 2 μm dans les ROI latéraux et centraux du rat maigre. Notamment, l’amplitude FFT du pic est un indice de la régularité du signal mitochondrial, et les changements de cette amplitude révèlent des altérations dans la distribution mitochondriale.
Les figures 4E, F montrent les différences dans le spectre FFT entre les fibres dérivées de Lean et d’Ob où les retours sur investissement latéraux et centraux ont été analysés, respectivement. Dans les ROI latéraux (Figure 4E), la fréquence de la distribution longitudinale mitochondriale était similaire dans les fibres maigres et dérivées de l’Ob ; néanmoins, l’amplitude du pic maximal de FFT dans les fibres dérivées de l’Ob était plus élevée, ce qui est en accord avec la plus grande régularité du signal observée dans l’image de la figure 4B. Néanmoins, le ROI central (Figure 4F) de l’Ob est observé comme un exemple de réduction critique du pic FFT par rapport à la Lean lorsqu’une altération importante de la distribution mitochondriale est présente.
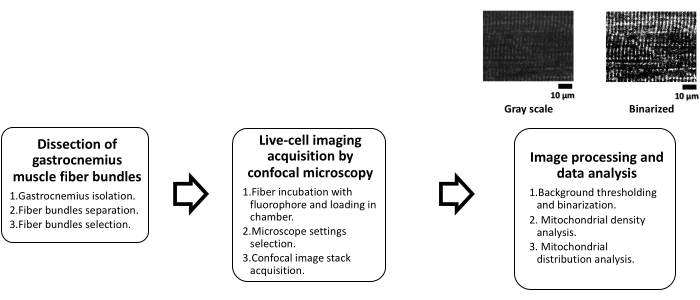
Figure 1 : Schéma d’analyse mitochondriale dans le muscle squelettique par microscopie confocale. Ce schéma résume les principales étapes du protocole en trois phases distinctes. La première phase, la dissection des faisceaux de fibres musculaires gastrocnémiennes, est subdivisée en trois étapes ultérieures, l’isolement du muscle gastrocnémien, suivi d’une dissection mécanique musculaire en faisceaux pour enfin faire une sélection visuelle des faisceaux viables. La deuxième phase consiste en l’acquisition par microscopie confocale d’imagerie de cellules vivantes, qui consiste en une incubation avec le fluorophore (TMRE) pendant 20 min à température ambiante pour placer les fibres dans la chambre. Ensuite, les réglages appropriés sont effectués dans le microscope pour effectuer l’acquisition des images confocales. Au cours de la troisième phase, le traitement confocal de l’image et l’analyse des données sont effectués. À commencer par le traitement d’images, où un seuil est nécessaire pour générer des images binaires à partir desquelles les calculs de densité mitochondriale et la distribution mitochondriale par FFT sont effectués. Abréviations : TMRE = ester éthylique de tétraméthylrhodamine ; FFT = transformée de Fourier rapide. Veuillez cliquer ici pour voir une version agrandie de cette figure.
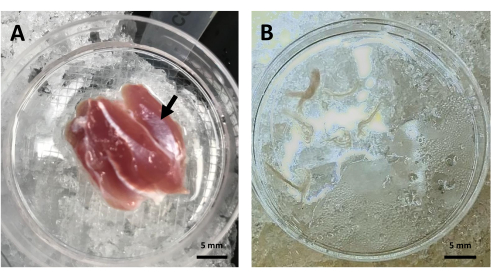
Figure 2 : Dissection d’un faisceau de muscles squelettiques. (A) Tête de gastrocnémien latérale de rat disséquée (flèche noire) dans une boîte de Pétri avec une solution Relax. (B) Image représentative des faisceaux de fibres musculaires gastrocnémiennes dans la solution Relax avant la charge TMRE. Abréviation : TMRE = ester éthylique de tétraméthylrhodamine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
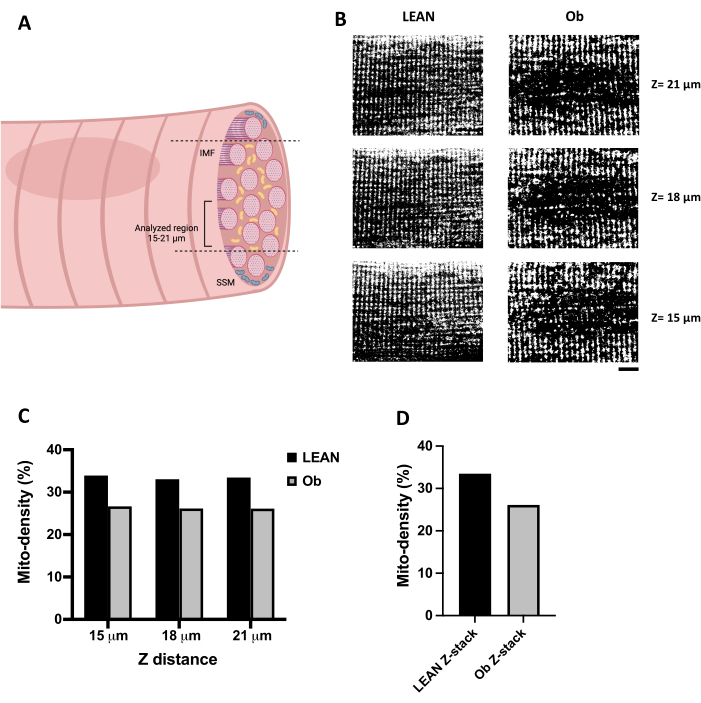
Figure 3 : Analyse de la densité mitochondriale. (A) Illustration qui représente la distance Z recommandée pour le balayage confocal des mitochondries IMF dans les fibres musculaires squelettiques. (B) Série d’images confocales de mitochondries chargées en TMRE dans les fibres musculaires squelettiques, obtenues à partir d’un rat Zucker +/+ exercé (Lean) et d’un rat Zucker fa/fa obèse (Ob) enregistrées à la distance Z (de 15 à 21 μm de profondeur). Les images ont été traitées par seuillage et transformées en images binaires. (C) Calcul de la mito-densité des coupes confocales obtenues à différentes distances Z observées dans le panneau B. (D) La mito-densité obtenue à partir de la pile composée par les images observées dans le panneau B. Les images du panneau B sont de 65 x 50 μm. Barre d’échelle = 10 μm. Abréviations : Densité mitochondriale = Densité mitochondriale ; FMI = mitochondries intermyofibrillaires ; Ob = Obèse ; SSM = mitochondries sous-sarcolemmales. Veuillez cliquer ici pour voir une version agrandie de cette figure.
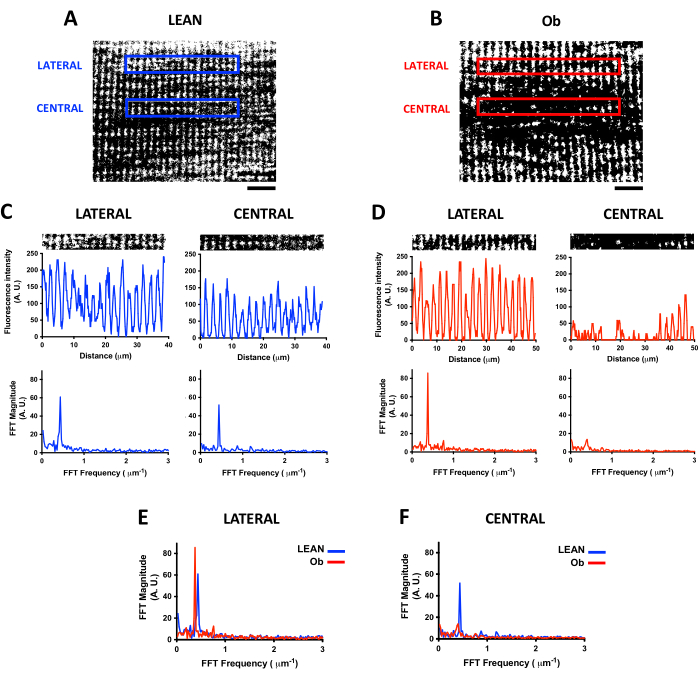
Figure 4 : Analyse de la distribution mitochondriale par FFT. Images confocales représentatives de mitochondries chargées avec l’indicateur fluorescent TMRE acquises à 21 μm de la profondeur des fibres musculaires squelettiques obtenues à partir d’un rat Zucker +/+ exercé (Lean, panel A) et d’un rat Zucker fa/fa obèse (Ob, panel B). Les images ont été traitées par seuillage et transformées en images binaires. Retours sur investissement latéraux et centraux du panneau A (panneau C) et du panneau B (panneau D) avec leurs profils respectifs d’intensité de fluorescence (graphique supérieur) et de spectre FFT (graphique inférieur). La FFT a été calculée à partir de ROI d’une largeur de 256 pixels, ce qui correspond à une taille de retour sur investissement de 39 x 5 μm dans le panneau A et une taille de retour sur investissement de 50 x 5 μm dans le panneau B. Le panneau E montre les différences du spectre FFT trouvées entre les mitochondries dérivées de rats Lean et Ob dans le ROI latéral, tandis que le panneau F montre les différences du spectre FFT du ROI central. Barre d’échelle = 10 μm. Abréviations : A.U. = Unités arbitraires ; FFT = Transformée de Fourier rapide ; ROI = régions d’intérêt ; Ob = Obèse. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Réactif | Concentration finale dans 100 mL | Stock |
| K-aspartate | 100 mM | |
| Kcl | 20 mM | |
| HEPES (en anglais seulement) | 20 mM | |
| Acide L-glutamique | 3 mM | |
| Acide malique | 3 mM | |
| EGTA (en anglais seulement) | 0,1 mM | 10 mM |
| MgCl2 | 1 mM de Mg2+ libre | |
| CaCl2 | 0,00002 mM de Ca2+ libre | |
| Phosphocréatine di-Na | 5 mM | 500 mètres d’épaisseur |
| Créatine phosphokinase | 5 U/mL | 200 U/mL |
| MgATP | 5 mM | |
| pH 7,3 (avec NaOH) |
Tableau 1 : Relâcher les réactifs de la solution et la concentration.
Figure supplémentaire S1 : Effet des méthodes de prétraitement de l’image. (A) Images confocales représentatives de mitochondries chargées de l’indicateur fluorescent TMRE acquises à une profondeur de 18 μm dans des fibres musculaires squelettiques obtenues à partir d’un rat Zucker +/+ exercé (Lean, panneau supérieur) et d’un rat Zucker fa/fa obèse (panneau inférieur), ainsi que leurs images respectives obtenues après prétraitement à l’aide du seuillage d’Otsu, du filtre médian et du seuillage d’Otsu, et la déconvolution 2D et le seuillage d’Otsu. (B) Tracé du profil de mito-densité obtenu à partir des images confocales (panneau A) après prétraitement avec différentes méthodes. Les images du panneau A sont de 65 x 50 μm. Barre d’échelle = 10 μm. Abréviations : 2D-Decon = déconvolution 2D ; Mito-densité = Densité mitochondriale. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Les mitochondries sont des organites à haute capacité de remodelage. Leur contenu, leur densité et leur distribution peuvent être rapidement modifiés par l’activation des mécanismes de fusion et de fission mitochondriales, connus sous le nom de dynamique mitochondriale1, et par l’équilibre entre les mécanismes de renouvellement mitochondrial : la biogenèse mitochondriale et la voie de dégradation spécialisée des mitochondries, mitophagie21,22. Le contenu et la morphologie mitochondriaux peuvent varier en fonction du type de cellule et du stade de développement et peuvent être remodelés sous différents stimuli physiologiques et pathologiques 17,22,23,24. Par conséquent, l’étude de la morphologie mitochondriale est pertinente depuis plus d’un demi-siècle25. Notamment, l’analyse des mitochondries par microscopie électronique a été la technique standard appliquée dans de nombreuses études26.
Les études fluorescentes par microscopie confocale ont gagné en pertinence au cours des dernières années en raison de leur capacité d’imagerie de mitochondries de cellules vivantes à différentes profondeurs de fibres, ce qui pourrait aider à mieux comprendre le rôle des mitochondries dans le muscle squelettique dans différentes conditions adaptatives et inadaptées27. Dans cette étude, une méthodologie pour l’analyse de la densité et de la distribution des mitochondries dans les fibres musculaires squelettiques vivantes par microscopie confocale est décrite. L’un des principaux défis du travail avec des fibres musculaires squelettiques vivantes est d’éviter la contraction des processus d’isolement jusqu’à l’enregistrement confocal mitochondrial. Pour atteindre cet objectif, une solution Relax17 à haute teneur en Mg et ATP est utilisée pour maintenir les fibres détendues pendant au moins 2 h, ce qui laisse suffisamment de temps pour effectuer le processus d’isolation des fibres, la charge de fluorophore et l’acquisition du signal mitochondrial par microscopie confocale. Un point critique du protocole est l’obtention mécanique des fibres car cela nécessite une grande précision et du tissu frais ; Cependant, il est possible d’obtenir des faisceaux de fibres viables à partir de muscles de rat avec cette technique précédemment utilisée et rapportée28. L’obtention de fibres intactes permet de préserver le sarcolemme et l’environnement intracellulaire, en maintenant la diaphonie métabolique et fonctionnelle entre les structures cellulaires28,29.
Contrairement au travail avec des tissus ou des cellules fixes, l’acquisition d’images fluorescentes d’imagerie de cellules vivantes par microscopie confocale permet de surveiller en temps réel l’effet de diverses conditions expérimentales. Le présent protocole peut être utilisé pour explorer les changements dans la densité et la distribution mitochondriales en temps réel et explorer les différences entre les groupes expérimentaux, tels que les exemples présentés ici entre les fibres dérivées de Lean et d’Ob (Figure 3 et Figure 4). Il faut toujours considérer que l’imagerie des cellules vivantes implique de standardiser des conditions de travail optimales avec des dommages cellulaires mineurs. Le temps de travail, la qualité des solutions utilisées, les paramètres d’acquisition et l’exposition des lasers doivent être finement contrôlés. Par conséquent, des considérations essentielles sont mentionnées ci-dessous.
Les mitochondries des fibres musculaires ne peuvent pas être enregistrées entièrement longitudinalement par microscopie confocale en raison de la taille de la fibre et des dommages de la fibre qui peuvent être causés par une longue exposition au laser. Néanmoins, un échantillon représentatif de la fibre est enregistré selon cette technique. Bien qu’il soit possible d’enregistrer toute l’épaisseur de la fibre musculaire squelettique d’un rat par microscopie confocale, cela implique un temps d’enregistrement et d’exposition au faisceau laser plus long. Dans le cas des rats témoins, aucun problème n’a été rencontré avec ces enregistrements. Cependant, les fibres provenant de conditions pathologiques peuvent être plus sensibles aux dommages, comme cela a été observé dans les fibres des rats Ob. Par conséquent, il est préférable d’acquérir une pile d’images confocales représentatives obtenues à différentes distances Z. Lorsque seule une section de l’épaisseur de la fibre est enregistrée, il est recommandé de prendre la pile à la même profondeur sur toutes les fibres testées car la distribution et la densité mitochondriales peuvent varier en fonction de sa position dans la fibre. L’acquisition du signal à une profondeur supérieure à 15 μm est recommandée pour obtenir des images confocaux représentatives de l’IMF, en évitant les populations de MSU situées à proximité de la périphérie.
Lors de l’acquisition confocale, certaines considérations importantes doivent être prises en compte. Tout d’abord, la sélection de l’objectif d’immersion en tenant compte du grossissement, de l’ouverture numérique élevée et du milieu d’immersion. Étant donné que les cellules sont maintenues dans un milieu d’incubation hydrophile, l’indice de réfraction du milieu d’incubation et d’immersion doit être similaire pour obtenir un bon signal et balayer profondément dans le tissu. Généralement réalisé à l’aide d’une lentille d’objectif à immersion dans l’eau. Les images confocaux de la figure 3 et de la figure 4 ont été acquises avec un objectif d’immersion dans l’eau 20x, 0,7 NA. Cet objectif permet d’enregistrer la fibre dans toute sa profondeur, mais le balayage à 15, 18 et 21 μm a été décidé car des images confocales représentatives de l’IMF peuvent être obtenues avec un signal d’intensité de fluorescence élevée et des dommages mineurs à la fibre. D’autres grossissements, tels que 40x et l’huile comme milieu d’immersion, peuvent être envisagés mais doivent être évalués.
Deuxièmement, la taille des pixels pour l’acquisition de l’imagerie est calculée selon le théorème de Nyquist, ce qui permet de sélectionner une taille de pixel appropriée qui évite le suréchantillonnage (exposition laser plus élevée) et le sous-échantillonnage (conduit à une résolution moindre)30. Le calcul dépend des caractéristiques de l’objectif sélectionné et de la longueur d’onde (~90 nm). Il peut être ajusté avec le zoom ; Par conséquent, un seul réglage de zoom fournit une taille de pixel optimale30. Néanmoins, dans la pratique, le zoom dépend également de la zone de l’échantillon à analyser. Ainsi, trouver l’équilibre permet de travailler avec une taille de pixel qui se rapproche le plus du critère de Nyquist et qui correspond également à la zone à analyser. Les figures 3 et 4 ont été acquises avec une taille de pixel de 150 et 190 nm, ce qui a permis d’analyser la largeur totale de la fibre, soit ~50-80 μm.
Troisièmement, il convient d’utiliser un diamètre de trou d’épingle approprié qui empêche la lumière floue d’atteindre le détecteur. Typiquement, 1 Airy est considéré comme la taille optimale du sténopé car il permet la détection de ~80% des photons provenant du plan de focalisation30. Néanmoins, certains échantillons biologiques colorés qui présentent de faibles niveaux de fluorescence nécessitent une augmentation du trou d’épingle30. Les images confocaux de la figure 3 et de la figure 4 ont été acquises avec un trou d’épingle de 3 Airy en raison d’un faible signal capturé avec un Airy inférieur. Il est important de considérer que l’augmentation de l’intensité du signal résultant de l’augmentation de la taille du sténopé entraîne une réduction de la résolution en raison de l’augmentation de la lumière capturée floue. Pour cette raison, nous vous recommandons d’utiliser une taille de sténopé aussi proche que possible de 1 aéré.
Lorsqu’elles sont acquises de manière adéquate, les images confocales peuvent être traitées pour obtenir des informations quantitatives sur la densité et la distribution mitochondriales. Quoi qu’il en soit, l’étape critique de traitement de l’image de seuillage doit être effectuée avant l’analyse pour améliorer la quantification du signal. Au cours de cette étape cruciale, la valeur d’intensité de fluorescence qui sépare les pixels positifs des mitochondries de ceux de l’arrière-plan est définie. Le seuil peut être défini par un ajustement gaussien du pic représentant les mitochondries lorsque l’histogramme de l’image affiche deux pics, l’un correspondant à l’arrière-plan et l’autre aux mitochondries. Cependant, une distribution bimodale n’est pas toujours obtenue dans chacune des images, de sorte que d’autres méthodes de seuillage doivent être appliquées.
Dans ce protocole, la mise en œuvre du seuillage d’Otsu est décrite, qui est une méthode non paramétrique et non supervisée conçue pour trouver la valeur de seuil lorsque les deux pics ne sont pas séparés ou que d’autres pics sont présents31. Otsu peut facilement être appliqué à l’aide d’une plate-forme open source pour l’analyse d’images biologiques. Cependant, d’autres méthodes de seuillage peuvent être testées. La même méthode de seuillage doit être appliquée à toutes les images confocaux et doit être calculée indépendamment pour chaque image confocale. L’application du seuil à l’ensemble d’une pile entraîne des résultats incorrects. Une fois les images binaires obtenues après le processus de seuillage, l’analyse de la densité mitochondriale et de la FFT peut être facilement réalisée en suivant les instructions décrites dans ce protocole. Cependant, il faut faire attention lors de l’exécution des deux analyses pour éviter d’inclure des noyaux et des capillaires, car cela entraînerait des erreurs de quantification. En ce qui concerne la densité, il suffit de soustraire les pixels, ou la surface occupée par les noyaux ou les capillaires, des pixels ou de la surface totale à analyser. De plus, lors de l’analyse FFT, il faut vérifier que le signal mitochondrique est droit. Inversement, lorsque le signal mitochondrial est incliné, il peut produire des profils qui ne représentent pas la distribution longitudinale mitochondriale, ce qui donne des données de spectre FFT incorrectes. De plus, une étape de prétraitement peut être appliquée pour réduire le bruit dans les images. Ce protocole décrit deux étapes de prétraitement facultatives utilisant un filtre médian et une déconvolution 2D. Les effets de ces méthodes de prétraitement sur l’image et la densité mitochondriale sont présentés dans la figure supplémentaire S1. Il est important de considérer que si ces prétraitements peuvent améliorer la qualité de l’image, ils peuvent également entraîner la perte de certains détails de l’image. Par conséquent, ils doivent être utilisés avec prudence et appliqués de manière cohérente à toutes les images analysées.
Malgré ses avantages, la microscopie confocale est limitée par une résolution latérale (XY) de 180-250 nm lorsque les conditions optimales d’acquisition sont mises en œuvre32. Le diamètre mitochondrial est de ~200-700 nm, proche de la limite de diffraction de la microscopie confocale ; par conséquent, les structures sous-mitochondriales ne peuvent pas être détectées de manière adéquate33 et ne peuvent pas être évaluées par les analyses de densité et de FFT présentées dans ce protocole. D’autres techniques de microscopie à super-résolution, telles que la microscopie de reconstruction optique stochastique (STORM), la nanoscopie à déplétion par émission stimulée (STED) ou la microscopie à illumination structurée (SIM), peuvent être explorées pour résoudre les structures sous-mitochondriales32. Dans ce protocole, les images confocaux des mitochondries sont obtenues à l’aide du fluorophore TMRE, qui dépend du potentiel membranaire mitochondrial. Par conséquent, l’intensité de la fluorescence mitochondriale peut varier en fonction de leur potentiel membranaire. Un processus de seuillage est effectué avant l’analyse des données pour surmonter ce problème. Tous les pixels au-dessus d’un seuil défini sont considérés comme positifs pour le signal mitochondrial, indépendamment de leur valeur de fluorescence. Néanmoins, il faut noter que les mitochondries à très faible potentiel membranaire ne peuvent pas être résolues avec cette technique. Ainsi, des études complémentaires de quantification de la teneur en protéines mitochondriales sont recommandées. L’un des avantages de l’utilisation de la TMRE est que les images confocales peuvent également être utilisées pour l’analyse du potentiel membranaire mitochondrial, mais des contrôles adéquats avec des agents de découplage tels que la carbonylcyanure-p-trifluorométhoxyphénylhydrazone (FCCP). De plus, les instructions pour l’analyse de la densité et de la distribution mitochondriales peuvent être réalisées à l’aide d’indicateurs fluorescents verts pour les mitochondries, qui chargent les mitochondries quel que soit leur potentiel membranaire, mais la stratégie d’incubation et les paramètres d’acquisition confocale doivent être normalisés.
Étant donné que la structure des mitochondries est liée aux fonctions mitochondriales et cellulaires essentielles, le protocole décrit ici peut fournir des informations précieuses sur leur remodelage au cours d’une maladie ou d’un stress particulier. Il pourrait contribuer à une meilleure compréhension des fonctions clés du muscle squelettique régies par les mitochondries, telles que la production d’énergie, ou dans lesquelles les mitochondries jouent un rôle important dans l’interaction avec d’autres organites, comme le couplage contraction-métabolisme. Suivre les instructions du protocole permet d’estimer la densité et la distribution mitochondriales dans le muscle squelettique vivant. Les étapes du protocole sont divisées en trois étapes principales axées sur la dissection des faisceaux de muscles squelettiques, la microscopie confocale et l’analyse d’images, où des instructions détaillées et des considérations importantes sont incluses. Notamment, le protocole peut être optimisé davantage pour explorer des étapes Z supplémentaires pour une reconstruction mitochondriale complète dans la fibre en fonction des besoins de l’utilisateur. Par exemple, l’image confocale et les étapes d’analyse peuvent être testées pour étudier des structures cellulaires ayant une distribution similaire, telles que le TT dans des échantillons vivants et fixes.
Déclarations de divulgation
Les auteurs déclarent qu’il n’y a pas de conflits d’intérêts.
Remerciements
Ce travail a été soutenu par l’École de médecine et l’Institut de recherche sur l’obésité de Tecnologico de Monterrey. La figure 3A a été créée à l’aide du logiciel d’imagerie et d’illustration scientifique.
matériels
| Name | Company | Catalog Number | Comments |
| Adenosine 5’-triphosphate disodium salt hydrate | Sigma-Aldrich | A6419 | |
| Borosilicate glass coverslip | Warner Instruments | 64-0709 | |
| Calcium chloride | Sigma-Aldrich | C5670 | |
| Confocal microscope | Leica | TCS SP5 | |
| Confocal microscope software Leica Application Suite | Leica | 2.7.3.9723 | |
| Creatine Phosphokinase | Sigma-Aldrich | C3755 | |
| DeconvolutionLab2 (DeconvolutionLab_2.jar) | Biomedical Imaging Group, EPFL | http://bigwww.epfl.ch/deconvolution/deconvolutionlab2/ | |
| Dimethyl Sulfoxide | Sigma-Aldrich | D2650 | |
| DL-Aspartic acid potassium sat hemihydrate | Sigma-Aldrich | 11240 | |
| Ethylene glycol-bis(2-aminoethylether)-N,N,N´N´-tetraacetic acid | Sigma-Aldrich | E4378 | |
| Forceps | Miltex | MH-18 | |
| HC PL APO 20x/ 0.7 IMM objective | Leica | 506517 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Iris scissors | Miltex | 5-304 | |
| L-(-)-Malic acid | Sigma-Aldrich | M7397 | |
| L-glutamic acid monosodium salt hydrate | Sigma-Aldrich | G1626 | |
| Magnesium chloride hexahydrate | Sigma-Aldrich | M2393 | |
| Maxchelator | UC Davis Health | https://somapp.ucdmc.ucdavis.edu/pharmacology/bers/maxchelator/downloads.htm | |
| Micro scissors | Miltex | 18-1633 | |
| Open-source platform for biological-image analysis Fiji | Public, maintained by Eliceiri/LOCI group, Jug group, and Tomancak lab.Fiji | https://fiji.sc/ | |
| Phosphocreatine disodium salt hydrate | Sigma-Aldrich | P7936 | |
| Potassium chloride | Sigma-Aldrich | P9333 | |
| PSF Generator (PSF_Generator.jar) | Biomedical Imaging Group, EPFL | http://bigwww.epfl.ch/algorithms/psfgenerator/ | |
| Recording chamber | Warner Instruments | RC-27N | |
| Sodium hydroxide | Sigma-Aldrich | S5881 | |
| Spreadsheet Microsoft Excel | Microsoft | ||
| Stereo microscope | Zeiss | Stemi 508 | |
| Tetramethylrhodamine, ethyl ester | Invitrogen | T669 |
Références
- Lackner, L. L. Shaping the dynamic mitochondrial network. BMC Biology. 12, 35 (2014).
- De Mario, A., Gherardi, G., Rizzuto, R., Mammucari, C. Skeletal muscle mitochondria in health and disease. Cell Calcium. 94, 102357 (2021).
- Chang, C. R., Blackstone, C. Dynamic regulation of mitochondrial fission through modification of the dynamin-related protein Drp1. Annals of the New York Academy of Sciences. 1201, 34-39 (2010).
- Willingham, T. B., Ajayi, P. T., Glancy, B. Subcellular specialization of mitochondrial form and function in skeletal muscle cells. Frontiers in Cell and Developmental Biology. 9, 757305 (2021).
- Kuznetsov, A. V., et al. Mitochondrial subpopulations and heterogeneity revealed by confocal imaging: possible physiological role. Biochimica et Biophysica Acta. 1757 (5-6), 686-691 (2006).
- Díaz-Vegas, A. R., et al. Mitochondrial calcium increase induced by RyR1 and IP3R channel activation after membrane depolarization regulates skeletal muscle metabolism. Frontiers in Physiology. 9, 791 (2018).
- Boncompagni, S., et al. Mitochondria are linked to calcium stores in striated muscle by developmentally regulated tethering structures. Molecular Biology of the Cell. 20 (3), 1058-1067 (2009).
- Reggiani, C., Marcucci, L. A controversial issue: Can mitochondria modulate cytosolic calcium and contraction of skeletal muscle fibers. The Journal of General Physiology. 154 (9), e202213167 (2022).
- Heinzel, F. R., et al. Remodeling of T-tubules and reduced synchrony of Ca2+ release in myocytes from chronically ischemic myocardium. Circulation Research. 102 (3), 338-346 (2008).
- Al-Qusairi, L., Laporte, J. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skeletal Muscle. 1 (1), 26 (2011).
- Pérez-Treviño, P., Pérez-Treviño, J., Borja-Villa, C., García, N., Altamirano, J. Changes in T-tubules and sarcoplasmic reticulum in ventricular myocytes in early cardiac hypertrophy in a pressure overload rat model. Cellular Physiology and Biochemistry. 37 (4), 1329-1344 (2015).
- Celestino-Montes, A., Pérez-Treviño, P., Sandoval-Herrera, M. D., Gómez-Víquez, N. L., Altamirano, J. Relative role of T-tubules disruption and decreased SERCA2 on contractile dynamics of isolated rat ventricular myocytes. Life Sciences. 264, 118700 (2021).
- Song, L. S., et al. Orphaned ryanodine receptors in the failing heart. Proceedings of the National Academy of Sciences of the United States of America. 103 (11), 4305-4310 (2006).
- Houzelle, A., et al. Human skeletal muscle mitochondrial dynamics in relation to oxidative capacity and insulin sensitivity. Diabetologia. 64 (2), 424-436 (2021).
- Call, J. A., et al. Ulk1-mediated autophagy plays an essential role in mitochondrial remodeling and functional regeneration of skeletal muscle. American Journal of Physiology. Cell Physiology. 312 (6), C724-C732 (2017).
- Fealy, C. E., Grevendonk, L., Hoeks, J., Hesselink, M. K. C. Skeletal muscle mitochondrial network dynamics in metabolic disorders and aging. Trends in Molecular Medicine. 27 (11), 1033-1044 (2021).
- Rivera-Alvarez, I., et al. A single session of physical activity restores the mitochondrial organization disrupted by obesity in skeletal muscle fibers. Life Sciences. 256, 117965 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2022).
- Sage, D., et al. DeconvolutionLab2: An open-source software for deconvolution microscopy. Methods. 115, 28-41 (2017).
- Perry, S. W., Norman, J. P., Barbieri, J., Brown, E. B., Gelbard, H. A. Mitochondrial membrane potential probes, and the proton gradient: a practical usage guide. Biotechniques. 50 (2), 98-115 (2011).
- Ma, K., et al. Mitophagy, mitochondrial homeostasis, and cell fate. Frontiers in Cell and Developmental Biology. 8, 467 (2020).
- Meinild, L. A. -. K., et al. Exercise training increases skeletal muscle mitochondrial volume density by enlargement of existing mitochondria and not de novo biogenesis. Acta Physiologica. 222 (1), (2018).
- Memme, J. M., Erlich, A. T., Phukan, G., Hood, D. A. Exercise and mitochondrial health. Journal of Physiology. 599 (3), 803-817 (2021).
- Gan, Z., Fu, T., Kelly, D. P., Vega, R. B. Skeletal muscle mitochondrial remodeling in exercise and diseases. Cell Research. 28 (10), 969-980 (2018).
- Schiaffino, S., Hanzlíková, V., Pierobon, S. Relations between structure and function in rat skeletal muscle fibers. Journal of Cell Biology. 47 (1), 107-119 (1970).
- Vincent, A. E., et al. The spectrum of mitochondrial ultrastructural defects in mitochondria myopathy. Scientific Reports. 6, 30610 (2016).
- Mishra, P., Varuzhanyan, G., Pham, A. H., Chan, D. C. Mitochondrial dynamics is a distinguishing feature of skeletal muscle fiber types and regulates organellar compartmentalization. Cell Metabolism. 22 (6), 1033-1044 (2015).
- Cheng, A. J., Westerblad, H. Mechanical isolation, and measurement of force and myoplasmic free [Ca2+] in fully intact single skeletal muscle fibers. Nature Protocols. 12 (9), 1763-1776 (2017).
- Kuznetsov, A. V., Javadov, S., Margreiter, R., Hagenbuchner, J., Ausserlechner, M. J. Analysis of mitochondrial function, structure, and intracellular organization in situ in cardiomyocytes and skeletal Muscles. International Journal of Molecular Sciences. 23 (4), 2252 (2022).
- Pawley, J. B. Fundamental limits in confocal microscopy. In: Pawley, J. (eds) Handbook of Biological Confocal Microscopy. , (2006).
- Otsu, N. A. Threshold selection method from gray-level histogram. IEEE Transactions on System Man Cybernetics. 9, 62-66 (1979).
- Schermelleh, L., Heintzmann, R., Leonhardt, H. A guide to super-resolution fluorescence microscopy. The Journal of Cell Biology. 190 (2), 165-175 (2010).
- Jakobs, S., Stephan, T., Ilgen, P., Brüser, C. Light microscopy of mitochondria at the nanoscale. Annual Review of Biophysics. 49, 289-308 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon