このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ショウジョウバエ活動モニタシステムを使用した耐熱性アッセイ:データ解析のための実行可能アプリケーションのガイド
要約
このレポートでは、インキュベーターチャンバー内の空気伝導熱ストレッサーに応答して、Drosophila Activity Monitor(DAM2)を使用して成虫のDrosophila melanogasterのノックダウンまでの時間を測定する方法について説明します。DAM2は、赤外線ビームを横切る個々のハエの動きを記録することにより、活動を測定します。データ分析は、著者によって作成された新しい実行可能ファイルによって促進されます。
要約
ショウジョウバエの耐熱性の研究は、何十年にもわたって研究者にとって特に関心を集めており、耐熱性を評価するための一般的なアプローチは、高温にさらされた後のノックダウン時間(TKD)を監視することです。古典的には、ハエは個々のバイアルに収容され、温水浴の中に置かれます。その後、TKDは研究者によって手動で監視されます。非常に確立されていますが、これらの手動アッセイを実施する際には、主観性の問題と、筋肉のけいれんを含むすべての動きの停止の具体的な定義の一貫した適用の問題が残っています。私たちは、TriKinetics Drosophila Activity Monitors(DAM2)を使用して、耐熱性アッセイを自動化するためのハイスループット法を開発しました。DAM2システムに付随するプログラムを作成し、生成されたアクティビティデータから最後の移動時間を自動的に読み取る使いやすい実行可能ファイルを作成しました。次に、このスクリプトは、各ハエの熱麻痺までの時間 (TKD) を .csv ファイルに書き込みます。私たちのデータは、この自動化されたDAM2メソッドが一貫性と信頼性を持っていることを示しています。一方、アクティビティ カウント データから作成されたアクティビティ プロファイルは重要です。これらの活性プロファイルはまとめることができ、熱耐性アッセイを拡大して、比較的研究されていない耐熱性の行動要素を含める可能性があります。このプロトコルでは、DAM2システムとHoTDAM!D. melanogasterの耐熱性を推定するソフトウェア。
概要
外温動物は通常、自発運動の増加を伴う熱ストレスに反応します。この現象は何十年にもわたって研究者に明らかであり、1944年にCowlesとBogertによって記述された特徴的な行動反応があります1。彼らは、熱ストレス下にある生物が最初に自発運動の増加を示す方法を説明しました。熱ストレスが蓄積すると、活動の短いバーストと非アクティブな期間が散在します。生物が協調的な動きを示さなくなる温度は、臨界熱極大(CTmax)です。筋肉スパムが続き、最終的に生物は崩壊します1,2。この崩壊は定義するのが難しく、「熱の厳しさ、昏睡状態、または死」2に似たものを表しています。ここでは、生理的崩壊という用語を使用して、理論的にはこのぼやけた熱ストレスのエンドポイントを指します。
ショウジョウバエやその他の小さな昆虫は、熱ストレスを研究するための貴重なモデルとなっています。耐熱性を構成する形質の複雑なコレクションの少なくとも一部を推定するために、多くの研究者は、生理学的崩壊が発生する時間と温度を手動で観察してきました。これは、それぞれノックダウンまでの時間(TKD)とCTmaxを表しています。これらの手動アッセイ方法は非常に確立されていますが、いくつかの欠点があります。生理学的崩壊の運用上の定義は、特に観察者が経験が少ない場合、すべてのケースに確立して適切に適用することが難しい場合があります。たとえば、生物はどの時点で筋肉のけいれんから崩壊しますか?虚脱前の筋肉のけいれんと発作活動のパターンは予測不可能であり、正確な観察を複雑にする可能性があります 2,3、精度と精度を脅かす可能性があります。一方、観察が難しいため、一度に分析できる生物の数も制限され、スケーラビリティが制限されます。
活性の増加は熱に対する一貫した反応であり、TKDとCTmaxは最終的に活性が停止するポイントであるため、TriKineticsのショウジョウバエ活動モニター(DAM2)を使用して耐熱性アッセイを自動化することを目指しました。私たちは最近、DAM2システム4を使用した自動アッセイの方法と使いやすいソフトウェアを発表しました。このアッセイは、TKDの観点からの耐熱性の測定値を、いくつかの要因にわたる従来の手動観察ベースのTKDアッセイと比較することにより検証されました。また、TKDアッセイの自発運動活動成分を調査して、誘導性熱耐性表現型をさらに特徴付けました。このアッセイと付属のソフトウェアをHoTDAM!(ショウジョウバエ活動モニタリングシステムを使用した耐熱性アッセイ)。ここでは、DAM2システムとHoTDAM!ソフトウェア。このアッセイは使いやすく、一度に多くの生物を測定できるように容易に拡張できます。
この原稿では、熱感覚変異型ハエ(一過性受容体電位アンキリン1;TRPA1)およびそれらの遺伝的制御(白1118; W1118)。これらの生物は、アッセイの熱ストレス中に見られる特徴的な活性の増加の重要性を強調するために選択されました。つまり、 TRPA1 生物はこの逃避行動を示さず、保存された行動反応とTKDなどの暑さ耐性の推定値との間に本質的な関係があることを示しています。雌と雄の両方に対してアッセイを行い、熱硬化前処理を実施しました。ここで紹介する代表的な結果は、以前に発表されたオリジナルのバリデーションアッセイで使用されたものよりもまったく新しいアッセイのデータです。
プロトコル
1.ハエの飼育
- 調査に適したフライストック/ラインを選択します。
注:アッセイを説明するために、一過性受容体電位 TRPA1 ノックアウトストックとその遺伝的制御である w1118 ストックを使用しました。 - 必要に応じて、フライストックを一貫した条件下で維持します。このプロトコルに従うには、標準的な食品(コーンミール、糖蜜、トルラ酵母)を12:12の日周期で25°Cで飼育します。
- 軽い麻酔で男性と女性を分けます。
注:実験によっては、処女バエまたは交配ハエが使用される場合があります。- 成体のオスとメス(両方の株で別々に)を5日間交配させ、産卵させます。ボトルから大人を片付けます。
- 数日後に成虫が閉じ始めたら、ボトルを再び空けます。2日後、軽いエーテル麻酔を使用してオスとメスを分離し、バイアルあたり25ハエの密度で別々に成熟させます。
2. 前処理
- 実験グループ(遺伝的、環境的、薬理学的、またはその他)を定義する前処理または独立変数を適用します。
- このプロトコルに従うには、成虫を性別で分け、5日後に、生物を含む密封されたバイアルを37°Cの水浴に1時間浸して、成虫の半分を前処理します。インキュベーター内のコントロールを25°Cに保ちます。ハエを前処理後24時間、耐熱性アッセイの前に回復させます。
3. DAM2 システムのセットアップ
- フライをDAM2モニターチューブにロードし、チューブの両端を綿で覆います。ハエの耐熱性をすぐに評価する場合は、麻酔への曝露に関連する潜在的な交絡効果を避けるために、生物をモニターチューブに装填している間は麻酔を使用しないでください。代わりに、保持バイアルからモニターチューブに個々のハエを吸引します。
- アッセイチューブをアクティビティモニターに挿入し、さまざまなグループがロードされているスロット番号に注意してください。
注:これらは、モニター内の位置が交絡変数と見なされる可能性がある場合、実験に応じてランダム化される場合があります。 - DAM2データ収集ソフトウェア
注意: DAM2システムとソフトウェアは、同社のサイトで入手可能なDAMSystem3ソフトウェアデータシートに詳しく説明されています webサイト( 資料の表を参照)。特定のトラブルシューティングと一般的な機能については、DAM2の手順を参照してください。ここでは、当社の耐熱性アッセイのコンテキストでシステムを使用するためのガイダンスを提供します。- DAM2システムは、各チューブ内の個々のフライが赤外線ビームを遮断する回数を監視します。その後、データ集録ソフトウェアは、定義された時間間隔ごとにこのカウントをインデックス化してリセットします。 「設定」で、アッセイで使用する 読み取り間隔 を選択します。分解能と読み取りエラーのバランスをうまく取るために、15秒の読み取り間隔を見つけました。
メモ: 読み取り間隔は、使用するモニターの数よりも秒単位で短くしないことをお勧めします。読み取り間隔を短くすると、アッセイの時間分解能が向上しますが、読み取りエラーのインスタンスも増加する可能性があります。ソフトウェアは、読み取り値のインデックス作成を試みている間に遅れることがあります。さらに、より新しく、より高速なコンピューターは、読み取りエラーを防ぐのに大いに役立ちます。 - 読み取りエラーを考慮しながら、DAM2データ収集ソフトウェアの実行に使用しているコンピュータが、アッセイを中断しないようにスリープまたは休止状態にならないように設定されていることを確認してください。さらに、データの収集中は、 自動更新 (教育機関が制御するネットワーク更新を含む)が オフ に設定されていることを確認してください。
- すべてのモニターが接続され、ソフトウェアと通信していることを確認します。 現在のデータ タブで、各モニターのステータスが緑色になっていることを確認します。
注:さまざまなカラーコードが参照する問題の詳細については、DAMSystem3ソフトウェアデータシートを参照してください。 - データ集録ソフトウェアは、システムファイル内の データ フォルダ内のテキストファイルにアクティビティカウントを自動的に書き込みます。データ解析を容易にするために、アッセイのデータ取得ソフトウェアを起動する前に、この データ フォルダ内のテキストファイルをすべて削除してください。
注:テキストファイルは自動的に入力されるため、このフォルダからテキストファイルを削除して、プログラムを妨げることなく古いデータを消去することができます。
- DAM2システムは、各チューブ内の個々のフライが赤外線ビームを遮断する回数を監視します。その後、データ集録ソフトウェアは、定義された時間間隔ごとにこのカウントをインデックス化してリセットします。 「設定」で、アッセイで使用する 読み取り間隔 を選択します。分解能と読み取りエラーのバランスをうまく取るために、15秒の読み取り間隔を見つけました。
4. 耐熱性アッセイ
- モニターをアッセイインキュベーターにロードします。
- アクイジションソフトウェアを起動し、熱ストレスを適用する前に、定義された時間(たとえば、読み取り間隔が15秒に設定されている場合は40インデックスまたは10分)ソフトウェアにインデックスを付けます。
注意: これにより、チューブへのある程度の順応と、モニターのセットアップ中のモニターの動きからの回復が可能になります。特に、アッセイ中の活性が分析されている場合、この順化時間は、熱ストレスが誘発される前にベースライン活性を確立します。実施されるアッセイの特定の性質によっては、この順化フェーズをスキップし、モニターをすでにストレス温度のインキュベーターに直接配置することができます。 - 静的(TKD)アッセイを実施する場合は、馴化期間後にインキュベーターをできるだけ早く設定された有害温度まで上昇するように設定してください。応答変数は、TKD を推定するために、最後に記録された移動時間 (つまり、最後の非ゼロ インデックス) として運用されます。
- ダイナミックアッセイを実施する場合は、順化期間後に温度が上昇する速度を決定します。ここで測定された応答変数は、技術的には再び時間です。最後の動きが記録される時間は、ランピングの速度に応じて、温度(CTmax)と一致します。
- DAMシステムディスプレイのAcquisition Softwareでアクティビティカウントをリアルタイムで監視したり、DAMSystem3プログラムファイルのdataフォルダ内のテキストファイルを直接調べたりすることができます。テキストファイルをコピーし、データフォルダ内の元のファイルではなく、コピーを開いて、ライブデータ記録で問題が発生しないようにします。
- 数分間、どのハエにも動きが見られない場合は、取得ソフトウェアを停止します。
注:私たちのアッセイでは、数分間から数分の不活動が、従来の手動TKDアッセイで見られるのと同様の熱ストレスによる生理学的崩壊を示していることがわかりました。ただし、これは自発的な逃避行動に依存します。そのため、調査の特定の治療がこの行動反応を変える可能性がある場合は、考えられる交絡変数を考慮してください。さらに、アッセイの特定のパラメータ(例えば、温度、処理)に応じて、アッセイの長さは明らかに異なります。
5. データの整理と分析
注: GitHub から実行可能アプリケーションをダウンロードする方法と、ソフトウェアの基本機能については、 補足ビデオ S1 を参照してください。
- データを取得したら、参照されているソフトウェア( 資料の表を参照)を使用してテキストファイルをスキャンしてエラーがないか確認し、アクティビティデータのビニングに特定の開始点と終了点を選択します。10 分の順応間隔が実装された場合は、アクティビティ記録の 10 分後にビニングを開始します。ビン分割の詳細については、ディスカッションを参照してください。
- HoTDAMを開きます!分析ソフトウェアを使用し、スキャンしたモニター・データ・ファイルをインポートするために、「 ファイル」メニューの「モニター・データのロード」をクリックします。
注:ソフトウェアと実行可能アプリケーションは、GitHub(https://github.com/MatthewR47/HoTDAM)または会社のWebサイトの分析ソフトウェア セクションから入手できます。現時点では、実行可能アプリケーションはWindowsオペレーティングシステムとのみ互換性があることに注意してください。 - DAM2モニター内のどの細胞に対応する治療群かを示すために、グループ指定を追加します。
メモ: ソフトウェアインタフェースのレイアウトは、モニターのレイアウトに対応しています。 - 「 マルチグループ定義の開始 」をクリックして、複数のセルに適用されるグループ指定を追加するためのダイアログ・ボックスを表示します。グループの指定が承認されたら、セルをクリックしてグループの指定を適用し、[ 複数グループの指定を停止]をクリックします。
注:このソフトウェアは、DAMSystem3データを整理してエクスポートし、統計ソフトウェアで分析する.csvファイルにエクスポートします。 - モニター内の各フライのTKD(つまり、最後のゼロ以外のインデックス)を.csvファイルにエクスポートするには、[ ファイル]|ノックダウンデータのエクスポート |[すべてのモニターをエクスポート] または [選択したモニターをエクスポート] をクリックします。各フライのTKDは、グループ指定ごとに出力に整理されます。
- 各フライトのアクティビティデータをエクスポートするには、[ ファイル] |アクティビティデータのエクスポート |「Export All Monitors」または「Export Selected Monitors 」を.csvファイルに保存し、タイムスタンプとカウントデータのみを保持してデータファイルの操作を容易にするとともに、フライごとに指定されたグループラベルを割り当てます。
注:DAMSystem3データファイルの最初のいくつかの列は、取得中のモニターの内部データ(光監視やエラーメッセージなど)に対応しています。カウントデータは11〜42列目にあります(詳細については、DamSystem3データシートを参照してください)。分析ソフトウェアを使用してアクティビティ データをエクスポートすると、タイムスタンプとカウント データ列を除くすべての列が削除されます。 - CTmax実験を行う場合は、TKDを使用して、温度上昇率を使用してCTmaxを決定します。
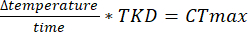
注:分析ソフトウェアは、C#(ソースコードはGitHubで入手可能、https://github.com/MatthewR47/HoTDAM)でオブジェクト指向の方法で記述されているため、プログラムの側面を簡単に変更して、特定の目的に合わせてカスタマイズできます。
6. 統計学
注:実験設定の詳細に応じて、TKDデータの分析にさまざまなテストを使用できます。
- 生存時間解析(Cox回帰、Kaplan-Meierなど)を使用して、ノックダウンをアッセイ内の各フライが経験する イベントとして概念化します。
注:詳細なレビューについては、生存分析とその実装について論じたBradburnとClarkの4つの論文シリーズ5,6,7,8を参照してください。 - ANOVAを使用して、グループの違いを評価し、特に特定の条件で自動アッセイを検証する場合にモダリティを比較します。
- Kaplan-Meier生存時間解析を用いてTKDデータを解析します。解析が別々に実行されるように、ファイルをストックごとに分割します(たとえば、TRPA1とw1118ストックラインの場合)。時間変数として TKD (分単位)、イベントとしてノックダウン、因子として前処理、層として性別を選択します。
- log-rank、Breslow、およびTarone-Wareテストを実行して、各層(つまり、性別)の前処理を比較します。
- 生存プロットを作成します。
結果
TRPA1 と w1118 株の解析は別々に行いました。パーセンタイルTKD時間およびその他の記述は、表1に記載されています。
| パーセンタイル | ||||||||
| 性 | 処遇 | 2... | ||||||
ディスカッション
ここで説明する耐熱性アッセイ法は、汎用性と拡張性に優れています。私たちは以前に、HoTDAM!この手法を従来の観察ベースのTKDアッセイに導入し、いくつかの因子にわたって同じ一般的な傾向を示す自動アッセイを発見しました4 (図3)。つまり、従来の手動TKDアッセイと同様に、DAM2自動アッセイは、性別、アッセイ温度、硬?...
開示事項
著者は、利益相反がないことを宣言します。
謝辞
記載されているプロジェクトは、国立衛生研究所の国立総合医科学研究所からの制度開発賞(IDeA)助成金(5P20GM103427および1U54GM115458)によって支援されました。UNK学部研究フェロープログラムとUNMC医学生夏期研究プログラム。
資料
| Name | Company | Catalog Number | Comments |
| 14 mL polystyrene test tubes | Falcon | 352057 | |
| 30 gallon fish tank | Wal-mart | ||
| 8 oz bottles | Genesee | 32-129F | |
| Constant Climate Chamber | Memmert | HPP750eco | |
| cornmeal | Lab Scientific | FLY801010 | |
| DAM2 Drosophila Activity Monitor | TriKinetics | DAM2 | (DAMSystem3 Data Sheet) https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| DAMSystem data acquisition software | TriKinetics | free download | |
| Drosophila agar | Lab Scientific | FLY80201 | |
| ethanol | Fisher Scientific | BP82011 | |
| Ether | Fisher Scientific | E134-4 | |
| FileScan software | TriKinetics | for scanning for text errors, binning data, and output | |
| FlyStuff Flugs for bottles | Genesee | 49-100 | |
| FlyStuff Flugs for vials | Genesee | 49-102 | |
| FlyStuff vials | Genesee | 32-113RL | |
| HoTDAM software | Github or Trikinetics | https://github.com/MatthewR47/HoTDAM | |
| Immersion circulating heater | PolyScience | MX-CA11B | |
| molasses | Lab Scientific | FLY80084 | |
| propionic acid | Fisher Scientific | A258-500 | |
| Pyrex Glass tubes 5 x 65 mm for DAM2 | TriKinetics | PGT 5x65 | https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| small paint brush | Wal-mart | ||
| SPSS Statistics | IBM | ||
| tegosept | Lab Scientific | FLY55015 | |
| torula yeast | MP Biomedicals | 290308505 | |
| TRPA1 mutant stock | Bloomington Stock center | 26504 | w[1118]; TI{w[+mW.hs]=TI}TrpA1[1] |
| w1118 stock | Bloomington Stock center | 3605 |
参考文献
- Cowles, R. B., Bogert, C. M. A preliminary study of the thermal requirements of desert reptiles. Bull Am Mus Nat Hist. 83, 261-296 (1944).
- Lutterschmidt, W. I., Hutchison, V. H. The critical thermal maximum: history and critique. Can J Zool. 75, 1561-1574 (1997).
- Jørgensen, L. B., Malte, H., Overgaard, J. How to assess Drosophila heat tolerance: Unifying static and dynamic tolerance assays to predict heat distribution limits. Funct Ecol. 33 (4), 629-642 (2019).
- Rokusek, B., et al. HoTDAM! An easy-to-use automated assay expands the inducible thermotolerance phenotype in Drosophila melanogaster: Heat hardening reduces motility. Comp Biochem Physiol A Mol Integr Physiol. 286, 111522 (2023).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part III: Multivariate data analysis - Choosing a model and assessing its adequacy and fit. Br J Cancer. 89 (4), 605-611 (2003).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part II: Multivariate data analysis- An introduction to concepts and methods. Br J Cancer. 89 (3), 431-436 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part IV: Further concepts and methods in survival analysis. Br J Cancer. 89 (5), 781-786 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part I: Basic concepts and first analyses. Br J Cancer. 89 (2), 232-238 (2003).
- Hazra, A., Gogtay, N. Biostatistics series module 9: survival analysis. Indian J Dermatol. 62 (3), 251-257 (2017).
- Stevenson, R. D. The relative importance of behavioral and physiological adjustments controlling body temperature in terrestrial ectotherms. Am Nat. 126 (3), 362-386 (1985).
- Grigg, G. C., Beard, L. A., Augee, M. L. The evolution of endothermy and its diversity in mammals and birds. Physiol Biochem Zool. 77 (6), 982-997 (2004).
- Soto-Padilla, A., et al. Thermosensory perception regulates speed of movement in response to temperature changes in Drosophila melanogaster. J Exp Biol. 221 (10), jeb174151 (2018).
- Hoffmann, A. A., Sørensen, J. G., Loeschcke, V. Adaptation of Drosophila to temperature extremes: bringing together quantitative and molecular approaches. J Therm Biol. 28 (3), 175-216 (2003).
- Terblanche, J. S., et al. Ecologically relevant measures of tolerance to potentially lethal temperatures. J Exp Biol. 214 (22), 3713-3725 (2011).
- Rezende, E. L., Castaneda, L. E., Santos, M. Tolerance landscapes in thermal ecology. Funct Ecol. 28 (4), 799-809 (2014).
- MacLean, H. J., Hjort Hansen, J., Sørensen, J. G. Validating the automation of different measures of high temperature tolerance of small terrestrial insects. J Insect Physiol. 137, 104362 (2022).
- Gioia, A., Zars, T. Thermotolerance and place memory in adult Drosophila are independent of natural variation at the foraging locus. J Comp Physiol A. 195, 777-782 (2009).
- Kjærsgaard, A., et al. The effect of developmental temperature fluctuation on wing traits and stressed locomotor performance in Drosophila melanogaster, and its dependence on heterozygosity. Evol Ecol Res. 14 (7), 803-819 (2012).
- Bak, N. K., Rohde, P. D., Kristensen, T. N. Strong sex-dependent effects of malnutrition on life- and healthspan in Drosophila melanogaster. Insects. 15 (1), 9 (2023).
- Bettencourt, B. R., et al. Natural variation in Drosophila stressed locomotion meets or exceeds variation caused by Hsp70 mutation: analysis of behavior and performance. Behav Genet. 393, 306-320 (2009).
- Kjærsgaard, A., et al. Locomotor activity of Drosophila melanogaster in high temperature environments: plastic and evolutionary responses. Clim Res. 43 (1-2), 127-134 (2010).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved