Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Hitzetoleranz-Assays mit dem Drosophila Activity Monitor System: Ein Leitfaden für eine ausführbare Anwendung zur Datenanalyse
In diesem Artikel
Zusammenfassung
Dieser Bericht beschreibt eine Methode zur Messung der Zeit bis zum Knockdown bei adulten Drosophila melanogaster mit einem Drosophila Activity Monitor (DAM2) als Reaktion auf einen Luftleitungs-Wärmestressor in einer Inkubatorkammer. Das DAM2 misst die Aktivität, indem es einzelne Flugbewegungen aufzeichnet, wenn sie einen Infrarotstrahl überqueren. Die Datenanalyse wird durch eine neuartige ausführbare Datei erleichtert, die von den Autoren erstellt wurde.
Zusammenfassung
Die Untersuchung der Hitzetoleranz bei Drosophila melanogaster ist seit Jahrzehnten von besonderem Interesse für Forscher, wobei ein gängiger Ansatz zur Bewertung der Hitzetoleranz darin besteht, die Zeit bis zum Knockdown (TKD) nach Exposition gegenüber einer erhöhten Temperatur zu überwachen. Klassischerweise werden Fliegen in einzelnen Fläschchen untergebracht und in ein beheiztes Wasserbad gelegt. TKD wird dann manuell von Forschern überwacht. Obwohl diese manuellen Assays sehr gut etabliert sind, gibt es nach wie vor Probleme der Subjektivität und der konsequenten Anwendung einer greifbaren Definition der Beendigung aller Bewegungen, einschließlich Muskelkrämpfe, bei der Durchführung dieser manuellen Assays. Wir haben eine Hochdurchsatzmethode zur Automatisierung von Hitzetoleranz-Assays mit den TriKinetics Drosophila Activity Monitoren (DAM2) entwickelt. Um das DAM2-System zu begleiten, haben wir ein Programm geschrieben und eine einfach zu bedienende ausführbare Datei erstellt, die automatisch den Zeitpunkt der letzten Bewegung aus den generierten Aktivitätsdaten ausliest. Dieses Skript schreibt dann die Zeit bis zur Hitzelähmung (TKD) für jede Fliege in eine .csv Datei. Unsere Daten zeigen, dass diese automatisierte DAM2-Methode konsistent und zuverlässig ist. In der Zwischenzeit sind Aktivitätsprofile von Interesse, die aus den Aktivitätszähldaten erstellt wurden. Diese Aktivitätsprofile können zusammengestellt werden und haben das Potenzial, Hitzetoleranz-Assays um die relativ ununtersuchten Verhaltenskomponenten der Hitzetoleranz zu erweitern. In diesem Protokoll wird ausführlich beschrieben, wie das DAM2-System und das HoTDAM verwendet werden! Software zur Abschätzung der Hitzetoleranz bei D. melanogaster.
Einleitung
Ektotherme reagieren auf Hitzestress typischerweise mit erhöhter Bewegungsaktivität. Dieses Phänomen ist für Forscher seit Jahrzehnten offensichtlich, mit der charakteristischen Verhaltensreaktion, die von Cowles und Bogert 1944 beschriebenwurde. Sie beschrieben, wie ein Organismus unter Hitzestress zunächst eine vermehrte Bewegung des Fortbewegungsapparates zeigt. Wenn sich der Hitzestress aufbaut, wechseln sich kurze Aktivitätsausbrüche mit Perioden der Inaktivität ab. Die Temperatur, bei der der Organismus keine koordinierte Bewegung mehr zeigen kann, ist das kritische thermische Maximum (CTmax). Es folgen muskuläre Spams, und schließlich bricht der Organismus zusammen 1,2. Dieser Zusammenbruch ist schwer zu definieren und stellt so etwas wie "Hitzestarre, Koma oder Tod"2 dar. Hier werden wir den Begriff physiologischer Kollaps verwenden, um uns theoretisch auf diesen verschwommenen Endpunkt von Hitzestress zu beziehen.
Drosophila, melanogaster und andere kleine Insekten waren wertvolle Modelle zur Untersuchung von Hitzestress. Um zumindest einen Teil der komplexen Sammlung von Merkmalen abzuschätzen, die die Hitzetoleranz ausmachen, haben viele Forscher die Zeit und die Temperatur, bei der der physiologische Kollaps auftritt, manuell beobachtet, was der Zeit bis zum Knockdown (TKD) bzw. CTmax entspricht. Obwohl diese manuellen Assay-Methoden sehr gut etabliert sind, weisen sie einige Nachteile auf. Es kann schwierig sein, eine operationelle Definition des physiologischen Kollapses zu etablieren und angemessen auf alle Fälle anzuwenden, insbesondere wenn die Beobachter weniger erfahren sind. An welchem Punkt geht der Organismus zum Beispiel von Muskelkrämpfen zum Zusammenbruch? Das Muster von Muskelkrämpfen und Anfallsaktivität vor dem Kollaps kann unvorhersehbar sein und eine genaue Beobachtung erschweren 2,3, was die Genauigkeit und Präzision gefährdet. Gleichzeitig begrenzt die Schwierigkeit der Beobachtung auch die Anzahl der Organismen, die gleichzeitig untersucht werden können, was die Skalierbarkeit einschränkt.
Da eine Erhöhung der Aktivität eine konsistente Reaktion auf Hitze ist und TKD und CTmax letztendlich der Punkt sind, an dem die Aktivität aufhört, haben wir versucht, die Drosophila Activity Monitore (DAM2) von TriKinetics zur Automatisierung von Hitzetoleranz-Assays einzusetzen. Wir haben kürzlich eine Methode für einen automatisierten Assay zusammen mit einer einfach zu bedienenden Software unter Verwendung des DAM2-Systems4 veröffentlicht. Der Assay wurde validiert, indem die Messungen der Hitzetoleranz in Bezug auf TKD mit einem klassischen manuellen beobachtungsbasierten TKD-Assay über mehrere Faktoren hinweg verglichen wurden. Wir untersuchten auch die lokomotorische Aktivitätskomponente von TKD-Assays, um den induzierbaren Thermotoleranz-Phänotyp weiter zu charakterisieren. Wir nannten den Assay und die dazugehörige Software HoTDAM! (Hitzetoleranz-Assays mit dem Drosophila Activity Monitoring System). Hier finden Sie eine detaillierte Beschreibung der automatisierten Hitzetoleranz-Assay-Methode mit dem DAM2-System und dem HoTDAM! Software. Der Assay ist einfach zu bedienen und leicht skalierbar, um die Messung vieler Organismen gleichzeitig zu ermöglichen.
In diesem Manuskript führten wir TKD-Assays an thermosensorischen mutierten Fliegen durch (transientes Rezeptorpotential Ankyrin 1; TRPA1) und ihre genetischen Kontrollen (weiß1118; W1118). Diese Organismen wurden ausgewählt, um die Bedeutung der charakteristischen erhöhten Aktivität, die bei Hitzestress beobachtet wurde, für den Assay hervorzuheben. TRPA1-Organismen zeigen dieses Fluchtverhalten nämlich, was den intrinsischen Zusammenhang zwischen konservierten Verhaltensreaktionen und Schätzungen der Hitzetoleranz, wie z. B. TKD, verdeutlicht. Wir führten den Assay sowohl für Weibchen als auch für Männchen durch und führten eine wärmehärtende Vorbehandlung durch. Bei den hier vorgestellten repräsentativen Ergebnissen handelt es sich um Daten von völlig neuen Assays als denen, die in den zuvor veröffentlichten ursprünglichen Validierungsassays verwendet wurden.
Protokoll
1. Fliegenhaltung
- Wählen Sie den passenden Fliegenstock/die passende Linie für die Untersuchung.
HINWEIS: Zur Veranschaulichung des Assays verwendeten wir den TRPA1-Knockout-Stamm des transienten Rezeptorpotentials und seine genetische Kontrolle, den w1118-Stamm . - Bewahren Sie die Fliegenbestände gegebenenfalls unter gleichbleibenden Bedingungen auf. Um dieses Protokoll zu befolgen, sollten die Lagerbestände bei 25 °C und einem Tageszyklus von 12:12 Uhr mit Standardfutter (Maismehl, Melasse und Torula-Hefe) gelagert werden.
- Trennen Sie Männchen und Weibchen mit leichter Betäubung.
HINWEIS: Je nach Versuch können jungfräuliche oder verpaarte Fliegen verwendet werden.- Lassen Sie erwachsene Männchen und Weibchen (getrennt für beide Stämme) 5 Tage lang paaren und Eier ablegen. Befreien Sie die Erwachsenen von den Flaschen.
- Wenn Erwachsene einige Tage später anfangen, sich zu verschließen, räumen Sie die Flaschen wieder auf. Nach 2 Tagen trennen Sie die Männchen und Weibchen mit leichter Äthernarkose und lassen Sie sie getrennt bei einer Dichte von 25 Fliegen pro Fläschchen reifen.
2. Vorbehandlung
- Wenden Sie die Vorbehandlung oder die unabhängige Variable an, die die Versuchsgruppen definiert (genetisch, umweltbedingt, pharmakologistisch oder anderweitig).
- Um dieses Protokoll zu befolgen, trennen Sie die Erwachsenen nach Geschlecht und behandeln Sie nach 5 Tagen die Hälfte der Erwachsenen, indem Sie ein versiegeltes Fläschchen mit den Organismen 1 h lang in ein Wasserbad bei 37 °C tauchen. Halten Sie die Regler im Inkubator bei 25 °C. Lassen Sie die Fliegen nach der Vorbehandlung 24 Stunden lang erholen, bevor Sie die Hitzetoleranz testen.
3. Einrichtung des DAM2-Systems
- Laden Sie die Fliegen in die DAM2-Monitorröhrchen und verschließen Sie die Röhrchen an beiden Enden mit Watte. Wenn die Fliegen sofort auf ihre Hitzetoleranz beurteilt werden sollen, verwenden Sie keine Anästhesie, während Sie die Organismen in die Monitorröhrchen laden, um mögliche Störeffekte im Zusammenhang mit der Anästhesieexposition zu vermeiden. Stattdessen werden einzelne Fliegen aus den Haltegefäßen in die Monitorröhrchen abgesaugt.
- Setzen Sie die Analysenröhrchen in die Aktivitätsmonitore ein und notieren Sie sich, mit welchen Steckplatznummern die verschiedenen Gruppen geladen sind.
HINWEIS: Diese können je nach Experiment randomisiert werden, wenn die Position innerhalb des Monitors als Störvariable angesehen werden könnte. - DAM2 Datenerfassungssoftware
HINWEIS: Das DAM2-System und die Software werden im DAMSystem3-Software-Datenblatt, das auf der Website des Unternehmens verfügbar ist, ausführlich beschrieben (siehe Materialtabelle). In den DAM2-Anweisungen finden Sie Informationen zur Fehlerbehebung und allgemeinen Funktionalität. Hier geben wir eine Anleitung für die Verwendung des Systems im Rahmen unseres Hitzetoleranz-Assays.- Das DAM2-System überwacht, wie oft eine einzelne Fliege in jeder Röhre einen Infrarotstrahl bricht. Die Datenerfassungssoftware indiziert diese Zählung dann und setzt sie in jedem definierten Zeitintervall zurück. Wählen Sie unter "Einstellungen" das Leseintervall aus, das im Assay verwendet werden soll. Wir haben ein Leseintervall von 15 s gefunden, um ein gutes Gleichgewicht zwischen Auflösung und Lesefehlern zu erreichen.
HINWEIS: Es wird empfohlen, das Leseintervall in Sekunden nicht kürzer zu halten als die Anzahl der verwendeten Monitore. Ein kürzeres Leseintervall sorgt für eine bessere zeitliche Auflösung des Assays, erhöht aber möglicherweise auch die Anzahl von Lesefehlern. Die Software kann beim Versuch, die Messwerte zu indizieren, ins Hintertreffen geraten. Darüber hinaus trägt ein neuerer, schnellerer Computer wesentlich dazu bei, Lesefehler zu vermeiden. - Stellen Sie bei der Berücksichtigung von Lesefehlern sicher, dass der Computer, auf dem die DAM2-Datenerfassungssoftware ausgeführt wird, so eingestellt ist, dass er nie in den Ruhezustand versetzt wird, um den Assay nicht zu unterbrechen. Stellen Sie außerdem sicher, dass automatische Updates (einschließlich aller von der Einrichtung gesteuerten Netzwerkupdates) während der Datenerfassung deaktiviert sind.
- Vergewissern Sie sich, dass alle Monitore angeschlossen sind und mit der Software kommunizieren. Vergewissern Sie sich, dass der Status jedes Monitors auf der Registerkarte Aktuelle Daten grün ist.
HINWEIS: Im Datenblatt der DAMSystem3-Software finden Sie Einzelheiten zu den Problemen, auf die sich verschiedene Farbcodes beziehen. - Die Datenerfassungssoftware schreibt die Aktivitätszählungen automatisch in Textdateien im Datenordner innerhalb der Systemdateien. Um die Datenanalyse zu vereinfachen, löschen Sie alle Textdateien in diesem Datenordner , bevor Sie die Datenerfassungssoftware für einen Assay starten.
HINWEIS: Die Textdateien werden automatisch ausgefüllt, daher ist es zulässig, sie aus diesem Ordner zu entfernen, um alte Daten zu löschen, ohne das Programm zu behindern.
- Das DAM2-System überwacht, wie oft eine einzelne Fliege in jeder Röhre einen Infrarotstrahl bricht. Die Datenerfassungssoftware indiziert diese Zählung dann und setzt sie in jedem definierten Zeitintervall zurück. Wählen Sie unter "Einstellungen" das Leseintervall aus, das im Assay verwendet werden soll. Wir haben ein Leseintervall von 15 s gefunden, um ein gutes Gleichgewicht zwischen Auflösung und Lesefehlern zu erreichen.
4. Hitzetoleranz-Assay
- Legen Sie die Monitore in den Assay-Inkubator.
- Starten Sie die Erfassungssoftware und lassen Sie die Software für eine definierte Zeitspanne (z. B. 40 Indizes oder 10 min, wenn das Leseintervall auf 15 s eingestellt ist) indizieren, bevor Sie die Wärmespannung anwenden.
HINWEIS: Dies ermöglicht eine gewisse Eingewöhnung an die Röhren und eine Erholung von der Bewegung der Monitore beim Aufstellen. Insbesondere wenn die Aktivität während des Assays analysiert wird, etabliert diese Akklimatisierungszeit eine Ausgangsaktivität vor der Induktion von Hitzestress. Abhängig von der spezifischen Art des durchzuführenden Assays kann diese Akklimatisierungsphase übersprungen werden, wobei die Monitore bereits bei der Stresstemperatur direkt in den Inkubator gestellt werden. - Wenn Sie einen statischen (TKD) Assay durchführen, stellen Sie den Inkubator so ein, dass er nach der Eingewöhnungsphase so schnell wie möglich auf die eingestellte schädliche Temperatur hochfährt. Die Antwortvariable wird als die letzte aufgezeichnete Zeit der Bewegung (d. h. der letzte Index ungleich Null) operationalisiert, um die TKD zu schätzen.
- Wenn Sie einen dynamischen Assay durchführen, bestimmen Sie die Geschwindigkeit, mit der die Temperatur nach der Eingewöhnungsphase ansteigt. Hier ist die gemessene Antwortvariable technisch gesehen wieder die Zeit. Der Zeitpunkt, zu dem die letzte Bewegung aufgezeichnet wird, stimmt mit einer Temperatur (CTmax) überein, die von der Rampengeschwindigkeit abhängt.
- Überwachen Sie die Aktivitätszahlen in Echtzeit auf dem DAM-Systemdisplay in der Erfassungssoftware oder untersuchen Sie direkt die Textdateien im Datenordner in den DAMSystem3-Programmdateien. Kopieren Sie die Textdateien, und öffnen Sie die Kopie im Gegensatz zur Originaldatei im Datenordner, um Probleme bei der Live-Datenaufzeichnung zu vermeiden.
- Nachdem mehrere Minuten lang keine Bewegung in einer der Fliegen zu sehen ist, stoppen Sie die Erfassungssoftware.
HINWEIS: Bei unseren Assays haben wir festgestellt, dass einige bis mehrere Minuten Inaktivität auf einen physiologischen Kollaps aufgrund von Hitzestress hinweisen, ähnlich wie bei den klassischen manuellen TKD-Assays. Dies hängt jedoch vom spontanen Fluchtverhalten ab. Berücksichtigen Sie daher mögliche Störvariablen, wenn die spezifische Behandlung in der Untersuchung diese Verhaltensreaktion verändern könnte. Darüber hinaus variiert die Länge des Assays natürlich in Abhängigkeit von den spezifischen Parametern des Assays (z. B. Temperatur, Behandlung).
5. Datenorganisation und -analyse
HINWEIS: Im Ergänzenden Video S1 finden Sie eine exemplarische Vorgehensweise zum Herunterladen der ausführbaren Anwendung von GitHub sowie die grundlegenden Funktionen der Software.
- Nachdem die Daten erfasst wurden, scannen Sie die Textdateien mit der referenzierten Software (siehe Materialtabelle) auf Fehler und wählen Sie bestimmte Start- und Endpunkte für das Binning von Aktivitätsdaten aus. Wenn ein Akklimatisierungsintervall von 10 Minuten implementiert wurde, starten Sie das Binning nach 10 Minuten in der Aktivitätsaufzeichnung. Weitere Informationen zum Binning finden Sie in der Diskussion.
- Öffnen Sie das HoTDAM! und importieren Sie die gescannten Monitordatendateien, indem Sie auf Datei | Monitordaten laden klicken.
HINWEIS: Die Software und die ausführbare Anwendung sind auf GitHub (https://github.com/MatthewR47/HoTDAM) oder auf der Website des Unternehmens im Abschnitt Analysesoftware verfügbar. Beachten Sie, dass die ausführbare Anwendung derzeit nur mit Windows-Betriebssystemen kompatibel ist. - Fügen Sie Gruppenbezeichnungen hinzu, um anzugeben, welche Behandlungsgruppen welcher Zelle innerhalb der DAM2-Monitore entsprechen.
HINWEIS: Das Layout der Softwareoberfläche entspricht dem Layout der Monitore. - Klicken Sie auf Multigruppendefinition starten , um ein Dialogfeld aufzurufen, in dem Sie eine Gruppenbezeichnung hinzufügen können, die auf mehrere Zellen angewendet wird. Sobald die Gruppenbezeichnung akzeptiert wurde, klicken Sie auf die Zellen, um die Gruppenbezeichnung zu übernehmen, und klicken Sie dann auf Multigruppenzuordnung stoppen.
HINWEIS: Die Software organisiert und exportiert DAMSystem3-Daten in .csv Dateien, die in der Statistiksoftware analysiert werden sollen. - Exportieren Sie die TKD (d.h. den letzten Index ungleich Null) für jede Fliege innerhalb der Monitore in eine .csv Datei, indem Sie auf Datei | Exportieren von Knockdown-Daten | Exportieren Sie alle Monitore oder exportieren Sie ausgewählte Monitore. TKD für jede Fliege wird in der Ausgabe nach Gruppenbezeichnung organisiert.
- Exportieren Sie die Aktivitätsdaten für jede Fliege, indem Sie auf Datei | Exportieren von Aktivitätsdaten | Exportieren Sie alle Monitore oder Exportieren Sie ausgewählte Monitore in eine .csv Datei, wobei nur der Zeitstempel und die Zähldaten beibehalten werden, um die Arbeit mit der Datendatei zu erleichtern und gleichzeitig bestimmte Gruppenbeschriftungen für jede Fliege zuzuweisen.
HINWEIS: Die ersten Spalten in den DAMSystem3-Datendateien entsprechen den internen Daten für die Monitore (z. B. Lichtüberwachung oder Fehlermeldungen) während der Erfassung. Die Zähldaten befinden sich in den Spalten 11-42 (weitere Informationen finden Sie im DamSystem3-Datenblatt). Beim Exportieren der Aktivitätsdaten mit der Analysesoftware werden alle Spalten mit Ausnahme des Zeitstempels und der Zähldatenspalten entfernt. - Wenn Sie ein CTmax-Experiment durchführen, verwenden Sie den TKD, um den CTmax anhand der Rate des Temperaturanstiegs zu bestimmen.
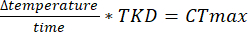
HINWEIS: Die Analysesoftware wurde objektorientiert in C# geschrieben (Quellcode auf GitHub verfügbar; https://github.com/MatthewR47/HoTDAM), so dass Aspekte des Programms leicht geändert werden können, um eine Anpassung an bestimmte Zwecke zu ermöglichen.
6. Statistik
HINWEIS: Zur Analyse der TKD-Daten können viele verschiedene Tests verwendet werden, abhängig von den Besonderheiten des Versuchsaufbaus.
- Verwenden Sie Überlebensanalysen (z. B. Cox-Regression, Kaplan-Meier), um den Knockdown als ein Ereignis zu konzeptualisieren, das jede Fliege innerhalb des Assays erleben wird.
HINWEIS: Für eine detaillierte Übersicht siehe Bradburns und Clarks 4-Artikel-Serie, in der die Überlebensanalyse und ihre Umsetzungdiskutiert 5,6,7,8. - Verwenden Sie die ANOVA, um Gruppenunterschiede zu bewerten und Modalitäten zu vergleichen, insbesondere bei der Validierung des automatisierten Assays für bestimmte Bedingungen.
- Analysieren Sie die TKD-Daten mit der Kaplan-Meier-Überlebensanalyse. Teilen Sie die Datei nach Aktien auf, so dass die Analyse separat durchgeführt wird (z. B. für TRPA1- und w1118-Lagerzeilen). Wählen Sie die Zeitvariable als TKD (in min), den Knockdown als Ereignis, die Vorbehandlung als Faktor und das Geschlecht als Schicht.
- Führen Sie die Log-Rank-, Breslow- und Tarone-Ware-Tests durch, um die Vorbehandlung für jede Schicht (d. h. das Geschlecht) zu vergleichen, und zeigen Sie zur Veranschaulichung verschiedene Methoden.
- Konstruieren Sie Überlebenspläne.
Ergebnisse
Die Analysen für TRPA1 - und w1118-Bestände wurden getrennt durchgeführt. Perzentile, TKD-Zeiten und andere Deskriptive sind in Tabelle 1 zu finden.
...| Perzentilea | ||||||||
| Sex | Behandlung | 25.00% | ||||||
Diskussion
Die hier beschriebene Hitzetoleranz-Assay-Methode ist vielseitig und skalierbar. Wir haben bereits eine Validierungsstudie veröffentlicht, in der wir die HoTDAM! Methode mit einem klassischen, beobachtungsbasierten TKD-Assay verglichen und stellte fest, dass der automatisierte Assay den gleichen allgemeinen Trend über mehrere Faktoren hinweg zeigte4 (Abbildung 3). Mit anderen Worten, auf die gleiche Weise wie der klassische manuelle...
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Das beschriebene Projekt wurde durch Zuschüsse des Institutional Development Award (IDeA) des National Institute of General Medical Sciences der National Institutes of Health (5P20GM103427 und 1U54GM115458) unterstützt. Das UNK Undergraduate Research Fellows Program und das UNMC Medical Student Summer Research Program.
Materialien
| Name | Company | Catalog Number | Comments |
| 14 mL polystyrene test tubes | Falcon | 352057 | |
| 30 gallon fish tank | Wal-mart | ||
| 8 oz bottles | Genesee | 32-129F | |
| Constant Climate Chamber | Memmert | HPP750eco | |
| cornmeal | Lab Scientific | FLY801010 | |
| DAM2 Drosophila Activity Monitor | TriKinetics | DAM2 | (DAMSystem3 Data Sheet) https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| DAMSystem data acquisition software | TriKinetics | free download | |
| Drosophila agar | Lab Scientific | FLY80201 | |
| ethanol | Fisher Scientific | BP82011 | |
| Ether | Fisher Scientific | E134-4 | |
| FileScan software | TriKinetics | for scanning for text errors, binning data, and output | |
| FlyStuff Flugs for bottles | Genesee | 49-100 | |
| FlyStuff Flugs for vials | Genesee | 49-102 | |
| FlyStuff vials | Genesee | 32-113RL | |
| HoTDAM software | Github or Trikinetics | https://github.com/MatthewR47/HoTDAM | |
| Immersion circulating heater | PolyScience | MX-CA11B | |
| molasses | Lab Scientific | FLY80084 | |
| propionic acid | Fisher Scientific | A258-500 | |
| Pyrex Glass tubes 5 x 65 mm for DAM2 | TriKinetics | PGT 5x65 | https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| small paint brush | Wal-mart | ||
| SPSS Statistics | IBM | ||
| tegosept | Lab Scientific | FLY55015 | |
| torula yeast | MP Biomedicals | 290308505 | |
| TRPA1 mutant stock | Bloomington Stock center | 26504 | w[1118]; TI{w[+mW.hs]=TI}TrpA1[1] |
| w1118 stock | Bloomington Stock center | 3605 |
Referenzen
- Cowles, R. B., Bogert, C. M. A preliminary study of the thermal requirements of desert reptiles. Bull Am Mus Nat Hist. 83, 261-296 (1944).
- Lutterschmidt, W. I., Hutchison, V. H. The critical thermal maximum: history and critique. Can J Zool. 75, 1561-1574 (1997).
- Jørgensen, L. B., Malte, H., Overgaard, J. How to assess Drosophila heat tolerance: Unifying static and dynamic tolerance assays to predict heat distribution limits. Funct Ecol. 33 (4), 629-642 (2019).
- Rokusek, B., et al. HoTDAM! An easy-to-use automated assay expands the inducible thermotolerance phenotype in Drosophila melanogaster: Heat hardening reduces motility. Comp Biochem Physiol A Mol Integr Physiol. 286, 111522 (2023).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part III: Multivariate data analysis - Choosing a model and assessing its adequacy and fit. Br J Cancer. 89 (4), 605-611 (2003).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part II: Multivariate data analysis- An introduction to concepts and methods. Br J Cancer. 89 (3), 431-436 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part IV: Further concepts and methods in survival analysis. Br J Cancer. 89 (5), 781-786 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part I: Basic concepts and first analyses. Br J Cancer. 89 (2), 232-238 (2003).
- Hazra, A., Gogtay, N. Biostatistics series module 9: survival analysis. Indian J Dermatol. 62 (3), 251-257 (2017).
- Stevenson, R. D. The relative importance of behavioral and physiological adjustments controlling body temperature in terrestrial ectotherms. Am Nat. 126 (3), 362-386 (1985).
- Grigg, G. C., Beard, L. A., Augee, M. L. The evolution of endothermy and its diversity in mammals and birds. Physiol Biochem Zool. 77 (6), 982-997 (2004).
- Soto-Padilla, A., et al. Thermosensory perception regulates speed of movement in response to temperature changes in Drosophila melanogaster. J Exp Biol. 221 (10), jeb174151 (2018).
- Hoffmann, A. A., Sørensen, J. G., Loeschcke, V. Adaptation of Drosophila to temperature extremes: bringing together quantitative and molecular approaches. J Therm Biol. 28 (3), 175-216 (2003).
- Terblanche, J. S., et al. Ecologically relevant measures of tolerance to potentially lethal temperatures. J Exp Biol. 214 (22), 3713-3725 (2011).
- Rezende, E. L., Castaneda, L. E., Santos, M. Tolerance landscapes in thermal ecology. Funct Ecol. 28 (4), 799-809 (2014).
- MacLean, H. J., Hjort Hansen, J., Sørensen, J. G. Validating the automation of different measures of high temperature tolerance of small terrestrial insects. J Insect Physiol. 137, 104362 (2022).
- Gioia, A., Zars, T. Thermotolerance and place memory in adult Drosophila are independent of natural variation at the foraging locus. J Comp Physiol A. 195, 777-782 (2009).
- Kjærsgaard, A., et al. The effect of developmental temperature fluctuation on wing traits and stressed locomotor performance in Drosophila melanogaster, and its dependence on heterozygosity. Evol Ecol Res. 14 (7), 803-819 (2012).
- Bak, N. K., Rohde, P. D., Kristensen, T. N. Strong sex-dependent effects of malnutrition on life- and healthspan in Drosophila melanogaster. Insects. 15 (1), 9 (2023).
- Bettencourt, B. R., et al. Natural variation in Drosophila stressed locomotion meets or exceeds variation caused by Hsp70 mutation: analysis of behavior and performance. Behav Genet. 393, 306-320 (2009).
- Kjærsgaard, A., et al. Locomotor activity of Drosophila melanogaster in high temperature environments: plastic and evolutionary responses. Clim Res. 43 (1-2), 127-134 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten