Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Анализ термостойкости с использованием системы мониторинга активности дрозофилы : руководство по исполняемому приложению для анализа данных
В этой статье
Резюме
В этом отчете описывается метод измерения времени до нокдауна взрослой особи Drosophila melanogaster с помощью монитора активности дрозофилы (DAM2) в ответ на тепловой стрессор воздушной проводимости в камере инкубатора. DAM2 измеряет активность, записывая движения отдельных мух, когда они пересекают инфракрасный луч. Анализ данных облегчается новым исполняемым файлом, созданным авторами.
Аннотация
Изучение устойчивости к жаре у Drosophila melanogaster представляет особый интерес для исследователей на протяжении десятилетий, при этом общий подход к оценке устойчивости к жаре заключается в мониторинге времени до нокдауна (TKD) после воздействия повышенной температуры. Классически мух помещают в отдельные флаконы и помещают внутрь водяной бани с подогревом. Затем ТКД контролируется исследователями вручную. Несмотря на то, что эти исследования хорошо известны, остаются проблемы субъективности и последовательного применения осязаемого определения прекращения всех движений, включая мышечные спазмы, при проведении этих ручных анализов. Мы разработали высокопроизводительный метод автоматизации анализов термостойкости с использованием мониторов активности дрозофилы TriKinetics (DAM2). Для сопровождения системы DAM2 мы написали программу и создали простой в использовании исполняемый файл для автоматического считывания последнего времени движения по сгенерированным данным об активности. Затем этот скрипт записывает в файл .csv время до теплового паралича (TKD) для каждой мухи. Наши данные показывают, что этот автоматизированный метод DAM2 является последовательным и надежным. Между тем, профили активности, созданные на основе данных о количестве активности, представляют интерес. Эти профили активности могут быть составлены и имеют потенциал для расширения анализов термотолерантности, чтобы включить в них относительно неизученные поведенческие компоненты термотолерантности. В этом протоколе будет подробно описано, как пользоваться системой DAM2 и HoTDAM! программное обеспечение для оценки теплостойкости у D. melanogaster.
Введение
Эктотермы обычно реагируют на тепловой стресс повышенной локомоторной активностью. Этот феномен был очевиден исследователям на протяжении десятилетий, а характерная поведенческая реакция была описана Коулзом и Богертом в 1944году. Они описали, как организм при тепловом стрессе сначала проявляет повышенную двигательную двигатель. По мере нарастания теплового стресса короткие всплески активности перемежаются периодами бездействия. Температура, при которой организм больше не может демонстрировать скоординированное движение, является критическим тепловым максимумом (CTmax). Далее следует мышечный спам, и в конечном итоге организм разрушается 1,2. Этот коллапс трудно поддается определению, и он представляет собой нечто сродни «тепловому истощению, коме или смерти»2. Здесь мы будем использовать термин «физиологический коллапс» для теоретического обозначения этой размытой конечной точки теплового стресса.
Drosophila melanogaster и другие мелкие насекомые были ценными моделями для изучения теплового стресса. Чтобы оценить, по крайней мере, часть сложного набора признаков, составляющих устойчивость к жаре, многие исследователи вручную наблюдали за временем и температурой, при которой происходит физиологический коллапс, представляя время до нокдауна (TKD) и CTmax соответственно. Несмотря на то, что эти методы ручного анализа очень хорошо зарекомендовали себя, они имеют некоторые недостатки. Операционное определение физиологического коллапса может быть трудно установить и надлежащим образом применять ко всем случаям, особенно когда наблюдатели менее опытны. Например, в какой момент организм переходит от мышечных спазмов к коллапсу? Характер мышечных спазмов и судорожной активности до коллапса может быть непредсказуемым и может затруднить точное наблюдение 2,3, угрожая точности и аккуратности. Между тем, сложность наблюдения также ограничивает количество организмов, которые могут быть проанализированы одновременно, ограничивая масштабируемость.
Поскольку увеличение активности является последовательной реакцией на тепло, а TKD и CTmax в конечном итоге являются точкой, в которой активность прекращается, мы решили использовать мониторы активности дрозофил (DAM2) от TriKinetics для автоматизации анализов термоустойчивости. Недавно мы опубликовали метод автоматизированного анализа, а также простое в использовании программное обеспечение с использованием системы DAM24. Анализ был валидирован путем сравнения показателей термостойкости с точки зрения ТКД с классическим ручным анализом ТКД, основанным на наблюдении, по нескольким факторам. Мы также исследовали компонент локомоторной активности в анализах TKD для дальнейшей характеристики фенотипа индуцируемой термотолерантности. Мы назвали тест и сопутствующее программное обеспечение HoTDAM! (Анализ термоустойчивости с использованием системы мониторинга активности дрозофилы). Здесь мы приводим подробное описание автоматизированного метода определения термостойкости с использованием системы DAM2 и HoTDAM! программное обеспечение. Анализ прост в использовании и легко масштабируется, что позволяет измерять множество организмов одновременно.
В данной рукописи мы выполнили анализ ТКД на термосенсорных мутантных мухах (транзиторный рецепторный потенциал анкирин 1; TRPA1) и их генетический контроль (белый1118; w1118). Эти организмы были выбраны для того, чтобы подчеркнуть важность для анализа характерной повышенной активности, наблюдаемой во время теплового стресса. А именно, организмы TRPA1 не демонстрируют такого поведения побега, что иллюстрирует внутреннюю связь между консервативными поведенческими реакциями и оценками устойчивости к жаре, такими как TKD. Мы провели анализ как для женщин, так и для мужчин, а также провели предварительную термозакалку. Представленные здесь репрезентативные результаты представляют собой данные совершенно новых анализов, чем те, которые использовались в оригинальных валидационных анализах, опубликованных ранее.
протокол
1. Разведение мух
- Выберите подходящий материал/линию для исследования.
Примечание: Чтобы проиллюстрировать анализ, мы использовали нокаутный запас транзиентного рецептора TRPA1 и его генетический контроль, запас w1118 . - При необходимости поддерживайте поголовье мух в постоянных условиях. Чтобы следовать этому протоколу, храните запасы при температуре 25 °C в суточном цикле 12:12 на стандартных продуктах питания (кукурузная мука, патока и дрожжи торула).
- Разделите самцов и самок с помощью легкой анестезии.
ПРИМЕЧАНИЕ: В зависимости от эксперимента, могут использоваться девственные или спаренные мухи.- Дайте взрослым самцам и самкам (отдельно для обеих стад) спариться и отязать яйца в течение 5 дней. Очистите взрослых от бутылок.
- Когда взрослые начнут закрываться через несколько дней, снова очистите бутылки. Через 2 дня разделите самцов и самок с помощью легкой эфирной анестезии и дайте им созреть отдельно при плотности 25 мух во флаконе.
2. Предварительная обработка
- Примените предварительную обработку или независимую переменную, которая будет определять экспериментальные группы (генетические, экологические, фармакологические или иные).
- Чтобы следовать этому протоколу, разделите взрослых особей по половому признаку, а через 5 дней предварительно обработайте половину взрослых особей, погрузив герметичный флакон с микроорганизмами в водяную баню при температуре 37 °C на 1 час. Держите органы управления в инкубаторе при температуре 25 °C. Дайте мухам восстановиться в течение 24 часов после предварительной обработки, перед анализом на устойчивость к жаре.
3. Настройка системы DAM2
- Загрузите мух в трубки монитора DAM2 и закройте трубки с обоих концов ватой. Если необходимо немедленно оценить устойчивость мух к жаре, не используйте анестезию во время загрузки микроорганизмов в трубки монитора, чтобы избежать любых потенциальных искажающих эффектов, связанных с воздействием анестезии. Вместо этого аспирируйте отдельных мух из флаконов в контрольные трубки.
- Вставьте пробирки для анализа в мониторы активности, обращая внимание на номера слотов в различные группы.
ПРИМЕЧАНИЕ: Они могут быть рандомизированы в зависимости от эксперимента, если расположение внутри монитора может считаться искажающей переменной. - Программное обеспечение для сбора данных DAM2
ПРИМЕЧАНИЕ: Система и программное обеспечение DAM2 подробно описаны в техническом описании программного обеспечения DAMSystem3, доступном на веб-сайте компании (см. Таблицу материалов). Обратитесь к инструкциям DAM2 для устранения конкретных неполадок и общих функций. Здесь мы даем рекомендации по использованию системы в контексте нашего анализа термостойкости.- Система DAM2 отслеживает, сколько раз отдельная муха в каждой трубе прерывает инфракрасный луч. Затем программное обеспечение для сбора данных индексирует и сбрасывает это число каждый определенный интервал времени. В разделе «Настройки» выберите интервал считывания , который будет использоваться в анализе. Мы нашли интервал чтения в 15 секунд для достижения хорошего баланса между разрешением и ошибками чтения.
ПРИМЕЧАНИЕ: Рекомендуется, чтобы интервал считывания не был короче в секундах, чем количество используемых мониторов. Более короткий интервал чтения обеспечит лучшее временное разрешение анализа, но также потенциально увеличит количество ошибок чтения. Программное обеспечение может отставать при попытке индексировать показания. Кроме того, более новый и быстрый компьютер имеет большое значение для предотвращения ошибок чтения. - При рассмотрении ошибок чтения убедитесь, что компьютер, на котором запущено программное обеспечение для сбора данных DAM2, настроен на то, чтобы никогда не переходить в спящий режим или гибернацию, чтобы не прерывать анализ. Кроме того, убедитесь, что автоматические обновления (включая любые сетевые обновления, контролируемые учреждением) отключены во время сбора данных.
- Убедитесь, что все мониторы подключены и обмениваются данными с программным обеспечением. Убедитесь, что состояние каждого монитора отображается зеленым цветом на вкладке текущих данных .
ПРИМЕЧАНИЕ: Смотрите техническое описание программного обеспечения DAMSystem3 для получения подробной информации о проблемах, к которым относятся различные цветовые коды. - Программное обеспечение для сбора данных автоматически записывает данные о количестве действий в текстовые файлы в папке «Данные » в системных файлах. Чтобы упростить анализ данных, удалите все текстовые файлы в этой папке данных перед запуском программного обеспечения для сбора данных для любого анализа.
ПРИМЕЧАНИЕ: Текстовые файлы будут автоматически заполнены, поэтому допустимо удалить их из этой папки, чтобы очистить старые данные, не мешая работе программы.
- Система DAM2 отслеживает, сколько раз отдельная муха в каждой трубе прерывает инфракрасный луч. Затем программное обеспечение для сбора данных индексирует и сбрасывает это число каждый определенный интервал времени. В разделе «Настройки» выберите интервал считывания , который будет использоваться в анализе. Мы нашли интервал чтения в 15 секунд для достижения хорошего баланса между разрешением и ошибками чтения.
4. Тест на термостойкость
- Загрузите мониторы в пробирный инкубатор.
- Запустите программное обеспечение для сбора данных и оставьте индекс программного обеспечения на определенный период времени (например, 40 индексов или 10 минут, если интервал считывания установлен на 15 с) перед применением теплового напряжения.
ПРИМЕЧАНИЕ: Это позволяет в некоторой степени акклиматизироваться к трубкам и восстановиться после движения мониторов во время их настройки. Особенно если анализируется активность во время анализа, то это время акклиматизации установит исходную активность до возникновения теплового стресса. В зависимости от специфики проводимого анализа, эту фазу акклиматизации можно пропустить, поместив мониторы непосредственно в инкубатор уже при стрессовой температуре. - При проведении статического анализа (TKD) установите инкубатор на ускорение до заданной вредной температуры после периода акклиматизации. Переменная отклика будет операционализирована как последнее зарегистрированное время движения (т.е. последний ненулевой индекс) для оценки TKD.
- Если вы проводите динамический анализ, определите скорость, с которой температура будет повышаться после периода акклиматизации. Здесь измеряемая переменная отклика технически снова является временем. Время, в которое записывается последнее движение, будет совпадать с температурой (CTmax), в зависимости от скорости нарастания.
- Отслеживайте подсчет активности в режиме реального времени на дисплее системы DAM в программном обеспечении для сбора данных или непосредственно изучайте текстовые файлы в папке данных в файлах программы DAMSystem3. Скопируйте текстовые файлы и откройте копию, а не исходный файл в папке данных, чтобы не вызвать проблем с записью данных в реальном времени.
- После того как в течение нескольких минут ни у одной из мух не будет видно движения, остановите работу программного обеспечения для сбора данных.
ПРИМЕЧАНИЕ: С помощью наших анализов мы обнаружили, что от нескольких до нескольких минут бездействия указывают на физиологический коллапс из-за теплового стресса, подобный тому, который наблюдается при классических ручных анализах TKD. Это, однако, зависит от спонтанного поведения бегства. Таким образом, рассмотрите возможные смешанные переменные, если конкретное лечение в исследовании может изменить эту поведенческую реакцию. Кроме того, в зависимости от конкретных параметров анализа (например, температуры, обработки), продолжительность анализа, очевидно, будет варьироваться.
5. Организация и анализ данных
ПРИМЕЧАНИЕ: В дополнительном видео S1 вы найдете пошаговое руководство по загрузке исполняемого приложения с GitHub, а также основные функциональные возможности программного обеспечения.
- После получения данных отсканируйте текстовые файлы на наличие ошибок с помощью указанного программного обеспечения (см. Таблицу материалов) и выберите конкретные начальные и конечные точки для группирования данных о действиях. Если был реализован интервал акклиматизации в 10 минут, начните группирование через 10 минут после начала записи активности. Дополнительные сведения о группировании см. в обсуждении.
- Откройте HoTDAM! и импортировать отсканированные файлы данных монитора, нажав Файл | загрузить данные монитора.
ПРИМЕЧАНИЕ: Программное обеспечение и исполняемое приложение доступны на GitHub (https://github.com/MatthewR47/HoTDAM) или на веб-сайте компании в разделе «Программное обеспечение для анализа ». Обратите внимание, что в настоящее время исполняемое приложение совместимо только с операционными системами Windows. - Добавьте обозначения групп, чтобы указать, какие группы обработки соответствуют той или иной ячейке в мониторах DAM2.
ПРИМЕЧАНИЕ: Макет интерфейса программного обеспечения соответствует макету мониторов. - Нажмите кнопку Начать определение нескольких групп, чтобы открыть диалоговое окно для добавления обозначения группы, которое будет применено к нескольким ячейкам. После того, как обозначение группы будет принято, нажмите на ячейки, чтобы применить обозначение группы, затем нажмите «Остановить обозначение нескольких групп».
ПРИМЕЧАНИЕ: Программное обеспечение организует и экспортирует данные DAMSystem3 в .csv файлы для анализа в статистическом программном обеспечении. - Экспортируйте TKD (т.е. последний ненулевой индекс) для каждой мухи в мониторах в файл .csv, нажав Файл | Экспорт данных о нокдауне | Экспортируйте все мониторы или экспортируйте выбранные мониторы. TKD для каждой мухи будет организован в выходе по групповому обозначению.
- Экспортируйте данные об активности для каждой мухи, нажав на Файл | Экспорт данных о действиях | Экспортируйте все мониторы или экспортируйте выбранные мониторы в файл .csv, сохраняя только временные метки и данные подсчета, что упрощает работу с файлом данных, а также назначает назначенные групповые метки для каждого полета.
ПРИМЕЧАНИЕ: Первые несколько столбцов в файлах данных DAMSystem3 соответствуют внутренним данным для мониторов (например, данные о мониторинге освещенности или сообщения об ошибках) во время сбора данных. Данные подсчета находятся в столбцах 11-42 (подробнее см. в техническом описании DamSystem3). При экспорте данных о действиях с помощью аналитического программного обеспечения будут удалены все столбцы, кроме метки времени и столбцов данных о количестве. - При выполнении эксперимента с CTmax используйте TKD для определения CTmax по скорости нарастания температуры.
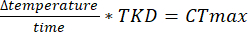
Примечание: Программное обеспечение для анализа было написано объектно-ориентированным образом на C# (исходный код доступен на GitHub; https://github.com/MatthewR47/HoTDAM) таким образом, что аспекты программы могут быть легко изменены для настройки под конкретные цели.
6. Статистика
ПРИМЕЧАНИЕ: Для анализа данных TKD можно использовать множество различных тестов, в зависимости от специфики экспериментальной установки.
- Используйте анализ выживаемости (например, регрессию Кокса, Каплана-Мейера) для концептуализации нокдауна как события, которое испытает каждая муха в рамках анализа.
ПРИМЕЧАНИЕ: Подробный обзор см. в серии статей Брэдберна и Кларка, посвященных анализу выживаемости и его реализации 5,6,7,8. - Используйте ANOVA для оценки различий в группах и сравнения модальностей, особенно при валидации автоматического анализа для конкретных условий.
- Проанализируйте данные ТКД с помощью анализа выживаемости Каплана-Мейера. Разбейте файл по акциям таким образом, чтобы анализ выполнялся отдельно (например, для линий TRPA1 и w1118 акций). Выберите переменную времени в качестве TKD (в минутах), нокдаун в качестве события, предварительную обработку в качестве фактора и пол в качестве страты.
- Проведите тесты логарифмического ранга, Бреслоу и Тарона-Уэра для сравнения предварительной обработки для каждого слоя (т.е. пола) в иллюстративных целях, показав несколько методов.
- Стройте сюжеты для выживания.
Результаты
Анализ акций TRPA1 и w1118 проводился отдельно. Процентиль умножения TKD и другие описательные данные можно найти в таблице 1.
| Процентилиa | ||||||||
Обсуждение
Метод определения термостойкости, который мы описываем здесь, является универсальным и масштабируемым. Ранее мы опубликовали валидационное исследование, в котором сравнили тест HoTDAM! к классическому, основанному на наблюдении анализу TKD и обнаружил, что автоматическ?...
Раскрытие информации
Авторы заявляют, что у них нет конфликта интересов.
Благодарности
Описанный проект был поддержан грантами Премии за институциональное развитие (IDeA) от Национального института общих медицинских наук Национальных институтов здравоохранения (5P20GM103427 и 1U54GM115458). Программа научных сотрудников бакалавриата UNK и летняя исследовательская программа UNMC для студентов-медиков.
Материалы
| Name | Company | Catalog Number | Comments |
| 14 mL polystyrene test tubes | Falcon | 352057 | |
| 30 gallon fish tank | Wal-mart | ||
| 8 oz bottles | Genesee | 32-129F | |
| Constant Climate Chamber | Memmert | HPP750eco | |
| cornmeal | Lab Scientific | FLY801010 | |
| DAM2 Drosophila Activity Monitor | TriKinetics | DAM2 | (DAMSystem3 Data Sheet) https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| DAMSystem data acquisition software | TriKinetics | free download | |
| Drosophila agar | Lab Scientific | FLY80201 | |
| ethanol | Fisher Scientific | BP82011 | |
| Ether | Fisher Scientific | E134-4 | |
| FileScan software | TriKinetics | for scanning for text errors, binning data, and output | |
| FlyStuff Flugs for bottles | Genesee | 49-100 | |
| FlyStuff Flugs for vials | Genesee | 49-102 | |
| FlyStuff vials | Genesee | 32-113RL | |
| HoTDAM software | Github or Trikinetics | https://github.com/MatthewR47/HoTDAM | |
| Immersion circulating heater | PolyScience | MX-CA11B | |
| molasses | Lab Scientific | FLY80084 | |
| propionic acid | Fisher Scientific | A258-500 | |
| Pyrex Glass tubes 5 x 65 mm for DAM2 | TriKinetics | PGT 5x65 | https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| small paint brush | Wal-mart | ||
| SPSS Statistics | IBM | ||
| tegosept | Lab Scientific | FLY55015 | |
| torula yeast | MP Biomedicals | 290308505 | |
| TRPA1 mutant stock | Bloomington Stock center | 26504 | w[1118]; TI{w[+mW.hs]=TI}TrpA1[1] |
| w1118 stock | Bloomington Stock center | 3605 |
Ссылки
- Cowles, R. B., Bogert, C. M. A preliminary study of the thermal requirements of desert reptiles. Bull Am Mus Nat Hist. 83, 261-296 (1944).
- Lutterschmidt, W. I., Hutchison, V. H. The critical thermal maximum: history and critique. Can J Zool. 75, 1561-1574 (1997).
- Jørgensen, L. B., Malte, H., Overgaard, J. How to assess Drosophila heat tolerance: Unifying static and dynamic tolerance assays to predict heat distribution limits. Funct Ecol. 33 (4), 629-642 (2019).
- Rokusek, B., et al. HoTDAM! An easy-to-use automated assay expands the inducible thermotolerance phenotype in Drosophila melanogaster: Heat hardening reduces motility. Comp Biochem Physiol A Mol Integr Physiol. 286, 111522 (2023).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part III: Multivariate data analysis - Choosing a model and assessing its adequacy and fit. Br J Cancer. 89 (4), 605-611 (2003).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part II: Multivariate data analysis- An introduction to concepts and methods. Br J Cancer. 89 (3), 431-436 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part IV: Further concepts and methods in survival analysis. Br J Cancer. 89 (5), 781-786 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part I: Basic concepts and first analyses. Br J Cancer. 89 (2), 232-238 (2003).
- Hazra, A., Gogtay, N. Biostatistics series module 9: survival analysis. Indian J Dermatol. 62 (3), 251-257 (2017).
- Stevenson, R. D. The relative importance of behavioral and physiological adjustments controlling body temperature in terrestrial ectotherms. Am Nat. 126 (3), 362-386 (1985).
- Grigg, G. C., Beard, L. A., Augee, M. L. The evolution of endothermy and its diversity in mammals and birds. Physiol Biochem Zool. 77 (6), 982-997 (2004).
- Soto-Padilla, A., et al. Thermosensory perception regulates speed of movement in response to temperature changes in Drosophila melanogaster. J Exp Biol. 221 (10), jeb174151 (2018).
- Hoffmann, A. A., Sørensen, J. G., Loeschcke, V. Adaptation of Drosophila to temperature extremes: bringing together quantitative and molecular approaches. J Therm Biol. 28 (3), 175-216 (2003).
- Terblanche, J. S., et al. Ecologically relevant measures of tolerance to potentially lethal temperatures. J Exp Biol. 214 (22), 3713-3725 (2011).
- Rezende, E. L., Castaneda, L. E., Santos, M. Tolerance landscapes in thermal ecology. Funct Ecol. 28 (4), 799-809 (2014).
- MacLean, H. J., Hjort Hansen, J., Sørensen, J. G. Validating the automation of different measures of high temperature tolerance of small terrestrial insects. J Insect Physiol. 137, 104362 (2022).
- Gioia, A., Zars, T. Thermotolerance and place memory in adult Drosophila are independent of natural variation at the foraging locus. J Comp Physiol A. 195, 777-782 (2009).
- Kjærsgaard, A., et al. The effect of developmental temperature fluctuation on wing traits and stressed locomotor performance in Drosophila melanogaster, and its dependence on heterozygosity. Evol Ecol Res. 14 (7), 803-819 (2012).
- Bak, N. K., Rohde, P. D., Kristensen, T. N. Strong sex-dependent effects of malnutrition on life- and healthspan in Drosophila melanogaster. Insects. 15 (1), 9 (2023).
- Bettencourt, B. R., et al. Natural variation in Drosophila stressed locomotion meets or exceeds variation caused by Hsp70 mutation: analysis of behavior and performance. Behav Genet. 393, 306-320 (2009).
- Kjærsgaard, A., et al. Locomotor activity of Drosophila melanogaster in high temperature environments: plastic and evolutionary responses. Clim Res. 43 (1-2), 127-134 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены