Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tests de tolérance à la chaleur à l’aide du système de surveillance de l’activité de la drosophile : Guide d’une application exécutable pour l’analyse des données
Dans cet article
Résumé
Ce rapport décrit une méthode permettant de mesurer le temps de chute de Drosophila melanogaster adulte à l’aide d’un moniteur d’activité de la drosophile (DAM2) en réponse à un facteur de stress thermique par conduction aérienne dans une chambre d’incubation. Le DAM2 mesure l’activité en enregistrant les mouvements individuels des mouches lorsqu’elles traversent un faisceau infrarouge. L’analyse des données est facilitée par un nouveau fichier exécutable créé par les auteurs.
Résumé
L’étude de la tolérance à la chaleur chez Drosophila melanogaster intéresse particulièrement les chercheurs depuis des décennies, une approche commune pour évaluer la tolérance à la chaleur étant de surveiller le temps de neutralisation (TKD) après une exposition à une température élevée. Classiquement, les mouches sont logées dans des flacons individuels et placées dans un bain d’eau chauffé. Le TKD est ensuite surveillé manuellement par les chercheurs. Bien que très bien établis, il reste des problèmes de subjectivité et d’application cohérente d’une définition tangible de l’arrêt de tout mouvement, y compris les spasmes musculaires, lors de la mise en œuvre de ces tests manuels. Nous avons développé une méthode à haut débit pour automatiser les tests de tolérance à la chaleur à l’aide des moniteurs d’activité de la drosophile TriKinetics (DAM2). Pour accompagner le système DAM2, nous avons écrit un programme et créé un exécutable facile à utiliser pour lire automatiquement le dernier moment de mouvement à partir des données d’activité générées. Ce script écrit ensuite dans un fichier .csv le temps de paralysie thermique (TKD) pour chaque mouche. Nos données montrent que cette méthode automatisée de DAM2 est cohérente et fiable. En revanche, les profils d’activité créés à partir des données de comptage d’activité sont intéressants. Ces profils d’activité peuvent être compilés et ont le potentiel d’élargir les tests de tolérance à la chaleur pour inclure les composantes comportementales relativement peu étudiées de la tolérance à la chaleur. Ce protocole décrira en détail comment utiliser le système DAM2 et le système HoTDAM ! logiciel pour estimer la tolérance à la chaleur chez D. melanogaster.
Introduction
Les ectothermes réagissent généralement au stress thermique par une activité locomotrice accrue. Ce phénomène est apparent pour les chercheurs depuis des décennies, avec la réponse comportementale caractéristique décrite par Cowles et Bogert en 19441. Ils ont décrit comment un organisme soumis à un stress thermique montrera d’abord une augmentation du mouvement locomoteur. Au fur et à mesure que le stress thermique s’accumule, de courtes périodes d’activité sont entrecoupées de périodes d’inactivité. La température à laquelle l’organisme ne peut plus présenter de mouvement coordonné est le maximum thermique critique (CTmax). Des spams musculaires suivent, et finalement l’organisme s’effondre 1,2. Cet effondrement est difficile à définir et représente quelque chose qui s’apparente à « la rigueur thermique, au coma ou à la mort »2. Ici, nous utiliserons le terme d’effondrement physiologique pour désigner théoriquement ce point final flou du stress thermique.
Drosophila melanogaster et d’autres petits insectes ont été des modèles précieux pour étudier le stress thermique. Pour estimer au moins une partie de l’ensemble complexe de traits qui constituent la tolérance à la chaleur, de nombreux chercheurs ont observé manuellement le moment et la température auxquels l’effondrement physiologique se produit, représentant respectivement le temps avant l’abattage (TKD) et le CTmax. Bien que très bien établies, ces méthodes d’essai manuel présentent certains inconvénients. Une définition opérationnelle de l’effondrement physiologique peut être difficile à établir et à appliquer de manière appropriée à tous les cas, surtout lorsque les observateurs sont moins expérimentés. Par exemple, à quel moment l’organisme passe-t-il des spasmes musculaires à l’effondrement ? Le schéma des spasmes musculaires et de l’activité convulsive avant l’effondrement peut être imprévisible et peut compliquer l’observation précise 2,3, menaçant l’exactitude et la précision. Pendant ce temps, la difficulté d’observation limite également le nombre d’organismes qui peuvent être analysés en même temps, ce qui limite l’évolutivité.
Étant donné qu’une augmentation de l’activité est une réponse cohérente à la chaleur et que TKD et CTmax sont finalement le point où l’activité cesse, nous avons cherché à utiliser les moniteurs d’activité de la drosophile (DAM2) de TriKinetics pour automatiser les tests de tolérance à la chaleur. Nous avons récemment publié une méthode de dosage automatisé, ainsi qu’un logiciel facile à utiliser, utilisant le système DAM24. Le test a été validé en comparant les mesures de tolérance à la chaleur en termes de TKD à un test TKD manuel classique basé sur l’observation sur plusieurs facteurs. Nous avons également exploré la composante de l’activité locomotrice des tests TKD afin de caractériser davantage le phénotype de thermotolérance inductible. Nous avons nommé le test et le logiciel qui l’accompagne HoTDAM ! (Tests de tolérance à la chaleur à l’aide du système de surveillance de l’activité de la drosophile). Nous fournissons ici une description détaillée de la méthode automatisée de dosage de la tolérance à la chaleur à l’aide du système DAM2 et du HoTDAM ! logiciel. Le test est facile à utiliser et est facilement évolutif pour permettre la mesure de plusieurs organismes à la fois.
Dans ce manuscrit, nous avons effectué des tests TKD sur des mouches mutantes thermosensorielles (potentiel de récepteur transitoire ankyrine 1 ; TRPA1) et leurs contrôles génétiques (White1118 ; w1118). Ces organismes ont été choisis pour souligner l’importance de l’activité accrue caractéristique observée pendant le stress thermique pour l’essai. En effet, les organismes TRPA1 ne présentent pas ce comportement d’échappement, illustrant le lien intrinsèque entre les réponses comportementales conservées et les estimations de la tolérance à la chaleur, telles que la TKD. Nous avons effectué le test pour les femelles et les mâles, ainsi que la mise en œuvre d’un prétraitement par durcissement thermique. Les résultats représentatifs présentés ici sont des données provenant d’essais entièrement nouveaux par rapport à ceux utilisés dans les essais de validation originaux publiés précédemment.
Protocole
1. Élevage de mouches
- Choisissez la crosse/ligne de mouches appropriée pour l’enquête.
REMARQUE : Pour illustrer le test, nous avons utilisé le stock knock-out TRPA1 du récepteur transitoire et son contrôle génétique, le stock w1118 . - Maintenez les stocks de mouches dans des conditions constantes, le cas échéant. Pour suivre ce protocole, faites des stocks à 25 °C sous un cycle diurne de 12:12 avec des aliments standard (semoule de maïs, mélasse et levure torula).
- Séparez les mâles et les femelles avec une anesthésie légère.
REMARQUE : Selon l’expérience, des mouches vierges ou accouplées peuvent être utilisées.- Laissez les mâles et les femelles adultes (séparément pour les deux stocks) s’accoupler et pondre pendant 5 jours. Retirez les adultes des bouteilles.
- Lorsque les adultes commencent à se refermer plusieurs jours plus tard, nettoyez à nouveau les bouteilles. Après 2 jours, séparez les mâles et les femelles à l’aide d’une anesthésie à l’éther léger et laissez-les mûrir séparément à une densité de 25 mouches par flacon.
2. Prétraitement
- Appliquez la variable de prétraitement ou la variable indépendante qui définira les groupes expérimentaux (génétique, environnemental, pharmacologique ou autre).
- Pour suivre ce protocole, séparez les adultes par sexe, et après 5 jours, prétraitez la moitié des adultes en immergeant un flacon scellé contenant les organismes dans un bain-marie à 37 °C pendant 1 h. Maintenez les commandes dans l’incubateur à 25 °C. Laissez les mouches récupérer pendant 24 h après le prétraitement, avant le test de tolérance à la chaleur.
3. Configuration du système DAM2
- Chargez les mouches dans les tubes de moniteur DAM2 et recouvrez les tubes aux deux extrémités avec du coton. Si l’on veut évaluer immédiatement la tolérance à la chaleur des mouches, ne pas utiliser d’anesthésie pendant le chargement des organismes dans les tubes de surveillance afin d’éviter tout effet de confusion potentiel associé à l’exposition à l’anesthésie. Au lieu de cela, aspirez les mouches individuelles des flacons de maintien dans les tubes de contrôle.
- Placez les tubes de test dans les moniteurs d’activité, en prenant note des numéros d’emplacement des différents groupes chargés.
REMARQUE : Ceux-ci peuvent être randomisés en fonction de l’expérience si l’emplacement dans le moniteur peut être considéré comme une variable confondante. - Logiciel d’acquisition de données DAM2
REMARQUE : Le système et le logiciel DAM2 sont décrits en détail dans la fiche technique du logiciel DAMSystem3 disponible sur le site Web de l’entreprise (voir le tableau des matériaux). Reportez-vous aux instructions du DAM2 pour un dépannage spécifique et des fonctionnalités générales. Nous fournissons ici des conseils pour l’utilisation du système dans le cadre de notre test de tolérance à la chaleur.- Le système DAM2 surveille le nombre de fois qu’une mouche individuelle à l’intérieur de chaque tube brise un faisceau infrarouge. Le logiciel d’acquisition de données indexe et réinitialise ensuite ce décompte à chaque intervalle de temps défini. Sous préférences, sélectionnez l’intervalle de lecture à utiliser dans le test. Nous avons trouvé un intervalle de lecture de 15 s pour obtenir un bon équilibre entre la résolution et les erreurs de lecture.
REMARQUE : Il est recommandé que l’intervalle de lecture ne soit pas plus court en secondes que le nombre de moniteurs utilisés. Un intervalle de lecture plus court donnera une meilleure résolution temporelle au test, mais augmentera également potentiellement les cas d’erreurs de lecture. Le logiciel peut prendre du retard lors de la tentative d’indexation des relevés. De plus, un ordinateur plus récent et plus rapide contribue grandement à prévenir les erreurs de lecture. - Lorsque vous examinez les erreurs de lecture, assurez-vous que l’ordinateur utilisé pour exécuter le logiciel d’acquisition de données DAM2 est configuré pour ne jamais se mettre en veille ou en veille prolongée afin de ne pas interrompre le test. De plus, assurez-vous que les mises à jour automatiques (y compris les mises à jour réseau contrôlées par l’établissement) sont désactivées lors de la collecte de données.
- Vérifiez que tous les moniteurs sont connectés et communiquent avec le logiciel. Vérifiez que l’état de chaque moniteur est vert sous l’onglet Données actuelles .
REMARQUE : Consultez la fiche technique du logiciel DAMSystem3 pour plus de détails sur les problèmes auxquels se réfèrent les différents codes de couleur. - Le logiciel d’acquisition de données écrira automatiquement le nombre d’activités dans des fichiers texte dans le dossier Données des fichiers système. Pour faciliter l’analyse des données, supprimez tous les fichiers texte dans ce dossier de données avant de démarrer le logiciel d’acquisition de données pour tout test.
REMARQUE : Les fichiers texte seront automatiquement remplis, il est donc permis de les supprimer de ce dossier pour effacer les anciennes données sans entraver le programme.
- Le système DAM2 surveille le nombre de fois qu’une mouche individuelle à l’intérieur de chaque tube brise un faisceau infrarouge. Le logiciel d’acquisition de données indexe et réinitialise ensuite ce décompte à chaque intervalle de temps défini. Sous préférences, sélectionnez l’intervalle de lecture à utiliser dans le test. Nous avons trouvé un intervalle de lecture de 15 s pour obtenir un bon équilibre entre la résolution et les erreurs de lecture.
4. Essai de tolérance à la chaleur
- Chargez les moniteurs dans l’incubateur de test.
- Démarrez le logiciel d’acquisition et laissez-le indexer pendant une durée définie (par exemple, 40 indices ou 10 min si l’intervalle de lecture est réglé sur 15 s) avant d’appliquer le stress thermique.
REMARQUE : Cela permet une certaine acclimatation aux tubes et une récupération du mouvement des moniteurs lors de leur installation. Surtout si l’activité pendant le test est analysée, ce temps d’acclimatation établira une activité de base avant l’induction du stress thermique. En fonction de la nature spécifique du test effectué, cette phase d’acclimatation pourrait être sautée, les moniteurs étant placés directement dans l’incubateur déjà à la température de stress. - Si vous effectuez un essai statique (TKD), réglez l’incubateur pour qu’il atteigne le plus rapidement possible la température nocive définie après la période d’acclimatation. La variable de réponse sera opérationnalisée comme la dernière heure de mouvement enregistrée (c.-à-d. le dernier indice non nul) pour estimer la TKD.
- Si vous effectuez un test dynamique, déterminez la vitesse à laquelle la température augmentera après la période d’acclimatation. Ici, la variable de réponse mesurée est techniquement le temps à nouveau. L’heure à laquelle le dernier mouvement est enregistré coïncidera avec une température (CTmax), en fonction de la vitesse de rampe.
- Surveillez le comptage de l’activité en temps réel sur l’écran du système DAM dans le logiciel d’acquisition ou examinez directement les fichiers texte dans le dossier de données des fichiers du programme DAMSystem3. Copiez les fichiers texte et ouvrez-les plutôt que le fichier d’origine dans le dossier de données pour éviter de causer des problèmes lors de l’enregistrement des données en direct.
- Une fois qu’aucun mouvement n’a été observé chez l’une des mouches pendant plusieurs minutes, arrêtez le logiciel d’acquisition.
REMARQUE : Avec nos tests, nous avons constaté que quelques à plusieurs minutes d’inactivité sont indicatives d’un effondrement physiologique dû à un stress thermique similaire à celui observé dans les tests manuels classiques de TKD. Cela dépend toutefois du comportement d’évasion spontanée. En tant que tel, considérez les variables confusionnelles possibles si le traitement spécifique de l’enquête pourrait modifier cette réponse comportementale. De plus, en fonction des paramètres spécifiques de l’essai (p. ex., température, traitement), la durée de l’essai variera évidemment.
5. Organisation et analyse des données
REMARQUE : reportez-vous à la vidéo supplémentaire S1 pour savoir comment télécharger l’application exécutable à partir de GitHub, ainsi que les fonctionnalités de base du logiciel.
- Une fois les données acquises, analysez les fichiers texte à la recherche d’erreurs à l’aide du logiciel référencé (voir la table des matériaux) et sélectionnez des points de début et d’arrêt spécifiques pour le regroupement des données d’activité. Si un intervalle d’acclimatation de 10 minutes a été mis en place, démarrez le binning 10 min après le début de l’enregistrement de l’activité. Voir la discussion pour plus de détails sur le binning.
- Ouvrez le HoTDAM ! et importez les fichiers de données du moniteur analysés en cliquant sur Fichier | Charger les données du moniteur.
REMARQUE : Le logiciel et l’application exécutable sont disponibles sur GitHub (https://github.com/MatthewR47/HoTDAM) ou sur le site Web de l’entreprise dans la section Logiciel d’analyse . Notez que l’application exécutable n’est compatible qu’avec les systèmes d’exploitation Windows pour le moment. - Ajoutez des désignations de groupe pour indiquer quels groupes de traitement correspondent à quelle cellule au sein des moniteurs DAM2.
REMARQUE : La disposition de l’interface logicielle correspond à la disposition des moniteurs. - Cliquez sur Démarrer la définition multigroupe pour ouvrir une boîte de dialogue permettant d’ajouter une désignation de groupe qui sera appliquée à plusieurs cellules. Une fois la désignation de groupe acceptée, cliquez sur les cellules pour appliquer la désignation de groupe, puis cliquez sur Arrêter la désignation multigroupe.
REMARQUE : Le logiciel organise et exporte les données de DAMSystem3 vers des fichiers .csv à analyser dans un logiciel de statistiques. - Exportez le TKD (c’est-à-dire le dernier index non nul) pour chaque mouche dans les moniteurs vers un fichier .csv en cliquant sur Fichier | Exporter les données de renversement | Exporter tous les moniteurs ou exporter les moniteurs sélectionnés. La TKD pour chaque mouche sera organisée dans la production par désignation de groupe.
- Exportez les données d’activité de chaque mouche en cliquant sur Fichier | Exporter les données d’activité | Exporter tous les moniteurs ou Exporter les moniteurs sélectionnés dans un fichier .csv, en ne conservant que les données d’horodatage et de comptage, ce qui facilite l’utilisation du fichier de données, tout en attribuant des étiquettes de groupe désignées pour chaque mouche.
REMARQUE : Les premières colonnes des fichiers de données DAMSystem3 correspondent aux données internes des moniteurs (par exemple, surveillance de la lumière ou messages d’erreur) lors de l’acquisition. Les données de comptage se trouvent dans les colonnes 11-42 (voir la fiche technique de DamSystem3 pour plus de détails). L’exportation des données d’activité avec le logiciel d’analyse supprimera toutes les colonnes, à l’exception des colonnes de données d’horodatage et de comptage. - Si vous effectuez une expérience CTmax, utilisez le TKD pour déterminer le CTmax en utilisant le taux de montée en puissance de la température.
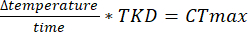
REMARQUE : Le logiciel d’analyse a été écrit de manière orientée objet en C# (code source disponible sur GitHub ; https://github.com/MatthewR47/HoTDAM) de sorte que certains aspects du programme peuvent être facilement modifiés pour permettre une personnalisation à des fins spécifiques.
6. Statistiques
REMARQUE : De nombreux tests différents peuvent être utilisés pour analyser les données TKD, en fonction des spécificités de la configuration expérimentale.
- Utilisez l’analyse de survie (par exemple, la régression de Cox, Kaplan-Meier) pour conceptualiser le renversement comme un événement que chaque mouche du test connaîtra.
REMARQUE : Pour un examen détaillé, voir la série de 4 articles de Bradburn et Clark traitant de l’analyse de survie et de sa mise en œuvre 5,6,7,8. - Utilisez l’ANOVA pour évaluer les différences entre les groupes et comparer les modalités, en particulier lors de la validation du test automatisé pour des conditions spécifiques.
- Analysez les données TKD à l’aide de l’analyse de survie de Kaplan-Meier. Divisez le fichier par stock de sorte que l’analyse soit effectuée séparément (par exemple, pour les lignes de stock TRPA1 et w1118 ). Choisissez la variable temporelle comme TKD (en min), knockdown comme événement, prétraitement comme facteur et sexe comme strates.
- Effectuer les tests log-rank, Breslow et Tarone-Ware pour comparer le prétraitement de chaque strate (c.-à-d. le sexe), à des fins d’illustration montrant plusieurs méthodes.
- Construisez des parcelles de survie.
Résultats
Les analyses des stocks TRPA1 et w1118 ont été effectuées séparément. Le tableau 1 présente les temps centiles de TKD et d’autres descriptifs.
| Percentilesa | ||||||||
| Sexe | Traitement | 25.00% | ||||||
Discussion
La méthode de dosage de la tolérance à la chaleur que nous décrivons ici est polyvalente et évolutive. Nous avons déjà publié une étude de validation dans laquelle nous avons comparé les modèles HoTDAM ! méthode à un test TKD classique, basé sur l’observation, et a constaté que le test automatisé donnait la même tendance générale à travers plusieurs facteurs4 (Figure 3). En d’autres termes, de la même manièr...
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts.
Remerciements
Le projet décrit a été soutenu par des subventions IDeA (Institutional Development Award) de l’Institut national des sciences médicales générales des National Institutes of Health (5P20GM103427 et 1U54GM115458). Le programme de bourses de recherche de premier cycle de l’UNK et le programme de recherche d’été pour les étudiants en médecine de l’UNMC.
matériels
| Name | Company | Catalog Number | Comments |
| 14 mL polystyrene test tubes | Falcon | 352057 | |
| 30 gallon fish tank | Wal-mart | ||
| 8 oz bottles | Genesee | 32-129F | |
| Constant Climate Chamber | Memmert | HPP750eco | |
| cornmeal | Lab Scientific | FLY801010 | |
| DAM2 Drosophila Activity Monitor | TriKinetics | DAM2 | (DAMSystem3 Data Sheet) https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| DAMSystem data acquisition software | TriKinetics | free download | |
| Drosophila agar | Lab Scientific | FLY80201 | |
| ethanol | Fisher Scientific | BP82011 | |
| Ether | Fisher Scientific | E134-4 | |
| FileScan software | TriKinetics | for scanning for text errors, binning data, and output | |
| FlyStuff Flugs for bottles | Genesee | 49-100 | |
| FlyStuff Flugs for vials | Genesee | 49-102 | |
| FlyStuff vials | Genesee | 32-113RL | |
| HoTDAM software | Github or Trikinetics | https://github.com/MatthewR47/HoTDAM | |
| Immersion circulating heater | PolyScience | MX-CA11B | |
| molasses | Lab Scientific | FLY80084 | |
| propionic acid | Fisher Scientific | A258-500 | |
| Pyrex Glass tubes 5 x 65 mm for DAM2 | TriKinetics | PGT 5x65 | https://www.trikinetics.com/Downloads/DAMSystem%20Price%20List%202024.7.pdf |
| small paint brush | Wal-mart | ||
| SPSS Statistics | IBM | ||
| tegosept | Lab Scientific | FLY55015 | |
| torula yeast | MP Biomedicals | 290308505 | |
| TRPA1 mutant stock | Bloomington Stock center | 26504 | w[1118]; TI{w[+mW.hs]=TI}TrpA1[1] |
| w1118 stock | Bloomington Stock center | 3605 |
Références
- Cowles, R. B., Bogert, C. M. A preliminary study of the thermal requirements of desert reptiles. Bull Am Mus Nat Hist. 83, 261-296 (1944).
- Lutterschmidt, W. I., Hutchison, V. H. The critical thermal maximum: history and critique. Can J Zool. 75, 1561-1574 (1997).
- Jørgensen, L. B., Malte, H., Overgaard, J. How to assess Drosophila heat tolerance: Unifying static and dynamic tolerance assays to predict heat distribution limits. Funct Ecol. 33 (4), 629-642 (2019).
- Rokusek, B., et al. HoTDAM! An easy-to-use automated assay expands the inducible thermotolerance phenotype in Drosophila melanogaster: Heat hardening reduces motility. Comp Biochem Physiol A Mol Integr Physiol. 286, 111522 (2023).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part III: Multivariate data analysis - Choosing a model and assessing its adequacy and fit. Br J Cancer. 89 (4), 605-611 (2003).
- Bradburn, M. J., Clark, T. G., Love, S. B., Altman, D. G. Survival analysis part II: Multivariate data analysis- An introduction to concepts and methods. Br J Cancer. 89 (3), 431-436 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part IV: Further concepts and methods in survival analysis. Br J Cancer. 89 (5), 781-786 (2003).
- Clark, T. G., Bradburn, M. J., Love, S. B., Altman, D. G. Survival analysis part I: Basic concepts and first analyses. Br J Cancer. 89 (2), 232-238 (2003).
- Hazra, A., Gogtay, N. Biostatistics series module 9: survival analysis. Indian J Dermatol. 62 (3), 251-257 (2017).
- Stevenson, R. D. The relative importance of behavioral and physiological adjustments controlling body temperature in terrestrial ectotherms. Am Nat. 126 (3), 362-386 (1985).
- Grigg, G. C., Beard, L. A., Augee, M. L. The evolution of endothermy and its diversity in mammals and birds. Physiol Biochem Zool. 77 (6), 982-997 (2004).
- Soto-Padilla, A., et al. Thermosensory perception regulates speed of movement in response to temperature changes in Drosophila melanogaster. J Exp Biol. 221 (10), jeb174151 (2018).
- Hoffmann, A. A., Sørensen, J. G., Loeschcke, V. Adaptation of Drosophila to temperature extremes: bringing together quantitative and molecular approaches. J Therm Biol. 28 (3), 175-216 (2003).
- Terblanche, J. S., et al. Ecologically relevant measures of tolerance to potentially lethal temperatures. J Exp Biol. 214 (22), 3713-3725 (2011).
- Rezende, E. L., Castaneda, L. E., Santos, M. Tolerance landscapes in thermal ecology. Funct Ecol. 28 (4), 799-809 (2014).
- MacLean, H. J., Hjort Hansen, J., Sørensen, J. G. Validating the automation of different measures of high temperature tolerance of small terrestrial insects. J Insect Physiol. 137, 104362 (2022).
- Gioia, A., Zars, T. Thermotolerance and place memory in adult Drosophila are independent of natural variation at the foraging locus. J Comp Physiol A. 195, 777-782 (2009).
- Kjærsgaard, A., et al. The effect of developmental temperature fluctuation on wing traits and stressed locomotor performance in Drosophila melanogaster, and its dependence on heterozygosity. Evol Ecol Res. 14 (7), 803-819 (2012).
- Bak, N. K., Rohde, P. D., Kristensen, T. N. Strong sex-dependent effects of malnutrition on life- and healthspan in Drosophila melanogaster. Insects. 15 (1), 9 (2023).
- Bettencourt, B. R., et al. Natural variation in Drosophila stressed locomotion meets or exceeds variation caused by Hsp70 mutation: analysis of behavior and performance. Behav Genet. 393, 306-320 (2009).
- Kjærsgaard, A., et al. Locomotor activity of Drosophila melanogaster in high temperature environments: plastic and evolutionary responses. Clim Res. 43 (1-2), 127-134 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon