免疫組織化学と免疫細胞化学:光顕微鏡による組織イメージング
概要
ソース: マイケル S. リー1とトーニャ J. ウェッブ1
1メリーランド大学医学部微生物学・免疫学科、マーリーン・スチュワート・グリーンバウム総合癌センター、ボルチモア、メリーランド州 21201
免疫組織化学(IHC)および免疫細胞化学(ICC)は、抗体を用いた特定抗原の発現および局在化を可視化するために用いられる技術である。IHCの最初の使用は、アルバート・クーンズが肺炎球菌に感染したマウスからの組織切片における肺炎球菌抗原の存在を視覚化する技術を使用した1941年でした(1)。免疫組織化学という名前は、IHCで使用される組織切片を参照して、抗体を参照して「免疫-」、および「histo-」の根に由来する。免疫細胞化学の根元「サイト-」は、ICCとIHCの主な違いを強調しています。IHCは組織全体の切片を使用しますが、ICCは組織から単離された細胞や培養中に増殖した細胞を使用します。使用されるサンプルの違いは、サンプル調製が技術的にIHCとICCの間で異なることを意味しますが、そうでなければICCとIHCのプロトコルは同一であり、用語は頻繁に同じ使用されることがわかります。
IHCおよびICCの両方において、ペルオキシダーゼまたはロダミンなどの化学的または蛍光タグを有する抗体は、タグ付けされた抗体を抗原に対する特異的結合を通じて目的の任意の抗原の分布を可視化するために使用される。IHCの場合、組織の薄いスライスは、染色される前に組織の構造を維持するためにスライド上に固定され、組織全体のコンテキストで抗原の視覚化を可能にする(図1)。ICCの場合、細胞は染色される前にスライド上に均等に分布し、個々の細胞内の抗原分布の可視化を可能にするが、特定の組織の構造内には存在しない。2 つのプロトコル間の類似性により、このプロトコルは IHC に関連するサンプル調製の追加の複雑さに対処するために IHC に焦点を当てます。
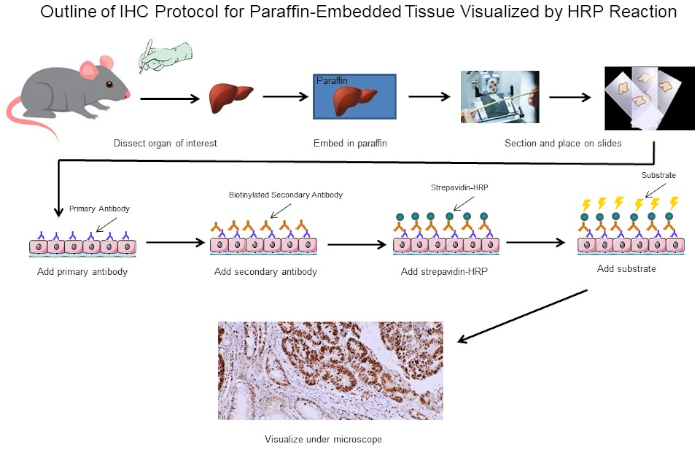
図1:IHCプロトコルの概要マウスから解剖したパラフィン埋め込み組織のIHCプロトコルの視覚的輪郭。このプロトコルは、ビオチン化二次抗体とストレパビジン-HRPを使用して、抗体結合の位置を可視化します。蛍光タグ付き抗体などの他のオプションも可能です。この図のより大きなバージョンを表示するには、ここをクリックしてください。
IHCを行う際の最初の主要な決定は、染色プロセス全体を通して組織の構造を維持するために組織セクションを調作成する方法である。2つの主要な選択は、パラフィン埋め込み組織のホルマリン固定セクションまたは凍結組織の新鮮なセクションである。どの方法を使用するかは、下流の解析を行うかによって異なります。パラフィン埋め込み組織のホルマリン固定は、一般的に、新鮮な組織を凍結しながら、IHCの外の後続のアッセイのためのタンパク質機能を維持しながら、最適なイメージングのための組織形態をより良く保存すると考えられている。さらに、新鮮な凍結組織切片は、遺伝子発現分析(2)により適することが示されている。第3の考慮事項は、一部の抗体は特定のタイプのセクションに対してのみ最適化され、他の抗体では機能しない可能性があるため、目的の抗原に対する抗体が固定組織セクションまたは凍結組織切片に適しているかどうかです。最後に、新鮮な凍結サンプルは-80°Cで保存する必要があり、固定されたセクションは室温ではるかに長く保存することができる間、1年を超えて持続しない可能性があるため、組織切片を保存する必要がある期間を決定する必要があります。これらは、パラフィン埋め込み組織のホルマリン固定切片または凍結組織の新鮮なセクションを使用するかどうかを決定するための主要な考慮事項のいくつかです。最終的には、十分な組織を持っている場合は、両方の一部を持っているだけで良いかもしれません。
本実験では、リンパ腫発症の自発的マウスモデルから拡大脾臓においてサイクリンD1発現が増加したかどうかを調べる。脾臓組織試料は、まず、野生型マウス、リンパ腫を有しないトランスジェニックマウス、または自発的にリンパ腫を発症したトランスジェニックマウスのいずれかから単離した。脾臓組織試料をパラホルムアルデヒドに固定し、パラフィンに埋め込み、切除し、マウス抗サイクリンD1一次抗体を用いて染色し、続いて馬の抗マウス二次抗体を用いて、3,3-ジアミノベンジジン(DAB)を用いて開発した。その後、ハリス・ヘマトキシリン溶液でセクションを逆染色し、その後、セクションを20倍の倍率で画像化した。
試薬
パラフィン埋め込みセクション
- 4% パラホルムアルデヒド(PFA)
- エタノール(無水変性、組織学的等級100%、95%、80%、75%、50%)。二重蒸留水(ddH2O)を使用して100%のストックから希釈することができます
- キシレン
- IHC互換ガラススライドは、組織セクションが手順全体を通して取り付けられたままであることを確認します。IHC互換ガラススライドは、特殊なコーティングを持っており、複数の小売業者から容易に入手可能です。ICCを実行する場合は、チャンバスライドを使用してください。チャンバースライドは、細胞がチャンバーに播種され、細胞がスライドに付着し、適切な合流に達するまでインキュベーターに置くことができ、その時点でチャンバーを除去し、染色をIHCと同様に進めることができます。
- パラフィン
- 0.3% 過酸化水素 (H2O2)/メタノール: 調味するには、1 mL 30% H2O2 ~ 99 mL メタノールを添加します。-20°Cでの保管
- 抗原検索バッファー: IHC クレートバッファー pH 6.0
新鮮な冷凍セクション
- 最適な切断温度(OCT)埋め込み化合物
- 最適な固定性:-20°Cに冷却された4%のPFAまたはアセトン
染色
- ブロック バッファ: ユーザーが決定する必要があります。一例は、1X PBSで希釈された馬血清です
- 希釈された一次抗体:メーカー仕様を参照
- 希釈ビオチン化二次抗体:メーカー仕様参照
- 希釈されたアビジン-ホースラディッシュペルオキシダーゼ(HRP):ペルオキシダーゼ可視化のみ。製造元の仕様を参照してください。
- DABまたは他の互換性のある基板
- カウンターステイン(オプション)
- エタノール(無水変性、組織学的グレード100%および95%)
- キシレン
- オルガノ/リモネン山
手順
1. 免疫細胞化学用細胞の調製
- チャンバ付きスライドまたはチャンバ付きカバーに関心のある種子細胞は、24ウェル培養プレートのウェルに0.5 mLの細胞懸濁液を加えることによってスリップする。
注:一部の細胞は、ポリリジンで処理されたカバースリップなど、治療されたカバースリップに成長を必要とする場合があります。最適な治療条件は、使用する細胞の種類に応じてユーザーによって決定されるべきである。 - プレートを加湿したCO2インキュベーターに入れ、細胞を37°Cで50~70%コンフルエントになるまで成長させます。
- 細胞が最適な合流に達したら、各ウェルから培養培地を取り出し、0.5mLの4%PFA(1X PBSで希釈)で細胞を固定し、室温で20分間インキュベートします。
- 固定液を取り外し、1X PBSの1 mLでウェルを3回洗います。
- 次に、各ウェルに0.1%トリトンX-100の0.5mLを1X PBSに加えて細胞を透過化し、室温で15
結果
申請書と概要
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
免疫組織化学と免疫細胞化学:光顕微鏡による組織イメージング
Immunology
79.1K 閲覧数

フローサイトメトリーと蛍光活性化細胞選別(FACS):脾臓Bリンパ球の単離
Immunology
93.2K 閲覧数

磁気活性化細胞選別(MACS):胸腺Tリンパ球の単離
Immunology
23.1K 閲覧数

ELISAアッセイ:間接、サンドイッチ、競争力
Immunology
239.3K 閲覧数

ELISPOTアッセイ:IFN-γ分泌脾細胞の検出
Immunology
28.8K 閲覧数

抗体生成:ハイブリドーマを用いたモノクローナル抗体の産生
Immunology
43.7K 閲覧数

免疫蛍光顕微鏡:パラフィン埋め込組織切片の免疫蛍光染色
Immunology
54.0K 閲覧数

共焦点蛍光顕微鏡:マウス線維芽細胞におけるタンパク質の局在を決定する技術
Immunology
43.4K 閲覧数

免疫沈殿ベースの技術:アガロースビーズを用いた内因性タンパク質の精製
Immunology
87.9K 閲覧数

細胞周期分析:CFSE染色と流れサイトメトリーを用いた刺激後のCD4およびCD8 T細胞増殖の評価
Immunology
24.3K 閲覧数

養子細胞移植:宿主マウスへのドナーマウス脾細胞導入とFACSによる成功評価
Immunology
22.6K 閲覧数

細胞死に対するアッセイ:細胞毒性能のクロム放出アッセイ
Immunology
151.5K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved