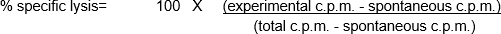細胞死に対するアッセイ:細胞毒性能のクロム放出アッセイ
概要
ソース: フランシス V. シャアスタッド1,2, ホイットニー・スワンソン2,3,トーマス・S・グリフィス1,2,3,4
1ミネソタ大学、ミネアポリス、MN 55455
2ミネソタ大学免疫学センター,ミネアポリス,MN 55455
3ミネソタ大学泌尿器科,ミネアポリス,MN 55455
4ミネソタ大学、ミネアポリス、MN 55455
免疫系の細胞の主な機能の一つは、ウイルスに感染しているか、腫瘍細胞に変換を受けた標的細胞を除去することです。免疫細胞の細胞傷害性を測定するためのインビトロアッセイは、長年にわたり実験室で定番となっています。これらのアッセイは、T細胞、NK細胞、または抗原特異的または非特異的な方法で標的細胞を殺す他の免疫細胞の能力を決定するために使用されている。死のリガンド(例えば、ファスリガンドまたはTRAIL)、サイトカイン(例えば、IFNgまたはTNF)、または細胞傷害性顆粒(すなわち、フェクター細胞によって発現されるペロフィン/グランザイムB)は、標的細胞死を誘発することができるいくつかの方法である。近年の腫瘍免疫療法研究の爆発的な増加に伴い、患者の転帰を改善するために免疫細胞の細胞傷害活性を高める薬剤を見つけることに関心が高まっています。逆に、一部の疾患は、免疫細胞細胞傷害活性の過度の活性によって顕著であり、その結果、これらの応答を緩和する薬剤を同定する努力をもたらす。したがって、ユーザーが任意の数の異なるエフェクター細胞、標的細胞、および/または応答修飾子を実験設計に容易に統合できるアッセイを有することは、エフェクター細胞および/の細胞傷害性を迅速に評価する貴重な手段として役立つことができる。またはターゲット セルの応答性。
これらのインビトロアッセイは、異なる細胞集団の混合を含むだけでなく、エフェクターおよび標的細胞の両方の比較的少ない数を使用する。したがって、アッセイの必要性の1つは、標的細胞を容易に検出および定量することができる方法で標識し、ユーザがエフェクター細胞によって媒介される「比的なリシスのパーセント」を決定できるようにすることである。放射能-特に、Na2 51 CrO4の形態のクロム51(51Cr)は、標的細胞内の細胞タンパク質を迅速かつ非特異的に標識する安価な方法である(1)。短い標識および総アッセイ時間は、標的細胞の数および/または表現型の有意な変化の可能性を減少させ、アッセイの結果に影響を与える可能性がある。エフェクター細胞の細胞傷害活性の結果として標的細胞の膜完全性が失われた場合、標的細胞内の51Cr標識細胞タンパク質が培養上清に放出され、定量。インビトロでの免疫細胞の機能を調べるアッセイと同様に、実験の性能向上を考慮すべき重要な考慮事項が数多くあります。最も重要な特徴の1つは、健康なエフェクター(最大細胞傷害活性のために)および標的(最大応答性および最小限の自発的死/51Cr放出)細胞を使用することである。エフェクターと標的細胞接触が必要である(細胞接触を促進するために丸底96ウェルプレートの一般的な使用につながる)(2)。最後に、データ分析は、正および負の制御ターゲット細胞集団を含めることに依存します。
以下のプロトコルは、Europiumを用いて非放射性バージョンが最近開発されたが、エフェクター細胞の集団の細胞傷害性を測定するための標準的な51Cr放出アッセイを行うための手順を概説する。51名Crは強力なγ放射エミッタです。したがって、このアッセイの使用には、適切な放射線安全訓練、専用の実験室スペース、ガンマカウンター、および放射性サンプルの処分が必要です。
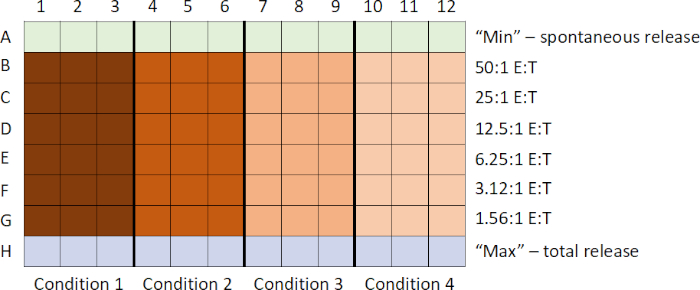
このアッセイにおけるイベントの一般的なシーケンスは次のとおりです: 1) 51Cr ラベル付きターゲットを準備します。2)エフェクターセルを準備し、ターゲット細胞が標識している間にプレートに追加します。3)プレートにラベル付きターゲットを追加します。4)インキュベートプレート;5)上清を収穫;6)カウンターでサンプルを実行した後にデータを分析します。サンプルは一般的に三つ編みで調製され、微妙なピペッティングの違いを考慮して平均化されます。
適切なPPEは、このアッセイのために重要です。具体的には、ユーザーはラボコートと手袋を着用する必要があります。研究室や施設に基づき、安全メガネが必要となる場合があります。すべてのステップの間に安全な貯蔵および使用のための十分な鉛の保護があるべきである。最後に、51Crを使用するための専用のラボスペースと機器が確保され、51Crのサンプルがどこに保管されているかを示す適切なサイネージと、可能な限りスペースを調査するためのガンマプローブを装備したガイガーカウンターが必要です。汚染。
本研究室では、ヒト末梢血単核細胞(PBMC)、(CpG刺激対非刺激)が黒色腫細胞を殺す能力を決定し、ヒト黒色腫細胞株WM793をモデル化し、クロム放出アッセイを用いて行う。
手順
手順の概要
細胞死を測定するための典型的な51Cr放出アッセイには、次の手順が含まれます。
- まず、標的細胞にNa2[51Cr]O4で標識される。これは、アッセイ中のエフェクター細胞と区別する。
- 標的細胞が標識している間に、エフェクター細胞が集められ、シリアル希釈技術を用いて、エフェクター細胞の減少滴定が丸底96ウェルアッセイプレートに生成される。
- 標的細胞標識の終わりに、細胞が最初に洗浄され、次に一連のエフェクター細胞希釈を既に含むアッセイプレートに一定数の細胞が追加されます。
- 次に、標的エフェクター細胞ミックスを一定期間インキュベートし、標的細胞との十分な細胞相互作用を可能にし、細胞リシスを媒介する。
- 最後に、培養上清を採取し、チューブに集化する。51Cr量は、ガンマカウンタを用いて定量される。
- 最後に、データが収集され
結果
申請書と概要
参考文献
- Brunner, K. T., Mauel, J., Cerottini, J. C. and Chapuis. B. Quantitative assay of the lytic action of immune lymphoid cells on 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology, 14 (2):181-196, (1968).
- Kemp, T. J., B. D. Elzey, and T. S. Griffith. Plasmacytoid dendritic cell-derived IFN-alpha induces TNF-related apoptosis-inducing ligand/Apo-2L-mediated antitumor activity by human monocytes following CpG oligodeoxynucleotide stimulation. The Journal of Immunology, 171 (1): 212-218, (2003).
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
細胞死に対するアッセイ:細胞毒性能のクロム放出アッセイ
Immunology
151.4K 閲覧数

フローサイトメトリーと蛍光活性化細胞選別(FACS):脾臓Bリンパ球の単離
Immunology
93.0K 閲覧数

磁気活性化細胞選別(MACS):胸腺Tリンパ球の単離
Immunology
22.9K 閲覧数

ELISAアッセイ:間接、サンドイッチ、競争力
Immunology
238.7K 閲覧数

ELISPOTアッセイ:IFN-γ分泌脾細胞の検出
Immunology
28.5K 閲覧数

免疫組織化学と免疫細胞化学:光顕微鏡による組織イメージング
Immunology
79.0K 閲覧数

抗体生成:ハイブリドーマを用いたモノクローナル抗体の産生
Immunology
43.6K 閲覧数

免疫蛍光顕微鏡:パラフィン埋め込組織切片の免疫蛍光染色
Immunology
53.9K 閲覧数

共焦点蛍光顕微鏡:マウス線維芽細胞におけるタンパク質の局在を決定する技術
Immunology
43.2K 閲覧数

免疫沈殿ベースの技術:アガロースビーズを用いた内因性タンパク質の精製
Immunology
87.8K 閲覧数

細胞周期分析:CFSE染色と流れサイトメトリーを用いた刺激後のCD4およびCD8 T細胞増殖の評価
Immunology
24.3K 閲覧数

養子細胞移植:宿主マウスへのドナーマウス脾細胞導入とFACSによる成功評価
Immunology
22.5K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved