免疫蛍光顕微鏡:パラフィン埋め込組織切片の免疫蛍光染色
概要
ソース: トーマス・チャフィー1, トーマス・S・グリフィス2,3,4,キャサリン・L・シュヴェルトフェガー1,3,4
1ミネソタ大学ミネソタ大学研究室医学病理学科,ミネアポリス,MN 55455
2ミネソタ大学泌尿器科,ミネアポリス,MN 55455
3ミネソタ大学、ミネアポリス、MN 55455
4ミネソタ大学免疫学センター,ミネアポリス,MN 55455
組織切片の病理学的解析は、正常な組織構造のより良い理解を得るために使用することができ、疾患のメカニズムの理解に貢献することができます。組織生検は、患者または生体内モデルの実験から、ホルマリンまたはパラホルムアルデヒドで固定し、パラフィンワックスに埋め込むことによって保存されることが多い。これは長期貯蔵およびティッシュが切除されることを可能にする。組織はマイクロトームを使用して薄い(5 μm)セクションに切断され、セクションはガラススライドに付着している。組織セクションは抗体で染色することができ、組織セクション内の特定のタンパク質の検出を可能にします。蛍光色素(フルオロクロムとも呼ばれる)に結合した抗体を用いた染色は、レーザーによって励起されたときに特定の波長で発光する化合物であり、免疫蛍光として知られている。セクション内のタンパク質を検出する機能は、組織内の細胞型の不均一性、特定のシグナル伝達経路の活性化、バイオマーカーの発現などの情報を提供できます。使用される蛍煙素や分析に利用できる顕微鏡の種類に応じて、複数の色を使用することができ、ターゲットの多重分析が可能です。
以下のプロトコルは、パラフィン埋め込組織セクションの免疫蛍光染色に関与する基本的なステップを概説する。このプロトコルは、組織の固定、パラフィン埋め込みのプロセス、または組織の断面に関する詳細を含まないことに注意することが重要です。組織が切り分けされ、ガラススライド上に置かれると、それらは一連の等級のエタノール(EtOH)インキュベーションを通して再水和される。セクションは、組織セクションへの抗体の非特異的結合を減少させるためにブロッキング試薬でインキュベートされる。その後、セクションは、蛍舞体で直接標識されてもよいし、そうでないかもしれない一次抗体でインキュベートされる。一次抗体が直接標識されていない場合、セクションは、フッ素で標識された二次抗体でインキュベートされます。異なる抗体は、異なる染色条件を必要とし、したがって、抗体の最適化のための提案が含まれる。すべての結合されていない抗体を除去するために洗浄した後、スライドは、核を蛍光標識するためにDAPIを含む媒体で取り付けられる。取り付け媒体が乾燥したら、異なる蛍光色素を検出できるレーザーを使用してスライドを画像化できます。
手順
1. セットアップ
- 一般的な染色プロトコルには、次の手順が含まれます。
- 一連の等級付けされたエタノールを使用してスライド上の組織セクションを再水和する。
- ブロッキングバッファーを用いて組織セクションをインキュベートすると、組織に対する抗体の非特異的結合をブロックし、バックグラウンド蛍光を減少させるのに役立ちます。
- ブロッキングバッファーを除去し、一次抗体中のセクションをインキュベートし、その時点で抗体はそのペプチド標的を結合する。
- 一次抗体を除去し、洗浄バッファー内のセクションを広範囲に洗浄する。
- 二次抗体でセクションをインキュベートして一次抗体への結合を可能にし、一次抗体がフッ素で直接標識されていない場合、二次抗体が必要とされる。
- 二次抗体をスライドから洗い流す。
- 取り付け媒体にスライドを取り付け、蛍光顕微鏡で可視化する前に乾燥させます。
- スライドホルダー(ガラスまたはプラスチック)、瓶、ピ
結果
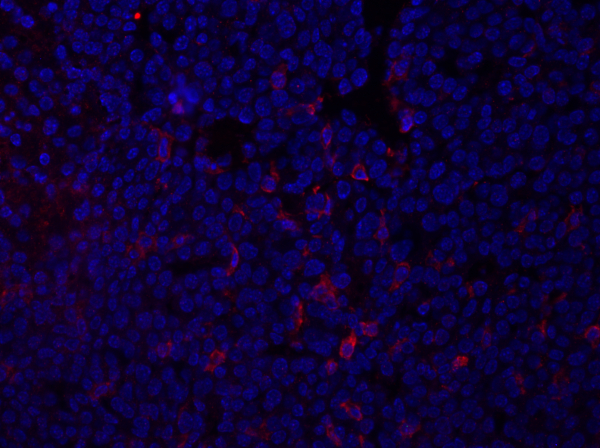
図1:乳腫瘍部のF4/80染色。固定後、マウス乳腺腫瘍を抗F4/80で切り分けて染色し、DAPI含有マウントメディアを用いて取り付けた。染色は、細胞表面F4/80染色によって赤色で示される。この図のより大きなバージョンを?...
申請書と概要
参考文献
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
免疫蛍光顕微鏡:パラフィン埋め込組織切片の免疫蛍光染色
Immunology
53.6K 閲覧数

フローサイトメトリーと蛍光活性化細胞選別(FACS):脾臓Bリンパ球の単離
Immunology
92.6K 閲覧数

磁気活性化細胞選別(MACS):胸腺Tリンパ球の単離
Immunology
22.7K 閲覧数

ELISAアッセイ:間接、サンドイッチ、競争力
Immunology
237.0K 閲覧数

ELISPOTアッセイ:IFN-γ分泌脾細胞の検出
Immunology
28.3K 閲覧数

免疫組織化学と免疫細胞化学:光顕微鏡による組織イメージング
Immunology
78.5K 閲覧数

抗体生成:ハイブリドーマを用いたモノクローナル抗体の産生
Immunology
43.4K 閲覧数

共焦点蛍光顕微鏡:マウス線維芽細胞におけるタンパク質の局在を決定する技術
Immunology
43.0K 閲覧数

免疫沈殿ベースの技術:アガロースビーズを用いた内因性タンパク質の精製
Immunology
87.4K 閲覧数

細胞周期分析:CFSE染色と流れサイトメトリーを用いた刺激後のCD4およびCD8 T細胞増殖の評価
Immunology
24.1K 閲覧数

養子細胞移植:宿主マウスへのドナーマウス脾細胞導入とFACSによる成功評価
Immunology
22.2K 閲覧数

細胞死に対するアッセイ:細胞毒性能のクロム放出アッセイ
Immunology
151.4K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved