Method Article
살아있는 세포의 단백질 조각 보완 분석 (PCA)에 의해 게놈 전체 단백질 - 단백질 상호 작용 상영
요약
Proteins interact with each other and these interactions determine in a large part their functions. Protein interaction partners can be identified at high-throughput in vivo using a yeast fitness assay based on the dihydrofolate reductase protein-fragment complementation assay (DHFR-PCA).
초록
Proteins are the building blocks, effectors and signal mediators of cellular processes. A protein’s function, regulation and localization often depend on its interactions with other proteins. Here, we describe a protocol for the yeast protein-fragment complementation assay (PCA), a powerful method to detect direct and proximal associations between proteins in living cells. The interaction between two proteins, each fused to a dihydrofolate reductase (DHFR) protein fragment, translates into growth of yeast strains in presence of the drug methotrexate (MTX). Differential fitness, resulting from different amounts of reconstituted DHFR enzyme, can be quantified on high-density colony arrays, allowing to differentiate interacting from non-interacting bait-prey pairs. The high-throughput protocol presented here is performed using a robotic platform that parallelizes mating of bait and prey strains carrying complementary DHFR-fragment fusion proteins and the survival assay on MTX. This protocol allows to systematically test for thousands of protein-protein interactions (PPIs) involving bait proteins of interest and offers several advantages over other PPI detection assays, including the study of proteins expressed from their endogenous promoters without the need for modifying protein localization and for the assembly of complex reporter constructs.
서문
단백질 상호 작용 네트워크 (핀)은 단백질이 기능적으로 셀 하나에 구성되는 방법의 낮은 해상도의지도를 제공합니다. 각각의 두 단백질 사이의 물리적 연결 또는 단백질 - 단백질 상호 작용 (PPI)는, 이러한 단백질 복합체 내에서 발견되는 것과 같은 시간에 안정한 연결을 나타낼 수 있고, 즉, 셀의 구조적인 조직에 기여한다. 이러한 연결은 또한 활성, 안정성 및 지역화 두 파트너의 상호 작용을 조절하는 일시적인 연관성을 나타낼 수있다. 주어진 단백질의 물리적 상호 작용 파트너를 식별하므로 그 단백질 2,3의 기능 및 규제에 대한 풍부한 정보를 제공합니다. 이러한 이유로, 많은 노력이 대장균 4-6, 애기 장대 (7), 사카로 미세스 세 레비 시아 8-12, 초파리 melanogaster의 <포함한 모델 생물, 핀 매핑으로 넣어왔다/ EM>는 13 Caenorhabditis 엘레 14 간스과 호모 사피엔스 15. 이러한 연구는 단백질 이전에 알려지지 않은 기능을 가진 단백질에 세포 따라서 키 정보를 구성하는 방법에 대한 중요한 통찰력을 제공하고 있습니다.
몇 가지 전략 핀을 연구하는 수년에 걸쳐 개발되고있다. 이러한 기술은 크게 (16 ~ 18에서 검토)가 프로톤 펌프 억제제에 제공하는 정보의 종류에 따라 세 가지 범주로 분류 할 수있다. 첫 번째는 효모 두 하이브리드 및 그 유도체 (19)에 기초한다. 이 기술들은 네트워크를 구성하는 이진 허용 단백질 쌍 간의 직접적인 연관에 대한 정보를 제공한다. 제 가족 미끼 단백질의 친화 정제와 같은 질량 분석 (20)에 의해 다음과 같은 친 화성 정제 관련 파트너의 동정에 기초한다. 이러한 접근법은 직접적이다 단백질 그룹을 식별일반적으로 또는 간접적으로 안정된 상태에서 관련, 및 단백질 복합체를 식별하기가 매우 강력하다. 세 번째 방법은 단백질 단편 상보성 분석 (PCA가) (11, 21)에 기초한다. 이 단백질 간의 직접 연결과 근위 검출 허용하는 이러한 접근법은, 이전의 두 방법 사이의 중간 해상도 레벨을 제공한다. 최근 18 평가로 각 기술은 고유의 장점과 단점이 있습니다.
그 프로테옴은 프로톤 펌프 억제제가 먼저 분석되어 검출하도록 다른 모델 진핵 생물 및 높은 처리량 검정법 때문에보다 상대적으로 덜 복잡하고보다 효율적으로하기 때문에 가장 한 진핵 PIN은 부분적으로 출아 효모 사카로 미세스 세 레비 시아에 크게 하나 인 이 모델 생물 9-12에서 구현. 효모 시스템에 특히 강력한 방법은 디 히드로 엽산 환원 효소 단백질 조각 보완 분석 (DHFR-PCA),되었습니다 분석입니다표준 및 교란 조건 11,22-26에서 효모 PIN을 연구하기 위해 다른 컨텍스트에 사용됩니다. 이 방법은 내인성 발현 및 정량 방법 (27)의 상호 작용 파트너 (11, 21)의 원시 세포 내에서 지역화 모두 주어진 단백질을 미끼 직접 가까운 프로톤 펌프 억제제의 직접 검출을 가능하게 생존 분석에 의존한다. 이 분석 (고밀도 콜로니 배열에 관한 즉 콜로니 크기)를 사용하여 수득 된 신호 따라서 야생형 세포의 것과 거의 동등한 셀룰러 환경에서 미끼 먹이 사이에 형성 단백질 복합체의 양을 반영한다. 어 세이는 엽산 대사에 관여 리포터 효소의 재구성에 기반, 디 히드로 엽산 환원 효소 (DHFR)가있다 관심 두 단백질에 융합 된 DHFR의 두 개의 상보적인 단편은 두 단백질이 상호 작용하는 경우에 근접하게되는 이어서 효소 활성 (1)의 재구성에 이르게 가역매체 포함 메토트렉세이트에 균주의 1과 성장 (MTX; 그림 1). 이 화합물은 내인성 DHFR 효소하지만, 분석에 사용되지 28 돌연변이를 억제한다. PCA 균주의 두 컬렉션을 포함 하나 마타가와 균주 ~ 4300 ORF가 DHFR F에 융합 [1,2] 조각과 ORF가 DHFR [3] 단편에 융합에 구입할 수와 균주 α ~ 4,800 MAT를 포함하는 하나 어떤 실험실에서 크고 작은 규모의 DHFR-PCA를 구현한다. 여기서 우리는 하나의 미끼 단백질이 분석법을 이용하여 ~ 4,800 먹이 단백질 사이의 프로톤 펌프 억제제에 대한 화면으로 일반적인하지만 상세한 프로토콜을 설명합니다.
프로토콜
1. 건설 / 미끼 균주의 확인
- 관심있는 미끼 변형 마타 DHFR F [1,2] 컬렉션에서 사용할 수있는 경우는 1.1.1에 기술 된 바와 같이, 단계 1.1.2에 설명 된대로, 그렇지 않으면 변형을 구성, 컬렉션에서 검색.
참고 :이 컬렉션은 DHFR F [1,2] 컬렉션보다 더 많은 균주가 들어 있으므로 여기에 설명 된 프로토콜, DHFR F할까요 등의 미끼와 DHFR F [3] 수집 등 [1,2] 변형을 사용합니다. 그러나, 하나는 상호 작용 체의 높은 범위를 필요로하는 경우 미끼 변형이 DHFR F [3] 컬렉션 또는 양쪽 방향으로 만 사용할 수있는 경우 주위의 화면을 다른 방법으로 수행 할 수있다.- 한 시간 동안 얼음에 미끼 균주를 포함하는 글리세롤 스톡 판을 녹여. 95 % 에탄올을 사용하여 플레이트를 덮는 알루미늄 박 멸균. 피어스 살균 팁과 호일, 선택적 효모 추출물 펩톤에 글리세롤 주식의 세포와 행진 2-3 μl를 재현 탁 아래로 피펫덱스 트로 오스 (YPD) + 100 μg의 단일 콜로니를 분리하기 위해 / ㎖ Nourseothricin (NAT). 30 ° C에서 이틀 동안 품어.
- 미끼 PCA 균주의 건설 (마타 DHFR F [1,2]).
- 플라스미드 pAG25 링커-DHFR F에서 DHFR F를 증폭, 고성능 폴리머 라제 및 표준 PCR 프로토콜을 사용하여 [1,2] 카세트 [1,2] -ADHterm 걸리 올리고 뉴클레오티드를 사용하여 ORF의 마지막 40 BP 상동 단부 종료 코돈 (정방향 프라이머)와 유전자의 3'-UTR (역방향 프라이머) (도 1a)의 제 40에 BP 제외 3'- 말단.
- (29) (도 1a)에서와 같이 표준 LiOAc / PEG 효모 변환 프로토콜을 사용 (일반적으로 변형 BY4741) 유능한 효모 세포 내로 PCR 생성물을 변형.
- 선택적 YPD + 냇 매체에 플레이트 긍정적 인 형질 전환 체를 분리합니다.
- 적절한 DHFR F [1,2] 융합을 확인하기 위해 고립 된 식민지에 진단 식민지 PCR을 수행합니다. 홍보 사용imers 유전자 코딩 서열 (앞으로 올리고) DHFR 융합의 상류 약 100 bp의 2) 카세트 (올리고 역) (그림 1B)의 ADH 종료에에) 1 어닐링.
- 적절한 유전자 융합을 확인 생거 시퀀싱함으로써 PCR 생성물 시퀀스.
- -80 ° C에서 25 % 글리세롤에서 확인 미끼의 피로를 보관합니다.
참고 : 프로토콜이이 단계에서 일시 중지 할 수 있습니다.
2. 핀 도구 살균 및 인쇄 절차
주의 : 아래에 기재된 멸균 절차 BM3-BC (S & P 로보틱스) 로봇 플랫폼에 의해 조작 핀 - 툴에 최적화되었지만, 다른 플랫폼에 적용 할 수있다. 이 절에서는 프로토콜의 나머지 다른 하나의 매체에서 세포를 전송하는 데 사용되는 핀 - 도구 살균 및 인쇄 절차에 대해 설명합니다. 이러한 루틴을 수행하는 데 사용 사내 스크립트는 요청에 따라 얻을 수있다. 참고 그쪽으로t는 모든 단계는 수동 핀 도구 (30)를 이용하여 로봇 플랫폼의 필요없이 수행 될 수있다.
- 로봇 플랫폼의 해당 핀 도구를 탑재합니다.
- 다음과 같이 청소와 습식 스테이션을 준비합니다 :
- 물 목욕 역에서 멸균 물 500㎖를 추가합니다.
- 브러시 역에서 멸균 320 ML을 추가합니다.
- 한천 플레이트에 액체 문화를 포함하는 마이크로 타이 터 플레이트에서 복제 할 때 한천 플레이트, 400 ㎖ (응고 매체의 35 ml의를 포함, 86 X 128mm의 omnitray) 한천 플레이트에서 복제 할 때 초음파기에 70 % 에탄올 380 ML을 추가합니다.
- 젖은 역 (멸균 빈 omnitray으로 구성)에서 멸균 35 ML을 추가합니다.
- 로봇 플랫폼을 필요로 하루의 시작 부분에서, 초음파기 목욕 한 분 동안 핀 도구를 다섯 번 소독. 다섯 분은 로봇 인클로저를 소독하는 한편, UV 램프를 켭니다.
참고 :이 강탈 경우 필요하지 않습니다오티는 멸균 후드 아래에 보관되어 있습니다. - 다음과 같이 각각의 핀 도구 복제 라운드 사이에, 핀 도구를 소독 :
- 세포 덩어리를 제거하기 위해 물 목욕 역에 핀 도구 10 초 동안 다섯 번 담근다.
- 두 번 앞뒤로 브러시 역에 핀 도구를 만끽 해보세요.
참고 : 회전 브러시 잔여 세포를 제거합니다. - 초음파기 역에서 20 초 동안 두 번 핀 도구를 만끽 해보세요.
참고 : 핀에 세포를 나머지는 초음파에 의해 제거 또는 에탄올에 의해 살해 될 것입니다. - 핀의 침지 깊이가 적절한 살균을 보장하기 위해 각 연속 욕조에서 증가 있는지 확인합니다.
- 25 초 동안 공기 건조기 역에 핀 도구를 건조.
- 소스 접시에 세포를 복용하기 전에, omnitray에 멸균 물 35 ㎖에 들어있는 습식 역에 핀을 젖은.
- 소스 판에서 식민지에서 두 번 핀을 찍어.
- AG을 터치하여 갓 부 대상 접시에 인쇄AR 표면 회 (이하 "프린트"어레이의 동작이라 함).
자동화 된 로봇 플랫폼을 사용하여 1536 배열의 DHFR F [3] 컬렉션의 3. 응축
- 얼음에 해동 DHFR F [3] 모음 (60 96 웰 플레이트)와 L-DHFR F [3] 제어 변형 DHFR F를 포함한다 (그림 1C), [3] 조각으로 가득 추가로 96 웰 플레이트 상류 링커 음성 대조군 단독 표현.
참고 : 원칙적으로,이 조각은 DHFR 단편 융합 단백질 (자세한 내용은 설명을 참조)과 상호 작용하지 않아야합니다. - 우물 사이의 교차 오염의 위험을 방지하기 위해 알루미늄 호일을 제거하기 전에 원심 분리 판 (빠른 회전).
- 384 균주 (그림 2A)의 16 배열에 컬렉션을 응축. 이렇게하려면 각 384 배열, 선택적 YPD + 250 ㎍ / ㎖의 하이 그로 마이신 B (HygB)의 네 사분면에 인쇄 네 개의 글리세롤 판은 일을 사용 omnitray즉 핀 (96)은 공구 (여기서, 어레이 (384)는 각각의 2 × 2 매트릭스 (96)의 위치에 배치 이루어진 네 개의 사분면에 똑같이 interspaced 세분 될 수있다). 정확히 네 1,536 배열을 채우기 64 판의 최종 세트를 가지고하기 위해 60 다른 판 사이에 L-DHFR F [3] 음성 대조군을 포함하는 4 개의 96 웰 플레이트를 삽입합니다. 단계 2에 기재된 바와 같이 각각의 복제주기 사이 핀 도구 멸균.
참고 : 최종 4 1536 배열에 각각 하나의 판을하기 위해 L-DHFR F [3] 플레이트를 삽입합니다. - 30 ° C에서 이틀 동안 번호판을 품어. 주 :이 단계에서는, DHFR 컬렉션 한천 플레이트상에서 최대 한 달 동안 4 ℃에서 (384)의 형식으로 저장하는 것이 가능하다.
- 1536 균주 (그림 2A)의 네 개의 배열로 컬렉션을 응축. 이렇게하려면 각 1536 배열, 여기에 (384 핀 도구를 사용하여 단계 3.2에서와 같은 매체의 판의 네 사분면에 384 균주의 네 배열을 인쇄, 1536 어레이는 네 개의 전자로 분할 될 수있다qually)는 2 × 2 행렬 배치에서 각각의 위치 (384)로 구성된 사분면 interspaced.
- 30 ° C에서 이틀 동안 번호판을 품어. 주 :이 단계에서는, DHFR 컬렉션 한천 플레이트상에서 최대 한 달 동안 4 ℃에서 1536 형식으로 저장 될 수있다.
- 1536 핀 도구를 사용하여 콜로니 크기를 표준화 동일한 매체 상에 네 개의 배열을 복제.
- 30 ℃에서 이틀 동안 번호판을 품어.
4. 높은 처리량 DHFR-PCA 절차
- 50 ML 튜브 (그림 2B)에 액체 YPD + 냇 20ml에 1.1.1 또는 1.1.2에서 얻은 미끼 변형 (DHFR F [1,2] 융합)의 문화를 접종한다.
- 문화가 포화에 도달 할 수 있도록 250 rpm으로 진탕하면서 30 ℃에서 이틀 동안 배양한다.
- 배양 이틀 판 후 YPD + NAT에서 문화의 5 ml의 omnitray. 세포는 5 ~ 10 분 동안 표면에 흡착하자 초과 액체 (그림 2B)를 제거합니다. 반복 twice 세 가지 반복 실험을합니다.
- 30 ° C에서 이틀 동안 품어.
- 네 번 이상 더 이상 각 셀의 잔디를 사용하여 1536 핀 도구 (DHFR F [3] 수집 × 세 복제물 4 판 짝짓기에 충분한) 단계 4.3 및 4.4 12 YPD 플레이트에서 미끼 부담을 인쇄합니다.
- 1536 핀 도구 (도 2C)를 사용하여 미끼 셀 위에 DHFR F [3] 컬렉션의 적절한 배열을 출력한다.
- 균주는 30 ° C에서 이틀 동안 배양하여 짝짓기를 보자.
- YPD + HygB + 냇 (그림 2C)를 포함 omnitrays에 식민지를 인쇄하여 이배체 세포를 선택합니다.
- 30 ° C에서 이틀 동안 품어.
- 단계 4.8 및 4.9 (그림 2B)에 설명 된대로 반복 배체 선택.
- .이 독성 화합물로 MTX로 작업 할 때 반드시 장갑을 착용주의, 보호 자전거 : MTX (MTX 매체) 일을 포함하는 미디어를 사용하기 전에 다음 단계 21 (주의를 다음과 같이 판을 준비ction의 안경을 처리 실험실 코트) (그림 2C)
- 10 배 -Lys 준비 / 탈 이온수 / 에이드 아미노산 드롭 아웃을 만났다. 대량으로 필요한 경우, 0.2 μm의 병 상단 여과 깔때기 (표 1) 0.2 μm의 멸균 주사기 필터를 사용하여 멸균 병의 드롭 아웃 필터 소독 또는.
- 디메틸 설폭 사이드 (DMSO)에 10 ㎎ / ㎖ MTX 스톡 용액을 준비한다. 용액을 제조 후 즉시 사용을 -20 ° C에서 나머지 동결. 이 감광 그대로 빛으로부터 보호. 를 해동 후 MTX 다시 냉동하지 마십시오.
- 다음과 같다. (배지 성분 및 수량 등 Tarassov 11에 사용 된 것과 동일) 미디어 준비 :
- 매체의 일 리터, 두 개의 분리 된 플라스크에서 혼합한다 : 1) 아미노산 않고 황산 암모늄이없는 효모 질소 염기 6.69 g 및 탈 이온수 330 ㎖; 탈 이온수의 한천 고귀하고 500 ml의 2) 25g.
- 20 분 동안 121 ° C에서 압력솥 플라스크.
- 적어도 한 시간 동안 55 ℃에서 수욕 온도를 평형화.
- 두 플라스크를 함께 혼합하고 살균 40 % 포도당 50ml의 100 배 살균 드롭 아웃 ml의 MTX 10 ㎎ / ㎖의 20 ㎖를 추가합니다.
- 35 ㎖를 붓고 omnitrays 매체의 (아래 참고 참조). 적어도 한 시간 반 동안 응고하자. 빛의 차폐 판.
참고 : 여기에, omnitray 당 배지 35 ml를 붓는 것은 모든 다운 스트림 단계에 중요 동일한 판 두께를 확인하는 것이 중요합니다.
- 로봇 플랫폼 또는 균일 한 판 조명과 일반 디지털 카메라와 함께 배체 선택의 두 번째 라운드에서 이미지 플레이트. 다운 스트림 분석을 수행 할 때 배열에 빈 위치를 식별하기 위해이 사진을 사용합니다. 카메라의 매개 변수가 항상 같은 로봇 표시등이 켜져 있는지 있는지 확인하십시오.
- MTX 미디어 USI에 이배체 세포를 인쇄1536 핀 도구 겨.
- 건조를 방지하기 위해 비닐 봉지에 30 ° C에서 나흘 품어.
- 단계 4.11에 설명 된대로 MTX 매체를 포함 omnitrays의 두 번째 배치를 준비합니다.
- 인큐베이션 나흘, 이미지 판은 로봇 플랫폼 또는 일반 디지털 카메라를 사용. 카메라의 매개 변수가 항상 같은 로봇 표시등이 켜져 있는지 있는지 확인하십시오.
- MTX 미디어의 두 번째 배치에 세포를 복제하여 MTX 선택의 두 번째 라운드를 수행합니다.
참고 :이 PCA 균주의 배경 성장을 감소시키고 정량적 해상도를 증가시킬 것이다. - 건조를 방지하기 위해 비닐 봉지에 30 ° C에서 나흘 품어.
- 같은 이미지 플레이트 단계 4.16에 설명.
5. 이미지 분석
- 사용자 정의 ImageJ에 31 개의 스크립트를 식민지 배열의 이미지를 분석하거나 식민지 개척자, 하프 타임 식민지 그리드 분석기, 셀 프로파일, 식민지 이미지로 출판 소프트웨어를 사용하여(32 컴파일) R, ScreenMill, YeastXtract 및 gitter. 이미지 분석은 하나의 또는 각각의 출력 어레이의 각 위치에 콜로니 크기를 포함하는 여러 스프레드 시트는, 모든 다운 스트림 분석 이러한 콜로니 크기를 사용한다.
참고 :이 연구에서 우리는 Leducq 등에 설명 된 사용자 정의 ImageJ에 스크립트를 사용 (33) (자세한 내용은 토론 섹션을 참조)..
6. 데이터 분석
주 : 이미지 분석의 결과는 엑셀 또는 R (34) 등의 스크립트 언어를 사용하는 것으로 태뷸에서 처리 될 수있다. 다음 단계는 사용자 정의 ImageJ에 31 스크립트를 사용하여 절차를 설명합니다.
- 커스텀 스크립트를 사용하여, 화상 해석의 출력 파일을 연결하고, 플레이트에 각 행에 주석을 부가하고 표 1과 같은 정보를 걸러.
- 콜로니 크기 값 (통합 밀도 또는 콜로니 면적이 로그 변환 여기서, 열 "을 IntDenBackSub & #8221; 보충 표 1)를 사용했다.
참고 : 값 분포는도 3a에서와 같이 보일 것이다. - 각 플레이트의 중간 값을 감산함으로써 이들 값을 정규화한다.
참고 : 자동 이미지 획득의 불평등 미디어 수량 또는 변화의 결과 및 간 복제 분산 (그림 3B)를 줄일 수있다 플레이트 바이어스에 대해이 단계를 제어합니다. - 반복 실험이 실험의 재현성을 평가하기 위해 서로 (그림 3C)와 상관 관계가 있는지 확인합니다.
- 비 상호 작용 미끼 먹이 쌍에서 상호 작용을 구분하기 위해, L-DHFR F [3] 컨트롤의 분포의 95 번째 백분위 수에 해당하는 높은 신뢰도 임계 값을 설정합니다.
주 :이 실험에서, 이는 3.39 (도 3d)에 대응한다. 대안 적으로, BioGRID 35에보고 된 것과 알려진 실제와 인터랙 오버랩에 기초하여 임계치가 사용될 수있다.자세한 내용은 설명을 참조하십시오. - DHFR-PCA 화면에서 거짓 긍정적 인 상호 작용에 관여 (자세한 내용은 설명을 참조)과 (열에서 "1"로 식별 "필터링") 보충 표 2에 나와있는 어떤 미끼를 들어, 필터가 확인 먹이한다.
- (보충 표 2에 열 "평균 점수")의 각각의 상호 작용의 세 복제물의 LOG2 정규화 된 식민지 크기 평균값.
물리적 인터랙 7. 검증 작은 규모의 실험을 사용하여
주 : 상기 스코어 또는 고체 또는 액체 MTX 매체 성장 분석을 이용하여 소규모 실험 설계에서 DHFR-PCA의 분석을 이용하여 검증 할 수있는 적용에 가까운 임계 특히 관심을 갖는 임의의 PPI. 아래 단계 수동 이배체 PCA 균주를 생성하고 MTX 매체 상에 스폿 분석을 수행하는 절차를 나타낸다. 실험자는 모든 necessar에 대해이 단계를 수행해야합니다Y 컨트롤 (미끼-DHFR F [1,2]의 X L-DHFR F [3], 지퍼 링커 - DHFR 배체 계통 및 링커 DHFR 배체 주).
- 1.1.2.6에서 생성 된 미끼 균주의 글리세롤 주식의 플레이트 2-3 μL), L-DHFR F [3] 제어 변형, YPD + 냇, YPD에 지퍼 링커 - DHFR와 링커 DHFR 배체 계통 + HygB 두 번 YPD + 냇 + HygB 미디어, 각각.
- 대신 YPD + 냇 매체의 YPD + HygB 매체에 부담을 DHFR F [3] 수집에 관심있는 먹이를 검색하고 1.1.1의 지침에 따라,하지만 행진.
- 먹이 궤적과 순서 제품에 [3] 융합 DHFR F를 확인하기 위해 1.1.2.4으로하는 진단 PCR을 수행합니다.
- 짝짓기를 반수체 균주 액체 YPD 배지 1 ㎖를 접종 (미끼는 미끼 x 길이-DHFR F [3] 제어, 먹이를 x)와 diploids이 형성 할 수 있도록 30 ° C에서 적어도 이일 성장한다.
- 고체 YPD + HygB + 냇 매체에 7.4 문화의 4-5 μl를 줄무늬로 diploids을 선택합니다. 30 ° C에서 이일 성장.
- SELECt 하나의 고립 된 식민지와 액체 문화 (1 ml)에 하룻밤 성장은 성장 분석을 수행 할 수 있습니다.
- 사용하기 전에 하루 MTX 및 DMSO (MTX 매체와 동일 성분,하지만 MTX없이) 판을 준비합니다. 자세한 내용은 단계 4.11를 참조하십시오.
- 제어 (DMSO) 및 선택 판 (MTX)의 서로 다른 문화의 연속 희석을 잡아 내 성장 분석을 수행합니다.
- OD = 1 precultures을 희석.
- 멸균 96 웰 플레이트 (625의 희석 배수까지) 5 배 희석을 수행합니다.
- 스팟 PCA 미디어 (DMSO와 MTX)에 각 희석의 4 μL.
- 건조를 방지하기 위해 비닐 봉지에 30 ° C에서 품어.
- 로봇 플랫폼이나 일반 디지털 카메라를 사용하여 1 배양 7 일부터 이미지가 접시.
결과
표 2는 부가 Nup82는 DHFR F 미끼로 [1,2] 단편에 융합 단백질을 효모를 사용하여 얻어진 결과의 대표 예이다. L-DHFR F로 정의 된 임계 값은 [3] 제어는 높은 신뢰도 히트 (도 3D 및 3E)을 결정하기 위해 경험적 임계치로서 사용될 수있다. 대안 적으로, 순위 점수 유전자 온톨로지 부화을 수행하는 데 사용되는 다른 기능성 또는 금 표준 37 (36)에 기초하여 분석 될 수있다. 미끼의 알려진 물리적 인터랙는 BioGRID (35)와 같은 데이터베이스에서 검색 한 데이터 (그림 3E 및 3 층)에 오버레이 할 수 있습니다. 이 예에서, 5 ~ 8 중 높은 신뢰 안타는 이전 Nup82의 인터랙로 신고 된 2 개는 Nup82의 subcomplex, Nup116 및 Nup159 (그림 3 층 및 3 세대)의 일부입니다. 복잡한 Nsp1의 다른 멤버는, 어떤 년 Interac를 표시하지 않습니다우리의 실험에서 기. 두할까요, Ade17과 (하지 그림 3 층 참조) Tef2이 적용된 하드 임계 값 이상의 점수를했지만, 이들은 그들이 우리가 (게시되지 않은 결과) 수행 한 PCA 화면에서 거의 모든 미끼 단백질과 상호 작용하는 오탐 (false positive)이 될 가능성이 높다. 한편, Pex30 Nup82은 신규의 물리적 인터랙을 나타낼 수 있고, 우리는 낮은 처리량 (도 3G)에서 DHFR-PCA를 이용하여 이러한 상호 작용을 확인 할 수 있었다. Pex30는 퍼 옥시 막 단백질과 약간의 직접적인 상호 작용은 핵 기공 단지 (NPC)이 세포 소기관 사이에보고되었다. 두 하이브리드 스크린 (38)의 물리적 Pex30 인터랙 같이, 다른 두 NPC 단백질 및 Nup53 ASM4 (Nup59)를 식별하고 그리고 Pex30 Nup170 간의 유전 적 상호 작용 (39)을보고되었다. 다른 두 가지 상호 작용 파트너 감지, Nup120 및 Nup85 (그림 3 층 및 3 세대), 능력을 보여주는, Nup82 서브 단지의 일부가 아닌DHFR-PCA의 내 큰 단지 11 서브 콤플렉스 사이의 상호 작용을 검출한다.
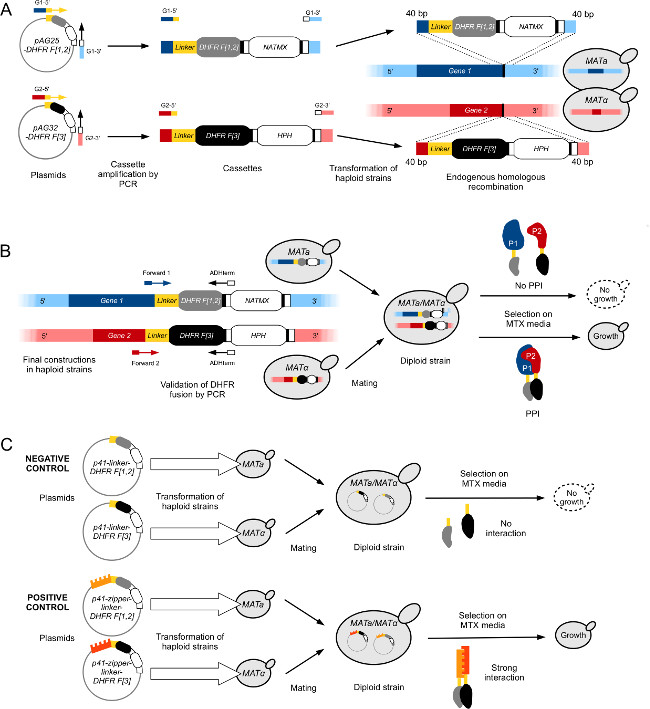
그림 1 :. 반수체 마타와 매트 α 균주의 높은 처리량 DHFR-PCA 엔지니어링 효모 균주 (. Leducq 등을 각색 한 그림 2012 33) (A) 건설 DHFR와 Gene1 (G1)과 Gene2 (G2)를 융합하는 F 각각 [1,2] -NatMX 및 DHFR F [3] -HPH 카세트,. 카세트는 G1-3 pAG25-DHFR F [1,2]와 pAG32-DHFR F [3] 앞으로 프라이머 G1-5 '과 G2-5'과 함께 역방향 프라이머를 플라스미드에서 증폭 '과 G2-3'를하고있다 상동 재조합에 의해 표적 유전자의 3 '말단에서 게놈에 삽입. 얻어진 단백질, P1 및 P2는 각각 D에 융합HFR F [1,2] 단편 (마타)과 유연한 링커를 통해 DHFR F [3] 단편 (MATα). (B) 건설의 검증에 (A)는 Gene1의 및 Gene2의 ORF와 사이의 접합을 시퀀싱에 의해 수행된다 DHFR 카세트. 교배형 대향 구성된 PCA 균주는 이배체 형성 어울리게된다. 두 개의 상보 DHFR 단편 DHFR 효소의 활성을 재구성 P1과 P2 사이의 상호 작용에 의해 근접하게되는 경우 이배체 균주 MTX 매체 상에 성장한다. (C) 구조의 제어 이배체 PCA는 DHFR-PCA 스크린에 대한 균주. 음성 대조군 (L-DHFR)는 플라스미드 P41-링커 DHFR F [1,2]와 P41-링커 DHFR F [3] (11), 각각 별도로 반수체 마타와 MATα 균주를 변환하여 구성된다. 두 균주는 DHFR 단편 없게되는 음성 대조군 균주 이배체 결과 삽합서로 (위) 보완. 양성 대조군은 음성 대조군에 대한 것과 동일한 방법을 이용하여 구성되지만, 플라스미드 반수성 균주 (P41-지퍼 링커 DHFR F [1,2] (P41-ZL-DHFR F [1,2])과 P41에 형질 -zipper 링커 - DHFR F [3] (P41-ZL-DHFR F [3])) DHFR 활동을 재구성 강한 구성 적 상호 작용에 이르게 보완 DHFR 조각에 융합이 GCN4 병렬 류신 지퍼 조각을 포함 (아래 ). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
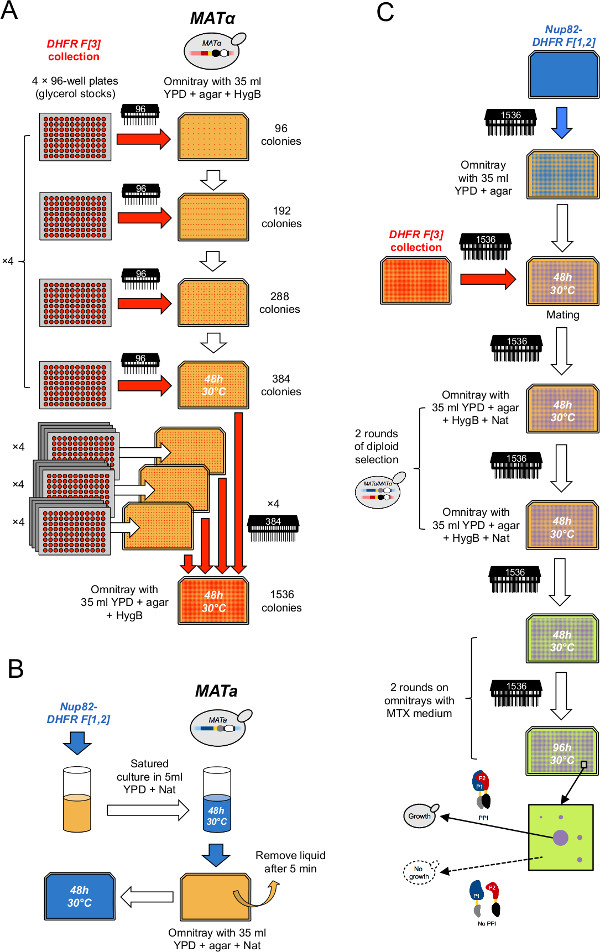
그림 2 : 높은 처리량 DHFR-PCA 절차 (Leducq 등 33에서 적응 그림.) (A) DHFR F [3] 수집 α MAT. 응축의 두 개의 연속 라운드를 통해 1536 형식으로 응축된다. 먼저, 글리세롤 스톡 플레이트 핀 (96)을 이용하여 공구 (384) 형식으로 선택 YPD 배지 + HygB 네 개의 그룹으로 조합된다. 둘째, (384) 어레이는 384 핀 도구를 사용하여 1536 형식으로 선택적 YPD + HygB 매체상의 네 그룹으로 조합된다. 마타 PCA 베이트 균주의 (B) 세포 잔디밭은 유인용 균주의 포화 배양을 성장시킴으로써 제조된다 YPD + 냇 omnitray. (C)이 잔디에 문화를 도금 선택적 YPD + 냇 매체와는 YPD 매체에 DHFR F [3] 컬렉션 미끼의 피로를 짝짓기하는 데 사용됩니다. 세포를 연속적으로 diploids과 두 번 PCA를 수행하는 MTX 매체에 선택 YPD + HygB + 냇 매체에 두 번 전송됩니다. DHFR 조각 미끼와 먹이 단백질 사이의 상호 작용 다음 서로를 보완하면 성장은 MTX 매체에서 관찰됩니다.e.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
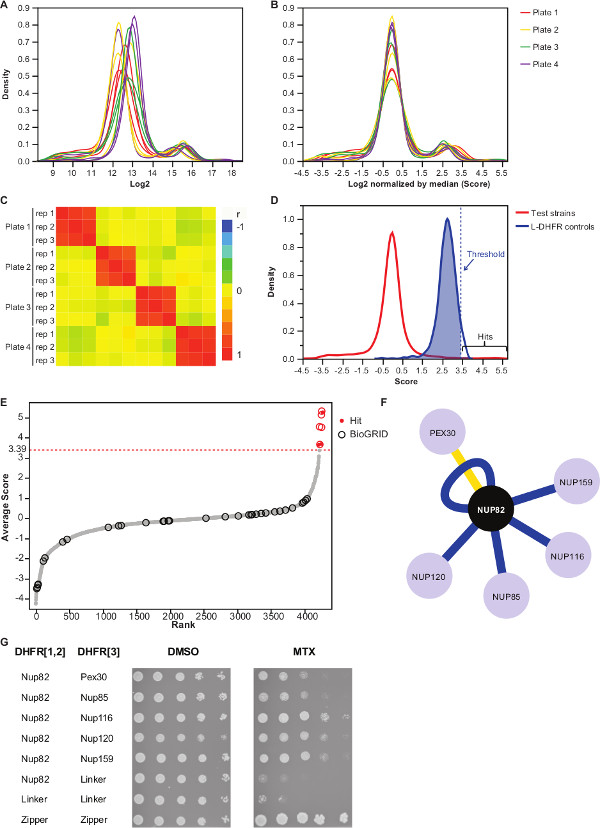
그림 3 :.. 각 이미지의 중간에 의한 데이터 정규화, 의미 임계 값과 긍정적 인 상호 작용의 확인 결정의 단계를 분석 식민지 크기의 (A) 밀도 분포를 각각의 접시에 (2 로그) (B) 정규화는 편견을 교정 플레이트 대 플레이트 효과와 연관된. (C) 히트 맵이 절차의 재현성을 확인 플레이트 사이 스피어 만 상관 계수를 도시. 시험 프로톤 펌프 억제제에 대한 점수 (D) 분포와 L-DHFR F [3] 컨트롤. 하드 임계 값의 95 번째 백분위 수로 설정할 수 있습니다 L-DHFR F [3] 점선 수직으로 표시 높은 신뢰 프로톤 펌프 억제제를 식별 할 수 분포 (각 먹이의 평균 점수의 선). (E) 순위 순서 배포. BioGRID 35 Nup82p의 이전에보고 된 물리적 상호 작용 파트너는 원으로 식별이 연구에서보고 된 빨간색 점으로 식별됩니다. (D)에서 정의 된 임계 값이 점선으로 도시되어있다. (F) 네트워크는 본 연구에서 확인 된 높은 신뢰도를 나타내는 프로톤 펌프 억제제. 블루 가장자리가 이전에보고 보여 실제 인터랙 (BioGRID 35)과 노란색 가장자리 Pex30과 이전에보고되지 않은 상호 작용을 보여줍니다. (G) Nup82-DHFR F [1,2]와 먹이 - DHFR F [3를 포함하는 PCA 배체 계통의 스팟 희석 분석 ] 쌍은 본 연구에서 Nup82p의 물리적 인터랙로 확인. 성장 분석은 DMSO 매체 (MTX 용매, 왼쪽 패널)와 MTX 매체 (오른쪽 패널)을 시행 하였다. F Nup82-DHFR 이루어지는 음성 대조군은 [1,2] - 링커 DHFR은 F [3] 및 링커 DHFR은 F [1,2] - 링커 DHFR은 F [3] 및 양성 대조군 t 이루어지는두 류신 지퍼 부분 사이에 그는 강한 상호 작용 (지퍼 DHFR F [1,2] - 지퍼 DHFR F [3])가 포함되어이었다. MTX 매체에서 음성 대조군에 우수한 세포 성장은 물리적 상호 작용으로 해석되어야한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 아미노산 | 수량 (g) |
| 아데닌 황산 * | 0.2 |
| L 트립토판 | 0.4 |
| L 티로신 | 0.3 |
| L 페닐알라닌 | 0.5 |
| L- 글루타민산 (모노 나트륨 염) | 1.0 |
| L-아스파라긴 | 1.0 |
| L 발린 | 1.5 |
| L 트레오닌 | 2.0 |
| L-세린 | 3.75 |
| Uracile | 0.2 |
| L 히스티딘 염산 | 0.2 |
| L 아르기닌 염산 | 0.2 |
| L - 메티오닌 * | 0.2 |
| L - 라이신 * | 0.2 |
| L-류신 | 0.6 |
| * (이 프로토콜에서와 같이) 표준 PCA를 수행하지만 다른 목적을 위해 첨가 할 수있는 경우 철회. | |
표 1. MTX 매체의 10 배 -Lys / 만족 / 에이드 드롭 아웃의 구성 수량 10 배 드롭 아웃 일리터위한 것입니다. 별 표준 MTX 매체 철회되어야 화합물을 나타내고 있지만, 다른 목적을 위해 첨가 할 수있다.
보충 표 1. 12 테스트 플레이트로부터 결합 된 데이터는 표 1에 연결된 DA를 포함ImageJ에 분석에서 따은 각 행은 각 1536 배열에서 하나의 위치에 대응하는 사용자 정의 ImageJ에 스크립트를 사용하여 수행. 또한, 각 행은, ORF 단백질 이름을 복제, 이미지 파일, DHFR 컬렉션 플레이트에 대한 정보와 함께 주석이되었다.
보충 표 2 :. 변형 당 평균 정규화 된 성장 표 2는 표준 편차와 함께 컬렉션의 각 변형에 대한 평균 로그인이 정규화 된 성장을 포함하고 있습니다. 필터링할까요, 안타 알려진 실제 인터랙 별도의 컬럼에서 확인된다.
토론
우리는 높은 처리량에 주어진 미끼 단백질을 물리적 인터랙의 체계적인 식별을 가능하게 DHFR-PCA 분석을 기반으로 프로토콜을 설명합니다. 이 프로토콜은 더 미끼 선별하여 적용하고,이 복제의 원하는 수준에서 할 수있다. 우리는 핵 기공 단지에 참여 미끼 단백질의 물리적 상호 작용 파트너의 식별에 의해이 프로토콜의 신뢰성을 보여줍니다 Nup82을. 우리의 분석은 효모 단백질 상호 작용 체를 공부하는 방법의 능력을 강조, 다섯 이전에보고 된 인터랙 한 이전에보고되지 않은 인터랙 (그림 3 층 및 3 세대)를 찾을 수 있었다.
여기에 설명 된 프로토콜은 실험주의를 지불해야되는 몇 가지 중요한 단계를 포함한다. 우리는 미끼 DHFR F는 [1,2] 융합 (그림 1B)이 올바른지 확인하십시오) 1 추천; 이는 건설 지표 성과를 시퀀싱함으로써 달성 될 수있다안티 DHFR F [1,2] 또는 항 DHFR F [3] 항체를 이용하여 적절한 단백질 발현을 보내고; 2) 화면을 시작하기에 앞서이 관심의 미끼는 PCA 화면에 무차별 상호 작용이 나타나는 경우 확인하는 것이 좋습니다. 이것은 적절한 L-DHFR 제어 또는 수동으로 해당 L-DHFR 제어와 미끼를 짝짓기와 MTX 매체의 성장 분석을 수행하여 교차 미끼로 제어 화면을 수행하여 수행 할 수 있습니다. 그들이 수분 인쇄 공정 중에 한천 표면에 세포 부착에 최적이되도록 사용하기 전에 3) 플레이트 일 붓고한다; 4) 소스 플레이트 대상 접시에 충분한 세포를 전송하는 4 배 이상을 사용해서는 안된다. 대상 판의 매수를 증가시키는 것은 팽창의 연속적인 단계 (-> 복사본 16 -> 64 사본 예 4 부)에 의해 수행 될 수있다. 또한, 세포 잔디 또는 복제의 다른 라운드 사이의 식민지에서 다른 위치로 선택 될 수있다; 5) 만약 여러 페이지ositions은 이배체 선택 (S), 소스 플레이트가 결합 단계에서 너무 많이 사용되지 않았 음을 확인 후 누락 (4.7 4.5 단계); 6) MTX 매체가 오른쪽 농도에서 모든 필수 성분을 함유하고 있는지 확인합니다. 전혀 성장이 MTX 매체 상 관찰되지 않는 경우 실제로, 그것이있을 수 상호 작용 중 하나는 관심있는 단백질 또는 MTX 매체가 제대로 제조되지 않았기 때문에 PCA에 의해 검출되지 않기 때문에. 매체는 DHFR이 보완 프래그먼트 나타내는 균주의 성장을 허용하는지 확인하기 위해, 구성 적 상호 작용은 컬렉션의 빈 위치에 첨가하고, 류신 지퍼 부분 (33) (도 1C)에 융합 된 DHFR-단편 같이 양성 대조군으로 사용할 수있다. 링커 DHFR 조각 또는 지퍼 링커 DHFR 조각을 사용하여 병렬 테스트 대하여 descr로, 거짓 긍정적 인 상호 작용을하는 경향이 모든 세포가 성장 할 수 있도록 조건 (낮은 MTX 농도 또는 미끼 단백질을 구별 할 수아래 ibed) 모든 균주의 성장을 (MTX 농도가 너무 높거나 필수 요소가 중간에 누락)을 방지 조건; 예를 들어, 핀 도구를 복제 라운드 및 / 또는 마지막 물에 제대로 소독되지 않은, 경우 7) PCA는 다른 하나의 매체 복제의 연속 라운드를 통해 수행되는 것을 감안할 때, 다른 판 사이 균주 간의 교차 오염이 발생할 수 있습니다 멸균 절차 목욕 (즉, 습식 역) 이전 복제 라운드의 식민지에 의해 오염된다. 이 어레이의 여러 위치는 비어 있고, 따라서 성장이 교차 오염을 검출하도록 관찰되지되어야 제어 장소로서 사용할 수있다.
이미지 분석은 여러 공개 소프트웨어 (프로토콜의 섹션 5 참조) 또는 커스텀 스크립트를 사용하여 수행 될 수있다. 1) 스크립트 공동 위하여 각 플레이트의 값을 화소에 빈 접시의 화소 값을 감산한다 : 본 연구에서는 커스텀 스크립트는 다음 단계를 실행한다조명 편견에 대한 rrect. 2) 스크립트 에지 콜로니에 사각형을 중첩하여 결정된 각 플레이트의 각 1536 포지션 용) (10) (3)의 화소 값이 임계 값을 이용하여 이진 각 배경 보정 된 화상을 변환하고, 스크립트가 ImageJ에 "가 입자를 분석 실행 ... 원형 선택에서 "기능. 원형 선택은 두 위치를 뺀 10 픽셀 사이의 간격 길이를 반경으로 설정됩니다. 4) 스크립트는 선택의 중심에서 가장 가까운 입자를 선택하고 그 위치는 두 개의 식민지 사이의 1/2 이상 간격을 멀리 선택의 중심에서 경우 식민지로 확인한다. 5) 스크립트는 백그라운드 보정 된 화상의 선택한 입자의 화소 값을 측정한다. 6) 상기 나머지 배경 조명 바이어스를 정정하기 위해 스크립트 콜로니의 화소 값에 입자의 일부가되지 않은 원형의 선택의 모든 픽셀들의 평균값을 감산한다. 이러한 보정 된 화소 값의 합보충 표 1의 열 "IntDenBackSub"저장 (S)는, 콜로니 크기의 척도로서 사용된다.
분석 부 내에서 중요한 단계는 의미 임계 값의 선택입니다. 여기에서는 네가티브 L-DHFR F [3] 컨트롤 분포에 기초하여 임계 값을 선택했지만 화면 목적에 따라 이러한 임계 값은 너무 엄격 할 수있다. 단편 상보 자발적 서로를 보완 할 수 있고, 따라서 이들 대부분의 단백질 발현 대표 아님 실제로 L-DHFR F [3] 컨트롤 과발현 (강한 TEF 프로모터) 등. 이는 L-DHFR F의 분포 [3] 컨트롤 배경 증가율 (도 3d)의 평균보다 높은 사실에 의해 강조된다. 따라서, 일부 이러한 엄격한 임계치 이하의 점수를 갖는 상호 작용하지만 그 성장 배경 분포의 외측 명확하다 인스턴스는, 일시적인 또는 인터 대한 약한 나타낼 수있다 추정 안타로 간주 될 수있다행동. 이들은 더욱 연구 될 수 있으며, 예를 들어, 두 개의 단백질 L-DHFR 컨트롤 같은 DHFR 단편의 자발적인 보완을 허용 할 수없는 수준으로 발현되고, 경우 돌파 유효성이. 대안으로서, 하나 이상의 가양 참 양성의 비율을 최대화하기 위해 35 BioGRID 같은 데이터베이스에보고 된 물리 인터랙 오버랩의 비율에 기초하여 중요도 임계 값을 설정할 수있다. 예를 들어, 알려진 실제 인터랙의 개수가 충분히 높지 않은 경우에는, L-DHFR 분포의 사용과는 달리, 이러한 대안은 항상 가능하지 않을 수있다. 또, 중요도의 임계 값 선택은 최종 데이터 세트에서 위양성 및 위음성의 비율에 영향을 미친다. 앞서 언급 한 바와 같이, 예를 들어 단백질이 매우 풍부하고, 만약 실제로, 다른 PPI의 검출법 같이 가양는 DHFR 융합 단백질과 단백질의 비특이적 인 상호 작용에 기인 할 수있다. 이일부할까요 체계적 따라서, PCA 화면의 모든 미끼 단백질과 상호 작용한다는 사실에 의해 예시되고, 분석 (11) (예 Tef2 및 Ade17 및 보충 표 2)에서 제거 될 필요가있다. 이 문제를, 해당 L-DHFR 제어에 대해 두 개의 모음 제어 PCA 화면을 우회하는 (F [1,2] 또는 F [3]) 자발 DHFR은 보완이 특정 조건에서 수행 될 수있는 단편 나타내는 베이트 및할까요를 식별 할 각 화면. 미끼 소정의 기능이 알려져있는 경우 또한, 유전자 온톨로지 엔리치 분석을 수행하는 데이터의 신뢰성을 높일 수있다. 한편, DHFR-PCA는 여러 가지 이유로 음성 (false negative)을 일으킬 수있다 : 1) 모든 단백질이 이들 단백질을 불안정하게하거나 예를 들어, 만약 현지화를 수정할 수 있으므로 DHFR 단편에 융합 될 수없는, 행 DHFR 융합체 C 말단은 현지화 신호 방해; 일부 세포 구획 m 2) DHFR의 재구성예를 들어, 엽산 합성에 필수적인 전구체를 사용할 수없는, AY 경우 엽산을 생산하지; DHFR의 보완이 (11)을 발생하는 3) C-말단 필요는 8 nm의 거리 내에 있어야합니다. 자신의 C-말단 공간에서 충분히 닫을 경우 따라서, 잘 알려진 상호 작용은 검색되지 않을 수 있습니다. 이것은 간접적 대부분 데이터베이스에보고 Nup82 물리적 상호 작용의 많은 부분은, 우리의 분석에서 검출되지 않았다는 사실에 의해 여기서 예시된다. DHFR가 보완을 나누고 11 감지되지 않습니다에 마찬가지로, C-말단은 막에 대해 트랜스에있는 막 단백질 사이의 상호 작용은 이어질하지 않습니다. 제한 1), 3) 단백질의 N 말단에-DHFR 단편을 융합에 의해 비교적 간단하게 회피 할 수있다. 그래서 C-말단 근처 현지화 신호를 방해하는 것을 방지 할 수 있고 막 단백질 N과 C 말단 사이의 상호 작용을 감지 할 수있다 시스 상대에 이렇게멤브레인.
몇 가지 문제는 (2,3 검토) 핀의 연구에 남아 있습니다. 지금까지 생산 된 핀의지도는 크게 각 종족에 대한 하나의 실험 조건에 기재되어 있으므로 단백질 네트워크를 구성 할 수있는 방법에 대한 하나의 스냅 샷을 제공했다. PIN 번호가 개발 또는 다음의 돌연변이에 걸쳐 환경 변화, 특정 자극에 응답하여 재구성 될 수있는 방법을 참조하는 다른 실험 조건의 탐색에 대한 필요성이 존재한다. 이러한 도전은 살아있는 세포에서 실시간으로 프로톤 펌프 억제제 테로 새로운 기술의 개발에 의해 그들이 실험실 큰 사회가 사용할 수 있도록 현재의 기술을 적용하여 해결 될 것이다. DHFR 상보의 양의 변화를 감지 할 수있는 기술이 양적 착체 27, DHFR-PCA는 이러한 문제를 극복하기 위해 적응 될 수 있고, 프로톤 펌프 억제제는 에이전트 (22) DNA 손상에 의해 영향을받는 방법을 연구하기 위해 사용되어왔다 화학 약품 (25), 유전자 삭제 23,26 또는 다른 효모 종과 하이브리드 (33). 이러한 새로운 차원 탐색하기 PIN의 동적을 나타 내기 위해 점점 더 중요하게 될 것이다.
공개
이 기사에 대한 오픈 액세스 출판 비용의 일부는 S & P 로봇에 의해 지불했다.
감사의 말
이 작품은 건강 연구의 캐나다 연구소 (CIHR) 191597, 299432 및 324265을, 부여에 의해 지원되었다 자연 과학 및 캐나다 디스커버리 그랜트 공학 연구위원회와 CRL에 인간 프론티어 과학 프로그램 부여합니다. CRL은 CIHR 새로운 탐정이다. 기욤 DISS는 PROTEO 교제에 의해 지원된다. 사무엘 로셰은 NSERC과 FRQNT 연구비에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| BioMatrix Robot, Bench-top Configuration | S&P Robotics Inc. | BM5-BC | |
| 96-format Pin-tool | S&P Robotics Inc. | PH-96-10 | Standard 96-format Pin-tool with 96 high-precision floating pins |
| 384-format Pin-tool | S&P Robotics Inc. | PH-384-10 | Standard 384-format Pin-tool with 384 high-precision floating pins |
| 1536-format Pin-tool | S&P Robotics Inc. | PH-1536-05 | Custom 1536-format Pin-tool with 0.5mm high-precision floating pins |
| Automated imaging module | S&P Robotics Inc. | IMG-02 | |
| Methotrexate | Bioshop Canada Inc. | MTX440 | CAUTION: toxic compound |
| Hygromycin B | Bioshop Canada Inc. | HYG003 | |
| Nourseothricin dihydrogen sulfate | Werner BioAgents | 5010000 | |
| Yeast-Interactome Collection | Thermo Scientific | YSC5849 | |
| Omni Tray w/lid sterile | Thermo Scientific | 242811 | |
| Anti-DHFR F[1,2] antibody | Sigma-Aldrich | D1067 | |
| Anti-DHFR F[3] antibody | Sigma-Aldrich | D0942 |
참고문헌
- Alberts, B. The cell as a collection of protein machines: preparing the next generation of molecular biologists. Cell. 92, 291-294 (1998).
- Diss, G., et al. Integrative avenues for exploring the dynamics and evolution of protein interaction networks. Curr Opin Biotechnol. 24, 775-783 (2013).
- Vidal, M., Cusick, M. E., Barabasi, A. L. Interactome networks and human disease. Cell. 144, 986-998 (2011).
- Hu, P., et al. Global functional atlas of Escherichia coli encompassing previously uncharacterized proteins. PLoS biology. 7, e96 (2009).
- Arifuzzaman, M., et al. Large-scale identification of protein-protein interaction of Escherichia coli K-12. Genome Res. 16, 686-691 (2006).
- Rajagopala, S. V., et al. The binary protein-protein interaction landscape of Escherichia coli. Nature biotechnology. 32, 285-290 (2014).
- Arabidopsis-Interactome-Mapping-Consortium. Evidence for network evolution in an Arabidopsis interactome map. Science. 333, 601-607 (2011).
- Babu, M., et al. Interaction landscape of membrane-protein complexes in Saccharomyces cerevisiae. Nature. 489, 585-589 (2012).
- Krogan, N. J., et al. Global landscape of protein complexes in the yeast Saccharomyces cerevisiae. Nature. 440, 637-643 (2006).
- Gavin, A. C., et al. Functional organization of the yeast proteome by systematic analysis of protein complexes. Nature. 415, 141-147 (2002).
- Tarassov, K., et al. An in vivo map of the yeast protein interactome. Science. 320, 1465-1470 (2008).
- Uetz, P., et al. A comprehensive analysis of protein-protein interactions in Saccharomyces cerevisiae. Nature. 403, 623-627 (2000).
- Guruharsha, K. G., et al. A protein complex network of Drosophila melanogaster. Cell. 147, 690-703 (2011).
- Li, S., et al. A map of the interactome network of the metazoan C. elegans. Science. 303, 540-543 (2004).
- Rual, J. F., et al. Towards a proteome-scale map of the human protein-protein interaction network. Nature. 437, 1173-1178 (2005).
- Landry, C. R., Levy, E. D., Abd Rabbo, D., Tarassov, K., Michnick, S. W. Extracting insight from noisy cellular networks. Cell. 155, 983-989 (2013).
- Berggard, T., Linse, S., James, P. Methods for the detection and analysis of protein-protein interactions. Proteomics. 7, 2833-2842 (2007).
- Wodak, S. J., Vlasblom, J., Turinsky, A. L., Pu, S. Protein-protein interaction networks: the puzzling riches. Current opinion in structural biology. 23, 941-953 (2013).
- Fields, S., Song, O. A novel genetic system to detect protein-protein interactions. Nature. 340, 245-246 (1989).
- Dunham, W. H., Mullin, M., Gingras, A. C. Affinity-purification coupled to mass spectrometry: basic principles and strategies. Proteomics. 12, 1576-1590 (2012).
- Michnick, S. W., Ear, P. H., Landry, C., Malleshaiah, M. K., Messier, V. A toolkit of protein-fragment complementation assays for studying and dissecting large-scale and dynamic protein-protein interactions in living cells. Methods Enzymol. 470, 335-368 (2010).
- Rochette, S., Gagnon-Arsenault, I., Diss, G., Landry, C. R. Modulation of the yeast protein interactome in response to DNA damage. Journal of proteomics. 100, 25-36 (2014).
- Diss, G., Dube, A. K., Boutin, J., Gagnon-Arsenault, I., Landry, C. R. A systematic approach for the genetic dissection of protein complexes in living cells. Cell Rep. 3, 2155-2167 (2013).
- Gagnon-Arsenault, I., et al. Transcriptional divergence plays a role in the rewiring of protein interaction networks after gene duplication. Journal of proteomics. 81, 112-125 (2013).
- Schlecht, U., Miranda, M., Suresh, S., Davis, R. W., St Onge, R. P. Multiplex assay for condition-dependent changes in protein-protein interactions. Proceedings of the National Academy of Sciences of the United States of America. 109, 9213-9218 (2012).
- Lev, I., et al. Reverse PCA, a systematic approach for identifying genes important for the physical interaction between protein pairs. PLoS Genet. 9, e1003838 (2013).
- Freschi, L., Torres-Quiroz, F., Dube, A. K., Landry, C. R. qPCA: a scalable assay to measure the perturbation of protein-protein interactions in living cells. Mol Biosyst. 9, 36-43 (2013).
- Pelletier, J. N., Campbell-Valois, F. X., Michnick, S. W. Oligomerization domain-directed reassembly of active dihydrofolate reductase from rationally designed fragments. Proceedings of the National Academy of Sciences of the United States of America. 95, 12141-12146 (1998).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods Enzymol. 350, 87-96 (2002).
- Schuldiner, M., Collins, S. R., Weissman, J. S., Krogan, N. J. Quantitative genetic analysis in Saccharomyces cerevisiae using epistatic miniarray profiles (E-MAPs) and its application to chromatin functions. Methods. 40, 344-352 (2006).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature methods. 9, 671-675 (2012).
- Wagih, O., Parts, L. gitter: A Robust and Accurate Method for Quantification of Colony Sizes From Plate Images. G3 (Bethesda). 4 (3), 547-552 (2014).
- Leducq, J. B., et al. Evidence for the robustness of protein complexes to inter-species hybridization. PLoS Genet. 8, e1003161 (2012).
- . . Development Core Team: A language and environment for statistical computing. , (2008).
- Stark, C., et al. BioGRID: a general repository for interaction datasets. Nucleic Acids Res. 34, D535-D539 (2006).
- Vinayagam, A., et al. Protein complex-based analysis framework for high-throughput data sets. Science signaling. 6, rs5 (2013).
- Jansen, R., Gerstein, M. Analyzing protein function on a genomic scale: the importance of gold-standard positives and negatives for network prediction. Current opinion in microbiology. 7, 535-545 (2004).
- Ito, T., et al. A comprehensive two-hybrid analysis to explore the yeast protein interactome. Proceedings of the National Academy of Sciences of the United States of America. 98, 4569-4574 (2001).
- Costanzo, M., et al. The genetic landscape of a cell. Science. 327, 425-431 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유