JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
형광 생체막 포스 프로브 : 하나의 세포에서 수용체 - 리간드 속도론의 동시 정량 및 바인딩에 의한 세포 내 신호
* 이 저자들은 동등하게 기여했습니다
요약
We describe a technique for concurrently measuring force-regulated single receptor-ligand binding kinetics and real-time imaging of calcium signaling in a single T lymphocyte.
초록
멤브레인 수용체 - 리간드 상호 작용은 다수의 세포 기능을 매개한다. 바인딩 역학 이러한 분자의 상호 작용에 의해 트리거 다운 스트림 신호는 가능성이 기계적인 환경에서 결합 및 신호 포획 장소에 의해 영향을받습니다. 최근 연구는 기계적인 힘에 의한 항원 인식을 조절하고 T 세포 수용체 (TCR)의 트리거링 할 것을 보여 주었다. 이 형광 현미경으로 단일 분자 힘 분광법을 결합한 새로운 우리가 개발 한 기술이라고 형광 생체막의 힘 프로브 (fBFP)에 의해 가능하게되었다. 민감한 힘 센서로서 고속 카메라와 실시간 영상 추적 기술을 매우 부드러운 인간 적혈구를 사용 fBFP 1 ~ PN (10-12 N) ~ 3nm 이상이며 ~ 0.5 밀리의 힘, 공간과 시간 해상도. fBFP으로, 하나는 정확하게 힘 조절에 따라 단일 수용체 - 리간드 결합 동력학과 동시에 이미지가 트리거 바인딩 세포 내 칼을 측정 할 수 있습니다cium 하나의 살아있는 세포에 신호. 이 새로운 기술은 기계적인 규제에서 다른 세포에서 다른 막 수용체 - 리간드 상호 작용과 신호 전달을 연구하는 데 사용할 수 있습니다.
서문
세포 간 및 세포 - 대 - 세포 외 기질 (ECM)의 밀착성이 세포 표면 수용체, ECM 단백질, 및 / 또는 지질 1 간의 결합에 의해 매개된다. 바인딩은 세포의 기능을 형성 한 구조뿐만 아니라, 인식, 통신, 및 환경 1-3에 반응 할 수있다. 수용성 단백질 (예 : 사이토킨 및 성장 인자), 3 차원 (3D)에서 결합하는 세포 표면 수용체 상 유체 상 달리 세포 부착 수용체 분자 구속 두 대향면을 연결하는 좁은 접합부 갭에 걸쳐 그들의 리간드 결합을 형성 두 차원 (2D) 인터페이스 4-7에 확산. 일반적으로 기존의 결합 분석 (예를 들어, 표면 플라즈몬 공명 또는 SPR)에 의해 측정되는 3D 동역학 달리, 챔버 (11, 12)을 흘러, 예컨대 원 자간 력 현미경 (AFM) 8-10 같은 전문 기술을 정량 2D 동력학 가지고 마이크로 피펫 13, 14, 광핀셋 (15)과 생체막의 힘 프로브 (BFP) 16-21.
단지 세포 응집력 물리적 링크를 제공하는 이상은, 부착 분자는 그 주변과 통신하는 셀에 대한 시그널링 장치의 주요 구성 요소이다. 부착 분자의 리간드 결합은 세포 내 신호 전달 및 방법은 초기 신호가 상기 형질 도입 된 세포의 내부를 개시한다 방법 이해에 관심이 증대되고있다. 직관적으로, 수용체 - 리간드의 성질은 그것이 유도 된 신호에 영향을 미칠 수 바인딩. 그러나, 그 때문에 예를 들면 많은 한계, 불량한 시간 해상도와 공간 해상도의 완전한 결핍의 생화학 적 분석법 전통적인 앙상블을 사용 세포 상호 작용 및 세포 내 신호 전달 기전 이벤트 간의 관계를 해부하기가 어렵다. 라이브에 모두 생물 물리학 (역학을 결합 2D 수용체 - 리간드)을 허용 방법과 생화학 (신호) 관측을 기존세포는 형광 기능을 24-26로 통합 조정 강성 (22)의 기판 (23) 엘라스토머 기둥 배열과 유량 용기 / 미세 유체 장치를 포함한다. 그러나, 신호와 결합 수용체 리간드의 판독이 어려운 신호 이벤트와 결합 특성의 공간적 관계를 해부하고, (다른 방법으로 가장 자주) 개별적으로 얻을 수있다.
기존의 BFP는 높은 시공간 해상도 (17)와 고감도 힘 분광법이다. 이는 단일 분자 동력학 2D, 기계적 특성 및 구조적 변화 14,16,19-21,27-29의 측정을 가능하게 힘 센서로서가요 적혈구 (RBC)를 사용한다. 형광 이미징 기반 BFP (fBFP)는 단일 분자 규모에서 결합 트리거 세포 신호와 수용체 - 리간드 결합 반응 속도의 상관 관계. 표면 mechani의 맥락에서 현장 세포 신호 활동이 설정으로CAL 자극은 T-27 세포에서 관찰되었다. fBFP 만능이며 다른 셀들에있는 다른 분자들에 의해 매개되는 세포 부착 및 시그널링의 연구에 사용될 수있다.
프로토콜
이 프로토콜의 지침을 다음과 조지아 공대의 인간 연구 윤리위원회에 의해 승인되었습니다.
1. 인간의 적혈구 분리, 바이오 티 닐화 및 삼투압 조절
참고 : 임상 시험 심사위원회가 프로토콜을 승인 한 단계 1.1, 숙련 된 의료 전문가 등의 간호사가 수행해야합니다.
- 손가락 찌르기에서 혈액의 8-10 μL (한 방울)를 얻어 탄산염 / 중탄산염 버퍼 1 ㎖에 추가 (표 1, 2). 부드럽게 G 와동 또는 900 X에서 1 분 동안 혼합 원심 분리기를 피펫. 뜨는을 취소하고 한 번 더 씻는다.
- 작은 비커 비오틴 PEG3500-NHS 링커 (표 1) 3.5-4 mg의 무게. 최종 농도가 3 ㎎ / ㎖ 있도록 카보네이트 / 중탄산염 완충액에 용해시킨다.
- 탄산염 / 중탄산염 버퍼 171 μL, 적혈구 팩 10 μL와의 1049 μl를 혼합비오틴 링커 PEG3500-NHS 용액을 30 분 동안 RT에서 배양한다. 탄산염 / 중탄산염 버퍼 한 번 적혈구를 세척 한 후 두 번 N2-5 % 버퍼 (표 1, 2)와.
- 한편, 5 분 동안 바닥 진공 건조제로 채워진 유리 진공 건조기에서 풀 캡으로 링커 병을 배치하고, 아르곤와 건조기를 입력합니다. 뚜껑을 조이고 병을 꺼내. 플라스틱 파라핀 필름 (표 1)와 병을 밀봉, -20 ° C에서 바닥 상점에 건조제로 충전 된 용기에 넣습니다.
주 : 1.2-1.4 포함 비오틴 PEG3500-NHS 링커의 사용을 포함하는 단계 (부화를 제외하고 1.3 씻어), 가능한 한 빨리 수행 될 필요가있다. - 40 μg / ML의 최종 농도를 만들어 N2-5 % 완충액으로 희석 니 스타틴. 니 스타틴의 71.4 μL (표 1) 솔루션 바이오틴 적혈구의 5 μl를 혼합하고 0에서 1 시간 동안 배양 &# 176; C. 냉장고에서 + 0.5 % BSA N2-5 % 완충액 (표 1) (5 ° C)와 N2-5 % 완충액 저장 회 씻는다.
2. 유리 구슬 실란 화
- 구슬 표면의 청소
- 유리 비드 분말 50mg을 달아 DI 물 500 μL에 그들을 재 - 보류.
- 50 ㎖ 비이커에 DI 물 9.5 ㎖로 0.5 ㎖의 30 % H 2 O 2 (표 1) 혼합 한 후 농축 NH 4 OH (표 1) 2 ㎖을 추가하고, 핫 플레이트상에서 보일러에이 용액을 가지고 .
- 끓는 용액에 유리 구슬을 추가하고 다른 5 분 동안 끓여을 계속합니다. 부드럽게 솔루션마다 분을 소용돌이 친다.
- 끓는 후, RT DI 물 15 ㎖의 마이크로 원심 분리기 튜브와 최고 최대로 ~이 뜨거운 구슬 현탁액 5 mL를 전송합니다. 5 분 동안 3,500 XG에 원심 분리기 제거하고 상층 액을 버린다.
- 세척 구슬에 뜨거운 구슬 서스펜션의 또 다른 5 mL를 전송하고 추가다시, 더 탈 이온수와 위로 잘 혼합하고 원심 분리기. 탈 이온수의 약 50 ㎖가 사용될 때까지 세척의 4 ~ 5 배의 총이 될 것이다,이 절차를 반복합니다.
- 1 ml의 유리 병에 구슬 현탁액을 전송합니다. 마지막으로 3 회 5 분 동안 17,000 XG에서 원심 분리하여 메탄올 (표 1)과 비드를 세척하고, 반복을 100 % 메탄올 1 ㎖ 중의 비드를 일시 중지 재.
- 구슬 표면 티올
- 50 mL의 원심 관에, 현탁액을 2.1에서 제조 한 1.15 mL의 3- 메르 캅토 프로필 트리 메 톡시 실란 (MPTMS) (표 1) 및 1 ml의 구슬 아세트산 메탄올 45.6 ㎖, 0.4 ㎖ (표 1), DI 물 1.85 ml에, 추가 다음 3 시간 동안 실온에서 품어.
- 반응 후, 신선한 메탄올로 한번 세정하여 모든 반응 물질을 제거하고, 메탄올 500 μL로 비드를 다시 일시. 균등 (20) 건조하고 깨끗한 유리 병의 집합으로이 집중 유리 구슬 서스펜션을 분할스크류 캡. 건조한 아르곤의 제트를 사용하여 메탄올을 증발시키고, 바이알의 양면에 건조 비드 박층가되도록 서서히 바이알을 회전한다.
- 느슨하게에 캡 (들)을 배치 빠르게 5 분 동안 120 ° C로 예열 된 오븐에 건조 구슬의 튜브를 배치 한 후 꺼내. 바닥에 건조제를 채운 글래스 진공 데시 케이 터 내에서 튜브를 배치하고 냉각 될 때까지 진공 펌프로 진공 건조기.
- 정상 대기압으로 건조기를 가지고 건조 아르곤으로 진공 건조기를 제거. 유리 병의 캡 (들)을 다시 조여 빠르게 데시 케이 터의 뚜껑을 제거하고. 플라스틱 파라핀 필름과 유리 병을 밀봉하고 건조 어두운 저장 상자에 실온에서 보관.
- 즉시 사용되면, 건조 구슬 중 하나 유리 병을 가지고 인산 버퍼 (표 1, 2), 4 ℃에서 인산 버퍼 및 저장의 50 μL에 다시 일시 중지 한 번 씻는다. 이 농축 된 비드 제제 부른다다음 단계에서 "MPTMS 비드"로.
참고 : 적절한 스토리지, MPTMS 구슬 최대 3 개월 동안 기능을 유지 할 수있다.
3. 구슬 기능화
- 공유 구슬에 단백질을 코팅
- 단백질 주식의 특정 볼륨 (예를 들어, 2.5 μL)를 가지고 해결 방법 1 만들 탄산염 / 중탄산염 버퍼의 동량 혼합.
주 : 볼륨 스톡 농도 및 비드 표면에 단백질의 원하는 최종 사이트 밀도에 의존한다. - 작은 비이커 MAL-PEG3500-NHS 링커 (표 1) 2-3 mg의 무게 및 0.231 mg / ml의 최종 농도에 도달하기 위해 탄산염 / 중탄산염 완충액으로 용해시킨다.
- 3.1.2에서 제조 링커 용액의 동량 혼합 용액 1. 2 액을 30 분 동안 실온에서 혼합물을 인큐베이션.
- 한편, 유리 진공 건조기의 F에서 풀 캡으로 링커 병 배치5 분 동안 바닥과 진공에 건조제와 함께 illed, 아르곤와 건조기를 입력합니다. 뚜껑을 조이고 병을 꺼내. 플라스틱 파라핀 필름으로 병을 밀봉 -20 ° C에서 바닥 상점에 건조제로 충전 된 용기에 넣습니다.
주 : (3.1.3에서 인큐베이션 제외) 3.1.2-3.1.4 포함 MAL-PEG3500-NHS 링커의 사용을 포함하는 단계를, 최대한 빨리 수행 될 필요가있다. - 해결 방법 2와 MPTMS 구슬의 5 μl를 혼합하고 250 μL의 최종 부피를 만들기 위해 인산 완충액 (표 1)를 추가합니다.
- , 실온에서 밤새 구슬을 품어 인산 버퍼로 3 회 세척하고, 4 ℃에서 인산 버퍼와 저장소의 100 μL에 다시 일시 중지합니다.
- 단백질 주식의 특정 볼륨 (예를 들어, 2.5 μL)를 가지고 해결 방법 1 만들 탄산염 / 중탄산염 버퍼의 동량 혼합.
- 준비 단백질 / 스트렙 타비 딘 (SA) 코팅 비즈
- 프로토콜 3.1.1-3.1.4을 따르십시오.
- 해결 방법 2와 MPTMS 구슬 5 μL 4 ㎎ / ㎖ 스트렙 타비 딘 - 말레이 미드 (SA-MAL) (표 1의 5 μl를 혼합) 용액 후 250 μL의 최종 부피를 위해 인산 완충액을 추가한다.
- 4 ° C에서 인산염 버퍼와 저장소의 100 μL에 다시 일시 중지 마지막으로, 실온에서 밤새 구슬을 품어 인산 버퍼로 3 회 반복합니다.
- 유리 구슬에 스트렙 타비 딘 코팅
- 4 ㎎ / ㎖ s 솔루션의 5 μL와 MPTMS 구슬의 5 μl를 혼합하고 인산염 완충액 140 μL를 추가합니다.
- , 실온에서 밤새 구슬을 품어 인산 버퍼로 3 회 세척하고, 4 ℃에서 인산 버퍼와 저장소의 50 μL에 다시 일시 중지합니다.
- 비오틴 단백질과 SA 코팅 비즈 코팅
- (볼륨이 원하는 코팅 밀도에 따라 다름) 단백질과 SA 코팅 구슬의 5 μl를 혼합하고 최종 부피는 100 μL 될 수 있도록 인산 버퍼를 추가합니다.
- 하룻밤 4 ℃ 또는 실온에서 3 시간 동안 혼합물을 품어 인산 버퍼로 3 회 세척하고, 50 μL의 산도에 다시 일시 중지osphate 버퍼 및 4 ℃에서 저장한다.
4. 셀 준비
참고 : 예를 들어, T-27 세포 또는 특정 세포주를 21,29, 세포를 정화 세포의 사용 형태에 대응하는 표준 셀 정제 프로토콜을 따르.
- fBFP 실험을 위해, 세포 현탁액이 준비되면, Fura2-AM, 2 μM의 최종 농도에 도달 RT에서 30 분 동안 배양 한 다음 번 씻어 세포 현탁액으로 DMSO에 용해 된 (표 1)을 추가한다. 어두운 곳에서 사용할 때까지이 찬란로드 세포 현탁액을 유지합니다.
5. 마이크로 피펫을위한 준비 및 세포 상공 회의소
- 마이크로 피펫을 준비
- 길이가 약 3 인치 짧은 조각으로 유리 커터로 잘라 긴 모세관 유리관 (표 1). 마이크로 피펫 풀러 (표 1), "당겨"를 클릭 위에 장착 한 조각 만t가되도록 모세관의 중앙이 시스템에 의해 가열되며 모세관 날카로운 팁 (원시 마이크로 피펫)과 함께 두 개의 모세관을 만드는 두 단부에 인출한다.
참고 : 제품의 가이드 라인에 따라, 원료 피펫의 원하는 형태가 6-8mm 테이퍼 및 0.1 ~ 0.5 μm의 팁이있다. - 마이크로 피펫 단조 (표 1)의 피펫 홀더에 원시 피펫을 마운트합니다. 열은 단조에 유리 구 용융합니다. 유리 구 안에 원시 피펫의 팁을 삽입합니다. 유리 구를 냉각 및 외부에서 휴식과 구 내부의 팁을 떠나 원시 피펫을 잡아 당깁니다. 원하는 팁 구멍을 얻을 때까지이 절차를 반복합니다.
마이크로 피펫 팁 내경의 예 : 참고 : 적혈구에 대한 2.0-2.4 μm의, 비드 ~ 1.5 μm의, ~ T 세포 2-4 μm의 하이 브리 도마 세포에 대한 -7 μm의.
- 길이가 약 3 인치 짧은 조각으로 유리 커터로 잘라 긴 모세관 유리관 (표 1). 마이크로 피펫 풀러 (표 1), "당겨"를 클릭 위에 장착 한 조각 만t가되도록 모세관의 중앙이 시스템에 의해 가열되며 모세관 날카로운 팁 (원시 마이크로 피펫)과 함께 두 개의 모세관을 만드는 두 단부에 인출한다.
- 셀 실 구축
주 : 셀 챔버가 홈 화에 기초하여 내장두 개의 금속 사각형 조각 (구리 / 알루미늄)와 함께 그들을 연결하는 핸들 (그림 1D)로 구성되어 전자 챔버 홀더. - 두 40mm X 11mm X 0.2 mm 조각으로 유리 커터를 이용하여 40mm X 22mm X 0.2 mm의 커버 슬립을 잘라 (커버 슬립을 1, 2). 접착제가 두 개의 금속 사각형을 브릿지하는 방식 챔버 홀더의 상부 측에 그리스에 의해 커버 슬립 (1)과 평행 커버 슬립 셀 챔버 (도 1D)을 형성 할 것이다 하측 마찬가지로 접착제 커버 슬립이.
- 두 된 커버 사이에 실험 버퍼의 200 μl를 주입 피펫을 사용합니다. 버퍼가 모두 된 커버에 부착되어 있는지 확인합니다. 부드럽게 회전 버퍼 챔버의 양쪽에 접촉하는 챔버를 흔들.
- 조심하여 야외에서 버퍼 밀봉 실험 버퍼 영역을 플 랭킹 챔버의 양측에 미네랄 오일을 주입. (예를 들면, 코팅 된 비드 pMHC) 프로브 비드 현탁액, 적혈구 및 대상을 주입각각의 버퍼 영역, 상부 중간 및 하부 영역에서 (예를 들면, T 세포).
6. BFP 실험
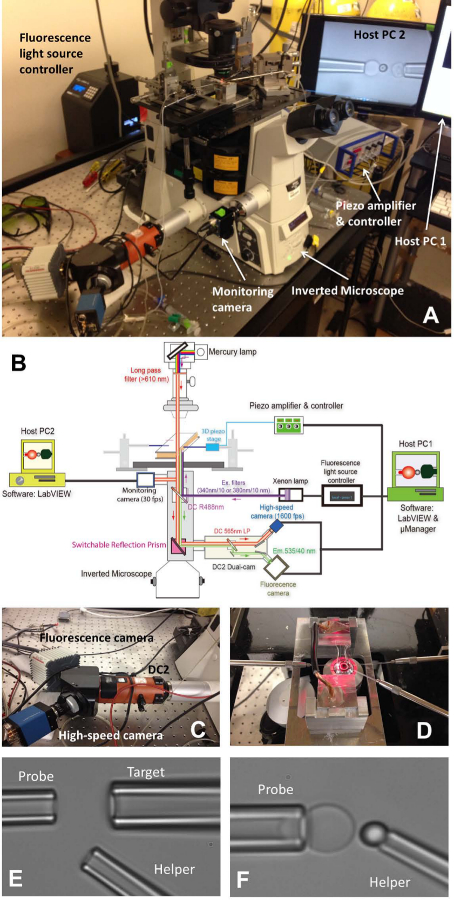
도 1 : fBFP 조립체 (A) fBFP 하드웨어 시스템의 개요 사진.. (B) fBFP 하드웨어 시스템의 개략도. (C) 고속 카메라 (파란색)와 형광 카메라 (흰색) 상에 장착 된 이중 CAM 시스템 "DC2"(오렌지). (D) 실험 챔버와 세 마이크로 피펫 조작 시스템을 적응 현미경 스테이지. (E 및 F) 실험 챔버 BFP 설정의 현미경 사진. (E) Micropipette과 조립 프로브 피펫 (왼쪽), 대상 피펫 (오른쪽)과 도우미 피펫을 보여주는 (낮은 Right). (F) 프로브 비드 배치. 프로브 비드가 힘 프로브를 형성하는 적혈구 정점에 도우미 피펫에 의해 조작 및 장착했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 현미경 (표 1)과 광원의 전원을 켭니다. 주요 현미경 단계 (그림 1A, D)에 챔버를 놓습니다.
- (대상 셀 또는 구슬, 오른쪽 잡아 : : : 적혈구, 권리를 잡기 위해, 프로브 구슬을 잡아, 도우미. 그림 1D 왼쪽) BFP의 세 Micropipette과를 설치합니다.
- 실험 버퍼 마이크로 피펫을 백필하는 마이크로 인젝터 (표 1)를 사용합니다. 피펫 홀더 (표 1)을 벗고 끝에서 떨어지는 물을 수 있도록 낮은 장소에서 그것을 유지. 신속 홀더 끝으로 마이크로 피펫을 삽입하고 공기 거품이 마이크로 피펫에 들어간 없는지 확인삽입시. 홀더 나사를 조입니다.
- 해당 마이크로 매니퓰레이터에 각 피펫 홀더를 탑재합니다. 자신의 팁 챔버 버퍼 영역을 입력하도록 챔버쪽으로 마이크로 피펫을 밀어 넣습니다. 마이크로 피펫의 위치를 조정하고보기의 현미경 필드에서 그들을 찾을 수 있습니다.
- 하나씩을 세 가지 요소의 식민지 (적혈구, 목표와 프로브 구슬)를 찾기 위해 챔버 홀더 무대 주위로 이동합니다. 마이크로 피펫 접근 한 셀 / 비드의 끝을 수 있도록 조작기의 노브를 돌려 해당 마이크로 피펫의 위치를 조정합니다. 해당 마이크로 피펫 내부의 압력을 조절함으로써 세포 / 비드 대기음. 세 가지 가능한 Micropipette 해당 요소를 캡처합니다.
- 멀리 실험이 수행 될 주입 된 요소의 식민지에서 열린 공간을 찾기 위해 챔버 홀더 무대 주위로 이동합니다. 완의 이미지를 시각화하기 위해 현미경 영상 모드를 전환컴퓨터 화면 터의 프로그램입니다. 프로그램의 비전 필드에 피펫 팁의 모든 세 가지 요소를 이동합니다.
- 간단히 철회 부드럽게 적혈구에 비드를 충돌하고, 프로브 비드 및 RBC를 맞추고 조심스럽게 RBC의 정점에 프로브 비드를 기동. 이 RBC 정점 (그림 1 층)에 붙어 남아있을 수 있도록, 부드럽게 떨어져 구슬을 불어 도우미 마이크로 피펫의 압력을 조정합니다. 도우미 마이크로 피펫을 벗어나 대상과 프로브 비드 (그림 2A)를 맞 춥니 다.
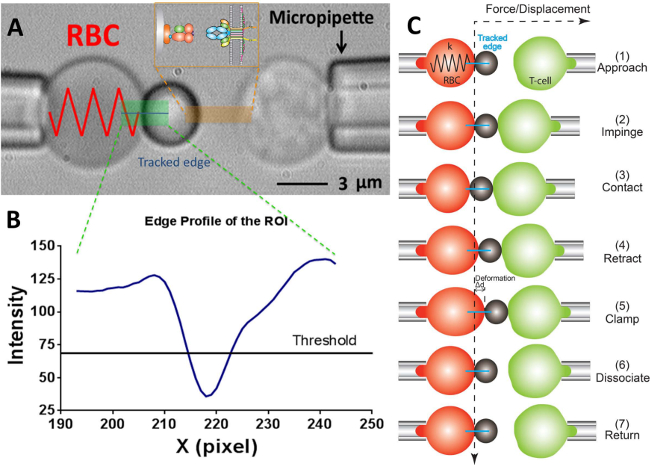
그림 2 :. BFP 방식 및 시험주기 (A) 힘 프로브 (왼쪽)와 각각의 pipettes.The 고정 힘 프로브에 의해 흡입 대상 T 세포 (오른쪽)를 묘사하는 비디오 현미경 부어 적혈구 및 부착으로 구성 리간드 베어링 구슬을. 수용체 - 베어링T 세포 (타겟)에 대 향하여 정렬 된 프로브 piezotranslator에 장착된다. 투자 수익 (ROI)은 녹색으로 표시됩니다. 에지 추적은 파란색 선으로 표시됩니다. 인서트는 오렌지색으로 표시 영역의 두 대향 표면에 리간드 (pMHC, 비드 측면)과 수용체 (TCR, T 세포 측) 쌍을 도시한다. (B) (A)에서의 에지 비드의 강도 프로파일. X의 Y 방향에서의 ROI 영역은 X시킴으로써 행한다 (화소 수있는) 및 (계조 값)의 광 강도의 Y Y 방향을 따라 30 픽셀 비닝함으로써 평균으로서 도시된다. (C) RBC의 편향 및 비드의 위치와 힘 클램프 분석의 테스트 사이클에서 타겟 (T 세포). 가로 및 세로 파선은 각각 RBC 에이펙스와 시간 경과의 제로 하중 위치를 나타낸다. 적혈구 변형 라인 에지 추적기는 각 패널에 파란색으로 표시됩니다. 동일한 아직 적은 단계 접착 주파수 채택( "해리"하는 단계를 결여) 및 열적 변동 분석 ( "클램프"및 "해리"의 단계를 결여) 분석.
- 프로그램, 비전 필드 창 프로브 마이크로 피펫 (R의 P)의 각각의 반경을 측정하기 위해 프로그램에 도구를 사용하여, RBC (R 1), RBC 및 프로브 비드 (R 온도) 사이의 원형 접촉 영역 다음 수학 식 17,30로 RBC (K)의 스프링 정수의 추정을 허용하는,
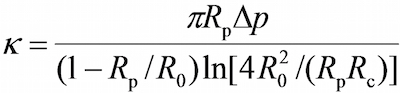
여기서 Δ p를 프로브 피펫 팁에서 흡입 압력이다.
주 : 결합력, F가, 스프링 상수 및 프로브 비드 (d)의 변위, 즉, F = D의이 제품에 의해 정량화 될 수 있음 훅 법칙을 따른다 (그림 2C). - (프로토콜 6.6 절을 참조하십시오. 스프링 상수는 일반적으로 힘 클램프 분석 및 접착 주파수 분석을위한 0.25 또는 0.3 PN이 / nm의 열 변동 분석 0.1 PN / nm에서 설정) 프로그램에 원하는 적혈구 스프링 상수를 입력 , 이는 물 센티미터 단위로 필요한 흡인 압력을 반환합니다. 필요한 흡입 압력에 도달 할 때까지 프로브의 피펫에 링크 수조의 높이를 조정한다.
- 이러한 라인을 따라, 각 화소의 휘도 (계조 값)를 나타내는 창에 인접하는 곡선을 산출한다 RBC 에이펙스 걸쳐 수평 라인을 그린다. 곡선 (그림 2A, B)의 절반 정도 깊이로 임계 선을 끕니다.
주 : 임계 선 아래 명도 곡선상의 최소 포인트 비드 경계의 위치, 따라서 오직 하나의 로컬 최소 허용을 나타낸다. 두 개 또는 그 이상의 국부 최소값이 존재하는 경우에, 그것을이미지 (때문에 초점이되는 이미지 또는 프로브 비드와 RBC 사이의 가난한 정렬에 가능성이) 최적되지 않음을 나타냅니다. - 열 변동 분석, 접착 주파수 분석 또는 힘 클램프 분석 : 원하는 실험 모드를 선택합니다. (힘 클램프 분석을 위해 힘 = 20 PN을 (클램핑 예를 들어, 충돌의 힘 = 15 PN, 로딩 속도 = 1,000 PN / s의, 접촉 시간 = 1 초), 등) 원하는대로 매개 변수를 설정합니다.
- 프로브와의 접촉에서 (자세한 내용은 대표 결과 섹션 참조) 대상 피펫을 이동하고 목표를 구동 할 수있는 프로그램을 수 있습니다 "시작"을 클릭합니다. 데이터 수집은 실시간 비드 프로브의 위치를 기록 병렬로 수행 될 것이다. 윈도우가 수집 된 데이터를 저장 할 수 있도록 튀어되는 시간에 버튼을 "중지 실험"을 클릭하여 프로그램을 중지합니다.
7. 형광 BFP (fBFP) 실험
- fluore을 사용하려면BFP 시스템에서 scence 기능은 별도의 프로그램 (표 1)에 의해 제어되는 여기 광원 (표 1) 및 형광 카메라 (표 1)를 켜. 프로그램 등 이득, 노광, 여진 채널 (이 경우, 340 nm 내지 380 nm의 광)을 포함한 형광 이미징을위한 파라미터를 선택한다. 340 나노 미터 또는 380 nm의 여기 광에 의해 여기 표적 세포 라이브 형광 이미지의 시각화 수 프로브와 목표를 정렬을 포함하여 BFP 실험 프로토콜에 모든 준비를하십시오.
- 대략 섹션 영역이있는 내 세포가 전체 기록 기간 동안 남아있을 것입니다 위해 단면 도구를 사용합니다.
참고 : 인해 접근 접촉면 후퇴 사이클의 사용으로, 세포 따라서 단면 영역은 셀 자체보다 훨씬 크다 반복적으로 전후 이동 될 것이다. - 340 나노 수 있도록 "기록"을 클릭D 380 nm의 빛을 교대로 번갈아 한 번씩 초마다 기록됩니다 세포 내 형광 염료 (Fura2), 및 형광 이미지를 대응 쌍을 자극합니다. 동시에 분석 분자 상호 작용과 세포 내 칼슘 신호를 모니터링 할 수있는 형광 이미징 실험에 대한 BFP 실험을 시작하기 위해 프로그램에서 "시작"을 클릭합니다. 시스템이 결합 수용체 리간드에 대한 원시 데이터 파일 (아래도 6A 참조)과 칼슘 신호 .TIFF 형식 형광 이미지의 시리즈를 생성한다.
8. 데이터 분석
- BFP 데이터 분석
- 접착 주파수 분석을위한 데이터 분석
- 순차적으로 각주기의 '힘 대 시간 "신호를 검사하고 단순히 사이클하지 접착 이벤트를 포함하고있는 어떤 기록하고 평균 접착 주파수를 산출하기 요약.
- 각 접착 이벤트의 파열 력을 수집하는본드 파열 전에 경 사진 직선 힘의 피크 값이다. 램프 비율의 범위에서 파단 힘의 충분한 양을 수집 한 후, 강제 의존 오프 레이트 수용체 리간드 해리 동적 힘 스펙트럼 측정 18,31을 이용하여 유도되는 각각의 램프 속도에서의 파단 하중 분포를 도출.
- 열적 변동에 대한 분석 데이터 분석
- 순차적 가능성 다중 결합 협회와 해리 이벤트를 포함하는 각주기의 클램핑 위상 신호를 검사합니다. 결합 이후, 결합 연결 및 분리 이벤트를 구별하기 위해 참조 신호 "대 시간의 힘 '에 클램핑 위상 열적 변동 레벨 (비드 총수의 70 연속 시점의 슬라이딩 구간의 평균, 표준 편차)을 사용하여 형성은 열적 변동의 감소에 대응한다.
- THER 때 (결합 해리의 순간에서 간격을 지정말 변동은 대기 시간을 다음과 같은 결합 형성의 순간에) 정상 레벨로 다시 시작하고, 두 데이터 검사 중에 수집 결합 수명 등 해리의 연결에서 결합의 지속 기간을 나타낸다. 각각 제로 힘 16,30 하에서 속도의에 속도의 상호 및 그 반영하는 평균 대기 시간과 평균 채권 수명을 계산합니다.
- 클램프 력에 대한 분석 데이터 분석
- 한 누적 수명 곡선을 그릴 수 있도록 시퀀스 번호뿐만 아니라 시작 시간 및 종료 시간과 평균 힘과 결합 수명을 포함한 모든 수명 이벤트의 기록 파라미터들 (예를 들어,도 6C, 노란색 곡선).
- 힘의 범위 하에서 수명 이벤트의 충분한 양을 수집. 각각의 힘 빈의 평균 수명을 생산하고, 모두 "평균 수명 대를 얻을 것입니다 다른 힘 쓰레기통에 그룹을,. 힘 "곡선 (그림 4).
- 접착 주파수 분석을위한 데이터 분석
- 칼슘 형광 이미징 데이터 분석
- 형광 이미지는 배경 잡음없이 모두 340 nm 내지 380 nm의 채널에서 셀의 명확한 윤곽을 표시 할 때까지 강도 임계치를 조정한다 (도 5A, B). 그 후 340 ㎚ / 380 nm 인 강도 비에 기초하여 유도되는 강도 레벨 (도 6b)를 나타내는 의사 - 컬러 프레임 의한 세포 내 칼슘 신호 프레임을 검토 VS "정규화 칼슘 농도를 생성하도록 . 시간 "곡선 (그림 6C). 둘째로 형광 레벨 초 표시 동영상을 생성하기 위해 의사 - 컬러 형광 이미지를 사용한다.
결과
BFP 기술 1995 17 에반스 실험실에 의해 개척되었다.이 picoforce 도구는 광범위하게, 그들의 리간드 16,19,20과 상호 작용하는 부착 분자의 이차원 동력학을 분석하기 위하여, 표면에 고정화 된 단백질의 상호 작용을 측정하기 위해 사용 된 30, 분자 탄성 21,29을 측정하고, 단백질의 구조적 (21)을 변경 결정합니다. 대한 fBFP, 추가되는 해당 소프트웨어 시스?...
토론
성공적인 fBFP 실험은 몇 가지 중요한 고려 사항을 수반한다. 힘의 계산이 신뢰할 수있는 위해 첫째, 마이크로 피펫, RBC, 프로브 비드가 가능한 동축에 가깝게 정렬되어야합니다. RBC 및 피펫 사이의 마찰을 무시할 수 있도록 피펫 내부 RBC의 투영 약 1 프로브 피펫 직경이어야한다. 전형적인 사람 RBC 들어, 최적 피펫 직경 17,30 식 1의 최적을 산출 2.0-2.4 ㎛ 인 것이다. 둘째, 힘 클램프 분석 및 ?...
공개
The authors have nothing to disclose.
감사의 말
Research related to this paper and the development of the fBFP technology in the Zhu lab were supported by NIH grants AI044902, AI077343, AI038282, HL093723, HL091020, GM096187, and TW008753. We thank Evan Evans for inventing this empowering experimental tool, and members of the Evans lab, Andrew Leung, Koji Kinoshita, Wesley Wong, and Ken Halvorsen, for helping us to build the BFP. We also thank other Zhu lab members, Fang Kong, Chenghao Ge and Kaitao Li, for their helps in the instrumentation development.
자료
| Name | Company | Catalog Number | Comments |
| Sodium Phosphate Monobasic Monohydrate (NaH2PO4 • H2O) | Sigma-Aldrich | S9638 | Phosphate buffer preparation |
| Anhy. Sodium Phosphate Dibasic (Na2HPO4) | Sigma-Aldrich | S7907 | Phosphate buffer preparation |
| Sodium Carbonate (Na2CO3) | Sigma-Aldrich | S2127 | Carbonate/bicarbonate buffer preparation |
| Sodium Bicarbonate (NaHCO3) | Sigma-Aldrich | S5761 | Carbonate/bicarbonate buffer preparation |
| Sodium chloride (NaCl) | Sigma-Aldrich | S7653 | N2-5% buffer preparation |
| Potassium chloride (KCl) | Sigma-Aldrich | P9541 | N2-5% buffer preparation |
| Potassium phosphate monobasic (KH2PO4) | Sigma-Aldrich | P5655 | N2-5% buffer preparation |
| Sucrose | Sigma-Aldrich | S0389 | N2-5% buffer preparation |
| MAL-PEG3500-NHS | JenKem | A5002-1 | Bead functionalization |
| Biotin-PEG3500-NHS | JenKem | A5026-1 | RBC biotinylation |
| Nystatin | Sigma-Aldrich | N6261 | RBC osmolarity adjustment |
| Ammonium Hydroxide (NH4OH) | Sigma-Aldrich | A-6899 | Glass bead silanization |
| Methanol | BDH | 67-56-1 | Glass bead silanization |
| 30% Hydrogen Peroxide (H2O2) | J. T. Barker | Jan-86 | Glass bead silanization |
| Acetic Acid (Glacial) | Sigma-Aldrich | ARK2183 | Glass bead silanization |
| 3-Mercaptopropyltrimethoxysilane (MPTMS) | Uct Specialties, llc | 4420-74-0 | Glass bead functionalization |
| Borosilicate Glass beads | Distrilab Particle Technology | 9002 | Glass bead functionalization |
| Streptavidin−Maleimide | Sigma-Aldrich | S9415 | Glass bead functionalization |
| BSA | Sigma-Aldrich | A0336 | Ligand functionalizing |
| Fura2-AM | Life Technologies | F-1201 | Intracellular calcium fluorescence dye loading |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | D2650 | Intracellular calcium fluorescence dye loading |
| Quantibrite PE Beads | BD Biosciences | 340495 | Density quantification |
| Flow Cytometer | BD Biosciences | BD LSR II | Density quantification |
| Capillary Tube 0.7-1.0 mm x 30 inches | Kimble Chase | 46485-1 | Micropipette making |
| Flaming/Brown Micropipette Puller | sutter instrument | P-97 | Micropipette making |
| Pipette microforce | Narishige | MF-900 | Micropipette making |
| Mineral Oil | Fisher Scientific | BP2629-1 | Chamber assembly |
| Microscope Cover Glass | Fisher Scientific | 12-544-G | Chamber assembly |
| Micro-injector | World Precision Instruments | MF34G-5 | Chamber assembly |
| 1 ml syringe | BD | 309602 | chamber assembly |
| Micropipette holder | Narishige | HI-7 | Chamber assembly |
| Home-designed mechanical parts and adaptors fabrications using CNC machining. | Biophysics Instrument | All parts are customized according to the CAD designs. | BFP system |
| Microscope (TiE inverted) | Nikon | MEA53100 | BFP system |
| Objective CFI Plan Fluor 40x (NA 0.75, WD 0.72 mm, Spg) | Nikon | MRH00401 | BFP system |
| Camera, GE680, 640 x 480, GigE, 1/3" CCD, mono | Graftek Imaging | 02-2020C | BFP system |
| Prosilica GC1290 - ICX445, 1/3", C-Mount, 1280 x 960, Mono., CCD, 12 Bit ADC | Graftek Imaging | 02-2185A | BFP system |
| Manual submicron probehead with high resolution remote control | Karl Suss | PH400 | BFP system |
| Anti-vibration table (5’ x 3’) | TMC | 77049089 | BFP system |
| 3D manual translational stage | Newport | 462-XYZ-M | |
| SolidWorks 3D CAD software | SOLIDWORKS Corp. | Version 2012 SP5 | BFP system |
| LabVIEW software | National Instruments | Version 2009 | BFP system, BFP program |
| 3D piezo translational stage | Physik Instrumente | M-105.3P | BFP system |
| Linear piezo accuator | Physik Instrumente | P-753.1CD | BFP system |
| Micromanager software | Version 1.4 | fBFP system, fluorescence imaging program | |
| Dual Cam (DC-2) | Photometrics | 77054724 | fBFP system |
| Dual Cam emission filter (T565LPXR) | Photometrics | 77054725 | fBFP system |
| Fluorescence Camera | Hamamatsu | ORCA-R2 C10600-10B | fBFP system |
| Plastic paraffin film (Parafilm) | Bemis Company, Inc | PM996 | bottle sealing |
| Carbonate/bicarbonate buffer (pH 8.5) | 8.4 g/L sodium carbonate (Na2CO3), 10.6 g/L sodium bicarbonate (NaHCO3) | ||
| Phosphate buffer (pH 6.5-6.8) | 27.6 g/L NaPhosphate monobasic (NaH2PO4 • H2O), 28.4 g/L Anhy. NaPhosphate dibasic (Na2HPO4) | ||
| N2-5% buffer (pH 7.2) | 20.77 g/L potassium chloride (KCl), 2.38 g/L sodium chloride (NaCl), 0.13 g/L potassium phosphate monobasic (KH2PO4), 0.71 g/L anhy. sodium phosphate dibasic (Na2HPO4), 9.70 g/L sucrose |
참고문헌
- Aplin, A. E., Howe, A., Alahari, S. K., Juliano, R. L. Signal transduction and signal modulation by cell adhesion receptors: the role of integrins, cadherins, immunoglobulin-cell adhesion molecules, and selectins. Pharmacological reviews. 50, 197-263 (1998).
- Davis, M. M., Bjorkman, P. J. T-cell antigen receptor genes and T-cell recognition. Nature. 334, 395-402 (1988).
- Dado, D., Sagi, M., Levenberg, S., Zemel, A. Mechanical control of stem cell differentiation. Regenerative medicine. 7, 101-116 (2012).
- Edwards, L. J., Zarnitsyna, V. I., Hood, J. D., Evavold, B. D., Zhu, C. Insights into T cell recognition of antigen: significance of two-dimensional kinetic parameters. Frontiers in immunology. 3, 86 (2012).
- Zhu, C., Jiang, N., Huang, J., Zarnitsyna, V. I., Evavold, B. D. Insights from in situ analysis of TCR-pMHC recognition: response of an interaction network. Immunological reviews. 251, 49-64 (2013).
- Huang, J., Meyer, C., Zhu, C. T. T cell antigen recognition at the cell membrane. Molecular immunology. 52, 155-164 (2012).
- Zarnitsyna, V., Zhu, C. T. T cell triggering: insights from 2D kinetics analysis of molecular interactions. Physical biology. 9, 045005 (2012).
- Binnig, G., Quate, C. F., Gerber, C. Atomic Force Microscope. Physical Review Letters. 56, 930-933 (1986).
- Marshall, B. T., et al. Direct observation of catch bonds involving cell-adhesion molecules. Nature. 423, 190-193 (2003).
- Kong, F., Garcia, A. J., Mould, A. P., Humphries, M. J., Zhu, C. Demonstration of catch bonds between an integrin and its ligand. The Journal of cell biology. 185, 1275-1284 (2009).
- Yago, T., et al. Catch bonds govern adhesion through L-selectin at threshold shear. The Journal of cell biology. 166, 913-923 (2004).
- Yago, T., et al. Platelet glycoprotein Ibalpha forms catch bonds with human WT vWF but not with type 2B von Willebrand disease vWF. The Journal of clinical investigation. 118, 3195-3207 (2008).
- Chesla, S. E., Selvaraj, P., Zhu, C. Measuring two-dimensional receptor-ligand binding kinetics by micropipette. Biophysical journal. 75, 1553-1572 (1998).
- Huang, J., et al. The kinetics of two-dimensional TCR and pMHC interactions determine T-cell responsiveness. Nature. 464, 932-936 (2010).
- Heinrich, V., Wong, W. P., Halvorsen, K., Evans, E. Imaging biomolecular interactions by fast three-dimensional tracking of laser-confined carrier particles. Langmuir : the ACS journal of surfaces and colloids. 24, 1194-1203 (2008).
- Chen, W., Evans, E. A., McEver, R. P., Zhu, C. Monitoring receptor-ligand interactions between surfaces by thermal fluctuations. Biophysical journal. 94, 694-701 (2008).
- Evans, E., Ritchie, K., Merkel, R. Sensitive force technique to probe molecular adhesion and structural linkages at biological interfaces. Biophysical. 68, 2580-2587 (1995).
- Evans, E., Leung, A., Heinrich, V., Zhu, C. Mechanical switching and coupling between two dissociation pathways in a P-selectin adhesion bond. Proceedings of the National Academy of Sciences of the United States of America. 101, 11281-11286 (2004).
- Ju, L., Dong, J. -. f., Cruz, M. A., Zhu, C. The N-terminal Flanking Region of the A1 Domain Regulates the Force-dependent Binding of von Willebrand Factor to Platelet Glycoprotein Ib. Journal of Biological Chemistry. 288, (2013).
- Chen, W., Lou, J., Zhu, C. Forcing switch from short- to intermediate- and long-lived states of the alphaA domain generates LFA-1/ICAM-1 catch bonds. The Journal of biological chemistry. 285, 35967-35978 (2010).
- Chen, W., Lou, J., Evans, E. A., Zhu, C. Observing force-regulated conformational changes and ligand dissociation from a single integrin on cells. The Journal of cell biology. 199, 497-512 (2012).
- Judokusumo, E., Tabdanov, E., Kumari, S., Dustin, M. L., Kam, L. C. Mechanosensing in T lymphocyte activation. Biophysical journal. 102, L5-L7 (2012).
- Bashour, K. T., et al. CD28 and CD3 have complementary roles in T-cell traction forces. Proceedings of the National Academy of Sciences of the United States of America. 111, 2241-2246 (2014).
- Nesbitt, W. S., et al. Distinct glycoprotein Ib/V/IX and integrin alpha IIbbeta 3-dependent calcium signals cooperatively regulate platelet adhesion under flow. The Journal of biological chemistry. 277, 2965-2972 (2002).
- Mazzucato, M., Pradella, P., Cozzi, M. R., De Marco, L., Ruggeri, Z. M. Sequential cytoplasmic calcium signals in a 2-stage platelet activation process induced by the glycoprotein Ibalpha mechanoreceptor. Blood. 100, 2793-2800 (2002).
- Lefort, C. T., Ley, K. Neutrophil arrest by LFA-1 activation. Frontiers in immunology. 3, 157 (2012).
- Liu, B., Chen, W., Evavold, B. D., Zhu, C. Accumulation of dynamic catch bonds between TCR and agonist peptide-MHC triggers T cell signaling. Cell. 157, 357-368 (2014).
- Lou, J., et al. Flow-enhanced adhesion regulated by a selectin interdomain hinge. The Journal of cell biology. 174, 1107-1117 (2006).
- Fiore, V. F., Ju, L., Chen, Y., Zhu, C., Barker, T. H. Dynamic catch of a Thy-1-alpha5beta1+syndecan-4 trimolecular complex. Nature communications. 5, 4886 (2014).
- Chen, W., Zarnitsyna, V. I., Sarangapani, K. K., Huang, J., Zhu, C. Measuring Receptor-Ligand Binding Kinetics on Cell Surfaces: From Adhesion Frequency to Thermal Fluctuation Methods. Cellular and molecular bioengineering. 1, 276-288 (2008).
- Marshall, B. T., Sarangapani, K. K., Lou, J., McEver, R. P., Zhu, C. Force history dependence of receptor-ligand dissociation. Biophysical. 88, 1458-1466 (2005).
- Xiang, X., et al. Structural basis and kinetics of force-induced conformational changes of an alphaA domain-containing integrin. PloS one. 6, e27946 (2011).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유