Method Article
네이티브, 태그 Huntingtin Exon1 모노 머와 스모 융합 전략을 사용 하 여 소의 생성
요약
여기, 우리가 현재 네이티브, 태그 무료 단위체의 밀리 그램 수량과 작은 유비퀴틴 관련된 한정자 (스모) 과도 융합에 따라 Huntingtin 단백질 (Httex1)의 exon1의 소의 생산을 위한 강력 하 고 최적화 된 프로토콜.
초록
Huntington의 질병 (HD) CAG 확장 (≥36)에 의해 발생 하는 상속 된 치명적인 신경 질환 HD 유전자의 첫 번째 엑손에서 Huntingtin 단백질 (Htt) 식의 결과로 또는 N 맨끝 확장된 polyglutamine (그 조각 polyQ) 스트레칭입니다.
Huntingtin 단백질 (Httex1)의 exon1는 휴대에 HD의 기능의 대부분을 작은 Htt 조각 및 동물 모델 Htt의 가장 널리 공부 조각 중 하나입니다. Httex1의 작은 크기는 더 이상 조각 또는 전장 Htt에 비해 표준 및 고해상도 기술을 사용 하 여 생물 특성을 실험적으로 더 많은 의무가 있습니다. 그러나, 높은 집계의 성향을 돌연변이 Httex1 (mHttex1) 증가 polyQ 콘텐츠 (≥42)는 어렵게 효율적인 표현과 충분 한 수량에이 단백질을 생산 하 여 그들을 액세스할 수 있도록 정화 시스템 개발 융해 단백질 또는 단백질의 기본 순서를 변경 하는 다른 전략을 사용 하지 않고 다른 분야에서 과학자. 우리는 강력 하 고 최적화 된 방법을 여기 제시 밀리 그램 양의 네이티브의 생산에 대 한 태그-무료 작은 유비퀴틴 관련된 한정자 (스모) 과도 융합에 따라 Httex1. 단순 하 고 전략의 효율성 Httex1, 따라서이 단백질 더 연구자에 게 편리 하 고 다른 실험실에서 실험의 재현성을 향상의 기본이 아닌 시퀀스를 사용 하는 필요를 삭제할 것 이다. 우리는 이러한 발전 또한 Htt로 개발 새로운 진단 도구 및 치료 치료 또는 HD의 진행을 느리게의 구조-기능 관계를 elucidating 겨냥 하는 미래 학문을 촉진 믿습니다.
서문
Htt 348 kDa 단백질 이며 여러 가지 생리 기능1에 연루 되어 있다. Htt의 N-말단에 이상 36 잔류물의 확장된 polyQ 지역 포함, HD2,3발생 합니다. HD 병 리 세포 포함이 고 피 질 신경 죽음, 영향을 받는 조직4,5의 위축에 의해 특징입니다. PolyQ 반복 요로 포함 하는 여러 N 맨끝 Htt 조각 HD 환자에서 사후 두뇌에서 발견 된 고 huntingtin 단백질6의 분해 처리에 의해 생성 될 것으로 생각 되. 최근 연구 결과 Httex1를 벗어난 mRNA 접합에 의해 형성 될 또한 것이 좋습니다. Httex1 병 적인 polyQ 돌연변이 포함 하 고 동물에서의 overexpression HD7, 따라서 HD 병리학과 질병 진행6,이 조각의 가능한 중앙 역할을 강조의 핵심 기능 중 많은 정리 수 있습니다. 8,9.
때문에 높은 집계의 성향을 돌연변이 Httex1 (mHttex1) 확장된 polyQ로, 기존 식 시스템의 대부분은 단백질 Httex1의 과도 융합에 기반 (티-S-전이 효소 (GST), thioredoxin (TRX) 등 또는 맥 아당 의무적인 단백질 (MBP) 및 펩 티 드 (폴 리 히스티딘) 차동의 식, 안정성, 정화 및 용 해도10,,1112,13,14 개선 하는 ,15,16,17,18,19,20,,2122,23 ,,2425,26,,2728. 퓨전 파트너 프로 테아 제 트립 신 등의 분열 사이트를 포함 하는 짧은 시퀀스와 Httex1에 연결 되어, 담배 엣지 바이러스 (TEV) 효소 또는 분열 및 집계의 개시 전에 Httex1의 출시에 대 한 허용 하는 PreScission 또는 정화입니다. 비 traceless 분열으로 인해 추가 잔류물 및 불완전 쪼개 짐 (때문이 아니라 Httex1의 시퀀스 내에서 miscleavage로 잘린 조각의 창조의 가능성을 포함 하는 이러한 방법의 단점 Vieweg 외. 장점 및이 방법의 제한에 더 심층적인 토론 참조)10. 이러한 한계를 해결 하기 위해 우리는 최근 Synechocystis sp. 의 임시 N 맨끝 퓨전을 이용 하 여 처음으로 기본 태그 무료 Httex1의 생성을 활성화 하는 식 전략 개발 (Ssp) DnaB intein Httex110. Intein 분열 traceless 이며 특정 단백질의 밀리 그램 수량을 산출 하는 동안 그것은 여전히 수익률을 줄일 수 있는 두 가지 단점이 겪고 있다: 즉, 조 분열 식, 및 분열을 통해 나타나는 사실 중 발생할 수 있는 intein의 특히 반복 확장 된 polyQ와 Httex1에 대 한 집계 인 단백질의 손실로 이어질 수 있는 몇 시간.
이러한 한계를 해결 하 고 아메리카의 생산을 위한 우리의 전략을 수정 하기 위해 태그 무료 Httex1, 우리 시스템을 개발 새로운 식 스모, 더 정확 하 게는 효 모 체 Smt3 Httex1에 과도 융합에 따라. 재조합 단백질의 생산을 위한 스모 시스템의 응용 프로그램 200429, 식의 증가 속도 스모 융해 단백질의 용 해도 시연 했다에 처음 출판 되었다. 스모 태그 인식 사이트를 필요 하지 않습니다 하지만 스모의 3 차 구조를 인식 하 고 실질적으로 miscleavage30의 가능성을 제거 하는 단백질 특정 효소 1 (ULP1) 같은 유비퀴틴에 의해 죽 습 있을 수 있습니다. 또한, ULP1 중재 분열 및 traceless 이며 뒤에 추가 잔류물을 떠나지 않습니다. 퓨전 태그의 조 숙한 분열 autocatalytic intein10관찰은 완전히 피할 수는 외부 효소의 요구에 의해. 스모 전략은 재조합 단백질 생산31,,3233요즘 널리 이용 된다, 하는 동안 우리가 보여이 문서에는 본질적으로 무질서의 세대를 위해 특히 유용 하다 Httex1 같은 집계 경향이, amyloidogenic 단백질. 우리는 믿고 단순성, 효율성 및 우리의 스모 퓨전-기반 방법의 견고성은 네이티브, 태그 무료 Httex1 더 액세스할 수 있도록 연구를 다른 분야에서 생체 외에서 Httex1의 비고유 시퀀스를 사용 하는 필요를 제거 . 이것은 Httex1의 구조-기능 관계를 명료 하 게 하는 미래 연구를 촉진 하는 중요 한 사전 이다.
프로토콜 설명 세균성 문화의 12 L에서 Httex1의 정화 하지만 프로토콜 쉽게 작은 또는 큰 규모 프로덕션에 대 한 적응 될 수 있습니다. 프로토콜 (wtHttex1) 야생 타입 Httex1의 생산에 설명 합니다 (23Q) 아래 polyQ 반복 길이 및 돌연변이 Httex1 (mHttex1)는 polyQ로 (43Q) 위에 길이 병원 성 임계값 (36Q) 반복.
프로토콜
1. 표현의 재조합 Httex1 23Q 및 43Q
- 필요한 버퍼 및 솔루션을 준비 합니다. 1000 x 암 피 실린 (앰프, 100 mg/mL) 재고 솔루션, 필터 (0.2 µ m), aliquot-20 ° c.에가 게를 준비 Lysogeny 국물 (파운드) 매체를 준비 (25 g 파운드 당 1 L H2O 밀러), 오토 클레이 브. 1 M 이소프로필 ß-D-1thiogalactopyranoside (IPTG) 재고 솔루션, 필터 (0.2 µ m), 약 수와 저장소 준비-20 ° c.에
- 화학 유능한 대장균 B 열 충격 방법34태그로 N 맨끝 His6-스모를 융합 하는 인간의 Httex1를 포함 하는 pTWIN1 벡터와 응급실 2566 변환.
참고: 대장균 BL21 DE3 긴장은 또한 사용 되었습니다. 그러나,이 경우 잘림의 금액을 증가 관찰 되었다. - 1 파운드 매체의 200 mL를 접종 앰프 살 균 피 펫 팁 한 천 배지에서 단일 식민지를 추가 하 여 1 L 원뿔 플라스 크에 x. 30 ° C와 세균 인큐베이터에 20 h (하룻밤)에 대 한 180 rpm에서 문화를 품 어.
- 살 균 피 펫과 문화의 1 mL 샘플을 가져가 라. 600에서 광학 밀도 측정 일회용 플라스틱 베트와 광도 계 (측정 범위 0.1과 1, 파운드 매체와 희석 사이 필요한 경우 존중) 샘플의 nm (OD600). 3 L 문화에 0.05의 시작 OD600 귀 착될 것 이다 preculture의 양을 계산 (OD600 의 preculture = 3 50 mL를 의미할 것입니다).
- 4 문화 접종 (1 파운드 매체의 각 3 L 앰프 5 L 플라스 크에 x), 살 균 피 펫과 preculture의 계산된 금액을 추가 하 여. 37 ° C와 세균 인큐베이터에서 180 rpm에서 문화를 품 어.
- 모든 30 분 살 균 피 펫과 문화의 1 mL 샘플을 가져가 라. 일회용 플라스틱 베트와 photometer 샘플의 OD600 을 측정 합니다. OD600 에 도달 했습니다 (일반적으로 1-2 시간) 후 0.1 세균 인큐베이터의 온도 14 ° C를 설정 하 고 냉각 하는 동안 부 화를 계속 합니다. 모든 30 분 살 균 피 펫과 문화의 1 mL 샘플을 가져가 라. 일회용 플라스틱 베트와 photometer 샘플의 OD600 을 측정 합니다.
참고: 시간 문화를 달라질 수 있습니다 사용, 인큐베이터와 그래서 냉각을 시작 하는 시간 인큐베이터 사용의 유형에 따라 적응 해야 할 수도 있습니다. 그러나, 온도 기울기를 변경 해야만 영향을 미칠 작은 수익률에 스모 융해 단백질 꽤 안정적인 것으로 나타납니다. - OD600 (일반적으로 후에 1-2 h) 0.3-0.4을 도달 했습니다 때, 문화는 overexpression의 SDS 페이지 분석에 대 한 사전 유도 샘플. 셀의 대 등 한 금액을 제공 하는 샘플 크기를 계산 하 고 Coomassie에 좋은 신호 스테인드 SDS 페이지: 10 대 잘 젤: 볼륨 0.2 mL = /od600; 15 잘 젤에 대 한 절반을 가져가 라.
- OD600와 세균성 문화 = 0.4, 걸릴 500 µ L. 계산 된 양의 멸 균 피 펫과 세균성 문화를 가져가 라. 샘플 (g, 4 ° C, 2 분 x 18000) 아래로 회전 시키십시오 그리고 삭제는 상쾌한. 분석 (1.11 단계)를 사용할 준비가 될 때까지-20 ° C에서 펠 릿을 유지.
- 각 3 L 문화 솔루션을 1 M IPTG 재고 솔루션의 pipetting 1.2 mL에 의해 단백질 표정 유도 (최종 농도 0.4 m m). (하룻밤) 16 h 14 ° C에서 문화를 배양을 계속 한다.
참고: 온도 일반적으로 도달 했습니다 ~ 20 ° C 때 IPTG 인큐베이터의 성능에 따라 추가 됩니다. - 1.7 단계에 설명 된 절차를 따라 overexpression의 SDS 페이지 분석에 대 한 문화의 후 유도 샘플을 가져가 라.
- 1 L 튜브 (3993 x g, 4 ° C, 10 분)에서 원심 분리 하 여 세포를 수확. 삭제는 상쾌한, 얼음에 셀 펠 릿을 유지 하 고 정화에 직접 진행.
- SDS 페이지35,36는 overexpression 분석. 버퍼와 염료를 로드 x 2의 20 µ L 20 µ L에서 사전 및 사후 유도 샘플을 resuspend. 열 블록에서 95 ° C에서 5 분에 대 한 샘플이 열 하 고 로드 하는 동안 여전히 뜨거운 15% 젤에 20 µ L. V. 얼룩 젤 Coomassie와 제조 업체의 지침에 따라 염색 180에 90 분 젤을 실행 합니다. 그림 1C의 대표적인 결과 함께 결과 비교 합니다.
참고: 프로토콜 여기 중지 될 수 있습니다, 그리고 셀 펠 릿을 동결 하 고 몇 주 동안-80 ° C에서 저장 수 있습니다. 최적의 결과 얻으려면 신선한 세균성 펠 릿을 사용 하 고 동결을 방지 하는 것이 좋습니다. 동결-해 동 세포 세포의 용 해 및 Httex1의 저하가 발생할 수 있습니다. 이 단백질의 품질과 수확량은 줄어들 수 있습니다.
2. 세포 세포의 용 해 및 그의6의 정화-스모 Httex1 융합 단백질은 금속 친화성 크로마토그래피 (IMAC)에 의해 움직일 수
- 유리병에 버퍼 A의 2 리터를 준비 (50 mM Tris (hydroxymethyl)-aminomethan (트리 스), 500 m NaCl, 15mm 이미 m). 1 L의 버퍼 B (50 mM Tris, 500 mM NaCl, 500mm 이미 pH 7.4) 유리병에 준비 합니다. 용 해 소금, 후 10 N HCl로 pH를 조정 하 고 병 상단 필터 (0.65 μ m)와 신선한 병에 솔루션을 필터링 합니다. 1000 x phenylmethylsulfonyl 불 소 (PMSF, 0.3 M) 준비 솔루션, 100 µ L를-20 ° c.에 게 aliquot를 재고
참고: 프로토콜은 반전 단계 고성능 액체 크로마토그래피 (HPLC RP) 정화 및 8-9 h 이내 동결은 세균 펠 릿의 세포에서 모든 단계를 완료 수 있도록 설계 되었습니다. 제한 집계와 베이스, 일시 중지 없이 빠르게 작동 하 고 또는 얼음에 4 ° C에서 모든 단계를 수행 하는 것이 좋습니다. - 미리 냉장된 버퍼 A. 추가 버퍼에 세균성 펠 릿의 100 ml PMSF 재고 솔루션 및 프로 테아 제 억제제의 5 개의 정제 (최종 볼륨의 30 mL 당 1) 100 µ L을 추가 하 고 자기 저 어 바 교 반 및 wi 위아래로 pipetting으로 현 탁 액을 균질 목 살 균 10 mL 피 펫 (~ 30 분).
- 50 mL 일회용 플라스틱 튜브에 40 mL의 aliquots에 박테리아 정지를 나눕니다. 세포 세포의 용 해 (70% 진폭, 총 쥡니다 시간 5 분, 간격 30 s 쥡니다, 30 s 일시 중지)에 대 한 물/얼음 일괄 처리에서 각 약 수 sonicate
참고: 쥡니다 단계에서 샘플 열 하지 않습니다 중요 하다. 쥡니다 동안 열 분산을 개선 하기 위해 얼음 목욕 물 좀 추가 하는 것이 좋습니다. 쥡니다 절차는 다른 악기를 사용 하는 경우 적응 할 수도 있습니다. 프랑스 누르거나는 microfluidizer와 같은 다른 세포 방법 뿐만 아니라 작동 한다 및 샘플 및 단백질 집단의 난방을 피하기 위해 도움이 될 수도 있습니다. 이 소자 들은 우리의 실험실에서 사용할 수 있었던 고 우리가 우리의 쥡니다 프로토콜 함께 좋은 결과 얻은. - 나트륨 라우릴 황산 polyacrylamide 젤 전기 이동 법 (SDS 페이지) 분석에 대 한 lysate의 50 µ L의 샘플을 가져가 라. Centrifuge 샘플 (18000 x g, 4 ° C, 2 분) 하 고 새로운 테스트 튜브에 녹는 일부 플라스틱. 버퍼 A는 피 펫의 50 µ L에서 불용 성 부분을 resuspend. SDS 페이지 분석 (단계 2.6)까지 얼음에 샘플을 유지.
- 명확히는 lysate 원심 (39191 g, 4 ° C, 60 분).
- 원심 분리 단계에서 세포 세포의 용 해 단계 SDS 페이지를 분석 합니다. 각각은 lysate의 가용성과 불용 성 부분에 염료를 로드 x 2의 50 µ L를 추가 합니다. 95 ° C에서 5 분에 대 한 열 하 고 여전히 뜨거운 15% 젤에 2 µ L을 로드 합니다. V. 얼룩 젤 Coomassie와 제조 업체의 지침에 따라 염색 180에 90 분 젤을 실행 합니다. 그림 1C의 대표적인 결과 함께 결과 비교 합니다.
- 상쾌한 (0.45 μ m, 주사기 필터) 필터. SDS 페이지 분석 (단계 2.11)에 대 한 필터링 된 상쾌한의 20 µ L의 샘플을 가져가 라.
참고: 일반적으로 명시 하 고 필터링 된 상쾌한의 90 ~ 100 mL의 볼륨은 얻어진 다. 일반적으로, 3 주사기 필터는 충분 합니다. 여과 성가신 경우 원심 분리 속도 및/또는 시간을 증가 하려고 합니다. - 고정된 금속 친화성 크로마토그래피 (IMAC) 4 ° C37에서 빠른 성능 액체 착 색 인쇄기 (FPLC) 시스템에 의해 명백 하 게 박테리아 lysate에서 His6-스모 Httex1 융합 단백질을 분리.
- 명확히 작성 superloop 및 Ni NTA 열에 부하로 lysate (제거, 청소 하 고 제조업체의 설명서에 따라 다시 로드, 이전 빈 실행 권장) 세척을 10 mL/min에서 버퍼 A의 2 mL/분 통과 10 열 볼륨 (CV, 200ml) 언바운드 단백질 밖으로.
- 2.5 융해 단백질을 elute 차입에 대 한 로드 하 고 세척 50 mL와 5 mL의 분수 크기를 사용 하는 버퍼 B 2 mL/분의 100%의 이력서 (50 mL). 그림 1D의 대표적인 결과 함께 결과 비교 합니다.
- SDS 페이지 분석 (20 µ L)에 대 한 각 분수의 샘플을가지고 고 수영장 아이맥 크로마의 피크에 융해 단백질을 포함 하는 분수. (2S, 3S) 추가-1,4-Bis (sulfanyl) 부탄-2, 3-diol (DTT) 및 L-시스테인 (최종 농도 100 mM) 분말과 부드럽게 튜브를 거꾸로 하 여 디졸브로.
참고: 우리의 경험에서 다른 분수에 융해 단백질의 순도 비교. 조치로, 순화 된 융해 단백질의 분수 아이맥 농축된 분수의 집계를 방지 하기 위해 후 빠르게 풀링된 수 한다. 또한, 스모 태그와 HPLC 정화의 분열에 직접 진행 하는 것이 좋습니다. 필요한 경우 프로토콜 여기 중지 될 수 있습니다. 융해 단백질의 희석된 솔루션 액체 질소에서 냉동,-80 ° C에 저장 되었고 수율에 있는 뜻깊은 감소 없이 녹고 후 정화. 24 h 4 ° C에서 융해 단백질의 희석된 솔루션의 저장소는 또한 비슷한 결과 제공합니다. - SDS 페이지 아이맥을 분석 합니다. 각 샘플 염료 로드의 20 µ L를 추가 합니다. 조 재료 (2.7), 언바운드 분수, 세척 분수와 15% 젤에 차입 피크의 각 분수의 2 µ L을 로드 합니다. V. 얼룩 젤 Coomassie와 제조 업체의 지침에 따라 염색 180에 90 분 젤을 실행 합니다. 그림 1D의 대표적인 결과 함께 결과 비교 합니다.
3. 분열은 그의6-스모-태그와 HPLC 정화
주의: Trifluoroacetic 산 (TFA) 휘발성 액체 이며 원인 심각한 화상 그래서 주의 처리할 수 있습니다. 증기 두건에 모든 처리를 하 고 적절 한 개인 보호 장비 (즉일회용 nitrile 장갑, 안전 안경, 연구실 코트)를 착용.
- 5 L 병에서 물 (용 매 a: H2O, 0.1% (TFA) 5 l 플라스틱 주사기 TFA의 5 mL을 추가. 이기의 2.5 L 병에 플라스틱 주사기 TFA의 2.5 mL을 추가 (용 매 b: 이기, 0.1 %TFA).
- HPLC 시스템 제조 업체에 의해 제안으로 준비 합니다. 깨끗 한 열을 보장 하기 위해 빈 실행을 수행 합니다.
- UPLC (3.5 단계)에 의해 분열 반응을 모니터링 하는 ULP1의 추가 하기 전에 융해 단백질의 100 µ L의 샘플을 가져가 라.
- 새로운 50 mL 튜브에 융해 단백질의 20 mL를 전송 ULP1 재고 솔루션의 0.4 mL를 추가, 얼음에 품 어. 얼음에 남아 있는 융해 단백질을 유지.
참고: 태그 그의 촉매 조각 403-621 유비퀴틴 같은 특정 효소 1의 (여기 "ULP1" 라고도 함) 다니엘 스모 태그에 사용 되었다. 융해 단백질 쪼개진된 Httex1 보다 더 안정적입니다. 전체 일괄 처리의 스모 태그 다니엘을 하지는 것이 좋습니다. 대신, 바로 그리고 완전히 HPLC 열에 적용 수 있는 크기의 aliquots를 계속 합니다. - 10 분 마다 울트라 고성능 액체 크로마토그래피 (UPLC)에 의해 진행 상황을 모니터링 하는 분열 반응의 100 µ L의 샘플을 가져가 라. 원심 (18000 rpm, 4 ° C, 2 분) 샘플 및 2 µ L UPLC, 상쾌한의 분석 (그라데이션 10%에서 90%에서에서 용 매 B A 0.25 ~ 3 분을, 1 분, 10 %B 참조 악기 사용에 대 한 제조 업체의 지침). ULP1의 추가 하기 전에 샘플 및 샘플 후 얻은 chromatograms를 비교 합니다. 그림 2B대표 결과 함께 결과 비교 합니다.
- 스모-절단 완료 되 면 (융해 단백질의 피크 UPLC 크로마에 사라졌다 고 새로 나타나는 스모와 Httex1 피크로 완전히 변환 됩니다), 주사기 필터 (0.22 μ m)와 샘플을 필터링.
참고: 스모 분열은 일반적으로 매우 빠르다 (4 ° C에서 10-20 분) 따라서 UPLC 분석 실행 시간 4 분의 반응을 모니터링 하는 데 유용한 도구입니다. HPLC 전에 샘플 필터링 정화 열의 수명 증가를 주로 예방 조치입니다. 샘플 탁 설정 하지 해야 합니다. - RP HPLC에 의해 필터링 된 샘플 정화 (용 매 A, 15 mL/분에서 40 분 이상에서 25-35% 용 매 B의 그라데이션 (0-10 분: 5%; 25 10-12.5 분: 5%; 12.5-52.5 분: 25 35%, 52.5 57.5 분 35 ~ 95%; 악기 사용에 대 한 제조 업체의 설명서를 참조 하십시오). 그림 2C대표 결과 함께 결과 비교 합니다.
참고: Httex1와 그의6-스모 별도 RP HPLC에 의해 잘. 그러나, 시작 및 피크의 끝에서 잘린된 Httex1의 소량 수 있습니다. 순수한 물자의 최대 금액을 얻기 위해 작은 분수를 수집 합니다.
주의:를 사용 하 여 적절 한 안전 장비 (즉, 연구실 코트, 절연된 장갑, 얼굴 방패) 때 극저온 유체를 처리. - HPLC 분수 전기 살포 이온화 질량 분석으로 분석 (ESI-MS, autosampler, 10 µ L를 주입, 0.6 mL/min, 용 매를 흐름: 20% B a, 열, 악기 사용에 대 한 제조 업체의 지침을 참조)와 UPLC (그라데이션 10%에서 90% 용 매 B a에서 0.25 ~ 3 분, 1 분, 10 %B 참조 하십시오 악기 사용에 대 한 제조 업체의 지침). 50 mL 플라스틱 튜브에 유사한 순도 수영장, 액체 질소에서 동결 및 lyophilize. 무게 2 mL 플라스틱 튜브로 동결 건조 된 단백질을 전송 하 고-20 ° c.에 저장
- UPLC, ESI-MS와 SDS 페이지 순화 된 소재를 특징. 1.5 mL 튜브에 깔끔한 TFA의 8 µ L에 동결 건조 된 Httex1의 100 µ g을 녹이 고 닫힌된 테스트 튜브에 실 온에서 20 분 동안 품 어. 신중 하 게 질소 또는 아르곤의 스트림 연기 후드에서 TFA 증발. 샘플의 손실을 방지 하기 위해 질소/아르곤의 낮은 압력을 사용 합니다.
- UPLC에 의해 H2o. 분석 2 µ L의 100 µ L에 3.8 단계에서 ESI-MS에 의해 5 µ L 단백질 분해. 혼합 20 µ L 단백질 해결책의 염료를 로드 x 2의 20 µ L로.
- SDS 페이지 10 µ g 1 µ g의 금액을 분석 합니다. V. 얼룩 젤 Coomassie와 제조 업체의 지침에 따라 염색 180에 90 분 젤을 실행 합니다. 그림 2D대표 결과 함께 결과 비교 합니다.
4. 피 및 Httex1 단백질의 Resolubilization
주의: TFA는 휘발성 액체 이며 원인 심각한 화상 그래서 주의 처리할 수 있습니다. 증기 두건에 모든 처리를 하 고 적절 한 개인 보호 장비 (즉, 처분할 수 있는 니트 릴 장갑, 안전 안경 및 실험실 코트)를 착용.
- 10 mL 50 mL 튜브에 premixed 분말에서 Dulbecco의 버퍼링 하는 인산 염 (DPBS) (137 m m NaCl, 2.7 m m KCl, 10mm 나2HPO4, 2mm KH2포4, pH 7.4)을 준비 합니다. 각 사용 하기 전에 0.2 µ m 필터를 통해 DPBS 솔루션을 필터링 합니다.
- 1.5 mL 튜브에 깔끔한 TFA의 12 µ L에서 동결 건조 된 Httex1의 150 µ g을 녹이 고 닫힌된 테스트 튜브에 실 온에서 20 분 동안 품 어. 신중 하 게 질소 또는 아르곤의 스트림 연기 후드에서 TFA 증발. 샘플38의 손실을 방지 하기 위해 질소/아르곤의 낮은 압력을 사용 합니다.
참고: 일반적으로, 해산 하 고 단백질의 50 µ g 세분화 4 µ L TFA를 사용 합니다. 이 절차는 내부에 단백질의 영화를 만들 것입니다 테스트 튜브의 벽. 를 방지 하기 위해 다음 단계에서 Httex1의 즉각적인 집계 사전 냉각된 버퍼를 사용 하 고 얼음에 항상 단백질을 유지 하 고 높은 농도 방지. - 사전 냉각된 DPBS의 1 mL에 분해 단백질을 녹이 고 pH 7.2-7.4로 1 M NaOH 조정. 1.5 mL 플라스틱 튜브 (20000 x g, 4 ° C, 20 분)로 단백질 해결책 100 kDa 원심 필터를 통해 필터링.
참고: Httex1의 계산된 이론 농도 손실 가능성에 대 한 계정에 원하는 최종 농도 보다 높은 수준 이다. 여과 단계는 단백질의 해체 동안 형성 수 있습니다 모든 집계를 제거 하는 데 필요한. - 아미노산 분석 (λ214에서 검출)에 따라 UPLC 보정 곡선을 사용 하 여 Httex1의 농도 결정 하 고 2 µ g 단백질의 아미노산 분석 농도10을 확인을 보낼. 3 µ M의 농도를 추가 하는 DPBS의 양을 계산 Httex1.
- 3 µ m 단백질 테스트 튜브에 DPBS의 계산된 금액을 추가 하 여 희석. 집계 프로토콜의 개시까지 얼음에 튜브를 유지.
참고: Httex1 43Q 솔루션에 저장 되지 합니다. 항상 신선한 단백질 솔루션 위의 프로토콜에 따라 준비 합니다. Httex1 단백질-20 ° c.에 동결 건조 된 분말으로 잘 저장 된다
5. 감시는 집계 활동의 Httex1 43Q UPLC 원형이 색 성 (CD) 분광학 및 전송 전자 현미경 (TEM)에 의해 집계의 특성을 사용 하 여의
- 이전에 보고 된39편 uranyl 편대 솔루션을 준비 합니다.
- Httex1의 집계 시작 37 ° C (피의 프로토콜에서 위에서 설명한 대로 준비 하는 솔루션의 1 mL 사용)에서 DPBS에서 3 µ M 솔루션을 배양 하 여 43Q.
참고: Httex1의 집계 요구와 실험의 목적에 따라 더 높은 농도에서 수행할 수 있습니다. - UPLC를 사용 하 여 표시 시간 점 (0, 1, 2, 4, 6, 8, 12, 24, 48 및 120 h)에 수용 성 단백질의 양을 계량. 그렇게 하려면, 35 µ L의 약 수를 받아 하 고 원심 (20000 x g, 4 ° C, 20 분)에 의해 불용 성 집계를 제거 합니다. UPLC에는 상쾌한의 4 µ L를 삽입할. 악기 소프트웨어 40을 사용 하 여 피크 면적의 변화에 따라 녹는 단위체의 비율을 계산 합니다. 그림 3A에 대표 결과 함께 결과 비교 합니다.
- 0에서 48 h에 CD 분광학을 사용 하 여 이차 구조에 변화를 특징. 100 µ L의 약 수를가지고 고는 타원 측정 (1 m m 쿼 츠 베트, 195 nm 250 nm, 20 ° C, 데이터 포인트 마다 0.2 nm, 속도 10 nm/min, 디지털 통합 시간 2 s, 1.0의 대역폭 nm). 샘플의 평균 6 스펙트럼을 취득 하 고 회선 폭 99의 이항 필터를 사용 하 여 부드러운. 평균 물질 어 금 니 타원 (θMRE)41로 스펙트럼을 플롯 합니다. 그림 3B대표 결과 함께 결과 비교 합니다.
- 가장 하 여 집계의 구조 및 형태학 속성 특징. Formvar/탄소 코팅 200 메쉬, 글로우 방전 구리 격자 1 분 씻어 0.7% (w/v) uranyl 편대와 30에 대 한 얼룩의 15 μ를 한번 15 μ 물으로 두 번 격자에 대 한에 단백질 해결책의 3 µ L를 넣어 0.7 %w / v uranyl 편대의 15 μ s. 격자의 TEM 분석을 수행 합니다. 그림 3C대표 결과 함께 결과 비교 합니다.
결과
Httex1는 N 맨끝으로 대장균 에 표현 된다 그의6-스모 태그. 표현과 융해 단백질의 정화의 대표적인 결과 그림 1에서 요약 된다. Httex1 시퀀스 Htt와 Ala2, 시작의 잔류물 2-90 Met1 있기 때문에 완전히 쪼개진 vivo에서42로 구성 됩니다. 23Q 변종 가리킵니다 아미노산의 번호 매기기, 표현된 융해 단백질의 완전 한 순서 그림 1에 표시 됩니다. 플라스 미드는 지역 사회와 공유 하는 가까운 장래에 Addgene에서 예금 될 것 이다. 플라스 미드와 표현된 융해 단백질의 회로도 그림 1B에 표시 됩니다. 융해 단백질의 대부분은 세포의 용 해, 모두는 23Q 및 43Q 변종에 대 한 후 성 분수에 및 His6-스모 Httex1 중간 수준 (그림 1C)에서 표현. 융해 단백질은 분자량에 따라 예상 보다 높은 마이그레이션합니다. 이것은 부분적으로 스모의 강한 배 주로 글루타민, 프롤린 잔류물을 포함 하는 Httex1의 특이 한 시퀀스 구성 때문입니다. Wildtype (23Q)와 돌연변이 (43Q) 융합 단백질 아이맥 (그림 1D) 공동 호스트 단백질 정화의 존재는 Httex1와 큰 샘플의 비교적 낮은 식 수준에 의해 설명 될 수 있다 하 여 ~ 80% 순도 농축 수 볼륨에는 열에 적용입니다.
그의 분열6-스모 태그와 Httex1의 정화 그림 2A에 표시 됩니다. UPLC는 그의 분열을 모니터링 하는 효율적인 도구입니다6-스모 태그 (그림 2B). 융해 단백질의 원래 피크 소비와 두 개의 새롭고 잘 분리 된 봉우리는 그에 해당6-스모 태그와 Httex1 나타납니다. 분열 반응 10-20 분에 완료 됩니다. 서쪽 오 점 (WB) 분열 반응을 효율적으로 모니터링 하는 데 너무 느립니다 하지만 참조용 스모 분열의 완전성을 설명 하기 위해 그림에 포함 되었습니다. 두 Httex1 23Q와 43Q는 그의에서 잘 분리 될 수 있다6-스모 라인란트-HPLC (그림 2C) 하 여 태그와 UPLC, MS 및 SDS 페이지 분석 (그림 2D)와 같이 고 순도에서 얻어 졌다.
이 방법으로 준비 하는 Httex1 단백질 Httex1의 예상된 집계 속성을 유지, 우리는 침 강 분석 결과 의해 37 ° C에서 Httex1 돌연변이의 fibrillization 활동 평가 설명 하기 위해 CD에 의해 이차 구조에 변화를 모니터링 분광학, 편으로 집계의 형태 특징. MHttex1 fibril 형성 침전 분석 결과 의해 결정 된 대로의 집계 활동의 대표적인 데이터 집합그림 3A에 표시 됩니다. 수용 성 Httex1 fibril 형성으로 인해 시간이 지남에 따라 43Q UPLC 여 계량 했다의 손실. 우리 보육의 48 시간 후 수용 성 단백질의 완전 한 고갈을 관찰합니다. 또한, 우리는 CD 분광학 (그림 3B)에 의해 단백질의 이차 구조를 결정. Httex1 43Q 교대에서 구조화 되지 않은 (λ분 205 nm) 주로 β 시트 풍부한 구조 (λ분 215 nm) 외피의 48 시간 후에. 이 구조적인 변화는 48 시간 (그림 3C)에서 가장에 의해 관찰로 긴 원 집계의 형성으로 동반 된다.
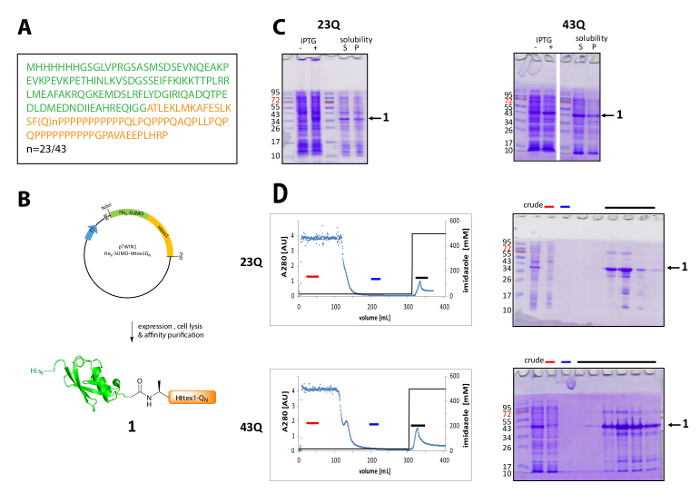
그림 1 . 식과 정화는 그의6-스모 Httex1 융합 단백질.
(A)는 그의 아미노산 시퀀스6-스모-Httex1-QN 퓨전 구문 (그의6-스모 녹색에서 및 주황색에서 Httex1 QN ); (B) 표현과; 융해 단백질의 정화의 도식 개요 (C) 식과 세포; 후 융합 단백질의 용 해도의 SDS 페이지 분석 융해 단백질의 아이맥 정화 및 SDS 페이지 분수의 분석 (D) 크로마 (빨간 바: 언바운드 분수, 블루 바: 세척 분수, 검은 바: 분수 차입 피크 포함 된); 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2 . 그의 분열6 스모 태그 및 태그 무료 Httex1 QN 단백질의 정화.
(A) 회로도 개요; UPLC에 의해 ULP1와 스모 태그의 분열의 (B) 분석 (파란색: ULP1;의 추가 하기 전에 블랙: 20 분 (23Q), 각각 10 분 (43Q) ULP1의 추가 후에) 및 WB (MAB5492 1: 2000, 보조 염소 안티 마우스 항 체 1: 5000); Httex1;의 대리점 RP HPLC 정화의 (C) 크로마 D: UPLC에 의해 순화 Httex1의 분석 SDS 페이지와 ESI-MS; 예상된 분자량 각각 9943 다 (23Q)와 12506 다 (43Q) 이다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
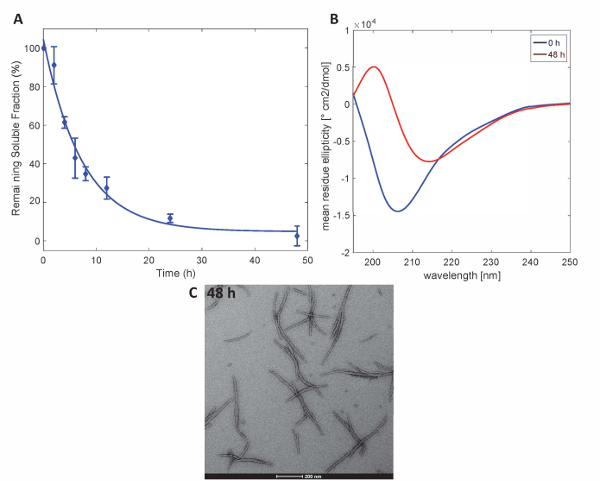
그림 3 . Httex1-43Q의 집계: UPLC에 따라 (A) 침전 분석 결과. (B)와 48 h에 집계의 48 h. (C) 가장 현미경에서 이차 구조의 CD 스펙트럼 (스케일 바는 200 nm). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 프로토콜에서 우리가 설명한 효율적인 절차를 얻는 밀리 그램 양의 네이티브, 없는 Httex1에 대 한 23 또는 43 글루타민 잔류물을 포함 하. 이 Httex1는 그의 C-터미널 융합으로 표현 하 여 달성 되었다6-아이맥 세포 lysate에서 융해 단백질을 사용 하 고 Httex1의 HPLC 정화 전에 죽 습 스모 태그. 스모 전략 다른 여러 가지 단백질의 생산에 사용 되었습니다, 우리의 방법이 보여준다는 스모 본질적으로 생성 하는 데 사용 또한 수 있는 독특한 속성 무질서, 집계 경향이 이전 되 고 입증 하는 amyloidogenic 단백질 43,44를 생산 하 고 처리 하기 매우 어려운. 선물이 프로토콜 "품행" 단백질의 생성에 대 한 간단 하 고, 사용 하기 쉬운 프로토콜 비교입니다. 스모 퓨전 solubilizes 고 표현과 아이맥 정화 단계 동안 Httex1를 안정 시킨다. 태그 집계 intein 전략10 와 관찰의 조 숙한 분열은 더 이상 문제가.
본질적으로 무질서 단백질은 특히 저하에 취약. N 맨끝 저하 N17 지역에서이 프로토콜을 사용 하 여 문제가 되지 않습니다, 하는 동안 Httex1의 PRD에 잘림 발생할 수 있습니다. 잘린된 단백질은 hydrophobicity, 크기 및 Httex1에 매우 비슷합니다, 크로마 방법으로 그들을 제거 하는 것은 도전적 이다, 따라서 그것은 첫번째 장소에 있는 그들의 대형을 방지 하기 위해 좋은. 프로토콜에 밀접 하 게 튀어나와, 얼음에 항상 노력 하 고 충분 한 양의 protease 억제제를 사용 하 여 데 도움이 됩니다 관찰된 자르기의 수준을 매우 낮게 유지. Httex1의 C-말단에 융합 태그 적용 제거할 수 잘림 PRD에 쉽게 잘린된 단백질 뿐만 아니라 선호도 태그를 잃을 것 이다. 그러나, 기본 시퀀스 Httex1 프롤린과 우리의 지식 최선을 끝나는 대로이 옵션을 적용할 수 없습니다 유지 하는 경우 프롤린 후 traceless 고 효율적인 분열을 유도 하는 것으로 알려져 있습니다 C 터미널 퓨전 태그가 없습니다 있다.
프로토콜의 가장 중요 한 부분은 스모 태그의 분열 후 ULP1에 의해 해방 하는 Httex1의 처리입니다. 단백질은 RP HPLC에 의해 즉시 정화 한다. 다행히, 이것은 일반적으로 4 ° c.에 10-20 분에 완료 되는 효율적이 고 빠른 반응 대조적으로, intein 전략 수익률을 극대화 하기 위해 절충 한 불완전 한 분열 및 시작 집계 백업은 intein의 완전 한 분열에 대 한 몇 시간을 필요 합니다. 빠른 검사 결과 돌연변이 Httex1를 위한 시작 됩니다 23Q 이체는 긴 시간에 대 한 안정적인 반면 분열 반응에 비교적 높은 농도에서 집계. RP HPLC 정화 중 스모의 또 다른 장점은 드러납니다: 스모 더 친수성 이며 C4 반전 단계 열에서 완전히 elutes Ssp DnaB intein 소수는 열에 강하게 집착 하는 동안. 상업적인 ULP1는 매우 비용이 많이 드는, 단백질 고수익 이전 게시 프로토콜29다음에 쉽게 생산 수 있습니다.
Httex1를 사용 하 여 이전 피의 프로토콜 적용의 중요 수 없습니다 충분히 강조. Httex1 같은 동결 건조 된 polyQ 단백질 안정 및 저장된 오랜 기간 수 있지만 물과 버퍼에 완전히 용 해 되지 않습니다. 미리 형성한 올리고 또는 소의 존재는 집계 속도 론 및 단백질45의 생물 속성에 큰 영향을 있을 수 있었다. 여기에 설명 된 피의 프로토콜 단백질의 피의 미리 형성한 집계의 제거 및 동결 건조 된 샘플에서 단위체 Httex1의 솔루션의 수 있습니다. Httex1로 얻은 스모 및 intein 전략에 대 한 비슷한 집계 속도 론 및 fibril 형태학을 관찰 합니다.
Httex1 생산을 위한 이전 방법에 비해, 여기에 설명 된 스모 전략 몇 가지 장점이 하 고 구조를 조사 하기 위해 가능한 연구의 범위와 건강 및 질병에이 단백질의 기능적 속성을 확장 합니다. 스모-Httex1 융합 단백질은 취급 하기 쉽다, 그것 수 있습니다 동결 및 저장 하거나 무료 mHttex1 것이 신속 하 게 집계 하는 동안 상 온에서 24 h에 대 한 솔루션에 유지. 안정성과 스모 Httex1 융합 단백질의 높은 가용성 단백질을 조작할 수 없는 가능한 분열 후 mHttex1으로 효소와 화학 수정 소개 하 더 큰 유연성을 제공 합니다. 이 소개를 포함 한다 포스트 번역 상 수정, fluorophores, 스핀 레이블, biotin 태그, 등 여기에 제시 된 발전 한다 1) Httex1;의 구조-기능 관계를 명료 하 게 미래 연구를 용이 하 게 2) 생성 하는 새로운 도구를 조사 Htt 집계 및 병리학 확산; 3) 활성화 돌연변이 Httex1 안정 하 고 그 집계;를 방지 하는 분자를 식별 하는 새로운 분석 실험의 개발 그리고 4)이이 단백질에 작동 하 고 치료약을 찾기 위해 Huntington의 질병에 대 한 우리의 모험을 가입 하 려 다른 분야에서 과학자.
공개
저자 들은이 문서의 내용으로 관심 없음 충돌 선언 합니다.
감사의 말
이 작품은 CHDI 재단과 스위스 국립 과학 재단에서 교부 금에 의해 주로 투자 되었다. 우리 감사 합니다 박사 소피 Vieweg 유용한 토론에 대 한이 새로운 식 시스템의 개발 및 Lashuel 그룹의 다른 구성원 중이 식 시스템으로 그들의 경험을 공유 하기 위한 그들의 입력 및 귀중 한 피드백. 우리는 또한 ULP1 플라스 미드를 제공 하기 위한 교수 올리버 Hantschel 감사 합니다. 저자 박사 존 B. 워너와 박사 Senthil K. Thangaraj 원고의 중요 한 검토에 대 한 감사
자료
| Name | Company | Catalog Number | Comments |
| Uranyl formate (UO2(CHO2)2) | EMS | 22450 | |
| Formvar/carbon 200 mesh, Cu 50 grids | EMS | FCF200-Cu-50 | |
| High Precision Cell made of Quartz SUPRASIL 1 mm light path from Hellma Analytics | HellmaAnalytics | 110-1-40 | |
| Buffer Substance Dulbecco's (PBS w/o Ca and Mg) ancinne ref 47302 (RT) SERVA | Witech | SVA4730203 | |
| Ampicillin | AxonLab | A0839.0100 | |
| Luria Broth (Miller's LB Broth) | Chemie Brunschwig | 1551.05 | |
| Isopropyl β-D-1-thiogalactopyranoside (IPTG) | AxonLab | A1008.0025 | |
| E. coli B ER2566 | NEB | NEB# E4130 | |
| Imidazole | Sigma | 56750-500G | |
| cOmplete Protease Inhibitor Cocktail | Roche | 4693116001 | |
| Anti-Huntingtin Antibody, a.a. 1-82 | Merck Millipore Corporation | MAB5492 | |
| IRDye 680RD Goat anti-Mouse IgG (H + L) | Licor | 925-68070 | |
| PMSF | AxonLab | A0999.0005 | |
| HisPrep 16/10 column | GE Healthcare | 28936551 | |
| C4 HPLC column | Phenomenex | 00G-4168.P0 | 10 µm C4 300 Å, LC Column 250 x 21.2 mm, Phenomenex, 19x10 mm guard column, not temperature jacketed |
| Acetonitrile HPLC | MachereyNagel | C2502 | |
| Filtre seringue Filtropur S 0,45 ul sans prefiltre sterile | Sarstedt AG | 83.1826 | |
| Spectrophotometer semi-micro cuvette | Reactolab S.A. | 2534 | |
| Superloop, 1/16" fittings (ÄKTAdesign), 50 ml | GE Healthcare | 18111382 | |
| Trifluoroacetic acid | Sigma | 302031 | |
| GREINER Tubes fo FPLC 16 x 100 mm, cap. 12.0 ml | Greiner Bio-One | 7.160 102 | |
| 100 kD Microcon fast flow filters | Merck Millipore Corporation | MRCF0R100 | |
| Vibra-cell VCX130 ultrasonic liquid processor | Sonics | ||
| Äkta 900 equipped with a fraction collector | GE Healthcare | ||
| Jasco J-815 Circular Dichroism | Jasco | ||
| Waters UPLC system | Waters | C8 BEH acquity 2.1x100 mm 1.7 micron column , preheated column (40 °C), flow rate of 0.6 mL/min, injection volume of 4 μL | |
| waters HPLC system | Waters | 2489 UV detector and 2535 quaternary gradient module, 20 mL loop in a FlexInject housing | |
| ESI-MS: Finnigan LTQ | Thermo Fisher Scientific | ||
| lyophylizer instrument | FreeZone 2.5 Plus | ||
| Tecnai Spirit BioTWIN | FEI | electron microscope equipped with a LaB6 gun and a 4K x 4K FEI Eagle CCD camera (FEI) and operated at 80 kV | |
| 37 °C shaking incubator | Infors HT multitron Standard | ||
| Biophotometer plus | Eppendorf |
참고문헌
- Saudou, F., Humbert, S. The Biology of Huntingtin. Neuron. 89 (5), 910-926 (2016).
- MacDonald, M. E., Gines, S., Gusella, J. F., Wheeler, V. C. Huntington's disease. Neuromolecular Medicine. 4 (1-2), 7-20 (2003).
- Li, S., Li, X. J. Multiple pathways contribute to the pathogenesis of Huntington disease. Molecular Neurodegeneration. 1, 19 (2006).
- DiFiglia, M. Aggregation of Huntingtin in Neuronal Intranuclear Inclusions and Dystrophic Neurites in Brain. Science. 277 (5334), 1990-1993 (1997).
- Atwal, R. S., et al. Huntingtin has a membrane association signal that can modulate huntingtin aggregation, nuclear entry and toxicity. Human Molecular Genetics. 16 (21), 2600-2615 (2007).
- Sathasivam, K., et al. Aberrant splicing of HTT generates the pathogenic exon 1 protein in Huntington disease. Proceedings of the National Academy of Sciences U S A. 110 (6), 2366-2370 (2013).
- Mangiarini, L., et al. Exon 1 of the HD gene with an expanded CAG repeat is sufficient to cause a progressive neurological phenotype in transgenic mice. Cell. 87 (3), 493-506 (1996).
- El-Daher, M. T., et al. Huntingtin proteolysis releases non-polyQ fragments that cause toxicity through dynamin 1 dysregulation. EMBO Journal. 34 (17), 2255-2271 (2015).
- Lunkes, A., et al. Proteases acting on mutant Huntingtin generate cleaved products that differentially build up cytoplasmic and nuclear inclusions. Molecular Cell. 10 (2), 259-269 (2002).
- Vieweg, S., Ansaloni, A., Wang, Z. M., Warner, J. B., Lashuel, H. A. An Intein-based Strategy for the Production of Tag-free Huntingtin Exon 1 Proteins Enables New Insights into the Polyglutamine Dependence of Httex1 Aggregation and Fibril Formation. Journal of Biological Chemistry. 291 (23), 12074-12086 (2016).
- Georgalis, Y., et al. Huntingtin aggregation monitored by dynamic light scattering. Proceedings of the National Academy of Sciences U S A. 95 (11), 6118-6121 (1998).
- Scherzinger, E., et al. Huntingtin-encoded polyglutamine expansions form amyloid-like protein aggregates in vitro and in vivo. Cell. 90 (3), 549-558 (1997).
- Scherzinger, E., et al. Self-assembly of polyglutamine-containing huntingtin fragments into amyloid-like fibrils: implications for Huntington's disease pathology. Proceedings of the National Academy of Sciences U S A. 96 (8), 4604-4609 (1999).
- Muchowski, P. J., et al. Hsp70 and hsp40 chaperones can inhibit self-assembly of polyglutamine proteins into amyloid-like fibrils. Proceedings of the National Academy of Sciences U S A. 97 (14), 7841-7846 (2000).
- Heiser, V., et al. Inhibition of huntingtin fibrillogenesis by specific antibodies and small molecules: implications for Huntington's disease therapy. Proceedings of the National Academy of Sciences U S A. 97 (12), 6739-6744 (2000).
- Bennett, E. J., Bence, N. F., Jayakumar, R., Kopito, R. R. Global impairment of the ubiquitin-proteasome system by nuclear or cytoplasmic protein aggregates precedes inclusion body formation. Molecular Cell. 17 (3), 351-365 (2005).
- Tam, S., et al. The chaperonin TRiC blocks a huntingtin sequence element that promotes the conformational switch to aggregation. Nature Structural & Molecular Biology. 16 (12), 1279-1285 (2009).
- Nekooki-Machida, Y., et al. Distinct conformations of in vitro and in vivo amyloids of huntingtin-exon1 show different cytotoxicity. Proceedings of the National Academy of Sciences U S A. 106 (24), 9679-9684 (2009).
- Wacker, J. L., Zareie, M. H., Fong, H., Sarikaya, M., Muchowski, P. J. Hsp70 and Hsp40 attenuate formation of spherical and annular polyglutamine oligomers by partitioning monomer. Nature Structural & Molecular Biology. 11 (12), 1215-1222 (2004).
- Legleiter, J., et al. Monoclonal antibodies recognize distinct conformational epitopes formed by polyglutamine in a mutant huntingtin fragment. Journal of Biological Chemistry. 284 (32), 21647-21658 (2009).
- Legleiter, J., et al. Mutant huntingtin fragments form oligomers in a polyglutamine length-dependent manner in vitro and in vivo. Journal of Biological Chemistry. 285 (19), 14777-14790 (2010).
- Nucifora, L. G., et al. Identification of novel potentially toxic oligomers formed in vitro. from mammalian-derived expanded huntingtin exon-1 protein. Journal of Biological Chemistry. 287 (19), 16017-16028 (2012).
- Dahlgren, P. R., et al. Atomic force microscopy analysis of the Huntington protein nanofibril formation. Nanomedicine. 1 (1), 52-57 (2005).
- Poirier, M. A., et al. Huntingtin spheroids and protofibrils as precursors in polyglutamine fibrilization. Journal of Biological Chemistry. 277 (43), 41032-41037 (2002).
- Duim, W. C., Chen, B., Frydman, J., Moerner, W. E. Sub-diffraction imaging of huntingtin protein aggregates by fluorescence blink-microscopy and atomic force microscopy. Chemphyschem. 12 (13), 2387-2390 (2011).
- Pieri, L., Madiona, K., Bousset, L., Melki, R. Fibrillar alpha-synuclein and huntingtin exon 1 assemblies are toxic to the cells. Biophysical Journal. 102 (12), 2894-2905 (2012).
- Monsellier, E., Redeker, V., Ruiz-Arlandis, G., Bousset, L., Melki, R. Molecular interaction between the chaperone Hsc70 and the N-terminal flank of huntingtin exon 1 modulates aggregation. Journal of Biological Chemistry. 290 (5), 2560-2576 (2015).
- Isas, J. M., Langen, R., Siemer, A. B. Solid-State Nuclear Magnetic Resonance on the Static and Dynamic Domains of Huntingtin Exon-1 Fibrils. Biochemistry. 54 (25), 3942-3949 (2015).
- Malakhov, M. P., et al. SUMO fusions and SUMO-specific protease for efficient expression and purification of proteins. Journal of Structural Function Genomics. 5 (1-2), 75-86 (2004).
- Mossessova, E., Lima, C. D. Ulp1-SUMO crystal structure and genetic analysis reveal conserved interactions and a regulatory element essential for cell growth in yeast. Molecular Cell. 5 (5), 865-876 (2000).
- Kumari, S., Pal, R. K., Gupta, R., Goel, M. High Resolution X-ray Diffraction Dataset for Bacillus licheniformis Gamma Glutamyl Transpeptidase-acivicin complex: SUMO-Tag Renders High Expression and Solubility. Protein Journakl. 36 (1), 7-16 (2017).
- Zhang, J., Sun, A., Dong, Y., Wei, D. Recombinant Production and Characterization of SAC, the Core Domain of Par-4, by SUMO Fusion System. Applied Biochemistry and Biotechnology. , (2017).
- Reif, A., et al. Semisynthesis of biologically active glycoforms of the human cytokine interleukin 6. Angewandte Chemie International Edition English. 53 (45), 12125-12131 (2014).
- Froger, A., Hall, J. E. Transformation of plasmid DNA into E. coli using the heat shock method. Journal of Visualized Experiments. (6), 253 (2007).
- Smith, B. J. SDS Polyacrylamide Gel Electrophoresis of Proteins. Methods in Molecular Biology. 1, 41-55 (1984).
- Lawrence, A. M., Besir, H. U. Staining of proteins in gels with Coomassie G-250 without organic solvent and acetic acid. Journal of Visualized Experiments. (30), (2009).
- Block, H., et al. Immobilized-metal affinity chromatography (IMAC): a review. Methods in Enzymology. 463, 439-473 (2009).
- Chen, S. M., Wetzel, R. Solubilization and disaggregation of polyglutamine peptides. Protein Science. 10 (4), 887-891 (2001).
- Booth, D. S., Avila-Sakar, A., Cheng, Y. Visualizing proteins and macromolecular complexes by negative stain EM: from grid preparation to image acquisition. Journal of Visualized Experiments. (58), (2011).
- O'Nuallain, B., et al. Kinetics and thermodynamics of amyloid assembly using a high-performance liquid chromatography-based sedimentation assay. Amyloid, Prions, and Other Protein Aggregates, Pt C. 413, 34-74 (2006).
- Greenfield, N. J. Analysis of circular dichroism data. Methods in Enzymology. 383, 282-317 (2004).
- Aiken, C. T., et al. Phosphorylation of threonine 3: implications for Huntingtin aggregation and neurotoxicity. Journal of Biological Chemistry. 284 (43), 29427-29436 (2009).
- Satakarni, M., Curtis, R. Production of recombinant peptides as fusions with SUMO. Protein Expression and Purification. 78 (2), 113-119 (2011).
- Davies, H. A., Wilkinson, M. C., Gibson, R. P., Middleton, D. A. Expression and purification of the aortic amyloid polypeptide medin. Protein Expression and Purification. 98, 32-37 (2014).
- Chen, S., Wetzel, R. Solubilization and disaggregation of polyglutamine peptides. Protein Science. 10 (4), 887-891 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유