Method Article
마이크로 로르 나를 사용한 네이티브 단백 입자의 농축과 그에 따른 절대/상대 미세 유 변 함량 및 셀룰러 전송 속도의 후속 측정
요약
여기서, 정량적 실시간 중 합 효소 연쇄 반응 기반 프로토콜은 지 단백질 입자의 천연 마이크로 RNA 함량 (절대/상대)의 결정을 위해 제시 된다. 또한, 마이크로 RNA 레벨을 증가 시키는 방법 뿐만 아니라, 지 단백질 입자의 세포 흡수 율을 결정 하는 방법이 입증 되어 있다.
초록
단백 입자 주로 지질과 혈 류에서 콜레스테롤의 전송기. 또한, 그들은 소량의 비 부호화 마이크로 로르 (miRNA) 가닥을 포함 합니다. 일반적으로, miRNA는 메신저 RNA (mRNA)와의 상호작용으로 인해 단백질 발현 프로필을 변경 한다. 따라서, 지 단백질 입자의 상대적이 고 절대적인 miRNA 함량의 지식은 세포 입자 흡수의 생물학적 효과를 추정 하는데 필수적 이다. 여기서, 정량적 실시간 중 합 효소 연쇄 반응 (qPCR) 기반 프로토콜은 지 단백질 입자의 절대적 miRNA 함량을 결정 하기 위해 제시 되 고-천연 및 miRNA 농축 된 단백질 입자에 대 한 것으로 예시 된다. 상대 miRNA 함량은 다 웰 미세 유체 어레이 카드를 사용 하 여 정량화 됩니다. 더욱이,이 프로토콜은 과학자 들이 세포 miRNA을 추정 하 고, 따라서, 지 단백질 입자 흡수 율을 추정할 수 있게 합니다. MiRNA와 인위적으로 로드 된 고밀도 지 단백질 (HDL) 입자를 사용할 때, 네이티브 HDL 입자와의 인큐베이션이 오히려 낮은 miRNA 콘텐츠로 인해 큰 영향을 미치지 않는 반면, 세포 miRNA 수준의 현저한 증가가 관찰 됩니다. 대조적으로, 저밀도 지 단백질 (LDL) 입자의 세포 흡수는 네이티브 miRNA도 인위적으로 로드 되지 않으며, 셀룰러 miRNA 수준을 변경 하지 않았습니다.
서문
단백 입자는 콜레스테롤 에스테 르 및 트리 글리세라이드 지방의 코어를 둘러싸는 양친 매 성 지질과 콜레스테롤의 단층으로 구성 됩니다. 입자의 생물학적 기능을 정의 하는 멤브레인 임베디드 apolipoproteins 전체 입자가 안정화 됩니다. 지 단백질 입자는 그들의 각각 증가 하는 조밀도에 따라 구별 될 수 있고, 따라서, 아주 저밀도 지 단백질 (IDL), LDL 및 HDL 입자와 같은 크기를 감소 시킵니다. 혈 류에서 불용 성 성분의 수송에도 불구 하 고, HDL 입자가 miRNA1,2의 비 코딩 가닥을 수행 하는 것이 입증 되었습니다. 마이크로-rnas는 매우 짧은 (일반적으로 2 다스 뉴클레오티드) RNA 가닥으로 서,이로 인해 내 식 상보성 mRNA 가닥을 분해 하 고 특정 단백질의 발현 프로필을변경 합니다. 6. 더욱이, miRNA 프로 파일의 변경은 다양 한 질병에서 발견 되었으며, 따라서, 프로 파일은 진단과 예 후에 대 한 바이오 마커로 서 적용 가능 하다. 단백질 입자를 통해 세포 사이의 miRNAs의 세포 외 수송은 세포 간 mRNA 레벨 변조를 위한 추가 메커니즘으로 작용할 수 있다. 생물학적 효과를 정량적으로 추정 하기 위해, 지 단백질 입자의 절대적 및 상대적인 miRNA 함량에 관한 지식이 필요 하다.
정량적 실시간 PCR은 이러한 정보를 얻기에 적합 하 고 비교적 빠른 방법 이다. 따라서, 상대 정량 (RQ) 값은 계산 될 수 있고, 상이한 샘플과 지 단백질 분 획 간의 상대적인 차이는 추정 가능 합니다. 다 웰 미세 유체 어레이 카드는 샘플에서 miRNAs의 상대적인 존재 (RQ 값과 동일)를 결정 하는 빠르고 사용 하기 쉬운 방법입니다. 다 웰 미세 유체 어레이 카드는 미세 유체 장치에 내장 된 개별 qPCR 반응에 대해 96 또는 384 개별 반응 챔버로 구성 됩니다. 각 챔버에는 하나의 개별 miRNA에 필요한 가수분해 프로브 및 특정 qPCR 프라이 머가 포함 되어 있습니다. 표준화, 간단한 워크플로우 및 피 펫 팅 단계 수 감소로 인 한 짧은 처리 시간입니다. 또한 필요한 샘플 볼륨이 최소화 됩니다. 상대적인 정량화와는 대조적으로, 절대 miRNA 함량은 miRNA 가닥의 알려진 절대 수의 표준 곡선과 qPCR 샘플 결과의 비교를 필요로 한다. 상대적으로 낮은 miRNA 함량으로 인해 표준 및 또한 단일 분자 민감성 이미징 기술이 실현 가능 하지 않기 때문에 miRNA을 가진 지 단백질 입자의 인공 농축은 세포를 연구 하는 데 불가피 합니다. 단백 입자 상호 작용 및 miRNA 전송. 이와 관련 하 여, HDL 입자의 delipidation는 후속 성물 함7 의 통합을 허용 하 고, 따라서, miRNA 가닥으로 농축. MiRNA를 가진 LDL 입자의 유사한 농축은 LDL 입자의 주요 성분 인 apoB-100 단백질의 소수 성으로 인해 실현 가능 하지 않습니다. 그러나, 지질 막에 침투할 수 있는 극성 용 매 디 메 틸 설 폭 사이드 (DMSO)를 첨가 함으로써, LDL 입자는 miRNA 가닥과 함께 인위적으로 로딩 될 수 있다.
고속 원자 힘 현미경 검사 법 (HS-AFM)은 서브 나노미터 공간 및 2 초 시간 분해능을 제공 하는 생물학적 표본의 특성화를 위한 강력한 도구입니다8. 따라서, 천연/재구성/라벨링 된 지 단백질 입자가 근 생리 적 환경 하에서 이미징 될 수 있으므로 변형 된 단백질 입자의 품질 관리를 위한 잘 적합 한 기술입니다.
여기서, qPCR 기반 프로토콜은 지 단백질 입자 및 세포 샘플의 절대적/상대적인 miRNA 함량을 결정 하기 위해 단계별로 제시 되며,이는 세포 단백질 입자 흡수 율의 추정을 가능 하 게 한다. 더욱이, miRNA와 함께 지 단백질 입자의 농축을 위한 방법이 입증 된다. 이 방법은 단백 콘텐츠의 일반적인 조작을 위해 적응 될 수 있고, 따라서, 약물 전달을 위한 표적으로 서 지 단백질 입자의 적용을 입증 한다.
프로토콜
혈액 기부금은 비엔나의과 대학 윤리 위원회에 의해 승인 되었습니다 (511/2007, EK-Nr. 1414/2016). 명명법은 정량적 실시간 PCR 실험 (MIQE)9 지침의 공표를 위한 최소 정보에 따라 이다.
1. 인간 혈액에서 단백 입자 분리
- Ultracentrifuge을 4°c로 냉각 시킵니다. 하룻밤 금식 후 건강 한 지원자 로부터 혈액을 채취 하십시오.
참고: 일반적으로 3 명의 기증자, 각각 80 mL를 기부 하 고, ethylenediaminetetraacetic 산 (EDTA)을 항 응고 제를 포함 하는 혈액 채취 튜브가 필요 합니다. - 2000 x g 에서 4 ° c에서 20 분간 원심 분리 하 고 혈장을 수확 (상); 전단 력을 피하십시오. 총 부피 V 를 결정 하 고 필요한 경우 인산 완충 식 염 수 (PBS)를 사용 하 여 원심 분리 튜브 부피의 배수를 조정 한다. 1 mL 3x의 질량을 측정 하 고 평균 밀도 ρ을 계산 합니다.
- 다음의 수학식10 을 사용 하 여 밀도 조절을 위한 칼륨 브롬 화물 (kbr)의 필요한 양을 계산 하 고 (그램/밀리 리터에서 원하는 밀도를 위해 = 1.019을 이용 하 고 kbr의 특정
 부피에 대해서는 0.364 ml/g를 사용 하십시오). Kbr을 플라즈마에 넣고 부드럽게 저 어 서 KBr이 완전히 용 해 될 때까지 전단 력을 피하십시오.
부피에 대해서는 0.364 ml/g를 사용 하십시오). Kbr을 플라즈마에 넣고 부드럽게 저 어 서 KBr이 완전히 용 해 될 때까지 전단 력을 피하십시오.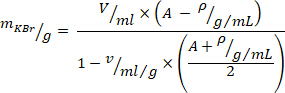
- 1.2 단계에서 설명한 바와 같이 밀도를 측정 하 고 필요한 경우 더 많은 KBr을 추가 하 여 다시 조정 합니다. 플라즈마로 초 원심 분리 적합 한 원심 분리기 튜브를 채우고 밀봉 하십시오. 기포를 피하십시오. 그렇지 않으면 튜브가 붕괴 될 수 있습니다. 제조업체의 지침에 따라 회전자에 튜브를 놓고 4°c에서 20 시간 동안 214000 x g 에 원심 분리기를 놓습니다.
- 제조업체의 지침에 따라 튜브를 열고 VLDL 및 IDL을 포함 하는 상부 상을 버립니다. 총 부피 V 를 결정 하 고 필요한 경우, PBS를 사용 하 여 원심 분리 관 부피의 배수를 조정 한다.
- 하단 분수의 밀도 ρ 을 결정 합니다. 밀도 조절을 위해 필요한 KBr의 양을 계산 합니다 (= 1.063 사용). KBr이 용 해 될 때까지 전단 력을 피하기 위해 부드럽게 저 어 주세요. 1.4 단계를 반복 합니다.
- LDL 입자를 포함 하는 상부 상을 제거 하 고 수집 한다. 4°c에서 불활성 기체 분위기 하에서 LDL 입자 용액을 저장 한다. 총 부피 V 를 결정 하 고 필요한 경우, PBS를 사용 하 여 원심 분리 관 부피의 배수를 조정 한다. 1.2 단계에서 설명한 바와 같이 하단 분 율의 밀도 ρ 을 결정 한다.
- 밀도 조정에 필요한 KBr의 양을 계산 하 고 (= 1.220 을 사용 하 여) 추가 합니다. KBr이 용 해 될 때까지 전단 력을 피하기 위해 부드럽게 저 어 주세요. 1.4 단계를 반복 합니다.
- HDL 입자를 포함 하는 상부 상을 제거 하 고 수집 한다. 총 부피 V 를 결정 하 고 필요한 경우 PBS를 사용 하 여 원심 분리 튜브 부피의 배수를 조정 한다. 밀도 ρ를 결정 합니다. 4 ° c에서 20 시간 동안 214000 x g 의 상 측의 2 차 원심 분리 단계를 알 부 민을 제거 하는 것이 좋다. 필요한 경우 1.8 단계를 반복 합니다. HDL 입자를 포함 하는 상부 상을 제거 하 고 수집 한다.
- 적어도 20l의 투 석 완충 액 (0.9% 염화 나트륨, 0.1 7.4%)을 4°c까지 준비 하 고 미리 냉각 시킨다. 사전 습식 투 석 관 (분자량 컷오프: 12 ~ 14 kDa) 및 제조업체의 지침에 따라 LDL 및 HDL 입자 용액을 추가 합니다. 4°c에서 5 L 투 석 완충 액을 Dialyze 후 1, 2 및 4 시간 후에 완충 액을 변경 한다.
- 24 시간 후, 석 관 으로부터 지 단백질 입자 용액을 회수 하 고 브래드포드 어 세이 (11 ) 또는 다른 적절 한 것을 사용 하 여 단백질 농도를 결정 한다. 4 ° c에서 불활성 가스 분위기 하에서 HDL 및 LDL 입자 용액을 저장 합니다.
2. 합성 miRNA
참고: RNA 올리고 뉴클레오티드를 취급할 때, RNase가 없는 작업을 하십시오. 신선 하 고 일회용 플라스틱 소모품 으로만 작업 하 고 항상 장갑을 착용 하 여 자주 변경 해야 합니다. 뉴 클레 아 제 없는 용액만을 사용 하십시오. 항상 얼음으로 작업 하십시오.
- 제조 업체에서 획득 한 바이 알을 최대 힘으로 스핀 다운 하 여 동결 건조 된 합성 miRNA 펠 렛을 형성 한다. 최종 농도 10 µ m (재고 농도) miRNA에 적합 한 10 mM 트리 스 (hydroxymethyl) 아미노 메탄 (트리 스) 완충 7.5 액의 적정 부피를 첨가 한다.
- 소생을 위해 몇 번 부드럽게 위아래로 피 펫 합니다. 멸 균 튜브에 각각 100 µ L을 준비 하십시오. 즉시 사용 하지 않을 경우-20°c에 보관 하십시오. 반복 해 동 및 동결을 피하십시오.
3. HDL 입자의 재구성
-
Delipidation
- 완충 액 A (150 mm 염화 나트륨 0.01, 10mm 트리 트리/HCl [pH 8.0])를 준비 한다. 원심 분리기를-10°c로 냉각 시킵니다. 에탄올의 혼합물의 100 mL의 프리 쿨: 디 에틸 에테르 (3:2)-20°c에서.
주의: 매우 가연성이 고 피부에 유해한 데 디 에틸 에테르를 처리 하는 동안 적절 한 개인 보호 장비를 착용 하 고 연기 후드에서 작업 하십시오. - 5 mg의 HDL 입자에 상응 하는 부피를 미리 냉각 된 에탄올 50 mL와 혼합 하 고: 디 에틸 에테르 (3:2) 혼합물을-20°c에서 2 시간 동안 배양 하였다. 2500 x g 에서 10 분 동안-10°c에서 원심 분리기.
- 상 등 액을 버리고, 미리 냉각 된 에탄올 50 mL로 펠 렛을 소생 시키고: 다이 에틸 에테르 혼합물을 vortexing 하 여,-20°c에서 2 시간 동안 배양 한다. 10°C에서 10 분 동안 2500 x g 에서 다시 원심 분리기.
참고: 원할 경우, HDL 입자의 지질 분 율에서 miRNA 함량의 분석을 위해 상층 액을 동결 건조 한다. - N2 가스 흐름 하에서 펠 릿을 건조 하 고 버퍼 A의 250 µ l에서 소생 시킵니다 (3.1.1 단계 참조). 브래드 퍼 드 단백질 분석 법 또는 다른 적절 한 것을 사용 하 여 단백질 농도를 결정 하 고 완충 액 A의 단백질 1 mg/250 µ L의 최종 농도로 희석 한다.
참고: 여기서 프로토콜을 일시 중지할 수 있습니다. 용액을 불활성 기체 분위기 하에서 4°c에서 밤새 보관 한다.
- 완충 액 A (150 mm 염화 나트륨 0.01, 10mm 트리 트리/HCl [pH 8.0])를 준비 한다. 원심 분리기를-10°c로 냉각 시킵니다. 에탄올의 혼합물의 100 mL의 프리 쿨: 디 에틸 에테르 (3:2)-20°c에서.
-
재구성
- 5.6 mg의 PC/m l의 농도로 클로로 포 름: 메탄올 2:1)의 혼합물을 사용 하 여 포스 파티 딜 콜린 (PC) 원 액을 제조 하였다. 마찬가지로, 콜 레스트 릴 올레 인산 (5mg/ml)의 스톡 용액과 콜레스테롤 (5mg/ml)을 준비 한다. 모든 솔루션을-20°c에 보관 하십시오.
- 깨끗 한 유리 튜브에 500 µ L의 PC, 100 µ의 CO 및 13.5 µ의 C를 섞는다. 이 부피는 100 PC의 대략적인 몰 비에 해당 한다: 22co: 4.8 c. 튜브를 회전 시키면서 N2 가스 흐름 하에서 혼합물을 건조 시켜 균질 한 표면 층을 얻었다.
참고: 여기서 프로토콜을 일시 중지할 수 있습니다. -20°c의 불활성 기체 분위기 하에서 유리 바이 알 (원할 경우 비축이 가능)을 저장 한다. - 완충 액에 신선한 30mm 스 페 광산 용액을 준비 합니다. 합성 2.2 miRNA의 1 개의 분 취 (100 µ l, 10µ m)을 혼합 하 여 100 µ l를 사용 하 여 30 ° c에서 30 분간 배양 한다.
참고: 네거티브 컨트롤 실험의 경우, miRNA 및/또는 spermine 용액을 동일한 양의 버퍼 A로 교체 하십시오. - 3.2.3 단계에서 PC/CO/C 마스터 혼합물을 혼합 하 여 녹 인 다.
- 버퍼 A에서 나트륨 deoxycholate의 30 mg/ml의 용액을 준비 하 고 3.2.4 단계에서 용액에 50 µ L을 추가 한다. 4°c에서 2 시간 동안 저 어 줍니다.
- 단계 3.1.4에서 delipidated HDL 솔루션의 250 µ L을 추가 합니다. 이 볼륨은 100 PC의 대략적인 몰 비에 해당: 22 CO: 4.8 c-1 delipidated HDL 단백질. 밤새 4°c에서 저 어 주세요.
-
투 석
- 4°c에서 적어도 15l의 PBS를 미리 냉각 시킵니다. 50 g의 흡착 제 비드를 이중 증류수 (Ddh2o)의800 mL에 넣고 1 분간 저 어 주십시오. 15 분 정도 기다린 후 상층 액을 decant 하 고 PBS로 절차를 반복 하십시오.
- 전처리 투 석 카세트 (분자량 컷오프: 20kda) 또는 적절 한 투 석 관 및 제조업체의 지침에 따라 주사기를 사용 하 여 3.2.6 단계에서 솔루션을 추가 합니다.
- 3.3.1 단계에서의 흡착 제 비드를 추가 하 여 4°c에서 3 L의 PBS로 dialyze. 1 시간 및 2 시간 후에 버퍼와 비드를 변경 합니다.
- 24 시간 후에는 재구성 된 HDL (rHDL) 입자 용액을 회수 하 고 브래드포드 분석을 사용 하 여 단백질 농도를 확인 합니다. RHDL 입자 용액을 4°c의 불활성 기체 분위기 하에 보관 하십시오.
4. LDL 입자의 라벨링
- 10 배 LDL 완충 액 (1.5 M 염화 나트륨 3mm EDTA 에틸렌 글리콜 비스 (β 아미노 에틸 에테르) 7.4 n을 제조 하 고 상 온에서 저장 하 여이를 보관 하 고 있습니다.
- RNase가 없는 물에 신선한 30mm spermine 솔루션을 준비 하십시오. 합성 2.2 miRNA의 분 취 액 (100 µ l, 10µ m)을 혼합 하 여 100 µ l을 사용 하 여 30 ° c에서 30 분간 배양 하십시오.
참고: 네거티브 컨트롤 실험의 경우, miRNA 및/또는 spermine 용액을 동일한 양의 1x LDL 버퍼로 교체 하십시오. - 4.2 단계의 miRNA/spermine 용액에 DMSO 100 µ L을 추가 하 고 1.2 mL의 1x LDL 완충 액으로 더 희석 하십시오.
- 약 4 mg/mL의 최종 농도로 LDL 입자 용액을 PBS로 희석 하 고 50 µ L의 10 배 LDL 완충 액으로 450 µ L을 섞어 줍니다. 얼음 위에서 10 분간 배양 합니다.
- 이전 단계의 LDL 입자 용액과 miRNA/spermine/DMSO 용액 (4.3 단계에서)을 결합 하 여 40 ° c에서 2 시간 동안 배양 하였다.
- 3.3 항에 기재 된 바와 같이 투 석을 수행 하 고 그에 따라 표지 된 LDL 입자 용액을 저장 한다.
5. 재구성/표지 된 지질 입자의 품질 관리
참고: 품질 관리를 위해, 단백질 입자의 직경과 일반적인 모양은 예를 들어 AFM 또는 전자 현미경 (EM)을 사용 하 여 결정 될 수 있습니다. 여기서, HS-AFM은 천연/재구성/라벨링 된 지 단백질 입자의 크기 분포를 측정 하는 데 사용 됩니다.
- HDL/LDL 입자 용액을 PBS (1:100~11000)에 희석 하 고 갓 절단 된 마이 카에 5 분간 배양 합니다. 운 모 (12)를 클 리 빙 하는 경우, 테이프를 벗으 면 서 기판에 접착 테이프를 누르고 상부 운 모 층을 제거 하십시오.
참고: 특정 AFM 계기, 관측 영역 및 초기 입자 농도에 따라, 희석 인자는 개별 입자를 관찰 하도록 조정 되어야 한다. - 인큐베이션 후에, PBS로 샘플을 헹 구 고 캔틸레버 k캔 트 ≪ 0.2 n/m의 스프링 상수를 갖는 태핑 모드에서 pbs와 두드리는 모드로 HS-AFM 이미징을 수행 합니다. 1 µm2 < 스캔 크기를 사용 하 고 이미징 힘을 최대한 낮게 유지 하는 것이 좋습니다.
- 적합 한 소프트웨어로 운 모 표면과 관련 하 여 이미지 된 입자의 높이를 결정 합니다.
- 데이터를 Gwyddion 온 (프리웨어)에 로드 하 고 곡물 분석 (임계 값으로 곡물 표시)을 통해 입자를 감지 하 고 기판 배경 위에 임계 값을 설정 하십시오. 이미지 병합 (다항식 배경 제거) 마스크 된 영역 제외 옵션을 선택 합니다.
- 감지 된 파티클의 높이 값을 내보내고 (다양 한 그레인 특성의 분포) 기록 된 모든 이미지에 대해 이러한 단계를 반복 합니다. 히스토그램을 생성 하거나 획득 한 입자 높이의 확률 밀도 함수를 계산 하 여 통계 분석을 수행 합니다.
- 기본으로 재구성/레이블이 지정 된 지질 입자와 5.1 ~ 5.3 단계를 반복 하 고 얻어진 결과를 비교 하 여 입자 품질을 확인 합니다. 이물질 및/또는 대기업 관찰 하는 경우 샘플을 버립니다.
6. 세포 배양
- Confluency 함에 도달할 때까지 확립 된 프로토콜 (예를 들어 ldlA7-SRBI13)에 따라 부착 세포를 성장 시키십시오.
참고: 실험의 수에 따라 여러 개의 독립적 인 챔버 (권장 실험 설정 당 두 개의 챔버) 및 음성 제어 실험 (권장 하는 단백질 입자의 추가 없이 두 개의 챔버가 필요 합니다). 또한, 셀 번호의 결정을 위해 두 개의 챔버가 필요 합니다. - 미리 데워 진 행 크의 균형 잡힌 염 용액 (HBSS)을 사용 하 여 셀 3x를 부드럽게 세척 하 여 세포 잔해를 제거 하 고 적절 한 양의 무 혈 청 성장 배지로 세포 층을 덮으 십시오. 50 µ g/mL 지 단백질 입자의 최종 농도에 도달 하기 위해 적절 한 양의 지 단백질 입자 용액을 첨가 하십시오. 16 시간 동안 37 ° c에서 5% co2를 배양 합니다.
참고: 실험 설계 및 세포 주에 따라, 배양 시간은 세포 miRNA 수준에서 충분 한 (즉, 측정 가능한) 증가를 달성 하도록 조정 되어야 한다. - 37 세포 잔해/지 단백질 입자를 제거 하 고 적절 한 양의 무 혈 청 배지로 세포 층을 덮으 십시오.
- 6.3 단계에서 시료 부피의 세포 수를 계산 하기 위해 적어도 2 개의 독립 된 챔버에서 적절 한 방법 (예를 들어, 혈액 세포 측정기, 자동 세포 계수기)을 사용 하 여 세포 밀도를 결정 한다. 이 숫자는 정규화에 사용 됩니다.
7. 세포 및 단백 입자 샘플에서 miRNA 추출
주: 세포 로부터의 miRNA의 추출은 다음의 수정과 함께 miRNA 추출 키트를 사용 하 여 수행 된다.
-
세포 샘플
- 원심 분리기를 4°c로 냉각 시켰다. 세포를 포함 하는 두 개의 챔버에 각각의 용 해 시 약 350 µ L을 추가 합니다. 음성 대조 실험으로 서, 세포 없이 챔버를 사용 한다.
주의: 페 놀과 이세티 포함 된 용 균 시 약을 처리 하는 동안 적절 한 개인 보호 장비를 착용 하 고 연기 후드에서 작업 하십시오. - 셀 분리에 대해 3 ~ 5 분 (셀 라인에 따라 다름)을 기다리십시오. 필요한 경우, 명시 야 현미경으로 세포 분리를 확인 하십시오. 1.5 mL 튜브에 두 챔버의 내용물을 풀.
- 20 G 바늘과 5Ml 주사기를 사용 하 여 시료를 5 ~ 10 배 더 균질 화/파괴 하 여 흡 인 및 3 분 동안 배양 합니다. 140 µ L을 클로로 포 름 (CHCl3)에 넣고 15 초 동안 힘차게 흔들어 준 후 삼 분간 배양 합니다.
- 4 ° c에서 15 분 동안 12000 x g 에서 원심 분리기. 그런 후 원심 분리기 냉각을 중지 하십시오.
- 상부 수성 상을 새로운 1.5 mL 튜브로 이송 하는 단계; 단계 혼합/오염을 방지 상호 단계 DNA를 포함 하 고 낮은 단계는 단백질을 포함. 100% 에탄올 부피의 1.5 배를 추가 하 고 파이 펫 팅을 통해 철저히 섞어 줍니다.
- 2 mL 수집 튜브에 스핀 칼럼을 배치 하 고 단계 7.1.5에서 혼합물의 700 µ L을 추가 합니다. 실 온에서 15 초 동안 8000 x g 에서 원심 분리기. 플로우 쓰루를 버리고 잔류 샘플 체적으로이 단계를 반복 하십시오.
- 흐름을 무시 하 고 첫 번째 세척 버퍼의 700 µ L을 스핀 열에 추가 합니다. 실 온에서 15 초 동안 8000 x g 에서 원심 분리기.
- 흐름을 무시 하 고 두 번째 세척 버퍼의 500 µ L을 스핀 열에 추가 합니다. 실 온에서 15 초 동안 8000 x g 에서 원심 분리기. 이 전체 단계를 2 분간 원심 분리 시간으로 두 번 반복 하십시오.
- 스핀 칼럼을 새로운 2ml 수집 튜브에 넣고 1 분간 최대 속도로 원심 분리 하 여 멤브레인을 건조 시킵니다.
- 스핀 칼럼을 1.5 mL 컬렉션 튜브에 넣습니다. 용 출을 위해 멤브레인의 중앙에 30 µ L의 RNase가 없는 물을 첨가 하 고 1 분 동안 8000 x g 의 원심 분리기로 분리 합니다 .이 전체 단계를 제 1 흐름을 통해 용 리 용액으로 다시 한번 반복 한다. 역 전사 단계는 추출 직후에 이루어지며; 그렇지 않으면 추출 된 miRNA 샘플을-20°c에 보관 하십시오.
- 원심 분리기를 4°c로 냉각 시켰다. 세포를 포함 하는 두 개의 챔버에 각각의 용 해 시 약 350 µ L을 추가 합니다. 음성 대조 실험으로 서, 세포 없이 챔버를 사용 한다.
-
단백 입자
- 가장 낮은 단백질 농도로 샘플의 부피를 100 µ (= 최대 샘플 부피)로 설정 합니다. 농도에 반비례 하 여이 정규화에 따라 다른 샘플의 샘플 부피를 계산 합니다. 음성 대조 실험의 경우, RNase가 없는 물 100 µ L을 사용 하십시오.
참고: 정규화는 필요 하지 않지만 qPCR 단계 및 분석 중에 결과의 직접 비교를 단순화 합니다. - 원심 분리기를 4°c로 냉각 시켰다. 단계 7.2.1의 샘플 부피에 700 µ L의 용 해 시 약을 추가 하십시오.
- 7.1.3-7.1.10 단계에 따라 miRNA 추출을 수행 합니다.
- 가장 낮은 단백질 농도로 샘플의 부피를 100 µ (= 최대 샘플 부피)로 설정 합니다. 농도에 반비례 하 여이 정규화에 따라 다른 샘플의 샘플 부피를 계산 합니다. 음성 대조 실험의 경우, RNase가 없는 물 100 µ L을 사용 하십시오.
8. 역 전사
참고: miRNA의 역방향 전사는 다음과 같이 수정 된 역방향 전사 키트를 사용 하 여 수행 됩니다.
- 키트 시 약 및 역방향 전사 프라이 머를 얼음에 해 동 한다. 얼음에 반응 튜브에 다음과 같은 마스터 믹스를 준비: 45.7의 RNase-프리의 µ L, 16.5 µ l의 역 전사 효소의 11 µ l, rnase 억제제의 2.1 µ l 및 dntp 혼합의 1.7 µ l. 부드럽게 섞으 세요, 소용돌이 하지 마십시오.
주: 축척은 샘플 수량에 따라 다릅니다. 여기서, 10 반응에 대해 계산 된다. - 이에 따라 0.2 mL 튜브를 혼합 하 고 7.1.10 단계에서 추출 된 샘플의 5 µ L을 사용 하 여 8.1 단계에서 마스터 믹스의 7 µ L을 역방향 전사 프라이 머의 3 µ l에 섞어 주었다. 부드럽게 섞은 후, 잠시 원심 분리 하 고, 혼합물을 얼음에 보관 하십시오.
- 각 세포 주에 대해 동일한 세포 번호를 사용 하기 위해, 더 높은 전체 세포 수를 갖는 세포 주에 대 한 샘플 부피를 감소 시킨다; 이것을 잔류 체적으로 사용 하 여 RNase가 없는 물의 5 µ L의 총 샘플 부피에 도달 합니다.
주: 단백 입자 샘플은 단계 7.2.1에서 이미 정상화 되었습니다. 표준 곡선 준비를 위해 RNase가 없는 물에서 miRNA의 분 취를 순차적으로 희석 하 고 샘플 부피 당 가닥 수를 계산 합니다. 생성 된 샘플 정량 사이클 (cq) 값의 범위 내에서 적어도 5 개의 데이터포인트가 필요 하다. 일반적으로, 총 희석 요인은 102 에서 106 에 이르기까지 적합 합니다. - 튜브를 써 모 시스템에 넣고 다음 프로그램을 시작 합니다: 16°c에서 30 분 (어 닐 링 단계) 85 ° c에서 30 분 (역 전사), 42에서 5 분 (용융 단계), 4°c에서 일시 정지. 역전사 직후의 qPCR 단계를 수행 하 고; 그렇지 않으면, miRNA 샘플 로부터 합성 된 상보성 DNA (cDNA)를-20°c에서 저장 한다.
9. qPCR
- 다음과 같은 수정으로 상업적으로 입수 가능한 검정 ( 재료 표참조)을 이용 하 여 CDNA의 Qpcr (miRNA 로부터 전사)를 수행 한다.
- 모든 시 약 (슈퍼 믹스, RNase가 없는 H2o), cDNA 샘플 (8.4 단계에서) 및 얼음에 대 한 프라이 머. Ice의 반응 튜브에 다음 마스터 믹스를 준비: 75 µ L의 슈퍼 믹스, 47.5의 RNase-프리의 µ L,7.56 µ l 프라이 머. 부드럽게 섞으 세요, 소용돌이 하지 마십시오.
주: 축척은 샘플 수량에 따라 다릅니다. 여기서, 10 반응에 대해 계산 된다. - 0.2 mL 튜브에 라벨을 부착 하 고 cDNA 샘플의 2 µ L을 마스터 믹스의 13 µ L에 넣고 부드럽게 섞어 줍니다. 일반적으로 각 샘플 2x를 측정 합니다.
참고: 적어도 두 개의 네거티브 컨트롤 샘플이 필요 합니다-샘플로 RNase 없는 물을 사용 합니다. 검 량 곡선이 샘플과 동일한 실행에서 결정 되지 않은 경우, 교정 곡선 측정의 한 샘플도 필요 합니다. 각 개별 실행을 동일한 반응 효율로 보정 하는 데 사용 됩니다. - PCR 기계에 튜브를 놓고 다음 프로그램을 시작 하십시오: 50 ° c에서 2 분, 95 ° c에서 10 분, 95 ° c에서 15 초 및 60 s에서 60 ° c. 프로그램의 마지막 두 단계를 최대 50 배까지 반복 합니다.
- PCR 기계의 소프트웨어 패키지를 사용 하 여 cq 값을 분석 하려면 dynamictube 정규화 (각 샘플 추적의 두 번째 미분을 사용 하 여 다양 한 배경 레벨의 보상) 및 노이즈 기울기를 활성화 합니다. 보정 (노이즈 레벨에 대 한 정규화).
참고: 음수 컨트롤의 cq 값은 가장 높은 샘플 cq 값 보다 여러 사이클이 높아야 합니다.- 보정 곡선 분석의 경우, 소프트웨어 패키지의 자동 찾기 임계값 기능을 사용 하 여 각 miRNA의 표준 곡선에서 개별적으로 각 miRNA 대 한 cq 계산에 대 한 임계값을 결정 하 고이를 일정 하 게 유지 합니다. 각 특정 miRNA.
- 샘플 분석의 경우, 필요한 경우 검 량 곡선 샘플에서 데이터 포인트로 실행 되는 샘플의 다양 한 반응 효율을 보정 합니다. 이 소프트웨어는 각 교정 곡선 측정의 임계 수준에서 샘플의 cq 값을 계산 합니다.
10. miRNA 콘텐츠 계산
-
보정 곡선
- MiRNA 가닥의 초기 수 100 (10 µ m miRNA, 데이터 시트의 분자량) 및 후속 일련 희석 단계 (8.3 단계에서의 5 miRNA l 샘플 볼륨)에 대 한 샘플 부피의 µ 가닥 수를 계산 합니다.
참고: 역방향 전사 효율 1을 가정 하면,이 수는 cDNA 가닥의 수와 동일 하다. - 9.3 단계에서 2 µ L의 샘플 부피에서 cDNA 가닥의 수를 계산 한다. 7.5 8.4 단계에서의 추가적인 희석 율을 고려 하 여 9.4 단계 로부터 15 µ l 샘플 부피 로부터 2 µ의 샘플 부피를 측정 하였다.
- 9.5.1 semilogarithmic 플롯의 10.1.2 단계에서 계산 된 스트랜드 n가닥 의 수를 기준으로 스텝에서 cq 값을 플로팅하 고 데이터 포인트를 다음 회귀 곡선 (M = 선형의 기울기)에 맞춥니다. 회귀 곡선 B = 오프셋).
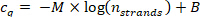
라인에 대 한 상관 계수 (r2)가 > 0.99 인지 확인 합니다.
- MiRNA 가닥의 초기 수 100 (10 µ m miRNA, 데이터 시트의 분자량) 및 후속 일련 희석 단계 (8.3 단계에서의 5 miRNA l 샘플 볼륨)에 대 한 샘플 부피의 µ 가닥 수를 계산 합니다.
-
단백 입자
- 측정 된 샘플 cq 값 (단계 9.5.2)을 사용 하 여 샘플 부피 당 miRNA 가닥의 수를 계산 하 고 다음 방정식 (M 및 B 는 특정 miRNA의 캘리브레이션 곡선 파라미터)을 이용 한다.
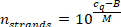
- 단계 7.2.1 (100 µ L)의 부피에서 시작 하 여 시료 부피에서 지 단백질 입자의 상응 하는 수를 계산 하 고, 그의 공지 된 농도 및 후속 희석 단계 (100 µ에서 > 30 µ L 샘플 부피 > 7.1.10 L [희석 1:6] > 8.4 단계에서 15 µ l의 총 부피에서 시료를 9.4 단계에서 2 µ l [희석 17.5]). 250 kDa의 HDL 입자 및 3 개의 LDL 입자에 대 한 MDa 및 miRNA 추출 단계 동안 miRNA의 100% 회수 (분자량에 대 한 지질 기여를 무시 하 고 miRNA 가닥 수에 대 한 약간의과 대 평가를 산출 한다고 가정 합니다. 단백질 입자).
- 단계 10.2.1에서 miRNA 가닥의 수를 이전 단계에서 계산 된 입자 수로 나누어 miRNA 가닥 당 단백질 입자 수를 얻었다.
- 측정 된 샘플 cq 값 (단계 9.5.2)을 사용 하 여 샘플 부피 당 miRNA 가닥의 수를 계산 하 고 다음 방정식 (M 및 B 는 특정 miRNA의 캘리브레이션 곡선 파라미터)을 이용 한다.
-
셀
- 단계 10.2.1에 따라 샘플 부피 당 miRNA 가닥의 수를 계산 합니다.
- 단계 10.2.2에 따라 샘플 체적에서 상응 하는 개수의 셀을 계산 하 고, 6.4 단계에서 측정 된 초기 세포 수 농도를 시작 한다.
- 10.3.1에서 miRNA 가닥의 수를 이전 단계에서 계산한 셀 수로 나누어 셀 당 miRNA 가닥 수를 산출 합니다.
- MiRNA/입자 비율에 의해 음성 대조 실험 으로부터 얻어진 세포의 배경 miRNA 수준에 대 한 보정 후 이전 단계에서 miRNA 가닥의 총량을 분할 하 여 단백 입자의 흡수 율을 계산 한다 (단계 10.2.3 ) 및 인큐베이션 시간 (16h)은 6.2 단계 참조).
11. 다 웰 미세 유체 어레이
-
miRNA 추출
- 7 단계에서 설명한 바와 같이 miRNA 추출을 수행 합니다.
-
역 전사
- 역방향 전사 용 프라이 머, 역 전사 키트 성분 및 MgCl 2(25mm)를 얼음 위에 해 동 한다. 8 개의 샘플에 대 한, µ의 역 전사 프라이 머의 2.25 µ l, dttp 100를 가진 dntps의 16.88 µ l, 50 역전사 µ의 역 전사 완충 액, 9.00 µ l의 mgcl 2의 10.12 µ l를 혼합 하 여 rnase 억제제 (20 U/µ l) , 뉴 클레 아 제 없는 물 1 µ L.
- 가볍게 섞어서 원심 분리기를 짧게 하십시오. 4.3 µ L을 추가 하 여 3.5 µ L의 역 전사 반응 믹스를 튜브에 넣고 혼합 하 고, 스핀 다운 하 고, 얼음을 5 분간 배양 합니다. 온도 조절기 기계에 튜브를 놓고 다음 프로그램을 시작 하십시오. 16 ° c에서 2 분 동안, 42 ° c에서 1 분 동안 및 50 ° c에서 1 초 동안 총 40x를 반복 하 고, 이어서 정지 반응으로 서, 85 ° c에서 5 분간 정지 하 고 정지할 때까지 4°c에서 유지 한다.
-
전치 증폭
- 얼음에 프라이 머를 해 동 하 고 짧게 원심 분리기. 전치 증폭 마스터 믹스 (2 배)를 병에 소용돌이 세요. 8 개의 샘플에 대 한 다음의 지시에 따라 프리 증폭 반응 믹스를 준비 한다: 112.5 µ L의 프리 증폭 마스터 믹스 (2x), 22.5 µ L의 전치 증폭 프라이 머 및 뉴 클레 아 제가 없는 물의 67.5 µ L. 반전 및 원심 분리기를 짧게 합니다.
- 11.2.2 단계에서의 역방향 전사 반응 산물의 2.5 µ L을 혼합 하 여 이전 단계에서의 전치 증폭 반응 혼합을 22.5 µ와 반전 및 원심 분리기를 짧게 하였다. 얼음 위의 시료를 5 분간 배양 합니다.
- 열 경 화성 기에 튜브를 놓고 다음 설정에서 배양 합니다: 95 ° c에서 10 분 동안, 55에서 2 분 동안 어 닐 링 하 고, 72 ° c에서 변성로 2 분간 소 둔 하 고, 두 번 반복 하 여 1 ~ 4 분 동안에는 95 ° c에서 15 초 동안 고 어 닐 링/60 연장 합니다. , 효소 불 활성화를 99.9 ° c에서 10 분간, 4°c에서 4 ° c로 한다.
- 스핀 다운, 7.5 µ L (pH 8.0) 및 뉴 클레 아 제 없는 물, 반전 및 원심 분리기의 67.5 µ L을 추가 하십시오. 샘플은 최대 1 주일 동안-20°c에서 보관할 수 있습니다.
-
qPCR
- 마스터 믹스를 병에 소용돌이 세요. 1 개의 카드에 대 한 PCR 반응 혼합을 준비: 450 µ L의 마스터 믹스, 441 µ L의 뉴 클레 아 제가 없는 물 및 11.3.4 단계 로부터의 프리 증폭 샘플의 9 µ L. 반전 및 원심 분리기를 짧게 합니다.
- 제조 지침에 따라 준비 된 PCR 반응 혼합의 100 µ L을 사용 하 여 멀티 웰 미세 유체 배열 카드의 각 충전 저장소를 로드 하 고 3000 x g에서 1 분 동안 2 배를 원심 분리 합니다. 2 개의 연속적인 원심 분리 단계 동안 가속도는 카드를 적절 하 게 채우는 데 중요 합니다. 제조업체의 지침에 따라 카드를 밀봉 하십시오.
- 다음 프로그램으로 PCR 시스템을 사용 하 여: 95 ° c에서 10 분 동안 효소 활성화 후 40x를 반복 하 고 변성에서 15 초 동안 95 ° c에서 1 분 동안 60 ° c에서 소 둔/연장.
- PCR 시스템에서 결과 파일을 가져오고 다음 분석 설정으로 시스템의 소프트웨어 패키지를 사용 하 여 RQ 값을 계산 합니다. 최대 허용 되는 cq 값 40.0, 계산에 포함 된 최대 cq 값 및 이상치 중 복제 제외. Benjamini-호크 버그 잘못 된 검색 비율을 p값 조정 (가양성의 발생의 수정) 및 정규화 방법으로 전역정규화 (모든 샘플에 대 한 중앙값 임계값 사용)에 대 한 옵션으로 활성화 합니다. 15).
결과
단백 입자 분리의 일반적인 계획
도 1 은 순차 부유 초 원심 분리 (16)을 사용 하 여 전 혈에서 시작 되는 지 단백질 입자 분리의 일반적인 계획을 보여준다. 원한다 면, VLDL 및 IDL 입자와 같은 다른 단백 입자 분 획을이 프로토콜 중에 수확 할 수 있습니다. 고정 앵글 티타늄로 터는 폴 리 프로필 렌 퀵 씰 튜브와 결합 하 여 원심 분리 력을 견딜 수 있습니다. 관 붕괴를 방지 하기 위해, 튜브에 기포를 방지 하는 것이 중요 하다. 원심 분리는 단백질 분해를 최소화 하기 위해 4°c에서 수행 된다. 일반적으로 혈장 (기증자 당 60-80 mL)에서 시작 하 여 3 명의 자원 봉사자의 공동 헌 혈 기부를 1-3 mg/ml의 범위에서 농도별로 각각 3 mL의 LDL 및 HDL 입자 용액 부피의 수율을 기대할 수 있다. 혈액 기증에서 시작 하는 전체 절차는 7 일 정도 걸렸습니다.
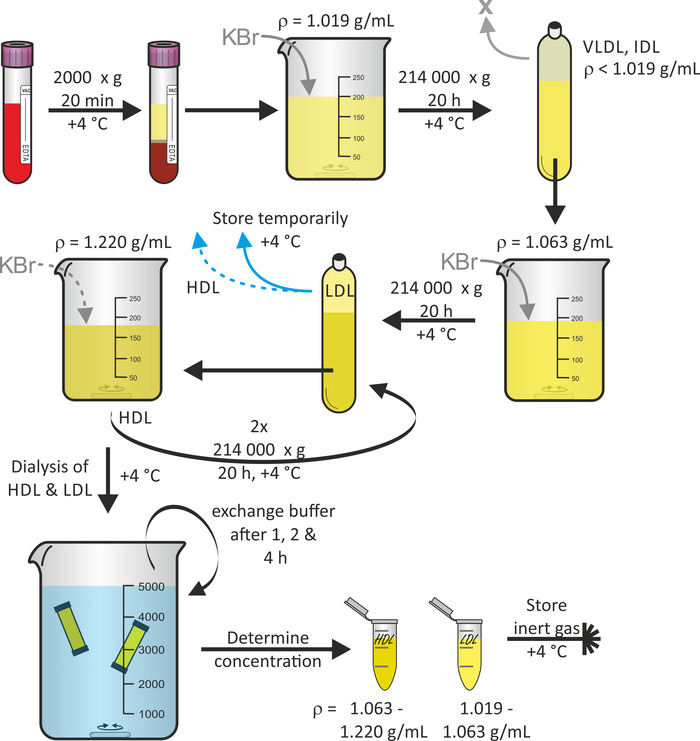
그림 1: 단백 격리의 순서도. 진공 용기 튜브의 건강 한 지원자 로부터 혈액을 원심 분리 하 고 플라즈마 (상)를 수집 합니다. 그 밀도를 KBr을 사용 하 여 ρ = 1.019 g/mL로 조정한 후, 용액을 4°c에서 20 시간 동안 214000 x g 에서 원심 분리기. 하 부 분 획의 밀도를 KBr을 사용 하 여 ρ = 1.063 g/mL로 조정한 후, 4°c에서 20 시간 동안 214000 x g 에서 용액을 다시 원심 분리 한다. LDL 입자를 포함 하는 상부 분 획을 4°c에서 임시 저장 한다. KBr을 사용 하 여 ρ = 1.220 g/mL에 대 한 하 부 분 율의 밀도를 조정한 후, 용액을 4°c에서 20 시간 동안 214000 x g 에서 두 번 원심 분리기. HDL 입자를 포함 하는 상부 분 획을 수집 하 고, HDL 및 LDL 입자 용액을 모두 dialyze, 1, 2 및 4 시간 후에 완충 액을 교환 한다. 24 시간 후, 단백질 농도를 결정 하 고 4°c에서 불활성 기체 하에 샘플을 저장 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
HDL 입자의 재구성
HDL 입자의 재구성은 이전에 조나스7에 의해 발표 된 프로토콜에 따라 수행 되었다. 제 1 단계는 도 2a에 도시 된 바와 같이 HDL 입자의 delipidation이 고,이 어 지질 PC, CO 및 C를 사용 하 여 도 2b에 도시 된 바와 같이 (즉, 재구성)의 제 2 단계를 miRNA 및 spermine의 혼합물에 첨가 하였다. 우리는 미르-223이 높은 풍부 함을 나타내고 미르-155은 단백 입자17에서 드문 때문에 인간 성숙한 미르-223 및 미르-155을 선택 했다. 일반적으로 두 단계는 2 개의 순차적 일에 수행 됩니다. 재구성 하는 동안, 다른 친지 성 및/또는 양친 매 성 구성 요소를 원하는 대로 추가할 수 있습니다. PC, CO 및 C의 에탄올/디 에틸 에테르 및 메탄올/클로로 포 름 용 매의 완전 한 증발이 매우 중요 하였다. 마지막 단계- 도 2c에 도시 된 바와 같이-무료 지질/miRNA/세제 로부터 재구성 된 HDL 입자 (rhdl)를 분리 하는 투 석 절차가 있었다. 이것은 추가 1-2 일이 걸렸습니다. 투 석 용액에 흡수 성 비드를 첨가 하 여 투 석 막을 따라 밀도 구배를 일정 하 게 유지 시켰다. RHDL 입자의 50%의 수율을 기대할 수 있습니다.
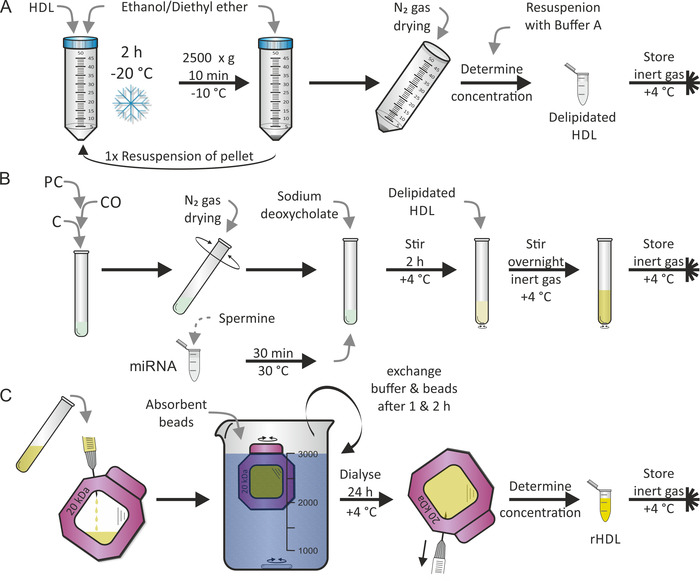
그림 2: HDL 입자 재구성의 순서도. (A): HDL 입자 용액을 미리 냉각 된 에탄올/다이 에틸 에테르와 혼합 하 고-20°c에서 2 시간 동안 배양 한다. 상층 액을 버리고 나면, 펠 렛을 소생 하 고 절차를 반복 합니다. 상기 펠 렛을 N2 가스로 건조 하 고이를 완충 액 A에서 소생 시켰다. 농도의 결정 후, 4 ° c에서 불활성 가스 분위기 하에 delipidated HDL을 저장 합니다. (B) 재구성: 포스 파티 딜 콜린 (PC), 콜 레 스 콜 레이트 올레 에이트 및 콜레스테롤 (C)을 혼합 한 후 튜브를 회전 시키면서 n2 가스를 사용 하 여 용 매를 증발 시킵니다. MiRNA 액을 30 ° c에서 30 분 동안 정액으로 배양 하 고, deoxycholate 나트륨을 첨가 하 고 건조 된 지질 필름을 소생 시켰다. 4°c에서 2 시간 동안 시료를 교 반 하 고, delipidated HDL 용액을 첨가 하 고,이 시간은 불활성 기체 분위기 하에서 4°c에서 밤새 다시 저 어 주었다. (C) 투 석: 재구성 된 Hdl (rhdl) 입자가 포함 된 패널 B 로부터 투 석 막 챔버 (분자량 컷오프: 20kda)로 용액을 전달 하 고 4°c에서 PBS 및 흡수 비드에 대해 dialyze. 버퍼와 비드를 1 시간 및 2 시간 후에 교환 한다. 24 시간 후 rHDL 입자 용액을 회수 하 고, 농도를 확인 하 고, 4°c에서 불활성 기체 분위기 하에 시료를 저장 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
LDL 입자의 라벨링
HDL 입자에 대해 입증 된 miRNA (도 3)로 ldl 입자의 라벨링은 ldl 입자의 주성분 인 apob-100 단백질의 소수 성으로 인해 실현 가능 하지 않았다. DMSO는 LDL 입자의 지질 단층의 침투를 위해 사용 되었고, 따라서, miRNA 연결을 매개 하였다. 전체 절차는 100%에 가까운 수율로 1-2 일을 했다.
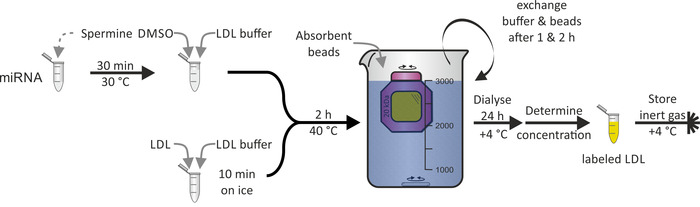
그림 3: LDL 입자 라벨링의 흐름도. 30°c에서 30 분 동안 miRNA 액을 spermine 용액으로 배양 하 고 DMSO 및 LDL 완충 액을 추가 합니다. Ldl 샘플 재치 LDL 완충 액을 얼음에 10 분간 배양 하 고 miRNA/spermine/DMSO 혼합물을 첨가 한다. 40 ° c에서 2 시간 동안 인큐베이션 한 후, 용액을 투 석 막 챔버 (분자량 컷오프: 20kda)로 이송 하 고 + 4°c에서 PBS 및 흡수 비드에 대해 dialyze. 교환 완충 액과 구슬 1 & 2 시간 후에 라벨링 된 LDL 입자 용액을 24 시간 후에 회수 하 고, + 4°c에서 불활성 기체 분위기 하에서 농도 및 저장을 결정 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
단백질 입자의 품질 관리
HS-AFM는 운 모에 있는 네이티브 및 재구성/표지 된 단백 입자의 크기 및 모양을 검토 하기 위하여 이용 될 수 있습니다. 사용 직전에, 운 모는 깨끗 하 고 평평한 표면을 제공 하기 위해 (접착 테이프를 사용 하 여 상부 층을 제거 하는) 새로 절단 해야 합니다. 운 모에 HDL/LDL 입자를 배양 할 때, 희석 계수 (및/또는 인큐베이션 시간)는 개별 입자를 관찰 하기 위해 조정 될 필요가 있다. 클러스터는 입자 치수의 결정을 허용 하지 않습니다. HDL 입자는 운 모에 이동 합니다. HS-AFM 대신에 종래의 AFM을 사용 하는 경우, 고 정화 프로토콜은 측면 입자 이동성을 감소 시키기 위해 (완충, 표면 코팅) 적절 하 게 적응 될 필요가 있다. 샘플을 스캔 하는 동안 입자의 변형을 방지 하기 위해 이미징 력이 낮게 유지 되어야 합니다 (태핑 모드) .이는 결과적으로 측정 된 값에 영향을 미칩니다. 데이터 분석을 위해, 입자는 임계 알고리즘 (예를 들어, Gwyddion 온에서 곡물 > 임계 값으로 표시)을 통해 검출 되었고, 그 높이는 마이 카 표면에 대하여 결정 되었다. 명백한 측면 치수가 끝 모양에 의해 확대 되므로 입자의 높이를 측정 하는 것이 입자 크기를 결정 하는 가장 정확한 방법입니다 ( 그림 4의 예시 이미지 참조). 입자 높이의 확률 밀도 함수 (pdf)는 다양 한 단백 입자의 통계적 평가 및 크기 분포의 비교를 위해 계산 되었다. 도 4 에 나타난 바와 같이 네이티브 및 miRNA 표시 된 ldl 입자의 비교는 가능 하 게 표지 된 및 비 표지 된 (즉, 네이티브) 지 단백질 입자 간의 주요한 유사성을 확인 합니다 (miRNA의 첨가 없이 ldl 입자로 표지 됨/ spermine 혼합물은 라벨링 절차 자체에 대 한 컨트롤로 표시 됩니다). 전체 절차는 약 1 일이 걸렸습니다.
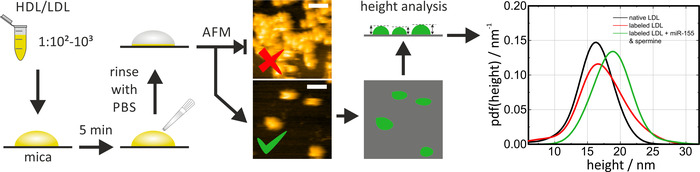
그림 4: HS-AFM 측정의 순서도 및 대표적인 결과 PBS (1:102-1:103)에 HDL/LDL 입자 샘플을 희석 하 고 5 분 동안 갓 절단 된 마이 카에 배양 한 후 PBS로 조심 스럽게 헹 구 어 (정전기가 없는) 입자가 제거 됩니다. HS-AFM 이미징을 수행 하 고 표면의 입자 밀도를 확인 합니다. 실 온에서 PBS로 측정을 수행 합니다. 이 그림의 상위 이미지는 너무 높은 입자 밀도를 보여줍니다. 하단 이미지는 분석에 적합 합니다. 단일 입자의 높이는 임계 화 및 고유 (검정 곡선) 및 재구성/표지 된 (적색 및 녹색 곡선) 입자를 통계적 인 평가에서 비교 하 여 분석 하였다. 스케일 바 = 100 nm. 이 그림은 Axmann 외19에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
miRNA 추출, 역 전사 및 qPCR
천연/인위적으로 농축 된 단백질 또는 세포 샘플 로부터 miRNA의 추출은 도 5a에 도시 된 바와 같이 miRNA 추출 키트를 사용 하 여 수행 하였다. 이로써 RNase가 없는 환경은 매우 중요 했습니다. 이 단계는 약 1 시간 정도 걸렸습니다. 추출 된 miRNA 샘플의 역 전사 (도 5b)는 제조자에 의해 기술 된 바와 같은 표준 생화학 적 절차를 사용 하 여 수행 하였다. 이 단계는 약 1.5 h를 했다. 최종적으로, 마지막 단계 동안 얻어진 cDNA의 양은 qPCR을 이용 하 여 측정 하였다 (도 5c). 얻어진 cq 값을 절대 miRNA 가닥 번호에 연관 시키는 표준 곡선은 초기 샘플의 절대 miRNA 컨텐츠를 산출 했습니다. 이것은 약 2.5 h를 했다.
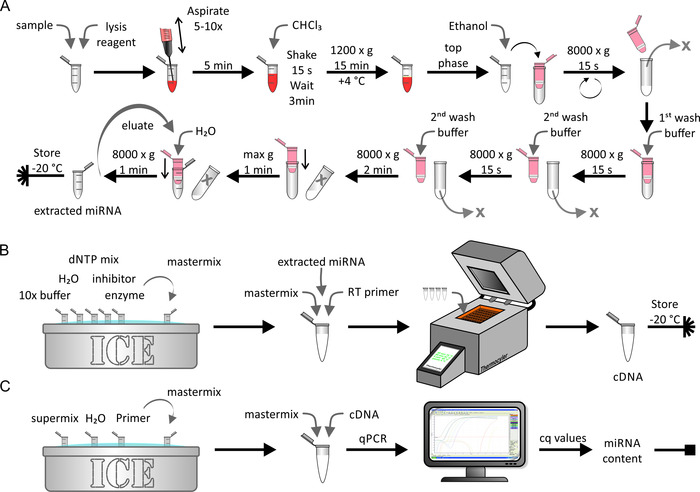
도 5: miRNA 추출, 역 전사 및 qPCR의 흐름도. (A) miRNA 추출: 샘플을 용 해 시 약과 혼합 하 고 주사기를 사용 하 여 흡 인을 통해 분해 합니다. 5 분간 배양 하 고 CHCl3을 추가 합니다. 15 초 동안 힘차게 흔들어 3 분간 배양 합니다. 1200 x g 에서 원심 분리 한 후 4°c에서 15 분 동안, 상부 상을 수집 하 고이를 에탄올과 혼합 한다. 용액을 스핀 칼럼 (최대 부피 < 700 µ L)으로 전송 하 고 15 초 동안 8000 x g 에서 원심 분리 합니다. 용 리 액을 버리고 나머지 용액으로 마지막 단계를 반복 하십시오. 첫 번째 세척 완충 액을 추가 하 고 15 초 동안 8000 x g 에서 원심 분리기를 첨가 합니다. 용 리 액을 버리고, 두 번째 세척 완충 액을 넣고, 15 초 동안 8000 x g 에서 원심 분리기를 추가 합니다. 마지막 단계를 2 분의 원심 분리 시간으로 반복 하십시오. 원심 분리를 통해 멤브레인을 최대 속도로 1 분 동안 더 건조 하 고, miRNA를 1분 동안 8만 x g 에서 원심 분리기를 사용 합니다. 추출 된 miRNA 샘플을-20°c에 보관 하십시오. (B) 역전사: 10 배 버퍼, H2o, dntp 혼합 억제제 및 얼음에 대 한 효소를 해 동 하 고 마스터 믹스를 준비 한다. 추출 된 miRNA를 패널 a 에서 마스터 믹스 및 역방향 전사 프라이 머에 추가 하 고 써 모 시스템을 사용 하 여 역 전사를 수행 한다. CDNA 샘플을-20°c에 보관 한다. (C) qpcr: 슈퍼 믹스를 동결 해제 하고 얼음에 프라이 머를 넣고 마스터 믹스를 준비 한다. CDNA를 패널 B 에서 마스터 믹스에 추가 하 고 qpcr을 수행 한다. 데이터를 분석 하 여 cq 값을 가져오고 샘플의 절대 miRNA 내용을 계산 합니다 ( 그림 6 및 자세한 내용은 대표적인 결과 참조). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
절대 miRNA 콘텐츠 및 전송 속도
네이티브 및 인위적으로 농축 된 HDL 및 LDL 입자의 절대 miRNA 함량은 도 6에 도시 된 바와 같이 각각의 miRNA의 샘플 및 표준 곡선의 cq 값 으로부터 계산 되었다. 도 6a 는 분석 소프트웨어에 의해 계산 된 데이터를 보여준다 (각각의 샘플 추적의 두 번째 미분을 사용 하 여 상이한 배경 레벨의 보상을 위한 활성화 된 dynamictube 정규화 ) 및 노이즈 슬로프 보정 [노이즈 레벨로 정규화]). 표준 곡선의 cq 값은 qpcr 기계에 의해 측정 된 정규화 된 형광 신호에 대 한 소프트웨어 패키지의 자동 찾기 임계 함수를 사용 하 여 결정 하였다. 이로써, 소프트웨어는 표준 곡선의 적합성의 R-값을 최대화 하였다. 임계 수준은 각 특정 miRNA 샘플 분석에 대해 일정 하 게 유지 되었다. 이어서, miRNA 가닥 수의 함수로 서 cq 값이 플롯 되 고 회귀 라인이 계산 되었다. 샘플 cq 값은 도 6b에 도시 된 바와 같은 임계 수준으로 결정 되었다; 상이한 qPCR 실행 들 간의 반응 효율 차이는 각 런에 포함 된 하나의 추가 검 량 곡선 샘플을 사용 하 여 소프트웨어에 의해 자동적으로 보상 되었다. 회귀 선 방정식을 사용 하 여 샘플에서 알 수 없는 양의 miRNA를 계산할 수 있습니다. 상기 단백 입자 수는 초기 단백질 농도 및 그것의 평균 분자량 (MWHDL ~ 250 kDa) 으로부터 추정 되었다. 이를 통해, 분자량에 대 한 지질 기여는 없다고 가정 하였다-따라서, 지 단백질 입자 당 miRNA 가닥의 수는 약간과 대 평가 되었다. 더욱이, miRNA 추출 단계 동안 miRNA의 100% 회수율을 가정 하였다. 더욱이, HDL 입자로 인큐베이션 전후의 세포의 miRNA 함량을 측정 하였으며, 도 6c에 도시 된 바와 같이 miRNA 전송률을 계산 하였다.
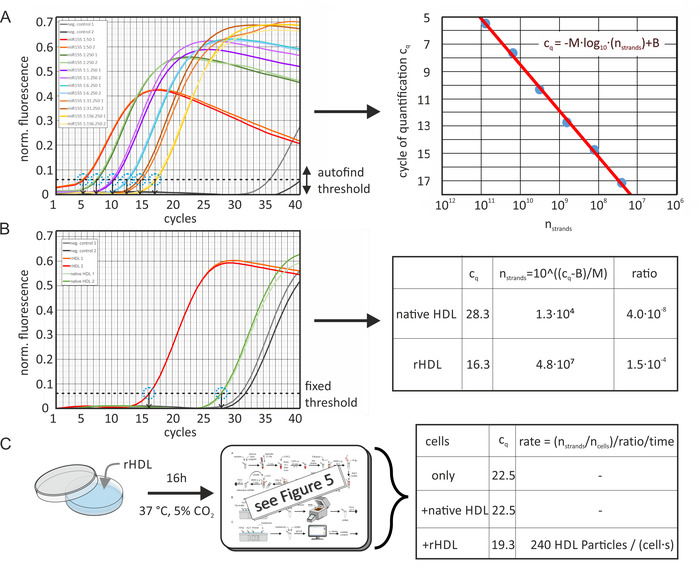
그림 6: 절대 miRNA 콘텐츠 및 전송 속도 계산 순서도. (A) 미르-155에 대 한 표준 곡선: mir-155 분 취 액 (100 µ, 10µ m)은 지시 된 바와 같이 RNA 없는 물로 순차적으로 희석 하였다. qPCR은 소프트웨어 패키지의 자동 찾기 임계값 기능을 사용 하 여 각 시리얼 희석 샘플에 대 한 cq 값 (2 회 측정)을 산출 했습니다. 음의 대조 실험 (miRNA의 추가 없이)은 > 35의 cq 값을 산출 했다. 샘플 부피 당 miRNA 가닥 수의 함수로 서의 cq 값의 데이터 포인트 (초기 농도 및 시리얼 희석 으로부터 계산)는 제시 된 방정식 (적색 선, 우측 이미지)에 끼워 지 며 M =-3.36을 산출 하 고 B = 42.12. 결정 된 PCR 효율은 0.98 이었다. 오차 막대는 실험적 반복의 결과 로부터 계산 되었고, 데이터 포인트 원의 직경 보다 작다. (B) cq /인위적으로 농축 된 HDL 입자의 값은 패널 A 에서 결정 된 것과 동일한 임계 수준으로 결정 되 고 Qpcr 샘플 부피에서의 miRNA 가닥의 수로 변환 되었다. 원본 시료의 miRNA의 절대 비율은 시료 부피 (3.2 입자)에서 HDL 입자의 수 (농도) 로부터 계산 하였다. (C) 세포 샘플 (세포 선 ldlA7)을 인위적으로 농축 된 HDL 입자 (50 µ/g)와 함께 16 시간 동안 인큐베이션 하 고 유사 하 게 분석 하였다. 결정 된cq 값은 세포에 대해서만 22.5, 22.5 및 19.3이 고, 세포에 대해서는 네이티브 hdl로 배양 되거나 rhdl 입자 용액 (모두 50 µ/g)으로 인큐베이션 된 세포에 대해 각각. 이러한 값은 패널 B에서 수행 되는 miRNA 가닥 수로 변환 되었습니다. 인큐베이션 후에 miRNA 가닥의 수 (7.3 x 106)는 인큐베이션 전 miRNA 가닥의 수를 감산 하 여 보정 하였다 (8.6 x105). 그 결과는 시료 부피 (3100)의 세포 수, miRNA의 입자 비 (1.5 x 104) 및 인큐베이션 기간 (16시간)으로 나누어진다. 이것은 miRNA 통풍 관 (세포 및 초 당 240 HDL 입자 흡수 이벤트)을 통해 단백 입자의 전송 속도를 산출 했습니다. 이 그림은 Axmann 외19에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
멀티 웰 미세 유체 어레이
MiRNA 추출의 작은 수율로 인해, 추출 된 miRNA의 역 전사는 전치 증폭 단계를 따른다. 마지막으로, 도 6에 도시 된 바와 같이, qpcr이 수행 되었다. 모든 단계에 대 한, 표준 생화학 절차는 제조 업체에 의해 설명 된 대로 사용 되었습니다. 여기서, 대 식 세포 (18 ) 로부터 콜레스테롤 불렀습니다에 대 한 CRF의 영향에 대 한 연구를 위해 모집 된 요 독 환자의 HDL 입자에 대 한 글로벌 miRNA 프로 파일의 일부가 도시 되어 있다. 이 연구에서, 콜레스테롤 수용 체 HDL 또는 혈 청에서-다른 사람 외에 — 17 젊은 성인 요 독 환자 (CKD 단계 3-5) 및 14 젊은 성인 혈액 투 석 환자 관련 된 질병 및 일치 하는 통제 없이 측정 하였다. 데이터를 분석 하기 위해 기본 설정이 사용 되었습니다 (최대 CT 값: 40.0, 계산에서 최대 CT 값을 포함 하 고 복제 간에 이상치 제외). P값은 Benjamini berg의 거짓 발견 율 (거짓 긍정의 발생에 대 한 정정)을 이용 하 여 조정 하였으며, 정규화 방법으로 서 글로벌 정상화 를 선택 하 여 모든 중에서 일반적인 분석 법을 찾는다. 중앙값을 사용 하 여 정규화 를 위해 샘플을 추출 합니다. 대표적인 결과에서, 요 독 환자의 HDLs 로부터 분리 된 miRNAs의 일부 RQs가 묘사 된다 (제어의 RQs는 1). 명백 하 게, miR-122 및 miR-224은 요 독 환자의 HDLs에서 높게 발현 된다. 이 전체 단계는 약 1 일이 걸렸습니다.
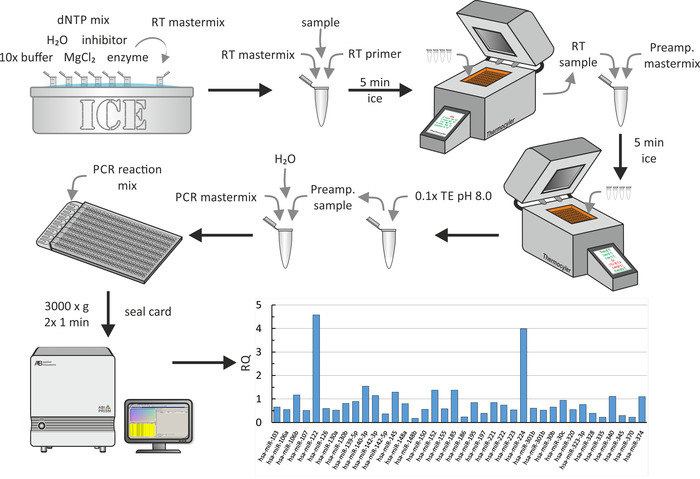
그림 7: 멀티 웰 미세 유체 어레이의 순서도 및 대표적인 결과. 도 5a에 도시 된 바와 같이 miRNA 추출 후, miRNA 샘플을 역방향 전사 프라이 머와 10 배 완충 액, H2o,Dntp 혼합 억제제, mgcl2및 효소를 포함 하는 마스터 믹스와 혼합 한다. 5 분간 얼음에 인큐베이션 한 후, 써 모 제를 사용 하 여 역 전사를 수행 한다. 프리 증폭 마스터 믹스를 추가 하 고, 얼음에서 5 분간 배양 한 후, 써 모 제 시스템을 사용 하 여 전치 증폭을 수행 합니다. 0.1xte (pH 8.0)를 추가 하 고 매 취를 PCR 마스터 믹스와 H2o를 혼합 한 후 pcr 반응 혼합을 다 웰 미세 유체 어레이의 충전 포트에 넣고 1 분 동안 3000 x g 에서 2 회 회전 시킵니다. PCR 시스템을 이용 하 여 qPCR을 수행 하 고 데이터를 분석 하 여 RQ 값을 산출 한다 (여기서, 건강 한 대조 군18에 비해 요 독 증 환자의 HDL 입자의 RQ 값을 보여준다). 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
여기서, 인간 혈액 으로부터 지 단백질 입자 분 획의 분리 및 그들의 개별적인 miRNA 함량의 결정은 단계별로 설명 된다. 분리 되 고 합성 된 miRNA를 처리 하는 동안 RNase가 없는 환경에서 작업 하는 것이 중요 합니다-입자-임베디드 miRNA는 분명히 효소 분해 로부터 보호 됩니다. 네이티브 지 단백질 입자의 miRNA/입자 비율이 다소 낮기 때문에, miRNA를 사용한 인공 농축은 세포의 홀로 입자 흡수를 연구 하는 데 필요 합니다. 따라서, 앞서 설명한 바와 같이 HDL 입자의 재구성 은 miRNA 가닥을 통합 하도록 변형 된다. 추가적으로,이 절차 도중 지질과 단백질 분 율의 별거는 과학자가 지 단백질 입자19의 지질 및 단백질 관련 성분을 검사할 것을 허용 합니다. 유사한 방법으로, LDL 입자의 라벨링 절차가 적응 된다. 흥미롭게도, miRNA의 자연 안정제 인 spermine을 첨가 하면 입자 비율에 영향을 미치지 않습니다. 원칙적으로,이 방법은 단백질 입자 내에서 miRNA 보다 다른 물질의 인 폴딩을 허용 한다는 점에 유의 해야 합니다. 물론 전체 크기의 HDL (지름: 5-12 nm) 및 LDL 입자 (직경: 18-25 nm)에 기초한 물질의 물리적 크기에 대해서는 한계가 있다.
재구성/라벨링 된 지 단백질 입자의 품질 관리와 관련 하 여, HS-AFM은 단일 입자 수준에서 HDL/LDL 입자를 특성화 하는 적용 가능한 방법입니다. EM에 비해, 그것은 짧은 준비 시간 및 가까운 생리 적 조건 (습식, 실 온)을 허용 한다.
고유 한 감도와 증폭으로 인해 qPCR은 낮은 miRNA 농도를 감지 하는 방법입니다. 양자 택일로, 개별 분자 조차 검출할 수 있는 단 하나 분자 과민 한 형광 현미경 검사 법은, 예를 들면, 입자 당 형광 표지 된 miRNA 가닥의 낮은 사격 량 때문에 적당 하지 않을 것입니다. 따라서, 네이티브 지 단백질 입자 당 miRNA 가닥의 비율은 10-8이 되는 것으로 밝혀졌다. 인공 농축은 세포 단백 흡수 율의 추정을 용이 하 게 하는 1만의 비율로 비율을 증가 시킵니다 (네이티브 지 단백질 입자 19를 사용 하 여 유의 한 차이가 검출 되지 않음). QPCR의 높은 감도는 인큐베이션 시간 및 miRNA/입자 비율 후에 miRNA 가닥의 수를 측정 하 여이 흡수 율을 결정할 수 있게 합니다. 계산 된 값은 세포 분해 및 miRNA의 방출을 무시 하 고, 따라서, 지 단백질 입자 흡수 율에 대 한 적어도 낮은 제한을 나타낸다.
앞으로,이 방법은 세포에서 제약 물질 (특히 친 유성 것 들)을 전달 하 고 세포내 농도에 대 한 그들의 생물학적 효과를 상관 (지 단백질 입자의 흡수 율을 통해 결정) 하도록 조정 될 수 있다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 작품은 오스트리아 과학 기금 프로젝트 P29110-B21, "Hochschuljubiläumsstiftung 더 슈 타트 빈 주 르 푀 르 더 위 즈 센 뒤" 프로젝트 H-3065/2011, 지역 개발을 위한 유럽 기금 (EFRE, IWB2020), 어퍼의 연방 국가에 의해 지원 되었다 오스트리아, 그리고 "토지 오에 바 시 핀 안 쯔 렁".
자료
| Name | Company | Catalog Number | Comments |
| Ultracentrifuge | Beckman | Optima L-100 XP | Lipoprotein isolation |
| Ultracentrifuge rotor | Beckman | TI 55.2 | Lipoprotein isolation |
| Vacutainer (EDTA) | Becton Dickinson | 366643 | Lipoprotein isolation |
| Kaliumbromid | Sigma Aldrich | 2110 | Lipoprotein isolation |
| Ultracentrifuge tubes | Beckman | 342414 | Lipoprotein isolation |
| Ultracentrifuge tube sealer | Beckman | 342428 | Lipoprotein isolation |
| Sodiumchlorid | Carl Roth GmbH | P029.2 | Lipoprotein isolation |
| EDTA | Fisher Scientific | D/0650/50 | Lipoprotein isolation |
| Dialysis tubes, MWCO 12 - 14k | Spectra | 132700 | Lipoprotein isolation |
| synthetic miRNA | microSynth | - | synthetic miRNA |
| TRIS buffer pH 7 | Ambion | AM9850G | synthetic miRNA |
| TRIS buffer pH 8 | Ambion | AM9855G | synthetic miRNA |
| sterile tubes | Carl Roth GmbH | ENE8.1 | synthetic miRNA |
| Photometer | Eppendorf | Eppendorf Biophotometer | Bradford assay |
| Cuvette | Carl Roth GmbH | XK20 | Bradford assay |
| Coomassie G-250 Stain | BioRad GmbH | 161-0786 | Bradford assay |
| Sodiumchlorid | Carl Roth GmbH | 3957.1 | Delipitation |
| EDTA | Fluka Analytical | 03690-100ML | Delipitation |
| TRIS buffer pH 8.0 | Ambion | AM9855G | Delipitation |
| Ethanol 100% | AustrAlco | Ethanol Absolut 99.9% | Delipitation |
| Diethyl ether | Carl Roth GmbH | 3942.1 | Delipitation |
| Centrifuge | Thermo Scientific | Multifuge X3R | Delipitation |
| Chloroform | Carl Roth GmbH | 3313.1 | Reconstitution |
| Methanol | Carl Roth GmbH | 4627.1 | Reconstitution |
| Phosphatidylcholine | Sigma Aldrich GmbH | P3556-25mg | Reconstitution |
| Cholesterol oleate | Sigma Aldrich GmbH | C-9253-250mg | Reconstitution |
| cholesterol | Sigma Aldrich GmbH | C8667-500mg | Reconstitution |
| glass tubes | Carl Roth GmbH | K226.1 | Reconstitution |
| spermine | Sigma Aldrich GmbH | S3256-1G | Reconstitution |
| Thermomixer | Eppendorf | Thermomixer comfort | Reconstitution |
| Sodium deoxycholate | Sigma Aldrich GmbH | 3097-25G | Reconstitution |
| Magnetic stir bar | Carl Roth GmbH | 0955.2 | Reconstitution |
| 100µL micropipettes | Carl Roth GmbH | A762.1 | Reconstitution |
| PBS | Carl Roth GmbH | 9143.2 | Dialysis |
| Amberlite XAD-2 beads | Sigma Aldrich GmbH | 10357 | Dialysis |
| Slide-A-Lyzer casette (cut-off 20 kDa) | Thermo Scientific | 66003 | Dialysis |
| Syringe | Braun | 9161406V | Dialysis |
| Syringe needle | Braun | 465 76 83 | Dialysis |
| EGTA | Carl Roth GmbH | 3054.2 | Labeling of LDL particles |
| DMSO | life technologies | D12345 | Labeling of LDL particles |
| Atomic Force Microscope | RIBM | SS-NEX | Quality control of reconstituted/labeled lipoprotein particles |
| Muscovite Mica (V-1 Grade) | Christine Gröpl | G250-1/V1 | Quality control of reconstituted/labeled lipoprotein particles |
| AFM Cantilever | Nanoworld | USC-F1.2-k0.15 | Quality control of reconstituted/labeled lipoprotein particles |
| Gwyddion 2.49 | Czech Metrology Institute | http://gwyddion.net | Quality control of reconstituted/labeled lipoprotein particles |
| Chamber slides, Nunc Lab-Tek | VWR | 734-2122 | Cell culture |
| HBSS | Carl Roth GmbH | 9117.1 | Cell culture |
| Cell counter | Omni Life Science GmbH | Casy | Cell culture |
| miRNeasy Mini Kit | QIAGEN | 217004 | miRNA extraction |
| Centrifuge | Eppendorf | 5415R | miRNA extraction |
| 20G needle | Braun | Sterican 465 75 19 | miRNA extraction |
| 5ml syringe | Becton Dickinson | 309050 | miRNA extraction |
| PCR cabinet | Esco | PCR-3A1 | Reverse Transcription |
| TaqMan Reverse Transcription Kit | Thermo Scientific | 4366596 | Reverse Transcription |
| Rnase-free water | Carl Roth GmbH | T143 | Reverse Transcription |
| 0.2 ml tubes | Brand | 781305 | Reverse Transcription |
| Centrifuge | Carl Roth GmbH | Microcentrifuge AL | Reverse Transcription |
| Thermocycler | Sensoquest | Labcycler | Reverse Transcription |
| TaqMan Primer | Thermo Scientific | - | qPCR |
| iTaq Universal probe supermix | BioRad GmbH | 1725131 | qPCR |
| PCR machine | Corbett | Rotor-Gene RG-6000 | qPCR |
| TaqMan MicroRNA Reverse Transcription Kit | Applied Biosystems | 4366596 | TaqMan Array |
| Megaplex RT Primers, Human Pool A v2.1 | Applied Biosystems | 4399966 | TaqMan Array |
| TaqMan PreAmp Master Mix | Applied Biosystems | 4391128 | TaqMan Array |
| Megaplex PreAmp Primers, Human Pool A v2.1 | Applied Biosystems | 4399933 | TaqMan Array |
| TaqMan Universal Master Mix II, no UNG | Applied Biosystems | 4440040 | TaqMan Array |
| TaqMan Advanced miRNA Human A Cards | Applied Biosystems | A31805 | TaqMan Array |
| Nuclease-free water | Thermo Scientific | R0581 | TaqMan Array |
| MgCl2 (25mM) | Thermo Scientific | R0971 | TaqMan Array |
| TE, pH 8.0 | Invitrogen | AM9849 | TaqMan Array |
| 7900HT Fast Real-Time PCR System | Applied Biosystems | 4351405 | TaqMan Array |
| TaqMan Array Card Sealer | Applied Biosystems | - | TaqMan Array |
참고문헌
- Vickers, K. C., Palmisano, B. T., Shoucri, B. M., Shamburek, R. D., Remaley, A. T. MicroRNAs are transported in plasma and delivered to recipient cells by high-density lipoproteins. Nature Cell Biology. 13 (4), 423-435 (2011).
- Tabet, F., et al. HDL-transferred microRNA-223 regulates ICAM-1 expression in endothelial cells. Nature Communications. 5, (2014).
- Wahid, F., Shehzad, A., Khan, T., Kim, Y. Y. MicroRNAs: Synthesis, mechanism, function, and recent clinical trials. Biochimica et Biophysica Acta - Molecular Cell Research. 1803 (11), 1231-1243 (2010).
- Carthew, R. W., Sontheimer, E. J. Origins and Mechanisms of miRNAs and siRNAs. Cell. 136 (4), 642-655 (2009).
- Fabian, M. R., Sonenberg, N., Filipowicz, W. Regulation of mRNA Translation and Stability by microRNAs. Annual Review of Biochemistry. 79 (1), 351-379 (2010).
- Filipowicz, W., Bhattacharyya, S. N., Sonenberg, N. Mechanisms of post-transcriptional regulation by microRNAs: Are the answers in sight?. Nature Reviews Genetics. 9 (2), 102-114 (2008).
- Jonas, A. Reconstitution of High-Density Lipoproteins. Methods in Enzymology. , 553-582 (1986).
- Ando, T., Uchihashi, T., Kodera, N. High-Speed AFM and Applications to Biomolecular Systems. Annual Review of Biophysics. 42 (1), 393-414 (2013).
- Bustin, S. A., et al. The MIQE Guidelines: Minimum Information for Publication of Quantitative Real-Time PCR Experiments. Clinical Chemistry. 55 (4), 611-622 (2009).
- Patsch, J. R., Patsch, W. Zonal ultracentrifugation. Methods in Enzymology. 129 (1966), 3-26 (1986).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry. 72 (1-2), 248-254 (1976).
- Yamamoto, D., et al. High-Speed Atomic Force Microscopy Techniques for Observing Dynamic Biomolecular Processes. Methods in Enzymology. 475, 541-564 (2010).
- Stangl, H., Cao, G., Wyne, K. L., Hobbs, H. H. Scavenger receptor, class B, type I-dependent stimulation of cholesterol esterification by high density lipoproteins, low density lipoproteins, and nonlipoprotein cholesterol. Journal of Biological Chemistry. 273 (47), 31002-31008 (1998).
- Hochberg, B. Controlling the False Discovery Rate: a Practical and Powerful Approach to Multiple Testing. Journal of the Royal Statistical Society. 57 (1), 289-300 (1995).
- Mestdagh, P., et al. A novel and universal method for microRNA RT-qPCR data normalization. Genome Biology. 10 (6), (2009).
- Schumaker, V. N., Puppione, D. L. 6] Sequential Flotation Ultracentrifugation. Methods in Enzymology. 128 (C), 155-170 (1986).
- Wagner, J., et al. Characterization of levels and cellular transfer of circulating lipoprotein-bound microRNAs. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1392-1400 (2013).
- Meier, S. M., et al. Effect of chronic kidney disease on macrophage cholesterol efflux. Life Sciences. 136, 1-6 (2015).
- Axmann, M., et al. Serum and Lipoprotein Particle miRNA Profile in Uremia Patients. Genes. 9 (11), 533 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유