Method Article
시험관 내 및 실리코 방법을 사용한 그룹 IV 바이러스 성 SSHHPS 분석
요약
우리는 바이러스성 다단백질에 내장된 상동 호스트 병원체 단백질 서열(SSHHPS)의 짧은 스트레칭을 확인하기 위한 일반적인 프로토콜을 제시한다. SSHHPS는 바이러스 성 프로테아제에 의해 인식되고 여러 그룹 IV 바이러스에 의해 특정 숙주 단백질의 표적 파괴를 지시한다.
초록
알파바이러스 효소는 단일 폴리펩티드에서 합성됩니다. 비구조적 다단백(nsP)은 nsP2 시스테인 프로테아제에 의해 처리되어 바이러스 복제에 필수적인 활성 효소를 생성합니다. 바이러스성 프로테아제는 매우 특이적이고 보존된 분열 부위 모티프 서열(~6-8 아미노산)을 인식한다. 여러 그룹 IV 바이러스에서, nsP 프로테아제(들) 절단 부위 모티프 서열은 선천적인 면역 반응을 생성하는 데 관여하는 특정 숙주 단백질에서 발견될 수 있으며, 경우에 따라 표적 화된 단백질은 바이러스 유발 표현형에 연결되는 것으로 보인다. 이 바이러스는 호스트 단백질의 표적으로 한 파괴를 위한 상동 호스트 병원체 단백질 서열 (SSHHPS)의 짧은 뻗어를 이용합니다. SSHHPS를 식별하기 위해 바이러스 성 프로테아제 절단 부위 모티프 서열을 BLAST로 입력할 수 있고 숙주 게놈(들)을 검색할 수 있다. 분열은 초기에 대장균에서만들어진 정제된 nsP 바이러스 성 프로테아제 및 형광 공명 에너지 전달(FRET) 기판을 사용하여 시험될 수 있다. FRET 기질은 청색 및 황색 형광 단백질 및 절단 부위 서열(CFP-서열-YFP)을 함유한다. 이러한 프로테아제 분석제는 플레이트 리더에서 지속적으로 사용되거나 SDS-PAGE 겔에서 연속상으로 사용될 수 있다. 결합된 펩티드 기판의 모델은 실리코에서 생성되어 기질 선택 및 돌연변이 발생 연구를 안내할 수 있다. CFP/YFP 기판은 또한 프로테아제 억제제 식별에 활용되었습니다. 이러한 시험관내 및 실리코 방법에서는 표적 숙주 단백질이 바이러스 복제에 영향을 미치는지 확인하기 위해 세포 기반 세포 기반 검사법과 함께 사용될 수 있다.
서문
바이러스에서 호스트로 또는 호스트에서 바이러스로의 수평 유전자 전달의 증거는 다양한 게놈1,2,3,4에서찾을 수 있습니다. 바이러스 내인성화의 예는 세균 숙주 게놈4에서발견되는 CRISPR 스페이서 서열이다. 최근에, 우리는 (+)ssRNA 그룹 IV 바이러스의 비구조적 다단백질에 내장된 숙주 단백질 서열의 증거를 발견했다. 바이러스 게놈의 코딩 영역 내에서 이러한 서열은 세대적으로 전파될 수 있다. 상동 숙주-병원체 단백질 서열(SSHHPS)의 짧은 스트레칭은 바이러스 및 숙주5,6에서발견된다. SSHHPS는 특정 숙주 단백질에 대한 상동성을 가지는 바이러스 성 프로테아제에 의해 인식된 보존된 분열 부위 모티프 서열이다. 이 서열은 특정 숙주 단백질의 파괴를 지시합니다.
우리의 이전 간행물6에서,우리는 바이러스 성 프로테아제에 의해 표적으로 된 모든 숙주 단백질의 목록을 컴파일하고 표적의 목록이 무작위가 아닌 것을 발견했습니다(표 1). 두 가지 추세가 분명했다. 먼저, 숙주 단백질을 절단하는 대부분의 바이러스 성 프로테아제는 그룹 IV 바이러스(25건 중 24건 중 24개 그룹 IV 바이러스 프로테아제)에 속하며, 1개의 프로테아제는 (+)ssRNA 그룹 VI 레트로바이러스(HIV, 인간 면역 결핍바이러스)에속한다. 7. 둘째, 바이러스 성 프로테아제에 의해 절단되는 숙주 단백질 표적은 일반적으로 분열이 숙주의 면역 반응을 길항하기 위한 것이었다는 것을 시사하는 선천적인 면역 반응을 생성하는데 관여했다. 바이러스 성 프로테아제에 의해 표적화된 숙주 단백질의 절반은 인터페론(IFN) 및 전염증성 사이토카인을 생성하는 시그널링 캐스케이드의 공지된 성분이었다(표1). 다른 사람들은 숙주 세포 전사8,9,10 또는 번역11에관여했다. 흥미롭게도, Shmakov 외4 많은 CRISPR 프로토스페이서 서열이 플라스미드 컨쥬게이션 또는복제에관여하는 유전자에 대응하는 것으로 나타났다 4.
그룹 IV에는 플라비리대, 피코나비리대, 코로나비리대, 칼시비리대, 토가비리대등이 포함됩니다. 몇몇 새로운 신흥 병원체는 Zika 바이러스 (ZIKV), 서쪽 나일강 (WNV), Chikungunya (CHIKV), 가혹한 심각한 호흡 증후군 바이러스 (SARS) 및 중동 호흡기 증후군 바이러스 (MERS)와 같은 그룹 IV에 속합니다. (+)ssRNA 게놈은 본질적으로 mRNA의 한 조각이다. 게놈 복제에 필요한 효소를 생성하기 위해, (+)ssRNA 게놈을 먼저 번역해야 한다. 알파바이러스 및 기타 그룹 IV 바이러스에서 복제에 필요한 효소는 단일 다단백질(즉, VEEV를 위한 nsP1234)에서 생성됩니다. 비구조적 다단백체(nsP)는 nsP2 프로테아제에 의해 프로테올리스 처리(nsP1234 nsP1, nsP2, nsP3, nsP4)로 활성효소를 생성한다(도1). nsP2 프로테아제에 의한 다단백질의 분열은 바이러스 복제에 필수적이다; 이는 nsP2 프로테아제13,14의활성 부위 시스테인의 결실 및 부위 지시 돌연변이 발생에 의해 입증되었다. 특히, 바이러스 성 단백질의 번역은 게놈 복제 사건을 선행합니다. 예를 들어, nsP4는 (+)ssRNA 게놈을 복제하는 데 필요한 RNA 의존성 RNA 폴리머라제를 함유한다. 게놈 복제는 dsRNA 중간을 생성할 수 있습니다; 이 중간체는 호스트의 타고난 면역 반응을 시작할 수 있습니다. 따라서, 이들 바이러스는 그들의 효과를 억제하기 위해 감염 초기에 숙주 면역 반응단백질을 15,16,17로갈라놓을 수 있다.
침묵은 DNA, RNA 및 단백질 의 수준에서 생길 수 있습니다. 도 1에 나타난 각 침묵 기전에서 공통되는 것은 짧은 외래 DNA, RNA 또는 단백질 서열이 그들의 기능을 길항하기 위해 특정 표적의 파괴를 유도하는 데 사용된다는 것입니다. 침묵 메커니즘은 세 가지 다른 언어로 작성된 "검색 및 삭제" 프로그램과 유사합니다. 짧은 분열 사이트 시퀀스는 "키워드"와 유사합니다. 각 프로그램에는 삭제할 "파일"의 짧은 시퀀스("키워드")와 단어 간의 일치를 인식하는 효소가 있습니다. 일치하는 것이 발견되면 효소는 더 큰 표적 서열을 잘라내게 됩니다("삭제"). 그림 1에 표시된 세 가지 메커니즘은 호스트를 바이러스로부터 방어하거나 호스트의 면역 체계로부터 바이러스를 방어하는 데 사용됩니다.
바이러스 성 프로테아제는 ~ 2-11 아미노산 사이의 짧은 절단 부위 모티프 서열을 인식; 뉴클레오티드에서, 이것은 6-33 염기와 일치합니다. 비교를 위해, CRISPR 스페이서 서열은 ~26-72 뉴클레오티드 및 RNAi는 ~20-22 뉴클레오티드18,19이다. 이러한 서열은 비교적 짧지만 구체적으로 인식할 수 있습니다. 아미노산의 높은 다양성을 감안할 때, 무작위 분열 이벤트의 확률은 6-8 아미노산 이상 단백질 서열을 인식하는 바이러스 성 프로테아제에 대해 상대적으로 낮다. 숙주 단백질에서 SSHHPS의 예측은 주로 검사되는 바이러스 성 단백질의 특이성에 달려 있습니다. 프로테아제에 엄격한 서열 특이성 요구 사항이 있는 경우, 분열 부위 서열을 찾을 확률은 6,400만 개에1/20 6 = 1/208 = 1 에서 256억; 그러나 대부분의 프로테아제에는 가변 하위 사이트 허용 오차가 있습니다(예: R 또는 K는 S1 사이트에서 허용될 수 있음). 따라서 호스트에서 발견된 서열과 바이러스 간의 서열 ID에 대한 요구 사항은 없습니다. 느슨한 서열 요구 사항이 있는 바이러스 성 프로테아제의 경우(예: 피코나비리대에 속하는 것) 숙주 단백질에서 분열 부위를 찾을 확률이 더 높을 수 있다. 표 1의 많은 항목은 피코나비리대 가족입니다.
Schechter & Berger 표기법20은 일반적으로 프로테아제 기판 및 이들이 결합하는 서브사이트에서 잔기를 기술하는 데 사용되며, 우리는 이 표기법 전반에 걸쳐 활용한다. 가위 결합의 N-말단인 기판내의 잔기는 P3-P2-P1로 표시되고 C-단말은 P1'-P2'-P3'로 표시된다. 이들 아미노산 잔기와 결합하는 프로테아제의 상응하는 하위 부위는 각각 S3-S2-S1 및 S1'-S2'-S3'입니다.
어떤 숙주 단백질이 표적으로 되고 있는지 결정하기 위하여는, 우리는 바이러스성 다단백질 분열 사이트에 있는 SSHHPS를 확인하고 그(것)들을 포함하는 호스트 단백질을 검색할 수 있습니다. 본 명세서에서, 우리는 공지된 바이러스 성 프로테아제 절단 부위 서열을 사용하여 SSHHPS를 식별하기 위한 절차를 간략하게 설명한다. 생물정보학 방법, 프로테아제 검법 및 기재된 실리코 방법에서 세포 기반 검법과 함께 사용되기 위한 것이다.
바이러스 성 프로테아제에 의해 표적으로 한 숙주 단백질의 서열 정렬은 이 짧은 분열 사이트 서열 내의 종 특정 다름을 밝혔습니다. 예를 들어, 베네수엘라 말 뇌염 바이러스(VEEV) nsP2 프로테아제는 인간 TRIM14, 삼자모티프(TRIM) 단백질6을절단하는 것으로 나타났다. 일부 TRIM 단백질은 바이러스 제한 인자(예를 들어, TRIM5α21)이며,대부분은 유비퀴틴 E3 리가제인 것으로 생각된다. TRIM14는 링 (정말 흥미로운 새로운 유전자) 도메인이 부족하고 E3 ligase22로생각되지 않습니다. TRIM14는 미토콘드리아 항바이러스 신호(MAVS)22에서어댑터로 제안되었으나, 다른 항바이러스 기능을 가질 수있다(23). 다양한 종에서 TRIM14 서열의 정렬은 말절단 사이트가 부족하고 C 말단 PRY / SPRY 도메인이 누락 된 TRIM14의 잘린 버전을 항구 것을 보여줍니다. 이 도메인에는 폴리유비퀴틴화 사이트가 포함되어있습니다(그림 2). 말에서, 이 바이러스는 높게 치명적입니다 (~20-80% 사망) 반면 인간에서는 단지 ~1% VEEV 감염에서정지24. PRY/SPRY 도메인의 분열은 MAVS 시그널링 캐스케이드를 일시적으로 단락시킬 수 있다. 이 캐스케이드는 dsRNA에 의해 시작될 수 있고 인터페론 및 프로 염증성 사이토카인의 생산으로 이끌어 냅니다. 따라서, SSHHPS의 존재는 어떤 종들이 특정 그룹 IV 바이러스에 대한 방어 시스템을 가지고 있는지 예측하는데 유용할 수 있다.
그룹 IV 바이러스에서, IFN 길항 메커니즘은25를곱하는 것으로 생각된다. 숙주 단백질 절단은 감염 도중 일시적일 수 있고 사격량은 시간이 지남에 복구할 수 있습니다. 우리는 TRIM14 분열 제품이 프로테아제 (cytomegalovirus 프로모터)를 코딩하는 플라스미드와 함께 형질감염 (6 시간) 후에 아주 일찍 검출될 수 있었다는 것을 세포에서 찾아냈습니다. 그러나, 더 긴 기간에, 분열 제품은 검출되지 않았습니다. 바이러스에 감염된 세포에서는, 역학은 달랐고 분열 제품은 6-48 h6사이에서 검출될 수 있었습니다. 그 외는 3-6 시간 포스트 감염9,11로일찌기 호스트 단백질 분열 제품의 외관을 보고했습니다.
세포에서 의 체액 활성은 종종 잡기 어렵다; 분열 제품은 용해도, 집중력, 안정성 및 수명이 다를 수 있습니다. 세포 기반 세포 기반 세포 에서, 절단 제품이 세포에 축적되거나 절단 된 단백질의 밴드 강도가 매우 빠르게 저하 될 수 있으며 예상 분자량 (MW)에서 서양 얼룩에서 검출되지 않을 수 있으므로 보상 증가 및 감소를 보일 것이라고 가정 할 수 없습니다 (예를 들어, epitope를 포함하는 영역은 다른 숙주 protins에 의해 절단 될 수 있음). 바이러스 성 프로테아제의 기질이 선천적인 면역 반응 단백질인 경우, 감염 시 농도가 달라질 수 있다. 예를 들어, 일부 선천성 면역 반응 단백질은 바이러스 감염 이전에 존재하며 인터페론26에의해 추가로 유도된다. 표적 단백질의 농도는 감염 시 변동될 수 있으며 감염되지 않은 세포 와 감염된 세포 리세이스의 비교는 해석하기 어려울 수 있다. 추가적으로, 모든 세포는 균일하게 형질 감염되거나 감염되지 않을 수 있습니다. 반면에 대장균에서 정제된 단백질을 이용한 시험관내 프로테아제 분석실험은 면역혈전이 아닌 SDS-PAGE를 사용하여 조절할 수 있는 변수가 적다. 오염 프로테아제는 CFP/YFP 기판의 단백질 정제의 초기 단계에서 억제될 수 있으며, 돌연변이된 바이러스 성 프로테아제는 분열이 바이러스 성 프로테아제 또는 오염된 세균 성 프로테아제 때문인지 를 결정하기 위한 대조군으로서 정제 및 테스트될 수 있다.
시험관 내 프로테아제 시험법의 한 가지 제한은 포유류 세포의 복잡성이 부족하다는 것입니다. 효소가 기판을 절단하려면 두 가지를 공동 국소화해야 합니다. 그룹 IV 바이러스 성 프로테아제는 구조 및 국소화가 다릅니다. 예를 들어, ZIKV 프로테아제는 소포체(ER) 막에 내장되어 시토솔을 마주하는 반면, VEEV nsP2 프로테아제는 세포질 및핵(27)에서용해성 단백질이다. ZIKV SSHHPS 분석에서 발견된 일부 절단 부위 서열은 일부 표적에 대해 공동 번역으로 발생할 수 있음을 시사하는 신호 펩티드에 있었다. 따라서, 세포 내의 프로테아제 및 기판의 위치또한 이러한 분석에서 고려될 필요가 있다.
세포 기반 세포 계 검사는 감염에서 확인된 숙주 단백질(들)에 대한 역할을 확립하는 데 유용할 수 있다. 프로테아제 억제제6 또는 돌연변이를 숙주표적(16)에 첨가하는 것과 같은 숙주 단백질의 바이러스 성 프로테아제 절단을 중단시키는 것을 목표로 하는 방법은 바이러스 복제에 대한 그들의 효과를 조사하기 위해 사용될 수 있다. 표적 단백질의 과발현은 또한 바이러스 복제에 영향을 미칠 수 있다28. 플라크 검사 또는 다른 방법은 바이러스 복제를 정량화하는 데 사용될 수 있다.
프로토콜
1. 생물 정보학: BLAST를 사용하여 호스트 게놈에서 SSHHPS식별
참고: 단백질 폭발은 blast.ncbi.nlm.nih.gov/Blast.cgi 찾을 수 있습니다.
- 입력 ~20 바이러스 성 다단백에 가위 결합을 둘러싼 아미노산. 비-중복 단백질 서열을 선택하고 검색할 숙주 게놈에서 유형(예를 들어, 호모 사피엔스).
- 필요한 경우 PHI-BLAST를 선택합니다. 패턴 서열에 입력(예를 들어, 아래에 도시된 V12의 25잔기의 경우 따옴표 없이 패턴 "AG"를 입력).

참고: PHI-BLAST에서, 사각 브래킷 [XY]는 아미노산 X 또는 Y가 하위 사이트 위치(예: AG[AC][GAY])에 있을 수 있음을 나타냅니다. - BLAST 결과를 검사하고 다단백질 절단 부위에 보존되는 잔기(예를 들어, 삼자모티프 단백질 14)에 높은 서열 동일도를 가지는 안타를 식별한다(그림3).
참고: 세린 프로테아제의 경우 P1 잔기의 더 높은 보존이 예상되는 반면, 시스테인 프로테아제의 경우 P2 잔기의 더 높은 보존이 예상된다. - 분열 부위 서열과 동일하고 순차적 순서(간격 없음)인 잔류물을 채색합니다. 잔류물을 서브사이트에서 허용하지만, 제2색으로 다른 분열 부위에 존재한다.
참고: 바이러스 성 분열 부위에 존재하지 않는 보수적 인 치환 (예를 들어, Leu 대 Val)을 나타내는 잔기는 또한 바이러스 성 프로테아제에 의해 인식될 수도 있고 인식되지 않을 수도 있다. - 연속적으로 동일하거나 허용되는 잔기의 수를 기준으로 BLAST 조회순위를 정렬하여 분열 사이트 시퀀스와 일치합니다. 목록에서, 프로테아제 분석에서 분석을 위해 ≥6 동일하거나 유사한 잔기들을 포함하는 단백질을 선택한다.
- 다른 분열 부위(nsP2/3, nsP3/4 등)에 대한 절차를 반복하고 PHI-BLAST 패턴에 더 높은 보존 잔류물을 추가하여 예측을 점진적으로 강화합니다.
- 필요한 경우 PHI-BLAST를 선택합니다. 패턴 서열에 입력(예를 들어, 아래에 도시된 V12의 25잔기의 경우 따옴표 없이 패턴 "AG"를 입력).
2. 시험관 내 어소시에이션: 프로테아제 기판 설계 및 준비
- 청색 형광 단백질(CFP)을 코딩하는 플라스미드를 구성하고, 절단 부위 서열의 ≤25 아미노산을 생성하고, 이어서 황색 형광 단백질(YFP, 일명 비너스29)을생성한다.
참고: 플라스미드는 서열 및 결찰 독립적인 복제(SLIC)30 또는 상업적 유전자 합성을 사용하여 시공될 수 있다. 도 4에 도시된 서열을 포함하는 pet15b 플라스미드를 상업적으로 합성하고 여기에 사용되었다.- 기판 길이를 최적화하기 위해, 2-단편 SLIC 반응을 이용하여 천연 바이러스 성 다단백 분열 부위 서열의 12-25 아미노산을 함유하는 추가가변 길이 FRET 기판을 구성한다. SDS-PAGE 겔 기반 분석을 사용하거나 아래 방법을 사용하여 정상 상태 운동 파라미터를 측정하여 절단을 분석합니다.
참고: 일부 경우에, 분열 부위는 공지된 분열부위(31)에대한 상동성에 의해 식별될 수 있다. 다단백 접합 서열을 포함하는 기판의 절단이 관찰되지 않는 경우, 추가의 잔기 또는 구조적 모티프(예를 들어, 알파 나선32)에대한 요구가 있을 수 있다. 대안적으로, 정제된 바이러스 성 프로테아제는 비활성일 수 있다. SSHHPS 분석을 추구하기 전에 바이러스 성 다단백 서열의 절단을 확인합니다. 기판 내의 잔기 의 수는 Vmax 및 Km32,33의분석에 이어 가변 길이 기판(12~25아미노산)을 사용하여 VEEV 프로테아제에 최적화되었다. 예시에 사용된 Zika 바이러스 성 ns2B/nsB 프로테아제 분열 부위는34,35.
- 기판 길이를 최적화하기 위해, 2-단편 SLIC 반응을 이용하여 천연 바이러스 성 다단백 분열 부위 서열의 12-25 아미노산을 함유하는 추가가변 길이 FRET 기판을 구성한다. SDS-PAGE 겔 기반 분석을 사용하거나 아래 방법을 사용하여 정상 상태 운동 파라미터를 측정하여 절단을 분석합니다.
- BL-21(DE3)의 8-20 μL을 새로 변형하여 CFP/YFP 기판을 준비합니다.E. coli50 μg/mL Ampicillin (37 °C)를 포함하는 루리아 베르타니 (LB) 한천 판에 제조 업체의 지시 및 플레이트에 따라 CFP-V12-YFP 플라스미드와 유능한 세포.
- 250 mL 플라스크에서 LB 미디어 (플라스크 당 1.5 L 미디어)와 100 mL의 LB를 포함하는 4 개의 4 L 플라스크를 오토 클레이브하십시오. 각 플라스크를 알루미늄 호일로 캡합니다.
- 100 mL 배양을 갓 형질전환된 박테리아의 콜로니와 함께 접종하고 밤새 흔들림(200 rpm)으로 37°C에서 성장시킨다.
- CFP/YFP 기판을 만들기 위해 4개의 4L 플라스크를 25 mL의 야간 배양물로 접종합니다. 37°C에서 배양을 흔들기 시작하고 시간당 600 nm에서 UV-vis 분광법에 의한 성장을 모니터링합니다.
- 박테리아가 600 nm에서 ~1.0의 흡광도에 도달하면 (성장의 약 ~ 3-4 시간) 플라스크 당 1 M isopropyl-β-D-티오 갈라크토사이드 (IPTG)의 0.5 mL을 추가하여 단백질 발현을 유도한다. IPTG를 첨가한 후, 떨이 인큐베이터의 온도를 17°C로 낮추고 17-20시간 동안 밤새 발현을 계속하도록 한다.
- 7,000 x g에서 10분(4°C)의 고속 원심분리기를 사용하여 박테리아를 펠릿(pellet)을 유지한다. 액체 매체를 제거하고 폐기합니다. 펠릿을 -80°C또는 용해즉시 보관하십시오.
- 50 mM Tris pH 7.6, 500 mM NaCl, 35 mL의 박테리아 단백질 추출 시약, 30 mg의 리소자임, 25 U의 DNase 및 1 프로테아제 억제제 정제를 포함하는 용해 완충제 100 mL을 준비하십시오. 파이펫으로 용해 완충액에 펠릿을 다시 중단하고 ~ 25-35 mL을 50 mL 일회용 원엽 튜브로 옮김.
- 얼음물이 들어있는 플라스틱 비커에 튜브를 놓습니다. 초음파 처리기 팁을 튜브 바닥에 ~ 1cm가 되도록 튜브에 삽입하고 용해기가 유체및 액화가 될 때까지 레벨 5에서 10-20 회 용해를 초음파 처리합니다.
참고: 초음파 처리 중에 청력 보호구를 사용하십시오. - 용해액을 4 °C에서 30 분 동안 20,500 x g에서 고속 원심 분리튜브 및 원심 분리기로 옮긴다. 스핀 후 상층부(~100 mL)를 유지하고 깨끗한 병으로 옮김을 옮니다. 펠릿을 버리십시오.
- 버퍼 A 1 L (50 mM Tris pH 7.6, 500 mM NaCl)을 준비합니다. 버퍼 B의 300 mL을 준비 (50 mM 트리스 pH 7.6, 500 mM NaCl, 300 mM Imidazole).
- 버퍼 A의 3 개의 열 볼륨과 5 mL / min의 유량을 사용하여 100 mL 니켈 컬럼을 평형화하십시오.
- 2~5mL/min의 유량을 사용하여 니켈 컬럼에 용해장치를 로드한 다음 버퍼 A의 2열 볼륨으로 컬럼을 세척한 다음 ~ 5개의 컬럼 볼륨을 20% 버퍼 B로 세척합니다. 20% 버퍼 B 세척 동안, 280 nm (A280)에서흡광도는 세척 시 컬럼으로부터 오염물질이 용해됨에 따라 증가한다. 용리수의 A280이 기준값으로 돌아올 때까지 열을 계속 세척합니다.
- 2-5 mL /min의 유량을 사용하여 100 % 버퍼 B의 2-3 컬럼 부피로 단백질을 용해시키고 10 mL 분획을 수집합니다. 각 분수의 A280을 측정합니다.
- 15 mL 원심 초여과 장치를 사용하여 A280 > 0.1을 함유한 분획을 결합하고 농축합니다. 15 분 동안 5,000 x g에서 초음파 장치를 회전하고 부피가 ~ ~ 50-75 mL로 감소 될 때까지 분수를 계속 추가하십시오.
- 6-8 kDa의 분자량 컷 오프 (MWCO)로 투석 튜브의 14 인치 조각을 잘라. 투석 튜브를 끓여 서 10 분 동안 300 mL의 물에 완전히 잠긴 다. 막의 한쪽 끝에 안전한 매듭을 묶는다. 균열이나 누출이 없는지 확인하기 위해 투석 버퍼로 가방을 채웁니다. 가방에서 버퍼를 제거하고 투석 버퍼에 잠긴 가방을 보관하십시오.
- 농축 된 단백질을 2.2.13에서 플라스틱 파이펫으로 투석 백에 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김. 가방에서 기포를 제거합니다. 두 번째 매듭이나 투석 클립으로 가방을 닫습니다. 50 mM Tris pH 7.6, 5 mM EDTA (에틸렌디아미네테트라아세트산), 250 mM NaCl에서 500 mLNaCl에 대해 500 mL에 대하여 단백질을 투석4°C에서 하룻밤 동안 졸업실린더.
- 단백질을 500 mM 의 트리스 pH 7.6에서 2 시간 동안 4°C에서 500 mL에 대해 두 번째로 투석한다.
- 음이온 교환 컬럼의 경우 버퍼 A(50 mM Tris pH 7.6) 및 500 mL 버퍼 B(50 mM Tris pH 7.6, 1.0 M NaCl)의 500 mL을 준비합니다. 버퍼 A(2-5mL/min)의 3열 볼륨으로 30mL 음이온 교환 열을 평형화합니다.
- 투석 가방에서 단백질을 제거하고 병으로 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 제거합니다. 병을 얼음 위에 두십시오. 투석된 단백질을 컬럼에 로드합니다(2-5 mL/min).
참고: CFP/YFP 단백질은 컬럼을 결합하고 외관에서 노란색이 될 것입니다. - A280이 기준선(5mL/min)으로 돌아올 때까지 버퍼 A로 열을 세척합니다. 그라데이션 (0-50 % 완충B, 100 mL)을 사용하여 단백질을 용해시키고 10 mL 분획을 수집합니다.
- SDS-PAGE를 사용하여 열 분수를 검사합니다. >95% 순수한 것을 결합하십시오.
- 15 mL 원심 초여과 유닛을 사용하여 A 280~10-20에 단백질을 농축한다. 4°C에서 4,500 x g에서 10분 동안 농축기를 돌리고 단백질함유 분획이 모두 결합될 때까지 단백질을 계속 첨가합니다.
- 투석 가방에서 단백질을 제거하고 병으로 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김으로 옮김을 제거합니다. 병을 얼음 위에 두십시오. 투석된 단백질을 컬럼에 로드합니다(2-5 mL/min).
- 피펫으로 농축기에서 단백질을 조심스럽게 제거하십시오. 단백질을 1.5 mL 미세원원지 튜브에 넣고 -80 °C에서 장기간 보관하기 위해 액체 질소에서 플래시 동결합니다. 완충액은 사용하기 전에 적절한 분석 버퍼와 평형화된 PD-10 컬럼을 사용하여 실온에서 단백질을 교환한다.
- 맥주의 법칙을 사용하여 A280 및 계산된 소멸 계수를 사용하여 단백질 농도를 계산합니다(예를 들어, V12 기판의 경우 47,790M-1 cm-1).
참고: 소멸 계수(들)는 Expasy ProtParam프로그램(https://web.expasy.org/protparam/)을사용하여 도 4의 단백질 서열로부터 계산될 수 있다.
3. 알파 바이러스 nsP2 시스테인 프로테아제의 제조
- 프로테아제 인코딩플라스미드를 설계하고 시공합니다. 시스테인 프로테아제의 경우 pet32 플라스미드를 사용하여 티오레독신(Trx) 융합 단백질을 생성합니다.
참고:pet32 플라스미드는 티오레독신과 그의 태그를 제거하기 위한 트롬빈 분열 부위(LVPRGS)를 인코딩합니다.그림 5). 티오레독신은 발현 동안 감소된 상태에서 활성 부위 시스테인을 유지하는 데 도움이 될 것이다. 세린 프로테아제의 경우 티오레독신은 필요하지 않으며 트롬빈에 의한 제거와 관련된 단계는 생략할 수 있습니다. VEEV nsP2 프로테아제 서열은 선택 제제를 취급하지 않도록 상업적으로 제조된 pet32b 플라스미드에 통합되었다.- 플라스미드 DNA를 제조사의 지시에 따라 BL21(DE3)pLysS 대장균으로 갓 변형시킵니다. Ampicillin를 포함하는 LB 한천 접시에 박테리아를 접시.
참고: 클로람페니콜은 pLysS 플라스미드를 운반하는 대장균 균주에만 사용되며 BL21(DE3) 세포가 사용되는 경우 생략됩니다. 이 단계에서 LB 한천 플레이트에 클로람페니콜을 포함할 필요는 없습니다. - 오토클레이브 4 4 L 플라스크 의 1.5 L LB 미디어 (6 L 총 볼륨) 및 250 mL 플라스크에 LB의 100 mL. 각 플라스크를 알루미늄 호일로 캡합니다.
- 플레이트로부터 콜로니와 함께 LB/Ampicillin의 100 mL 하룻밤 배양물을 접종하고 37°C에서 흔들리는 인큐베이터(200 rpm)에서 성장한다.
- 4 L 플라스크를 밤새 배양한 25 mL로 접종하고 적절한 항생제를 첨가합니다.
참고: PET32 플라스미드를 운반하는 BL21(DE3) pLysS 세포에 대한 매체는 25 μg/mL 클로람페니콜 과 50 μg/mL Ampicillin의 최종 농도가 있어야 합니다. - 600 nm에서 흡광도가 1.0에 도달할 때 배양에 0.5 mL의 IPTG를 첨가하여 단백질 발현을 유도한다. 흔들기 인큐베이터의 온도를 17°C로 낮춥시다. 식을 밤새 도록 허용합니다(~17시간).
- 원심분리에 의해 세포를 펠렛 (4 °C에서 10 분 동안 7,000 x g). 액체 매체를 제거하고 폐기합니다.
참고: 펠릿은 -80°C에서 몇 달 동안 보관하거나 즉시 용해시킬 수 있다. - 100 mL의 라시스 버퍼 (50 mM Tris pH 7.6, 500 mL NaCl, 2 mM 베타 메르카프토에탄올 (BME), 30 mg 리소자임, 5 % 글리세롤, 25 U DNase, 35 mL 세균 성 단백질 추출 시약)을 준비하십시오. 추가 할 때 화학 후드에 BME의 병을 엽니 다. 이 모든 후속 단계에 대한 얼음 또는 4 °C에서 세균 용해를 유지합니다.
참고: 시스테인 프로테아제의 경우, 2 mMBME는 핵성 시스테인을 감소시키기 위해 포함되어 있다. 컬럼은 냉각 버퍼를 사용하여 실온에서 실행할 수 있습니다. 버퍼는 4 °C로 냉각 차가운 탈이온 수로 만들어야한다. - 매해 완충액의 ~ 25 mL에서 세균 펠릿을 다시 중단하고 4 x 50 mL 일회용 원엽 튜브로 매해의 ~ 25 mL를 전달합니다. 튜브를 얼음물이 들어있는 플라스틱 비커에 넣습니다. 용해량은 레벨 5에서 15초 간격으로 10회 초음파 처리합니다.
- 매서니지를 고속 원심분리기 튜브로 옮김을 옮김으로 옮김을 옮김으로 옮김을 옮김을 넣습니다. 원심 분리 (30 분, 4 °C에서 20,500 x g)로 용해를 명확히하십시오.
- 완충A 0.5L(50 mM Tris pH 7.6, 500 mM NaCl, 5% 글리세롤, 2 mM BME)를 준비하고 4°C로 냉각한다.
- 완충B 250 mL(50 mM Tris pH 7.6, 500 mM NaCl, 5% 글리세롤, 2 mM BME, 300 mM imidazole)을 준비하고 4°C로 냉각합니다.
- 버퍼 A. 2-5 mL / min에서 컬럼에 정제 된 용해액을로드하고 펠릿을 폐기하는 3 개의 열 볼륨으로 50 mL 니켈 컬럼을 평형화하십시오.
- 버퍼 A의 2열 볼륨으로 컬럼(2-5mL/min)을 세척한 다음 버퍼 B(60mM Imidazole)를 포함하는 버퍼 A의 5열 볼륨을 사용합니다. 단백질(5 mL/min)을 100% 완충 B로 용해시키고 10 mL 분획을 모으습니다.
- 15 mL 원심 초여과 유닛을 사용하여 A280 ≥ 0.1을 함유한 프로테아제를 함유하고 4 °C에서 5,000 x g에서 15 분 회전을 결합하고 농축합니다. 부피가 ~5 mL로 감소된 후, 단백질에 신선한 투석 완충액을 첨가하여 농도 단위에서 단백질을 완충교환(50 mM Tris pH 7.6, 250 mM NaCl, 5 mM 디티오트레이톨(DTT), 1 mM EDTA, 5% 글리세롤). 4 °C에서 5,000 x g에서 15 분 동안 다시 스핀하십시오. 버퍼 교환 단계를 2-3번 반복합니다. 투석 전에 단백질(20 μL 의 1 단위/μL)에 트롬빈을 첨가하여 티오레독신과 히태그를 제거합니다.
- 단백질을 투석 백으로 옮기고 투석 완충제(4°C)의 500 mL에 대해 투석을 500 mL의 졸업실린더에서 하룻밤 동안 대지한다.
참고: FPLC (빠른 단백질 액체 크로마토그래피) 시스템과 니켈 컬럼은 음이온 교환 컬럼으로 진행하기 전에 스트리핑 버퍼 (2 M NaCl, 50 mM EDTA)로 철저히 세척해야합니다. FPLC 라인의 잔류 니켈은 혼합될 때 DTT 브라운을 함유하는 완충액을 돌립니다. 니켈 컬럼과 FPLC 시스템을 4열의 물로 세척합니다. 펌프는 FPLC 시스템을 물로 철저히 세척합니다. 니켈 컬럼은 후속 정제를 위해 수지 위에 0.2 M 니켈 황산염의 2 열 부피를 흐르게 하여 재생될 수 있다.
- 플라스미드 DNA를 제조사의 지시에 따라 BL21(DE3)pLysS 대장균으로 갓 변형시킵니다. Ampicillin를 포함하는 LB 한천 접시에 박테리아를 접시.
- 음이온 교환 컬럼의 경우 버퍼 A 1 L(50 mM Tris pH 7.6, 5 mM DTT, 5% 글리세롤)을 준비한다.
- 완충B 0.5 L(50 mM Tris pH 7.6, 5 mM DTT, 5% 글리세롤, 1.25 M NaCl)을 준비한다.
- 버퍼 A(3열 볼륨, 2-5mL/min)로 30mL 음이온 교환 열을 평형화합니다. 흐름을 수집하기 위해 튜브를 분수 수집기의 집합체에 배치합니다.
참고: VEEV 프로테아제는 8.7의 계산된 등전점(pI)을 가지며 양이온 교환 열을 결합하지만 음이온 교환 컬럼을 통해 흐릅니다. pI는 엑스파시 프로트파라름프로그램(https://web.expasy.org/protparam/)을사용하여 단백질 서열로부터 계산될 수 있다. - 완충A로 투석단백질 1:3을 희석한 다음 단백질(5 mL/min)을 적재합니다. 10 mL 분획에서 흐름을 수집합니다.
- FPLC 시스템에서 음이온 교환 열을 제거합니다. 양이온 교환 열을 FPLC 시스템에 연결합니다. 버퍼 A(5mL/min)의 3개의 열 볼륨으로 30mL 양이온 교환 열을 평형화합니다.
- 음이온 교환 컬럼의 흐름을 양이온 교환 컬럼에 2-5mL/min로 로드합니다. 단백질을 100 mL 그라데이션 (0-50 % 완충B)으로 용해시키고 10 mL 분획을 수집합니다.
참고: VEEV 프로테아제는 약 0.6 M NaCl에서 용해됩니다. - SDS-PAGE를 사용하여 열 분수를 검사합니다. 15 mL 원심 초여과 장치를 사용하여 >95% 순수하고 A280에 농축하는 분획을 결합합니다. 효소는 액체 질소에서 플래시 냉동 및 -80 °C에서 저장 될 수있다.
- 음이온 교환 컬럼의 흐름을 양이온 교환 컬럼에 2-5mL/min로 로드합니다. 단백질을 100 mL 그라데이션 (0-50 % 완충B)으로 용해시키고 10 mL 분획을 수집합니다.
4. 플레이트 리더를 사용하여 효소를 지속적으로 어기고
- 50 mL의 분석 버퍼 (50 mM HEPES pH 7.0)를 준비합니다.
- 알파바이러스 프로테아제는 상대적으로 낮은 k고양이 값을 가지므로, 분석 버퍼에서 효소를 4.7 μM으로 희석한다(이것은 대략 Trx가 없는 VEEV 프로테아제에 대해 A280 = 0.2에 해당한다).
- 효소의 활성을 측정하기 위해, 185 μM의 농도로 분석 완충액에 기판의 스톡을 준비; 이는 대략 A280 = 9에 해당합니다. 8개의 마이크로원심지 튜브에서, 185 μM 기판 스톡 및 완충액의 적절한 부피를 결합하여 표 2에 나타낸 반응 믹스를 준비한다. 흑색 반영역 96웰 플레이트 피펫45 μL의 반응에서 3개의 웰(컬럼 1, 2, 3)으로 혼합한다. 행 A는 [S] = 5 μM 반응 혼합을 포함해야 하며, 행 H는 [S] = 140 μM 반응 혼합을 포함해야 한다.
- 고정 된 광증관 (PMT) 설정 (예를 들어, 낮음)으로 두 개의 파장에서 동시에 형광을 감지하도록 플레이트 리더를 설정하십시오.
파장 1 여기 = 434 nm, 방출 = 527 nm
파장 2 여기 = 434 nm, 방출 = 470 nm - 읽기 시간을 20분(분당 1읽기 측정)으로 설정하고 읽을 웰을 선택합니다. 플레이트 리더에 플레이트를 삽입하고 20 분 동안 가수 분해의 자발적인 속도를 측정합니다.
- "UNCUT" 기판을 포함하는 플레이트의 끝점 판독을 실행합니다.
참고: 이러한 값은 후속 데이터 계산에 사용됩니다. 3웰에서 의 방출 비의 평균은 표 3에서t =0에서 "UNCUT" 기판의 값이 될 것이다. - 각 우물에 효소의 플레이트와 파이펫 5 μL을 제거합니다. 분당 1읽기로 20분 동안 접시를 다시 읽습니다. 플레이트 판독기를 사용하여 절대 값을 출력하도록 설정합니다.
참고: 이 분석의 경우 경사는 음수입니다. 각 웰은 총 부피 50 μL을 포함합니다. - 판독이 끝나면 증발을 방지하기 위해 필름으로 플레이트를 밀봉하십시오. 효소가 기판을 완전히 절단할 수 있도록 접시를 밤새 실온에 둡니다.
- ~24시간 후, 밀봉 필름을 제거하고 이전 플레이트에서와 동일한 PMT를 사용하여 플레이트의 엔드포인트 판독을 수행한다. 이러한 방출 비율을 평균화하고 표 3에 입력하여 "CUT"입니다. 아래에 기재된 SDS-PAGE 불연속 분석(Step 5.1)을 사용하여 기판의 절단을 확인한다.
- 데이터를 스프레드시트로 내보냅니다. 2파장에 대한 각 시점마다 형광 단위를 출력한다(표4).
- 주어진 시점에서 X가 방출비(527 nm/470 nm)인 방정식 1을 사용하여 시간 t에서 절단된 기판의 nmol을 계산하고, neg는 t=0에서 "UNCUT" 기판의 방출비가 되고, 포스는 절단 24시간 후에 측정된 완전히 "CUT" 기판의 방출비이다(표3).
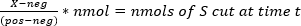
참고: 대표적인 형광 데이터는 표 4에서80 μM 기판(웰당 S몰의 4nmol)을 함유하는 하나의 웰(well E7)에 대해 도시된다. 플레이트의 각 웰에 대해 계산이 수행되었습니다. - 각 웰에 대해 nmol 대 시간(min)을 플롯하고 데이터를 y = mx + b에 피팅하여 초기 속도(경사)를 얻습니다. 4.1.5에서 수집된 데이터의 경우, 각 웰에 대해 nmol 대 시간(분)을 플롯합니다. 경사는 분당 생산되는 nmol 제품과 동일합니다. 효소 촉매 반응 속도로부터 4.1.5로 측정된 가수분해의 자발적 인 비율을 뺍니다(표 5).
참고: 플레이트 판독기로 플레이트가 이동하기 때문에 실제로 높은 경우 첫 번째 읽기는 데이터에서 잘리게 될 수 있습니다. - 각 웰에 첨가된 mg의 효소의 양을 계산한다(예를 들어, 0.0009 mg). 단위는 분당 생산된 제품의 μmol(μmol/min)으로 정의됩니다. mU/mg을 얻기 위해 웰에 존재하는 효소의 mg에 의해 nmol/min을 나눈다; U/mg을 얻기 위해 1,000으로 나눕니다.
- y축에 x축 및 U/mg에 [S] μM을 플롯하고 데이터를 Michaelis-Menten 방정식에 맞추어Vmax 및 Km를얻습니다. 이것은 소프트웨어 (예 : GraFit)에서 수행 할 수 있습니다.
5. SDS-PAGE 분석을 사용하여 효소를 지속적으로 분석
- 효소 대신 에 10 μM 기판 및 완충액을 함유한 50 μL 반응을 준비하고 "UNCUT"으로 라벨을 붙입니다.
참고: 기판과 버퍼의 부피가 표 2에나와 있습니다. 연속 분석이 실행된 경우, 샘플은 96 웰 플레이트로부터 직접 사용될 수 있다.- 10 μM 기판 및 5 μL 효소를 함유하는 50 μL 반응을 준비하고 "CUT"으로 라벨을 붙인다. 효소가 기판에 첨가될 때 타이머를 시작합니다.
참고: 억제제는 효소 및 기판을 포함하는 추가 관에 첨가될 수 있다. 추가된 버퍼의 부피를 조정하여 추가된 억제제 볼륨을 보정합니다. DMSO의 농도는 2 %를 초과해서는 안됩니다. - 실온 (22 ± 3 °C)에서 ~ 15-24 시간 동안 반응을 배양하십시오. 2x Laemelli 완충액의 50 μL을 추가하여 반응을 멈춥시다. 반응을 종기 중지 한 후, 각 튜브를 3-10 분 동안.
- 제조업체의 지시에 따라 젤 탱크를 조립하십시오. 17웰 프리캐스트 12% 폴리아크릴아미드 겔 카세트와 완충댐을 반대편에 삽입한다. 버퍼가 카세트의 맨 위에 도달할 때까지 셀의 내부 저장소를 1x SDS 실행 버퍼로 채웁니다. 동일한 버퍼로 외부 저장소를 반으로 채웁니다.
- 불연속 분석을 사용하여 분열을 분석하려면 각 반응 혼합물의 5 μL을 "UNCUT" 반응으로 시작하는 SDS-PAGE 겔의 레인에 로드합니다. 제1 또는 마지막 차선에 분자량 마커를 포함합니다.
- 겔 탱크의 전극을 전원 공급 장치에 부착하고 제품을 110V에서 60 분 동안 분리합니다. 젤을 플라스틱 트레이에 놓고 겔 염색 용액의 5-10 mL에 젤을 담급니다; 밴드는 30 분 이내에 볼 수 있습니다. 1-24시간 후에 여분의 얼룩을 제거하고, 물에 젤을 담그고 젤 이미저를 사용하여 겔의 사진을 찍습니다.
- 10 μM 기판 및 5 μL 효소를 함유하는 50 μL 반응을 준비하고 "CUT"으로 라벨을 붙인다. 효소가 기판에 첨가될 때 타이머를 시작합니다.
6. VEEV-nsP2 시스테인 프로테아제에 기판 펩티드도킹
- PDB(https://www.rcsb.org/)에서VEEV 시스테인 프로테아제에 대한 좌표 파일을 다운로드하십시오. PDB 코드는 2HWK입니다. 파일을 2HWK.pdb로 저장합니다.
- MOE(https://www.chemcomp.com/)를이용하여 단백질 구조를 준비한다. 단백질 PDB 파일을 MOE에 로드합니다. 오른쪽 바에 있는 용매 선택 및 용매를 클릭하고 용매를 삭제합니다.
- 상단 메뉴 바 단백질에서 구조 준비 패널을 엽니 다. 수정을 클릭하여 모든 구조 항목을 자동으로 수정하고 Protonate3D를클릭하여 구조를 프로토스화합니다. 부분 전하 패널을 열고 필요에 따라 앰버 99를 선택하고 수소와 론 쌍을 조정하여 단백질에 부분 전하를 추가합니다. 마지막으로 구조 파일을 "2HWK_dock.pdb"로 저장합니다.
- MOE를 사용하여 기질 펩티드(nsP12, nsP23, nsP34) 및 TRIM14에 대한 구조를 구축합니다. 단백질 빌더 패널을 열고 기판 순서를 입력하고 지오메트리를 확장으로 설정한 다음 빌드를 클릭합니다. 구조는 MOE 창에 표시됩니다.
- 패널에서 최소화를 클릭하여 펩타이드 구조를 최소화합니다. 구조를 PDB 파일로 저장합니다(그림6).
- PyRx/AutoDock 4.2(http://autodock.scripps.edu/)를 사용하여 기질 펩타이드를 VEEV-nsP2에 도킹합니다. PyRx 도구를 열고 기본 설정편집, 리간드 준비를 위한 모든 토르션 비활성화. 기판 분자를 로드하고 Navigator 패널의 분자 이름을 마우스 오른쪽 단추로 클릭하고 리간드 도킹 파일을 준비하려면 리간드 만들기를 선택합니다. 단백질 2HWK_clean.pdb를 로드하고, pdbqt 도킹 파일을 준비하기 위해 거대분자 만들기를 선택합니다(그림7).
- 하단의 도킹 패널에서 자동 독 마법사를 시작합니다. 준비된 리간드 및 단백질 파일을 선택합니다. 촉매 잔류 Cys-477을 중심으로 그리드 치수를 수동으로 조정하여 단백질 결합 포켓을 정의합니다. 기본 간격 매개 변수 0.375 Å. 실행 자동 그리드를 클릭하여 그리드 맵을 생성합니다.
- 자동 독을 실행하고 라마르키안 유전자 알고리즘 (LGA) 방법을선택합니다. 도킹 매개변수를 클릭하고 GA 실행 횟수를 50으로 설정합니다. 다른 사람에 대한 기본 매개 변수를 사용합니다. 도킹 실행을 시작하려면 앞으로 를 클릭합니다.
- 결과 분석 패널을 엽니다. 예측된 모든 바인딩 포즈를 검사합니다. 가장 낮은 예측 결합 에너지와 Cys-477과 절단 부위의 기판 간의 합리적인 결합 상호 작용을 갖춘 최상의 모델을 선택합니다. 추가 MD 시뮬레이션을 위해 바인딩 모델을 PDB 파일로 저장합니다.
7. 도킹 VEEV 기판 단지의 MD 시뮬레이션
- 황색(http://ambermd.org/)를사용 하 여 입력 파일을 준비 합니다. 표준 프로토콜에 따라, MD 시뮬레이션은 AMBER 패키지 및 ff99SB 힘 필드를 사용하여 예측된 기판 결합 모델에 대해 수행됩니다.
참고: 용해된 시스템은 MD 시뮬레이션 전에 철저한 에너지 최소화를 받습니다. 연속 시스템을 시뮬레이션하기 위해 주기적 경계 조건이 적용됩니다. 입자 메쉬 Ewald (PME) 방법은 장거리 정전기 상호 작용을 계산하기 위해 사용되었다. 시뮬레이션 시스템은 먼저 100ps 이상 0K에서 300K로 점진적인 온도 상승을 실시한 다음 300K에서 500ps로 평형화한 다음 총 2ns 길이의 생산 실행을 실시했습니다.- 고성능 컴퓨팅 시설에서 시뮬레이션 작업을 실행합니다. 우리의 시뮬레이션은 Biowulf 클러스터(https://hpc.nih.gov/)에서실행되었습니다(그림 8).
- VMD프로그램(http://www.ks.uiuc.edu/Research/vmd/)을사용하여 궤적 출력을 시각화합니다. nsP2의 활성 부위 내에서 기판 및 TRIM14의 결합 상호작용 및 형태 변화를 분석한다(도9).
결과
ZIKV ns2B/3 프로테아제의 SSHHPS 분석은 4개의 숙주 단백질 표적을 확인하였다: FOXG1, SFRP1, 망막 cDNA 라이브러리로부터의 Gs 알파 소부체, NT5M 미토콘드리아 5',3'-뉴클레오티다제(도 10)6. 특히, 다른 방법은 ZIKV 프로테아제의 잠재적인 표적으로 이 단백질을 예측하지 못했습니다. FOXG1 유전자에 있는 돌연변이는 microcephaly와 같은 손상한 발달 및 구조적인 두뇌 이상을 특징으로 하는 선천적인 증후군에 연결되었습니다. SFRP1은 분비된 곱슬머리 관련 단백질(SFRP); 이러한 수용성 수용체는 Wnt 리간드를 경쟁적으로 결합하여 Wnt 신호를 적대하고 억제할 수 있습니다. Wnt 신호 통로는 플라비바이러스 감염36동안 IFN 반응의 조절에 관여한다. SFRP1의 분열은 플라비바이러스 복제를 강화할 것으로 예상됩니다. SFRP1은 또한 Th17 세포분화(37)에관여한다. SSHHPS의 서열 정렬은 분열 부위 서열에서 종별 차이를보였다(도 10D). SFRP1의 분열 부위 서열은 인간과 닭에서 동일하였다; ZIKV는 닭 배아에서 사망률 및 소두증을 유발할 수 있다38. 설치류에서, 고도로 보존된 P1 잔류물 (K/R)R↓G는 글리신(RGG)으로 대체된다. 마우스의 면역 적격 균주는 일반적으로 ZIKV 감염 및 질병39에내성이 있다.
정상 상태 운동 파라미터 및 억제 상수는플레이트리더(31),40,41(도 11A)에서연속 분석기를 사용하여 바이러스 성 다단백 서열 및 숙주 단백질 서열에 대해 측정될 수 있다. 다양한 화합물에 의한 특정 서열의 분열 또는 프로테아제의 억제와 같은 질적 절단 정보의 경우, 불연속 분석제가 사용될 수있다(도 11B).
CFP와 YFP 사이에 잔기의 수를 최적화하는 것이 필요할 수 있습니다. 기판 바운드 모델은 실리코 방법을 사용하여 이루어질 수 있다. nsP1/nsP2 접합의 대표적인 도킹 모델은 그림 9에나와 있습니다. VEEV nsP2 프로테아제의 경우, 12-아미노산 셈리키 포레스트 바이러스(SFV) 서열의절단(Km= 0.58 mM)(Km=0.58 mM)이33으로보고되었다. 기판 서열을 19, 22 및 25 잔기로 연장하고 완충제의 이온 강도를 감소시켜Km의현저한 감소를 이끌어 냈습니다. VEEV nsP2 결정 구조 및 결정 패킹의 검사는 또한 접합부 중 하나의 일부가 프로테아제 도메인에 대해 포장되고 나선인 것으로 나타났다. 따라서, VEEV 기판이 길수록 이차 구조 모티프의 인식으로 인해 더 잘 결합할 수 있다.
TRIM14의 경우 Km = 21 μM6,33을얻었습니다. 숙주 단백질 서열을 운반하는 기질에 대한Km은 바이러스 성 다단백분열 부위 서열을 포함하는 기판의Km 값과 비교하였다(K m(V12) = 12 μM 및Km(V34)= 21 μM). nsP1/nsP2, nsP2/nsP3 및 nsP3/nsP4 접합부에서의 절단 사이트 시퀀스는 서로 다른 효율성으로 절단되었습니다. 세포에서, 이것은다단백질(42)의순차적 절단을 허용하는 것으로 생각된다.
부정적인 결과를 해석할 때는 주의를 기울여야 합니다. 분열이 발생하지 않는 경우, 절단 부위가 너무 짧거나 정제된 프로테아제는 비활성 상태일 수 있다. 절단되는 기질의 경우, 바이러스에 감염된 세포에서 전체 길이 단백질또는 분열의 절단을 확인하기 위해 추가 적인 실험이 필요합니다. 적절한 후속 실험을 선택해야 합니다. 바이러스 복제에 대한 표적 단백질의 과발현 또는 침묵의 효과도 시험될 수 있다.
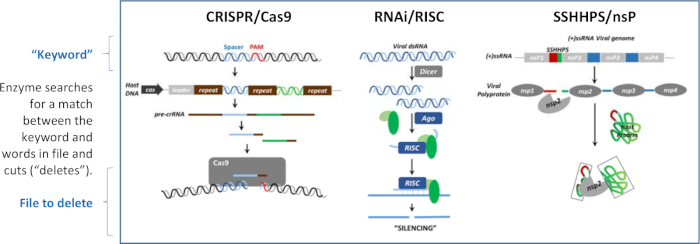
그림 1: 침묵의 세 가지 메커니즘. 침묵은 DNA, RNA 또는 단백질 의 수준에서 생길 수 있습니다. 이러한 "검색 및 삭제" 알고리즘은 각각 "키워드"를 사용하여 단어가 포함된 파일의 분열을 지시합니다. 이 도면은 모라자니외 32 및 그 안에 있는 참조로부터 수정되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 2: 분열 부위 서열의 종별 차이. TRIM14 호몰로그의 C 단말 PRY/SPRY 도메인이 선형에 표시됩니다. PRY/SPRY 도메인은 회색으로 강조 표시된 보존된 모티브로 식별할 수 있습니다. 휴먼 트림14는 VEEV nsP2 시스테인 프로테아제에 의해 QEAGA↓G에서 절단된다. SSHHP 시퀀스는 색상으로 표시됩니다. 녹색의 잔류물은 P1' 잔류물; 파란색은 P4 잔기이고, 빨간색은 분열 부위 모티프 서열 내의 다른 보존된 잔류물이다. 말은 PRY / SPRY 도메인이 없는 TRIM14의 잘린 버전을 항구합니다. 시안에서 강조 된 리신은 폴리 유비퀴틴화이며 MAVS 신호체의 조립에 중요합니다. C-말단 PRY/SPRY 도메인은 nsP2 프로테아제에 의해 일시적으로 절단되어 급성 바이러스 감염 동안 숙주의 항바이러스 반응을 세포내로 손상시킬 수 있다. 말에서 이 도메인은 항상 존재하지 않습니다. 이것은 TRIM14의 PRY/SPRY 도메인이 VEEV 감염에 대하여 보호 기능을 가질 수 있다는 것을 건의합니다. 이 그림은 Morazanni 등에서재현되었습니다. 6이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: BLAST를 사용한 SSHHPS 식별. VEEV nsP1/nsP2 접합부에서의 절단 부위 모티프 서열은 숙주 단백질 TRIM14에서 SSHHP 서열과 정렬된다. 녹색으로 칠해진 잔류물은 P1' 잔류물입니다. 파란색은 P4 잔기이고 빨간색은 분열 부위 모티프 서열의 다른 보존 잔류물이다. 대부분의 정렬은 보존 된 분열 사이트 모티프 외부 영역에 상동성을 포함하거나 P1 / P1 '가위 결합 잔류물을 포함하지 않았다. TRIM14는 P1 및 P1'을 포함하는 순차적으로 6잔고에 대한 일치를 보였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 4: VEEV nsP2 시스테인 프로테아제에 대한 CFP-V12-YFP 기판의 단백질 및 DNA 서열. NdeI (CATATG) 및 XhoI (CTCGAG) 제한 사이트는 대문자로 표시됩니다. 빨간색은 nsP1과 nsP2 사이에 있는 바이러스 성 다단백으로부터의 분열 부위 서열이다. 녹색의 잔류물은 P1의 잔류물이며 파란색은 분열 부위의 P4 잔류물입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

도 5: Trx-VEEV-nsP2 시스테인 프로테아제 생성물의 단백질 서열. 티오레독신(Trx)은 노란색으로 나타난다. 트롬빈 분열 사이트와 그의 태그는 시안으로 표시됩니다. 싸이스-그의 염료는 빨간색으로 표시되어 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
도 6: MOE에서 펩티드 구조. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 7: PyRx/AutoDock을 사용하여 기질 펩티드의 도킹. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
그림 8: Biowulf 클러스터에서 실행되는 작업입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
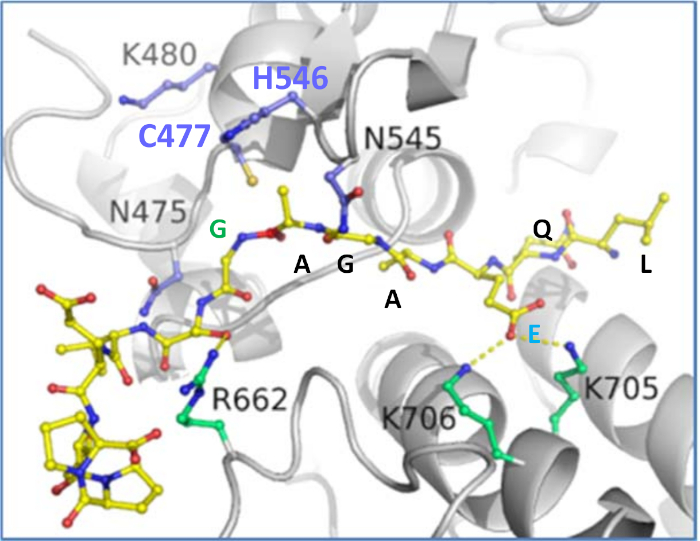
도 9: nsP1/nsP2 접합부에서의 절단 부위 서열을 포함하는 VEEV P12 기판의 모델. Cys-477/His-546 촉매 다이드는 파란색으로 표시됩니다. 도면은 피몰(https://pymol.org)을 사용하여 만들어졌다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
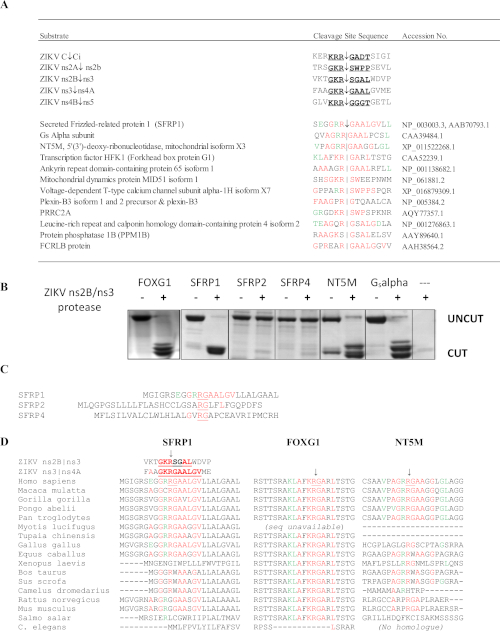
그림 10: 지카 바이러스 ns2B/ns3 프로테아제의 SSHHPS 분석. (a)ZIKV ns2B/ns3 프로테아제의 예상 숙주 단백질 표적. 적색의 잔기는 단일 분열 부위 서열과 일치한다. 녹색잔류물은 하위 부위에서 허용되며 다른 분열 부위의 잔류물을 일치시다. SFRP1은 연속순으로 동일한 잔기수가 가장 많았다. (b)CFP-기질-YFP 단백질(~50-60 kDa)을 발현하고 각 숙주 단백질(human)으로부터 예측된 SSHHP 서열을 함유하여 정제하였다. ZIKV 프로테아제는 망막 cDNA 라이브러리로부터 분리된 인간 FOXG1, SFRP1, NT5M 및 Gs알파 소부를 절단한다. 분열 제품은 약 28 ~ 30 kDa입니다. 기판 서열은 morazzani등에서 사용할 수 있습니다 6(C)ns2B/ns3 프로테아제 컷 SFRP1 동안, 그 상동체(SFRP2 및 SFRP4)를 절단하지 않았다. (D)상이한 동물 종으로부터의 분열 부위의 정렬은 그룹 IV 바이러스에 대한 동물 모델을 선택하는데 유용할 수 있다. 보존된 R↓G 시퀀스는 SFRP1에서 인간과 설치류 간에 다릅니다. 모라자니등에서재현 된 그림6이 그림의 큰 버전을 보려면 여기를 클릭하십시오.
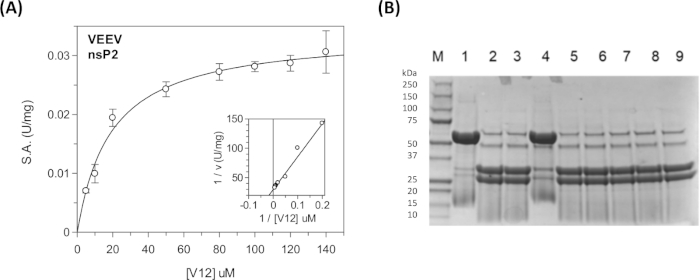
도 11: 연속 및 불연속 분석을 이용한 정상 상태 운동 분석. (A)표 5에 나타낸 운동 데이터는 GraFit에 플롯되었다. 인세트는 라인위버-버크 플롯을 표시합니다. (B)CFP-V12-YFP 기판의 분열 제품을 나타내는 SDS-PAGE 겔. 레인 1은 "UNCUT" 기판(48 kDa)입니다. 차선 2는 "CUT" 기판(31 kDa 및 27 kDa)입니다. 레인3-9상이량의 화합물을 이들은 저해 활성을 시험하기 위해 포함하였다. 레인 4에는 E64d 공유 억제제가 포함되어 있습니다. 이들 반응은 실온에서 ~17시간 동안 하룻밤 동안 실행되었다. 날카로운 밴딩 패턴을 달성하기 위해 샘플의 비등이 필요하였다. nsP2 프로테아제는 효소를 함유하는 반응에서 볼 수 있지만, 차선 1에서는 볼 수 없다. 레인 1은 "효소 없음" 대조군입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
외래 서열에 의해 유도된 단백질 또는 핵산의 서열 특이적 파괴는 생물학에서 단지 몇몇 경우에 볼 수 있다. 그림 1에 표시된 메커니즘은 호스트를 바이러스또는 호스트로부터 바이러스로부터 보호하는 방어 메커니즘입니다.
생물 정보학 방법을 사용하여 우리는 이러한 시스템에 의해 파괴되는 대상을 식별 할 수 있습니다. SSHHP 서열의 우리의 분석에서, 우리는 그(것)들의 많은 것이 타고난 면역 반응을 생성하는 데 필요한 단백질에서 찾아낼 수 있었다는 것을 것을을 발견했습니다. 일부는 MAVS 및 TRIF (TIR 도메인 함유 어댑터 -유도 인터페론-β)와 같은 명백한 역할을 가지고 있었고, 다른 것들은 더 복잡한 메커니즘 (예를 들어, 히스톤 H3, SFRP1, FOXG1)8,9. SSHHP 서열에 저장된 표적 정보는 이러한 바이러스에 대한 항 바이러스 효과가있는 경로를 식별 할 수있는 잠재력을 가지고 있습니다. 생체 내에서 항 바이러스 반응은 종종 바이러스 특이적26,43. 예를 들어, TRIM 단백질의 서브세트는 상이한 바이러스에 대한 항바이러스 효과를가지며, 43,44,45,일부는 바이러스 제한 인자(예를 들어, HIV 및 TRIM5α)이다. TRIM 단백질의 특이성 (~70이 확인됨)은 여전히44,45로조사되고 있다. SSHHPS 내의 정보는 이 바이러스가 타고난 면역 반응을 회피하는 방법의 우리의 이해에 기여할 수 있습니다. 더 많은 SSHHPS를 검사함에 따라 다른 패턴과 상관 관계가 발견될 수 있습니다.
종별 차이는 우리의 분석에서 명백하였다(그림 2, 그림 10). 이 바이러스는 그 외 보다는 몇몇 종에 더 많은 영향을 미치기 위하여 알려지고 있습니다. 호스트 범위, 호스트 감수성 및 호스트 방어에 대한 정보는 SSHHPS 내에 있을 수 있습니다. 예를 들면, 말, 말 뇌염 바이러스에 가장 영향을 받기 쉬운 종은, VEEV nsP2 프로테아제에 의해 일시적으로 절단된 인간 TRIM14의 지구를 결여했습니다. 인간은 VEEV 감염에서 거의 정지하지 않습니다 그러나24를감염될 수 있습니다. 인간 TRIM14 단백질은 nsP2 프로테아제 절단 서열6을운반하였다. 분열 사이트의 존재는 인간이 바이러스에 대하여 방어 기계장치가 있다는 것을 건의합니다. 조류는 이러한 바이러스46의잠재적 인 저수지로 생각되었다. 닭으로부터의 TRIM14 단백질에서 상응하는 SSHHP 서열은 인간 및 다른 종에서 발견되는 서열과 달랐다. 이와 같은 미묘한 차이는 표적 숙주 단백질을 더 쉽게 갈라놓을 수 있습니다. Aguirre등.16 뎅기열 바이러스 감염 후 IFN의 상부를 유도하는 삼촌 돌연변이 STRING 단백질과 그 마우스가 자연스럽게 뎅기열 ns2B3 프로테아제에 의해 절단되지 않는 STING의 버전을 운반하는 것으로 나타났다. 뮤린 스팅 단백질은 ZIKV 프로테아제47에의해 절단되지 않았다. 우리의 SSHHPS 분석에서, 우리는 또한 설치류의 것과 인간 단백질을 비교할 때 ZIKV 프로테아제 절단 부위 서열의 차이를 관찰했습니다(그림10D). 숙주 단백질의 종특이적 단백질용해 분열을 재현하는 것은 그룹 IV 바이러스에 사용되는 동물 모델에서 중요할 수 있다. 숙주 단백질 절단의 억제는 또한 그룹 IV 프로테아제 억제제의 발달에 관하여 연루가 있다. 우리의 이전 간행물에서, 우리는 우리가 CA074 메틸 에스테르6를사용하여 VEEV nsP2 프로테아제에 의해 TRIM14 절단을 억제 할 수 있음을 보여 주었다. 이 결과는 이러한 프로테아제의 소분자 억제제가 감염을 억제할 수 있는 선천적인 면역 반응을 조절할 수 있음을 시사한다6,31.
종 내의 유전 적 변이는 또한 단백질 분석 분열의 차이를 생성 할 수있는 잠재력을 가지고있다. 코돈 사용에 미묘한 차이 리보솜 일시 중지에 영향을 미칠 수있습니다 48. 몇몇 그룹 IV 바이러스성 proteases는 ER 막에 포함되기 때문에, 이 일시 정지에 있는 다름은 절단이 공동 번역으로 생기는 경우에 표적의 절단에 영향을 미칠 수 있었습니다. 우리가 확인한 분열 부위 중 일부는 예측된 신호 펩티드 서열(예를 들어, SFRP1)에 있었고, 다른 부위는 내부에 있었다.
SSHHPS 분석은 숙주 단백질 분석의 다른 방법과 다른 정보를 생성할 수 있습니다. SSHHPS 분석은 저렴하고 사용하기 쉬웠습니다. 세균 발현 시스템의 사용은 포유류 세포 배양을 사용하지 않고 포유류 서열의 짧은 세그먼트 (~25 아미노산)의 테스트를 허용했다. 우리는 CFP-YFP 기질이 시험된 인간 단백질 서열을 모두 견딜 수 있었다는 것을 발견했습니다; 그러나 수익률은 다양했습니다. 유사한 분석에서, 인간 단백질 서열을 함유하는 기질은 63개의 아미노산이 성공적으로 발현, 정제되고, 운동분석 및 억제제스크리닝49,50,51에활용되었다. 불연속 분석에 소량의 기판만 필요하기 때문에 많은 수의 표적을 탐색할 수 있습니다. 시스템의 한 가지 장점은 CFP/YFP 기판을 SDS-PAGE 분석 및 보다 정교한 운동 분석(예: IC50,Ki,Km,Vmax)에사용할 수 있다는 것입니다. 약물 발견을 위해, 억제 화합물은 형광 성 검사에서 유물을 생성 할 수 있습니다. 따라서, 연속 적인 분석과 결합된 불연속 분석법은 분열의 분열 또는 억제를 확인할 수 있게 한다. 불연속 SDS-PAGE 분석에 대한 샘플은 96웰 플레이트에서 직접 채취할 수 있습니다. CFP/YFP 기판은 화합물 라이브러리스크리닝(52)에사용되어 왔다. 그러나, 기판이 Z-factor53의계산과 같은 높은 처리량 스크리닝에 적합한지 여부를 결정하기 위해 추가적인 분석이 요구된다.
기판을 설계하는 한 가지 과제는 프로테아제에 의해 결합되고 인식되는 가위 결합 주위의 영역을 식별하는 것입니다. 여기에 표시된 예에서, 우리는 가위 결합을 중심으로 12 잔류 물 서열로 시작했다. 가위성 결합의 잔기 N-말단에 대한 골짜기 부위의 서열 정렬을 분석한 후 VEEV 프로테아제에 대해 발견되었으며, 반면 에 대한 ZIKV 프로테아제 상동성은 여러 C-말단 잔기로 발견되었다. 도킹된 기판의 실리코 모델은 기판의 결합 부위를 프로브하는 부위 지향 돌연변이 생성 실험을 설계하는데 사용될 수 있다. 기질 및 효소 서열이 플라스미드에 있기 때문에, 실리코 모델 또는 하위 사이트 내성에서 시험하기 위해 돌연변이될 수 있다. 이는 결합된 기판의 결정 구조를 사용할 수 없는 경우에 유리할 수 있다.
SSHHPS 분석은 또한 바이러스 유도표현형이 바이러스 효소에 의해 생성되는 기계장치에 관하여 새로운 정보를 산출할 수 있습니다. ZIKV 표적 중 하나인 SFRP1은 Wnt 신호 경로의 일부이며 뇌와 눈 발달 및 면역 반응36,37,54,55,56,57에서역할을 합니다. 우리는 ZIKV ns2B/ns3 프로테아제에 의해 절단될 수 있던 그밖 단백질 순서가 두뇌와 눈 발달에서 관련시킨 단백질에서 또한 이었다는 것을 것을을 발견했습니다; 둘 다에 있는 이상은 선천적인 Zika 증후군에서 관찰되고 바이러스 유도한 표현형58의일부인 것으로 생각됩니다.
호스트 병원체 상호 작용의 예측 가능성은 다양한 응용 프로그램에 대해 악용 될 수있다: 표적 특정 용해 바이러스 치료; 라이브 바이러스 백신의 위험 제거; 동물 모델의 정제, 예측 또는 선택; 호스트 범위 또는 감수성의 예측; 동물 유행 사건의 예측; 호스트 방어의 예측. 설명된 메서드는 시퀀스 기반이므로 나중에 소프트웨어에 통합하는 것이 좋습니다.
공개
여기에 표현 된 의견은 저자의 의견이며 미국 해군, 미국 육군, 미국 국방부 또는 미국 정부의 의견을 대표하지 않습니다.
감사의 말
이 작품은 국방 위협 감소 기관 (DTRA) 프로젝트 번호 CB-SEED-SEED09-2-0061 및 CBCall4-CBM-05-2-0019에 의해 지원되었다, NCATS의 교내 / 교내 연구 프로그램에 의해 부분적으로, NIH (XH) 및 해군 연구소 기지 기금.
자료
| Name | Company | Catalog Number | Comments |
| 250 mL Erlenmeyer Flask | VWR | 89000-362 | |
| 2-mercaptoethanol | Acros Organics (Fisher) | 125472500 | Danger: Acutely Toxic. Open bottle in hood to avoid inhaling the fumes. |
| 4 L Pyrex wide-mouth graduated Erlenmeyer flask with screw-cap | Millipore Sigma | CLS49954L-1EA | |
| AKTA Prime Plus | GE Healthcare | 17-0729-01 | |
| AKTA XK 16/20 Column | GE Healthcare | 28988937 | |
| Amicon Ultra-0.5 Centrifugal Filter Unit | Millipore Sigma | UFC501096 | |
| Amicon Ultra-15 Centrifugal Filter Unit | Millipore Sigma | UFC901096 | |
| Amicon Ultra-4 Centrifugal Filter Unit | Millipore Sigma | UFC801024 | |
| Ampicillin | Sigma | A0166 | Danger: Allergic reactions (skin or breathing). |
| Chelating Sepharose Fast Flow | GE Healthcare | 17-0575-02 | Once the resin is equilibrated with 0.2 M Nickel Sulfate it is refered to as a Nickel Column in the text. Column will have a green color after washing with water. The column will have a blue color after equilibrating with buffer. |
| Chloramphenicol | RPI | C61000 | Danger: May cause cancer. |
| Corning 50 mL centrifuge tubes | Corning | 430828 | Suggestion: Polypropylene tubes are less likely to crack during sonication than Polyethylene tubes |
| Corning 96 Well Half-Area Microplate, Non-Binding Surface | Corning | 3993 | |
| Dialysis Tubing Clips | Fisher Scientific | PI68011 | |
| Disposable PD-10 Desalting Column | GE Healthcare | 17-0851-01 | |
| DNAse | Sigma | DN25-1G | |
| DTT (DL-Dithiothreitol) | RPI | D11000-50.0 | Warning: Acute Oral Toxicity; skin and eye irritation |
| EDTA | Fisher Scientific | S311-500 | |
| Fisherbrand Petri Dishes with Clear Lid | Fisher Scientific | FB0875712 | |
| Glycerol | Acros Organics (Fisher) | 15892-0010 | |
| HEPES | Millipore Sigma | H4034-1KG | |
| Imidazole | Acros Organics | 301870010 | Danger: Toxic, Irritant |
| IPTG (Isopropyl β-D-thiogalactopyranoside) | Calbiochem (Millipore Sigma) | 420291 | Do not breathe dust. Avoid contact with eyes and skin. |
| Laemmli Sample Buffer | BIO-RAD | 1610737 | |
| Luria Bertani Agar | Fluka (Millipore Sigma) | L3027-1KG | Suggestion: Autoclave with magnetic stirrer in the liquid, and stir while cooling. Wait to add antibiotic until you can hold your hands on the bottle without pain for 30 seconds. |
| Luria Bertani Media | Fisher Bioreagents | BP1426-2 | |
| Lysozyme | Sigma | L4919-5g | |
| Mini-PROTEAN Tetra Vertical Electrophoresis CellGel Box | BIO-RAD | ||
| Nalgene Oak Ridge High-Speed PPCO Centrifuge Tubes | Nalgene (Thermo Scientific) | 3119-0050 | |
| Nanodrop | Thermo Fisher | ||
| New Brunswick Innova 42R Shaker Incubator | Eppendorf | M1335 | |
| Nickel Sulfate Hexahydrate (Crystalline/Certified ACS), Fisher Chemical | Fisher Scientific | N73-500 | Danger: Harmful if swallowed or inhaled, skin and eye irritation |
| One Shot BL21(DE3) Chemically Competent E. coli | Invitrogen (Thermo Fisher) | C600003 | May be harmful if inhaled or swallowed. May cause skin and eye irritation with susceptible people. |
| One Shot BL21(DE3) pLysS Chemically Competent E. coli | Invitrogen (Thermo Fisher) | C606003 | May be harmful if inhaled or swallowed. May cause skin and eye irritation with susceptible people. |
| pet15b plasmid DNA | Novagen (Millipore Sigma) | 69661 | GenScript Inc. was used for commerical DNA synthesis. The pet15b plasmid was used for the CFP/YFP substrates. |
| pet32b | Novagen (Millipore Sigma) | 69016-3 | The pet32b plasmid was used for the cysteine protease construct. |
| Pierce Protease Inhibitor Mini Tablets, EDTA-free | Thermo Fisher | A32955 | Warning: Skin corrosion/irriation; eye damage |
| Plate Reader | Molecular Devices | Model M5 | |
| Precision Plus Protein All Blue Prestained Protein Standard | BIO-RAD | 161-0373 | |
| Protein Extraction Reagent | Novagen (Millipore Sigma) | 70584-4 | BugBuster or Bper (Catalog # 78248, ThermoFisher) |
| Q-Sepharose Fast Flow | G.E. Healthcare | 17-0510-01 | Anion exchange resin |
| RunBlue (12%) 17-well PAGE gels | Expedeon | BCG01227 | Any 12% pre-cast polyacrylamide gel can be used |
| RunBlue 20x SDS Running Buffer | Expedeon | NXB50500 | Dilute 50 mL with 950 mL deionized water to obtain 1x |
| RunBlue Instant Blue Gel Stain | Expedeon | ISB1L | Do not dilute, use as directed |
| Sodium Chloride | Fisher Chemical | S271-10 | |
| Sonifier Cell Disrupter 450 Sonicator | Branson Ultrasonics (VWR) | Model No. 101-063-346R | Sonicator was used on level 5 |
| Spectra/Por 6-8 kD MWCO | Spectrum Labs | 132645T | Dialysis Tubing |
| SP-Sepharose Fast Flow | G.E. Healthcare | 17-0729-01 | Cation exchange resin |
| Thrombin from bovine plasma | Sigma | T6634-500UN | |
| Tris Base | Fisher Scientific | BP152-500 | Caution: Eye/Skin Irritant |
참고문헌
- Liu, H., et al. Widespread Horizontal Gene Transfer from Double-Stranded RNA Viruses to Eukaryotic Nuclear Genomes. Journal of Virology. 84 (22), 11876-11887 (2010).
- Hagai, T., Azia, A., Babu, M. M., Andino, R. Use of host-like peptide motifs in viral proteins is a prevalent strategy in host-virus interactions. Cell Reports. 7 (5), 1729-1739 (2014).
- Gorbalenya, A. E. Host-related sequences in RNA viral genomes. Seminars in Virology. 3, 359-371 (1992).
- Shmakov, S. A., et al. The CRISPR Spacer Space Is Dominated by Sequences from Species-Specific Mobilomes. MBio. 8 (5), 1-18 (2017).
- Legler, P. M., Morazzani, E., Glass, P. J., Compton, J. R. Proteome Editing System and A Biomarker of Veev Infection. United States patent application. , (2018).
- Morazzani, E. M., et al. Proteolytic cleavage of host proteins by the Group IV viral proteases of Venezuelan equine encephalitis virus and Zika virus. Antiviral Research. 164, 106-122 (2019).
- Alvarez, E., Castello, A., Menendez-Arias, L., Carrasco, L. HIV protease cleaves poly(A)-binding protein. Biochemical Journal. 396 (2), 219-226 (2006).
- Falk, M. M., et al. Foot-and-mouth disease virus protease 3C induces specific proteolytic cleavage of host cell histone H3. Journal of Virology. 64 (2), 748-756 (1990).
- Grigera, P. R., Tisminetzky, S. G. Histone H3 modification in BHK cells infected with foot-and-mouth disease virus. Virology. 136 (1), 10-19 (1984).
- Li, W., Ross-Smith, N., Proud, C. G., Belsham, G. J. Cleavage of translation initiation factor 4AI (eIF4AI) but not eIF4AII by foot-and-mouth disease virus 3C protease: identification of the eIF4AI cleavage site. FEBS Letters. 507 (1), 1-5 (2001).
- Kuyumcu-Martinez, M., et al. Calicivirus 3C-like proteinase inhibits cellular translation by cleavage of poly(A)-binding protein. Journal of Virology. 78 (15), 8172-8182 (2004).
- Pietila, M. K., Hellstrom, K., Ahola, T. Alphavirus polymerase and RNA replication. Virus Research. 234, 44-57 (2017).
- Hardy, W. R., Strauss, J. H. Processing the nonstructural polyproteins of sindbis virus: nonstructural proteinase is in the C-terminal half of nsP2 and functions both in cis and in trans. Journal of Virology. 63 (11), 4653-4664 (1989).
- Strauss, E. G., De Groot, R. J., Levinson, R., Strauss, J. H. Identification of the active site residues in the nsP2 proteinase of Sindbis virus. Virology. 191 (2), 932-940 (1992).
- Wang, D., et al. Foot-and-mouth disease virus 3C protease cleaves NEMO to impair innate immune signaling. Journal of Virology. 86 (17), 9311-9322 (2012).
- Aguirre, S., et al. DENV inhibits type I IFN production in infected cells by cleaving human STING. PLoS Pathogens. 8 (10), e1002934(2012).
- Barral, P. M., Sarkar, D., Fisher, P. B., Racaniello, V. R. RIG-I is cleaved during picornavirus infection. Virology. 391 (2), 171-176 (2009).
- Elbashir, S. M., Lendeckel, W., Tuschl, T. RNA interference is mediated by 21- and 22-nucleotide RNAs. Genes & Development. 15 (2), 188-200 (2001).
- Deveau, H., Garneau, J. E., Moineau, S. CRISPR/Cas system and its role in phage-bacteria interactions. Annual Review of Microbiology. 64, 475-493 (2010).
- Schechter, I., Berger, A. On the size of the active site in proteases I. Papain. Biochemical and Biophysical Research Communications. 27 (2), 157-162 (1967).
- Bieniasz, P. D. Intrinsic immunity: a front-line defense against viral attack. Nature Immunology. 5 (11), 1109-1115 (2004).
- Zhou, Z., et al. TRIM14 is a mitochondrial adaptor that facilitates retinoic acid-inducible gene-I-like receptor-mediated innate immune response. Proceedings of the National Academy of Sciences of the U S A. 111 (2), E245-E254 (2014).
- Wang, S., et al. TRIM14 inhibits hepatitis C virus infection by SPRY domain-dependent targeted degradation of the viral NS5A protein. Scientific Reports. 6, 32336(2016).
- Zacks, M. A., Paessler, S. Encephalitic alphaviruses. Veterinary Microbiology. 140 (3-4), 281-286 (2010).
- Hollidge, B. S., Weiss, S. R., Soldan, S. S. The role of interferon antagonist, non-structural proteins in the pathogenesis and emergence of arboviruses. Viruses. 3 (6), 629-658 (2011).
- Carthagena, L., et al. Human TRIM gene expression in response to interferons. PLoS One. 4 (3), e4894(2009).
- Montgomery, S. A., Johnston, R. E. Nuclear import and export of Venezuelan equine encephalitis virus nonstructural protein 2. Journal of Virology. 81 (19), 10268-10279 (2007).
- Nenasheva, V. V., et al. Enhanced expression of trim14 gene suppressed Sindbis virus reproduction and modulated the transcription of a large number of genes of innate immunity. Immunologic Research. 62 (3), 255-262 (2015).
- Nagai, T., et al. A variant of yellow fluorescent protein with fast and efficient maturation for cell-biological applications. Nature Biotechnology. 20 (1), 87-90 (2002).
- Li, M. Z., Elledge, S. J. SLIC: a method for sequence- and ligation-independent cloning. Methods in Molecular Biology. 852, 51-59 (2012).
- Hu, X., et al. Kinetic, Mutational, and Structural Studies of the Venezuelan Equine Encephalitis Virus Nonstructural Protein 2 Cysteine Protease. Biochemistry. 55 (21), 3007-3019 (2016).
- Morazzani, E. M., et al. Proteolytic cleavage of host proteins by the Group IV viral proteases of Venezuelan equine encephalitis virus and Zika virus. Antiviral Research. 164, 106-122 (2019).
- Zhang, D., Tozser, J., Waugh, D. S. Molecular cloning, overproduction, purification and biochemical characterization of the p39 nsp2 protease domains encoded by three alphaviruses. Protein Expression and Purification. 64 (1), 89-97 (2009).
- Lei, J., et al. Crystal structure of Zika virus NS2B-NS3 protease in complex with a boronate inhibitor. Science. 353 (6298), 503-505 (2016).
- Shiryaev, S. A., et al. Characterization of the Zika virus two-component NS2B-NS3 protease and structure-assisted identification of allosteric small-molecule antagonists. Antiviral Research. 143, 218-229 (2017).
- Smith, J. L., Jeng, S., McWeeney, S. K., Hirsch, A. J. A MicroRNA Screen Identifies the Wnt Signaling Pathway as a Regulator of the Interferon Response during Flavivirus Infection. Journal of Virology. 91 (8), (2017).
- Lee, Y. S., et al. The Wnt inhibitor secreted Frizzled-Related Protein 1 (sFRP1) promotes human Th17 differentiation. European Journal of Immunology. 42 (10), 2564-2573 (2012).
- Goodfellow, F. T., et al. Zika Virus Induced Mortality and Microcephaly in Chicken Embryos. Stem Cells and Development. 25 (22), 1691-1697 (2016).
- Morrison, T. E., Diamond, M. S. Animal Models of Zika Virus Infection, Pathogenesis, and Immunity. Journal of Virology. 91 (8), (2017).
- Morazzani, E. M., et al. Books of Abstracts, 254th American Chemical Society National Meeting. , Washington, D.C. (2017).
- Compton, J. R., Mickey, M. J., Hu, X., Marugan, J. J., Legler, P. M. Mutation of Asn-475 in the Venezuelan Equine Encephalitis Virus nsP2 Cysteine Protease Leads to a Self-Inhibited State. Biochemistry. 56 (47), 6221-6230 (2017).
- Vasiljeva, L., et al. Regulation of the sequential processing of Semliki Forest virus replicase polyprotein. Journal of Biological Chemistry. 278 (43), 41636-41645 (2003).
- Uchil, P. D., Quinlan, B. D., Chan, W. T., Luna, J. M., Mothes, W. TRIM E3 ligases interfere with early and late stages of the retroviral life cycle. PLoS Pathogens. 4 (2), e16(2008).
- Ozato, K., Shin, D. M., Chang, T. H., Morse, H. C. 3rd TRIM family proteins and their emerging roles in innate immunity. Nature Reviews Immunology. 8 (11), 849-860 (2008).
- van Tol, S., Hage, A., Giraldo, M. I., Bharaj, P., Rajsbaum, R. The TRIMendous Role of TRIMs in Virus-Host Interactions. Vaccines (Basel). 5 (3), (2017).
- Molaei, G., et al. Dynamics of Vector-Host Interactions in Avian Communities in Four Eastern Equine Encephalitis Virus Foci in the Northeastern U.S. PLoS Neglected Tropical Diseases. 10 (1), e0004347(2016).
- Ding, Q., et al. Species-specific disruption of STING-dependent antiviral cellular defenses by the Zika virus NS2B3 protease. Proceedings of the National Academy of Sciences of the U S A. 115 (27), E6310-E6318 (2018).
- Angov, E., Legler, P. M., Mease, R. M. Adjustment of codon usage frequencies by codon harmonization improves protein expression and folding. Methods in Molecular Biology. 705, 1-13 (2011).
- Ruge, D. R., et al. Detection of six serotypes of botulinum neurotoxin using fluorogenic reporters. Analytical Biochemistry. 411 (2), 200-209 (2011).
- Hu, X., et al. Structural insight into exosite binding and discovery of novel exosite inhibitors of botulinum neurotoxin serotype A through in silico screening. Journal of Computer-Aided Molecular Design. 28 (7), 765-778 (2014).
- Dunning, F. M., et al. Detection of botulinum neurotoxin serotype A, B, and F proteolytic activity in complex matrices with picomolar to femtomolar sensitivity. Applied and Environmental Microbiology. 78 (21), 7687-7697 (2012).
- Nguyen, T. G., et al. Development of fluorescent substrates and assays for the key autophagy-related cysteine protease enzyme ATG4B. Assay and Drug Development Technologies. 12 (3), 176-189 (2014).
- Zhang, J. H., Chung, T. D., Oldenburg, K. R. A Simple Statistical Parameter for Use in Evaluation and Validation of High Throughput Screening Assays. Journal of Biomolecular Screening. 4 (2), 67-73 (1999).
- Bovolenta, P., Esteve, P., Ruiz, J. M., Cisneros, E., Lopez-Rios, J. Beyond Wnt inhibition: new functions of secreted Frizzled-related proteins in development and disease. Journal of Cell Science. 121 (Pt 6), 737-746 (2008).
- Esteve, P., et al. SFRPs act as negative modulators of ADAM10 to regulate retinal neurogenesis. Nature Neuroscience. 14 (5), 562-569 (2011).
- Garcia-Hoyos, M., et al. Evaluation of SFRP1 as a candidate for human retinal dystrophies. Molecular Vision. 10, 426-431 (2004).
- Marcos, S., et al. Secreted frizzled related proteins modulate pathfinding and fasciculation of mouse retina ganglion cell axons by direct and indirect mechanisms. Journal of Neuroscience. 35 (11), 4729-4740 (2015).
- Moore, C. A., et al. Characterizing the Pattern of Anomalies in Congenital Zika Syndrome for Pediatric Clinicians. JAMA Pediatrics. 171 (3), 288-295 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유