JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
반복적인 후성유전체학 분석을 위한 재사용 가능한 단일 세포
요약
본 프로토콜은 재사용 가능한 단일 세포를 사용하여 반복적인 후성유전체 분석을 위한 단일 세포 방법을 설명합니다. 재사용 가능한 단일 세포를 통해 동일한 단일 세포에서 여러 후성유전학적 마크를 분석하고 결과를 통계적으로 검증할 수 있습니다.
초록
현재의 단일 세포 에피게놈 분석은 일회용으로 설계되었습니다. 세포는 일회성 사용 후 폐기되어 단일 세포에서 여러 후성유전학적 표지를 분석할 수 없으며 단일 세포에서 실험 배경 잡음과 신호를 구별하기 위해 다른 세포의 데이터가 필요합니다. 이 논문은 반복적인 후성유전체학 분석을 위해 동일한 단일 세포를 재사용하는 방법을 설명합니다.
이 실험 방법에서 세포 단백질은 단백질과 DNA에 가교하는 대신 먼저 폴리아크릴아미드 폴리머에 고정되어 구조적 편향을 완화합니다. 이 중요한 단계를 통해 동일한 단일 세포로 반복적인 실험이 가능합니다. 다음으로, 근접 결찰을 위한 스캐폴드 서열을 가진 무작위 프라이머를 게놈 DNA에 어닐링하고, DNA 중합효소를 이용하여 연장하여 프라이머에 게놈 서열을 첨가한다. 이어서, 후성유전학적 마커 및 대조군 IgG에 대한 항체는 각각 상이한 DNA 프로브로 표지되어 동일한 단일 세포 내의 각각의 표적에 결합된다.
근접 라이게이션은 랜덤 프라이머와 항체-DNA 프로브의 스캐폴드 서열에 상보적인 서열을 가진 커넥터 DNA를 부가함으로써 랜덤 프라이머와 항체 사이에 유도된다. 이 접근법은 항체 정보와 주변 게놈 서열을 근접 결찰의 단일 DNA 산물에 통합합니다. 이 방법을 사용하면 동일한 단일 세포로 반복 실험을 수행할 수 있으므로 희귀 세포의 데이터 밀도를 높이고 동일한 세포의 IgG 및 항체 데이터만 사용하여 통계 분석을 수행할 수 있습니다. 이 방법으로 제조된 재사용 가능한 단일 세포는 최소 몇 개월 동안 보관하고 나중에 재사용하여 후성유전학적 특성을 넓히고 데이터 밀도를 높일 수 있습니다. 이 방법은 연구자와 프로젝트에 유연성을 제공합니다.
서문
Single-cell 기술은 개별 single-cell omics 기술을 통합하는 single-cell multiomics의 시대로 진입하고 있습니다1. 최근 단일 세포 전사체학은 염색질 접근성(scNMT-seq2 및 SHARE-seq3) 또는 히스톤 변형(Paired-seq4 및 Paired-Tag5)을 검출하는 방법과 결합되었습니다. 보다 최근에는 단일 세포 전사체학 및 단백질체학이 염색질 접근성과 통합되었습니다(DOGMA-seq6). 이러한 방법은 염색질 접근성 또는 히스톤 변형을 감지하기 위해 전이효소 기반 태깅을 사용합니다.
전이효소 기반 접근 방식은 게놈 DNA를 절단하고 게놈 DNA 단편 끝에 DNA 바코드를 추가합니다. 절단된 각 게놈 단편은 최대 2개의 DNA 바코드(= 절단 부위당 하나의 후성유전학적 마크)만 수용할 수 있으며 절단 부위의 게놈 DNA는 손실됩니다. 따라서 분열 기반 접근법은 테스트된 후성유전학적 마크의 수와 신호 밀도 사이에 절충안이 있습니다. 이것은 동일한 단일 세포에서 여러 후성 유전 학적 표지의 분석을 방해합니다. 게놈 DNA를 절단하지 않는 단세포 후성유전체법이 이러한 문제를 극복하기 위해 개발되었다 7,8.
위에서 언급한 절단 유래 문제 외에도 전이효소 기반 접근 방식에는 다른 제한 사항이 있습니다. 단일 세포 후성유전체 분석에서는 게놈에서 히스톤과 DNA 관련 단백질의 위치를 아는 것이 중요합니다. 현재의 접근법에서, 이것은 고정되지 않은 단일 세포와 단백질-DNA 및 단백질-단백질 상호작용의 유지를 사용함으로써 달성된다. 그러나 이것은 히스톤 변형 분석에서도 접근 가능한 염색질 영역에 강한 편향을 일으킨다9. 게놈 상의 히스톤 및 게놈 관련 단백질의 위치는 폴리아크릴아미드 스캐폴드 7,8을 사용하여 단백질-DNA 및 단백질-단백질을 가교하지 않고 보존할 수 있습니다. 이 접근법은 단백질-DNA 및 단백질-단백질 상호작용에 의존하는 현재 접근법에서 관찰되는 구조적 편향을 줄입니다.
전이효소 기반 접근법은 단일 세포에서 신호를 한 번만 획득할 수 있습니다. 따라서 신호의 감소로 인해 단일 세포의 완전한 후성유전체를 묘사하는 것은 어렵습니다. 재사용 가능한 단일 세포는 동일한 단일 세포에서 반복적인 후성유전체 분석을 허용함으로써 현재의 한계를 극복하기 위해 개발되었습니다.
프로토콜
참고: 이 방법의 개략도는 그림 1에 나와 있습니다.
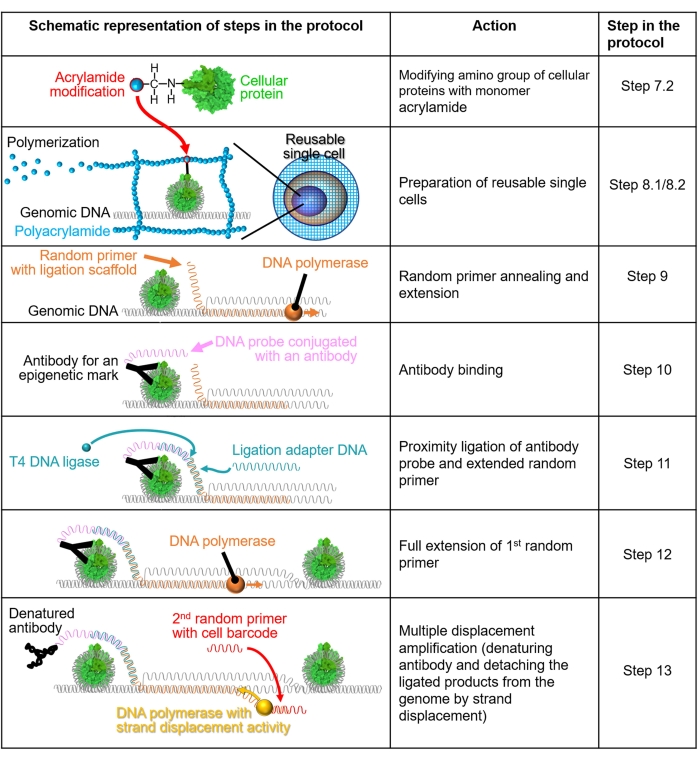
그림 1: 프로토콜 워크플로의 개략도. 7.2-13단계는 개략도를 통해 설명됩니다. 각 행은 프로토콜의 단계를 나타냅니다. 녹색으로 착색된 세포 단백질은 결정 구조(PDB: 6M4G)를 기반으로 생성된 인간 뉴클레오솜입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
1. 탈염 컬럼의 평형
참고: 탈염 스핀 컬럼은 다음 단계에 설명된 대로 평형을 이룹니다. 평형 탈염 컬럼은 2.1, 3.4 및 4.6 단계에서 사용됩니다.
- 탈염 컬럼의 하단 폐쇄(7kDa 컷오프, 0.5mL 수지 비드 부피, 재료 표 참조)를 제거하고 탈염 컬럼 상단의 캡을 풉니다.
- 컬럼을 1.5 mL 단백질 저결합 튜브(수집 튜브, 표 재료 참조)에 넣고 실온에서 1분 동안 1,500 × g 에서 원심분리하여 컬럼 내의 저장 용액을 제거하였다.
알림: 스윙 로터 원심분리기를 사용하여 비드 베드 상단을 평평하게 합니다. - 1.5mL 튜브에서 플로우스루를 제거하고 수지 베드 위에 150mM NaCl/100mM 인산염 완충액(pH 8.0)( 표 1 참조) 300μL를 추가합니다.
- 실온에서 1분 동안 1,500× g 의 원심분리하고 수집 튜브에서 유동을 제거합니다.
- 1.3-1.4단계를 세 번 더 반복합니다.
- 수집 튜브에서 버퍼를 버리고 컬럼을 새 수집 튜브에 넣습니다.
- 2.1, 3.4 및 4.4단계에서 평형 탈염 컬럼을 사용합니다.
2. 항체의 완충액 교환
참고: 항-H3K27ac 10, 항-H3K27me3 10, 항-Med111 및 항-Pol II10에서 글리세롤, 아르기닌 및 아지드화나트륨을 제거합니다(표 1에 표시된 완충액 조성 참조). 다음의 모든 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 소요시간: 1시간
- 항체 용액(100 μL, 표 2 참조)을 단계 1 다음에 제조된 평형화된 탈염 컬럼에 적용한다.
- 4°C에서 2분 동안 1,500× g 의 원심분리하고 수집 튜브에서 1.5mL 단백질 저결합 튜브로 플로우스루를 옮깁니다.
- 280 nm에서 흡광도를 사용하여 IgG 농도를 측정한다12 (마이크로 볼륨 분광 광도계 사용).
- 항체 용액을 한외여과 카세트(분자량 컷오프 100 kDa, 0.5 mL, 물질 표 참조)로 옮기고, 4°C에서 5분 동안 12,000 × g 에서 원심분리한다.
- 280 nm에서 흡광도를 이용하여 IgG 농도를 측정한다.
- IgG 농도가 2.4 mg / mL에 도달 할 때까지 2.5-1 단계를 반복하십시오.
3. 항체 활성화
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 2.5시간
- 숙신이미딜 6-히드라지노니코티네이트 아세톤 히드라존(S-HyNic, 재료 표 참조) 1mg을 무수 N,N-디메틸포름아미드(DMF, 재료 표 참조) 100μL와 함께 녹입니다.
참고: DMF는 가연성 유기 용매이며 피부를 통해 흡수되는 강력한 간 독소입니다. 장갑, 보안경 및 실험복을 착용하십시오. 기관 안전 지침을 따르십시오. 사용한 실험기구는 기관 지침에 따라 폐기하십시오. - 항체 용액 100μL에 S-HyNic/DMF 0.6μL를 추가합니다(150mM NaCl/100mM 인산나트륨, pH8.0 중 1mg/mL). 사용된 항체 및 대조군 IgG에 대해서는 표 2 를 참조한다.
- 실온에서 2 시간 동안 배양하십시오 (빛으로부터 보호).
- S-Hynic 반응 항체 100μL를 평형 탈염 컬럼 상단(1단계 참조)에 적용하고 1,500× g 에서 4°C에서 2분 동안 원심분리하여 샘플을 수집합니다.
- 사용 후에는 탈염 컬럼을 폐기하십시오.
참고: 단백질 및 기타 생체 분자에 대한 HyNic 그룹의 안정성은 다양합니다. HyNic으로 변형된 생체 분자를 즉시 접합하는 것이 좋습니다.
4. DNA 프로브의 활성화
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 2.5시간
- 항체 또는 대조군 IgG(항체 프로브, 표 3)에 대한 아민 변형 DNA 프로브 펠릿을 150mM NaCl/100mM 인산나트륨 완충액, pH 8.0 20μL로 용해합니다.
알림: 튜브 바닥에 얇고 투명한 펠릿/필름을 찾으십시오. 완충액을 펠릿에 직접 바르십시오. 펠릿이 보이지 않으면 펠릿이 분리되어 벽이나 뚜껑에 부착되었을 수 있습니다. 이 경우 튜브를 원심분리하고 튜브 바닥에서 펠릿을 찾습니다. - 1mg의 숙신이미딜 4-포르밀벤조에이트(S-4FB, 재료 표 참조)를 50μL의 무수 DMF와 함께 용해하고 10μL의 DMF를 용해된 항체 프로브에 추가합니다.
- 4.2단계에서 준비한 S-4FB/DMF 4μL를 넣고 혼합한 후 실온에서 2시간 동안 배양합니다(빛으로부터 보호).
- 34μL의 S-4FB 반응 항체 프로브를 평형 탈염 컬럼 상단에 적용합니다(1단계 참조).
- 15μL의 150mM NaCl/100mM 인산나트륨 완충액(pH 8.0)을 겔 베드 상단에 도포한 후 s-4FB 변형 항체 프로브를 수집하기 위해 4°C에서 2분 동안 1,500× g 에서 원심분리합니다.
- 후속 접합을 위해 플로우 스루를 사용하십시오. 260 nm에서 흡광도를 측정하고; 항체 프로브의 회수율을 계산합니다.
5. S-Hynic 개질 항체와 S-4FB 개질 항체 프로브의 접합
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 소요시간: 2시간
- S-Hynic 변형 항체와 S-4FB 변형 항체 프로브를 혼합하고 용액을 위아래로 피펫하여 혼합합니다.
- 실온에서 2 시간 동안 배양하십시오 (빛으로부터 보호).
- 반응을 켄칭하기 위해, 478.8 μL의 Quenching & Storage 용액을 첨가한다 ( 표 1 참조).
- 항체 프로브 접합 항체 용액을 한외여과 카세트(분자량 컷오프 100kDa)로 옮깁니다.
- 12,000 × g, 4 °C에서 5분 동안 원심분리한다.
- 피펫팅으로 카세트 내부의 용액 부피를 확인하십시오.
- 부피가 100μL에 도달할 때까지 5.5-5.6단계를 반복하고 -20°C에서 보관합니다.
참고 : IgG 농도는 IgG 표준을 사용하여 샌드위치 ELISA13,14,15로 측정됩니다.
6. 코어 마그네틱 비드의 제조
참고: 이 방법에서는 단일 셀이 이중층 아크릴아미드 비드에 삽입됩니다( 그림 2 참조). 코어는 자성 폴리아크릴아미드 비드입니다. 외부층은 폴리아크릴아미드 단독입니다. 코어 마그네틱 비드는 이 섹션에서 생성됩니다. 이 섹션은 실험에 필수적인 것은 아닙니다. 소요시간: 3시간
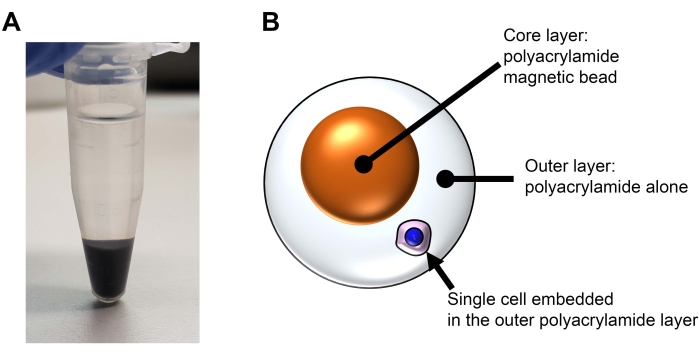
그림 2: REpi-seq 실험에서 가시성과 손쉬운 취급을 위한 이중층 폴리아크릴아미드 비드의 구조 . (a) 원심분리 후 단계 6.6의 자성 나노입자. 자성 나노 입자는 단량체 아크릴 아미드로 변형되어 B에 표시된 폴리 아크릴 아미드 자성 비드에 통합됩니다. (B) 폴리아크릴아미드 자성 비드가 있는 재사용 가능한 단일 셀의 개략도. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 50μL의 1M 중탄산나트륨 완충액, pH 8.5 및 450μL의 40% 아크릴아미드 용액을 혼합합니다.
참고: 아크릴아마이드는 신경독입니다. 장갑, 보안경 및 실험복을 착용하십시오. 기관 안전 지침을 따르십시오. 사용한 실험기구는 기관 지침에 따라 폐기하십시오. - NHS 에스테르 작용화 된 30 nm의 산화철 분말 ( 재료 표 참조) 1g을 아크릴 아미드 / 중탄산 나트륨 완충액에 현탁하고 4 °C에서 밤새 배양합니다.
알림: 아크릴아마이드 비드는 투명하기 때문에 비드의 위치를 보고 조작하기 어려울 수 있습니다. 산화철로 만들어진 코어 비드를 포함하면 자석을 사용하여 비드의 위치를 제어할 수 있기 때문에 가시성이 향상되고 조작이 용이합니다. 그러나 사용자가 REpi-seq 실험에 익숙하다면 코어 자성 폴리아크릴아미드 비드의 사용을 건너뛸 수 있습니다. - 나노비드 현탁액을 2개의 튜브(1.5mL)로 옮기고, 4°C에서 1시간 동안 21,300× g 에서 원심분리하고(각진 로터 사용), 상층액을 제거합니다.
- 바닥 슬러리를 40% 아크릴아마이드/비스-아크릴아미드 1mL(19:1, 재료 표 참조)로 현탁합니다.
참고: 비스-아크릴아마이드는 신경독입니다. 장갑과 실험복을 착용하십시오. 기관 안전 지침을 따르십시오. 사용한 실험기구는 기관 지침에 따라 폐기하십시오. - 4°C에서 21,300× g 의 원심분리기에서 1시간 동안(각진 로터 사용).
- 4°C에서 5,000× g 에서 30분 동안 원심분리(브레이크 없이 스윙 로터 사용).
- 저속 흡인이 있는 P1000 피펫을 사용하여 상층액을 제거합니다.
- 부피를 400 μL의 40 % 아크릴 아미드 / 비스 아크릴 아미드 (19 : 1, 재료 표 참조)로 조정합니다.
- 25 μL의 10% 과황산암모늄 용액을 첨가한다( 표 1 참조).
알림: 과황산암모늄은 강력한 산화제입니다. 과황산암모늄이 포함된 공기 중 먼지는 접촉 시 눈, 코, 목, 폐 및 피부를 자극할 수 있습니다. 장갑, 보안경 및 실험복을 착용하십시오. 기관 안전 지침을 따르십시오. 사용한 실험기구는 기관 지침에 따라 폐기하십시오. - 코어 자성 폴리아크릴아미드 비드를 생성하려면 아크릴아미드 변성 산화철 현탁액 0.5μL를 PCR 튜브로 옮깁니다.
- 4% N,N,N', N'-테트라메틸에틸렌디아민/미네랄 오일(TEMED, 표 1 참조) 50μL를 넣고 실온에서 밤새 배양합니다.
알림: TEMED는 가연성 용매입니다. 후드 아래에서 작업하십시오. 흡입하지 마십시오. 화염, 뜨거운 표면 및 발화원에서 멀리하십시오. 장갑, 보안경 및 실험복을 착용하십시오. 기관 안전 지침을 따르십시오. 사용한 실험기구는 기관 지침에 따라 폐기하십시오.
7. 세포 단백질의 아미노기를 단량체 아크릴아미드로 변형
참고: REpi-seq는 단일 세포 수준에서 마우스와 인간 세포의 후성유전체를 분석하도록 설계되었습니다. 이 방법을 마우스 또는 인간 이외의 종의 세포에 사용할 때 각 단계를 최적화해야 합니다.
- 세포 수확
참고: 소요시간: 30분- 세포 계수기를 사용하여 세포 농도 및 생존율을 측정한다( 재료 표 참조).
참고: 이 단계에서 세포의 생존력은 데이터 분석에서 살아있는 세포인 세포 수에 영향을 미칩니다. - 10% 소 태아 혈청이 포함된 배양 배지(*)를 사용하여 세포 농도를 1 ×10 5 cells/mL로 조정합니다.
참고: *배양 배지는 관심 세포에 최적의 배양 배지입니다. - 세포 현탁액 1mL를 1.5mL 튜브로 옮깁니다.
- 세포 현탁액을 240 × g 에서 4°C에서 5분 동안 원심분리하고 상층액을 제거한다.
- 1mL의 인산염 완충 식염수(PBS)를 첨가하고, 부드러운 피펫팅으로 세포를 혼합하고, 세포 현탁액을 4°C에서 5분 동안 240× g 에서 원심분리합니다.
- 상청액을 제거합니다.
알림: 위의 모든 단계는 오염을 방지하기 위해 층류 청소 후드에서 수행해야 합니다.
- 세포 계수기를 사용하여 세포 농도 및 생존율을 측정한다( 재료 표 참조).
- 세포 단백질의 아미노기를 단량체 아크릴아미드로 변형
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 1.5시간- 1mL의 아미노기 변형 용액( 표 1 참조)을 세포 펠릿에 넣고 부드러운 피펫팅으로 세포 펠릿을 현탁합니다.
- 튜브를 얼음 위에서 1시간 동안 인큐베이션하고, 세포 현탁액을 4°C에서 5분 동안 240 × g 에서 원심분리한다.
- 상층액을 제거하고 DNA용 삽입기 염료를 포함하는 4% 아크릴아미드/1mM EDTA/PBS 100mL로 세포를 재현탁합니다(표 1, 1 cell/μL 참조).
8. 재사용 가능한 단세포(single cell)의 제조
- 재사용 가능한 단일 셀의 준비(수동 버전)
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 9시간/96셀- 1mL의 세포 현탁액(1 cell/μL)과 DNA용 삽입기 염료가 포함된 199mL의 1mM EDTA/PBS (표 1 참조)를 혼합합니다.
- 세포 현탁액 200 μL를 평평한 바닥 96-웰 플레이트의 각 웰로 옮깁니다 (총 10 플레이트, 재료 표 참조).
- 덮개를 96웰 플레이트에 놓고 주사 현미경( 재료 표 참조)을 사용하여 10개의 플레이트를 스캔하여 단일 세포가 포함된 웰을 식별합니다.
- 단일 세포를 함유하는 웰의 내용물을 PCR 튜브로 옮긴다.
- 플레이트를 기울이고(작업자 쪽으로) 단일 셀이 웰의 아래쪽 가장자리로 가라앉을 때까지 몇 분 동안 기다립니다.
- 피펫 팁을 하단 모서리에 놓고 단일 세포와 완충액(흡인 210μL/웰 = 완충액 200μL + 공기 10μL)을 PCR 튜브로 옮깁니다.
알림: P200 저유지 팁을 사용해야 합니다. - 형광현미경을 이용하여 웰을 확인하여 전사를 확인하였다.
- 단일 세포가 여전히 웰에 있는 경우 DNA용 삽입기 염료가 포함된 1mM EDTA/PBS의 200μL/웰을 추가합니다.
- 그런 다음 전송을 반복합니다.
- 브레이크 없이 스윙 로터를 사용하여 4°C에서 5분 동안 240× g 에서 PCR 튜브를 원심분리합니다.
알림: 제동은 튜브에 소용돌이치는 물의 흐름을 일으켜 단일 셀의 침전을 방해합니다. 브레이크가 없는 스윙 로터로 원심분리할 때 단일 셀은 항상 튜브 바닥으로 가라앉습니다. 그러나 각진 로터를 사용하면 단일 셀이 PCR 튜브의 측벽에 부착되어 손실될 수 있습니다. - 매우 느린 피펫팅 속도로 195 μL의 상층액을 제거합니다.
- 195μL/튜브의 아크릴아마이드/비스-아크릴아마이드/APS 용액을 추가합니다( 표 1 참조).
- 브레이크 없이 스윙 로터를 사용하여 4°C에서 5분 동안 240× g 에서 PCR 튜브를 원심분리합니다.
- 매우 느린 피펫팅 속도로 195μL의 상층액을 제거합니다.
- 바닥 3μL를 4% TEMED/미네랄 오일과 자성 폴리아크릴아미드 비드(6단계에서 생성)가 포함된 PCR 튜브로 옮깁니다.
알림: P10 저유지 팁을 사용해야 합니다. 자성 폴리아크릴아미드 비드 근처에 셀을 분배합니다. 광유에서, 단일세포를 포함하는 액체는 표면장력에 의해 자성 폴리아크릴아미드 비드의 표면에 부착된다. - 실온에서 밤새 배양하십시오.
참고: 이 공정은 이중층 아크릴아미드 겔 비드를 생성합니다. 코어는 마그네틱 겔 비드입니다. 외부층은 단일 세포를 함유하는 폴리아크릴아미드 겔이다. 단세포는 겔의 외층에 매립된다. 안전한 정지점: 재사용 가능한 단일 세포를 50% 글리세롤/1mM EDTA/0.05% 트윈 20/0.5% BSA/TBS 완충액으로 세척한 후 재사용 가능한 단일 세포를 -20°C에서 최대 6개월 동안 보관할 수 있습니다.
- 재사용 가능한 단일 셀의 제조 (반자동 버전)
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 3시간/96셀- 1mL의 세포 현탁액(1 cell/μL)과 DNA용 삽입기 염료가 포함된 199mL의 1mM EDTA/PBS (표 1 참조)를 혼합합니다.
- 200 μL의 세포 현탁액을 4 nL 나노웰 플레이트의 각 웰로 옮기고(도 3 및 재료 표 참조) 4 nL 나노웰 플레이트를 자동화된 단일 세포 선별 로봇에 위치시킨다 (재료 표 참조).
- 96웰 PCR 플레이트를 자동 단일 세포 선별 로봇의 대상 플레이트로 배치합니다. 각 웰에 200μL/웰 아크릴아마이드/비스-아크릴아마이드/APS 용액이 포함되어 있는지 확인합니다( 표 1 참조).
- 단일 세포를 4nL 나노웰에서 96웰 PCR 플레이트의 웰로 옮깁니다( 보충 비디오 S1 참조).
- 96-웰 PCR 플레이트 상부에 커버를 씌우고 브레이크가 없는 스윙 로터를 이용하여 4°C에서 5분 동안 240 × g 의 96-웰 플레이트를 원심분리하였다.
- 자동 액체 처리 로봇의 데크에 96웰 PCR 플레이트를 놓습니다( 재료 표, 그림 4 및 보충 코드 1 참조).
- 보충 코드 1을 액체 취급 로봇의 소프트웨어 창(재료 표 참조)으로 끌어다 놓습니다.
- 자동 액체 처리 로봇에서 프로그램을 실행합니다(보충 비디오 S2 및 보충 비디오 S3 참조).
- 매우 느린 피펫팅 속도로 195 μL의 상층액을 제거합니다.
- 4% TEMED/미네랄 오일 50 μL를 추가합니다.
참고: 8.2.8.1-8.2.8.2 단계는 수동 피펫팅으로 수행할 수 있습니다.
- 실온에서 하룻밤 동안 배양합니다(그림 5). 안전한 정지점: 재사용 가능한 단일 세포를 50% 글리세롤/1mM EDTA/0.05% 트윈 20/0.5% BSA/TBS 완충액으로 세척한 후 재사용 가능한 단일 세포를 -20°C에서 최대 6개월 동안 보관합니다.
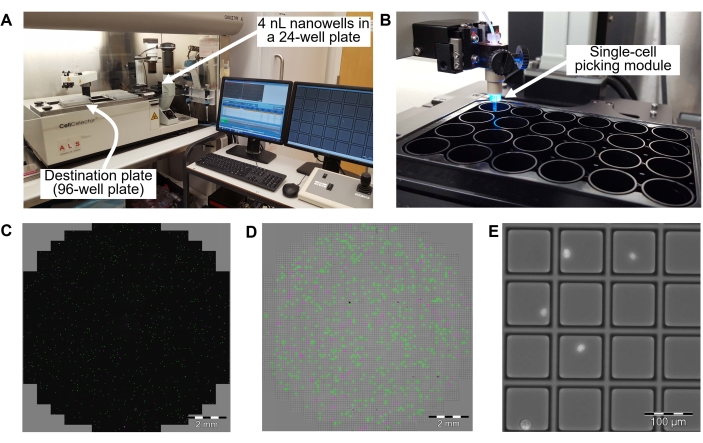
그림 3: 8.2단계에서 자동 단일 세포 선별 및 96웰 PCR 플레이트로의 이식 . (A) 단일 세포 선별 시스템의 개요. 단일 세포 선별 로봇은 오염을 방지하기 위해 층류 청정 후드에 있습니다. (B) 웰 내부에 4nL 나노웰이 있는 24웰 플레이트. (c) 24-웰 플레이트로부터 웰 내에서의 세포 분포. 녹색 점은 각 4nL 나노웰에서 단일 세포로 식별되는 세포입니다. 마젠타 도트는 세포의 이중항 또는 다중선으로 식별되는 셀입니다. (D) 24-웰 플레이트 내 웰의 명시야 이미지. 녹색 사각형은 단일 세포를 포함하는 4nL 나노웰입니다. 마젠타 정사각형은 여러 세포를 포함하는 4nL 나노웰입니다. (E) 약 4nL 나노웰의 확대된 필드. 밝은 점은 4nL 나노웰의 단일 세포입니다. 단일 세포 선별 시스템은 DAPI 염색을 통해 세포의 명시야 및 형광 이미지를 획득하여 단일 세포를 포함하는 나노웰을 식별합니다. 확인된 단일 세포는 4 nL 나노웰로부터 96-웰 PCR 플레이트의 웰로 옮겨진다. 스케일 바 = 2 mm (C, D), 100 μm (E). 약어 = DAPI = 4',6-diamidino-2-phenylindole. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
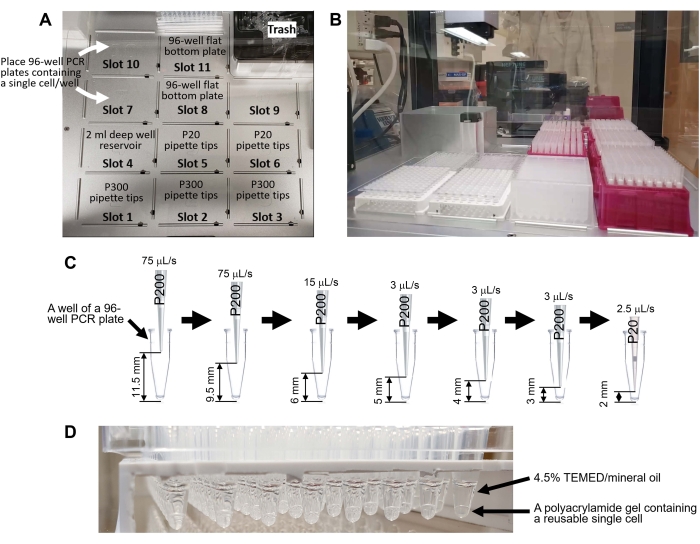
그림 4: 액체 처리 로봇을 사용하여 재사용 가능한 단일 셀 생성. (A) 액체 처리 로봇의 갑판. 데크에는 피펫 팁 랙용 슬롯 11개(P300 팁: 슬롯 1-3, P20 팁: 슬롯 5-6), 2mL 딥웰 96웰 플레이트(슬롯 4), 웰당 단일 셀이 포함된 96웰 PCR 플레이트 2개(슬롯 7 및 10), 액체 폐기물용 평평한 바닥 96웰 플레이트 2개(슬롯 8 및 11)가 있습니다. (B) 실험기구를 놓은 후의 데크. (C) 8.8.1 단계에서 로봇 피펫팅의 개략도. 이 프로그램은 96웰 PCR 플레이트의 바닥에서 단일 세포를 흡인하지 않고 상층액을 제거합니다. (D) 보충 코드 1을 사용하여 생성된 재사용 가능한 단일 셀. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
9. 무작위 프라이머 어닐링 및 확장
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 다음 단계에서 별표(*)는 자기 분리기를 사용하여 튜브에서 재사용 가능한 단일 세포를 포함하는 폴리아크릴아미드 비드의 위치를 제어할 수 있음을 나타냅니다. 그러나, 자기 분리기의 사용이 필수적인 것은 아니다. 튜브의 벽을 따라 피펫 팁을 천천히 아래로 이동시킴으로써, 세척 또는 완충액 교환을 위해 비드가 위로 밀려납니다. 소요시간: 9시간
- 피펫팅(*)으로 미네랄 오일을 제거하고 200μL의 1x TP Mg(-) 완충액으로 5회 세척(*)합니다(10x TP Mg(-) 완충액을 초순수로 1x 완충액으로 희석, 표 1 참조).
- 상층액(*)을 제거하고 15μL의 어닐링 완충액을 추가합니다( 표 1 참조).
- 얼음 위에서 1시간 동안 배양합니다.
참고: 이 배양의 목적은 원형질과 핵막을 투과시키고 무작위 프라이머를 세포핵에 전달하는 것입니다. - PCR 튜브를 열 순환기에 놓고 94°C에서 3분 동안 가열합니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 폴리아크릴아미드 비드의 부피를 포함하여 대략 20 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. - 튜브를 얼음 냉각 금속 블록으로 옮기고 2분 동안 배양합니다.
- 4μL의 MgSO4/NaCl/dNTP 혼합물( 표 1 참조)을 추가하고 중간 속도로 볼텍스 믹서와 혼합합니다.
- 1 μL의 Bst 중합효소, 큰 단편( 재료 표 참조)을 추가하고 중간 속도로 볼텍스 믹서를 사용하여 혼합합니다.
- 셰이커에서 4시간 동안 배양합니다(4°C에서 600rpm).
참고: 이 배양의 목적은 Bst 중합효소를 세포핵에 전달하는 것입니다. - PCR 튜브를 열 순환기에 놓고 다음 프로그램 중 하나를 실행합니다.
- 4시간 프로그램 실행: 10°C에서 30분, 20°C에서 30분, 25°C에서 180분.
- 또는 4시간 동안 4°C, 2시간 동안 10°C, 2시간 동안 20°C, 4시간 동안 25°C, 4°C에서 유지와 같은 야간 프로그램을 실행합니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 폴리아크릴아미드 비드의 부피를 포함하여 대략 25 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. 안전한 정지 지점: 재사용 가능한 단일 세포를 4°C에서 보관하여 최대 1일 동안 여기에서 실험을 중지합니다.
10. 항체 결합
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 1.5시간
- 1.625μL의 NaCl/EDTA/BSA 용액( 표 1 참조)을 추가하고 저속으로 볼텍싱하여 혼합합니다.
참고: 이 단계는 1) EDTA에 의한 Mg2+ 의 킬레이트화를 촉진하고, 2) 300mM NaCl에 의한 확장된 1차 무작위 프라이머의 결합을 안정화하고, 3) 후속 반응에서 소혈청알부민(BSA)을 사용하여 항체의 비특이적 결합을 차단하는 것을 목표로 합니다. - 얼음에서 1 시간 동안 배양하고 항체 프로브 (5 단계에서 제조)와 접합 된 항체 및 대조군 IgG의 각각 0.1 μg / mL를 첨가하십시오.
- 얼음 위에서 하룻밤 동안 셰이커를 부드럽게 흔들어 배양합니다.
11. 항체 프로브 및 근위 확장 무작위 프라이머의 근접 결찰
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 다음 단계의 별표(*)는 튜브에서 재사용 가능한 단일 셀을 포함하는 폴리아크릴아미드 비드의 위치를 제어하기 위해 자기 분리기를 사용할 수 있는 위치를 나타냅니다. 그러나, 자기 분리기의 사용이 필수적인 것은 아니다. 튜브 벽을 따라 피펫 팁을 천천히 아래로 이동시킴으로써 세척 또는 완충액 교환을 위해 비드를 밀어 올릴 수 있습니다. 소요시간: 6시간
- 얼음에서 200μL의 1x TPM-T 버퍼(각 세척에서 20분 배양)로 두 번 세척(*)합니다. 10x TPM-T 완충액(Tris-HCl/염화칼륨/황산마그네슘/Triton X-100)을 초순수로 1x로 희석합니다.
- 상층액을 제거(*)하고 1x T4 DNA 리가아제 완충액으로 한 번 세척(*)합니다( 재료 표 참조).
- 상층액을 제거(*)하고 19μL의 결찰 어댑터 용액을 추가합니다( 표 1 참조).
- 25°C에서 1시간 동안 배양합니다.
- 1 μL T4 DNA 리가아제( 재료 표 참조)를 추가하고 튜브를 중간 속도로 볼텍스 믹서에서 혼합합니다.
- 튜브를 열 순환기에 놓고 근접 결찰 프로그램, 16°C에서 4시간, 25°C에서 30분 프로그램을 실행합니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 폴리아크릴아미드 비드의 부피를 포함하여 대략 25 μL이다. 열 순환기 뚜껑의 온도는 실온입니다. - 200μL의 1x Bst Mg(-) EDTA(+) 완충액으로 2회 세척(*)하고( 표 1 참조, 10x 스톡 완충액에서 1x 완충액 준비) 세포를 4°C에서 밤새 보관합니다. 안전한 정지점: 재사용 가능한 단세포를 4°C에서 보관하여 여기에서 최대 1일 동안 실험을 중지합니다.
12. 1차 무작위 프라이머의 전체 확장
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 4.5시간
- 200μL 1x Bst Mg(-) EDTA(-) 완충액으로 2회 세척하고(표 1 참조, 10x 스톡 완충액에서 1x 완충액 준비), 상층액을 제거하고 Bst/dNTPs/MgSO4 혼합물 20μL를 추가합니다(표 1 참조).
- 중간 속도의 볼텍스 믹서와 혼합하고 오비탈 셰이커에서 4시간 동안 배양합니다(6°C 및 500rpm에서).
- 튜브를 열 순환기에 놓고 다음 프로그램을 실행하십시오: 완전 확장 프로그램: 10 °C 1 시간, 20 °C 1 시간, 30 °C 1 시간, 40 °C 1 시간, 50 °C 1 시간, 65 °C 1 시간, 94 °C 10 분, 4 °C에서 유지.
참고: 안전한 정지 지점: 재사용 가능한 단일 세포를 4°C에서 보관하여 여기에서 최대 1일 동안 실험을 중지할 수 있습니다.
13. 다중 변위 증폭
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 2.5시간(13.1-13.2단계) + 15분(13.3-13.4단계) + 1일(13.5-13.10단계)
- 0.4μL의 100μM 2차 무작위 프라이머( 표 3 참조)를 추가하고 중간 속도로 볼텍스 믹서와 혼합합니다.
- 오비탈 셰이커 상에서 6°C 및 500rpm에서 2시간 동안 인큐베이션하고, 튜브를 열 사이클러에 놓고 94°C에서 3분 동안 가열한다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 폴리아크릴아미드 비드의 부피를 포함하여 대략 25.4 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. - 튜브를 얼음 냉각 금속 블록에 넣고 1μL/튜브의 Bst DNA 중합효소를 추가합니다.
- 저속으로 소용돌이를 일으키고 튜브를 열 순환기에 놓고 다음 프로그램을 실행합니다.
4 °C에서 4 시간, 10 °C에서 30 분, 20 °C에서 30 분, 30 °C에서 30 분, 40 °C에서 30 분, 50 °C에서 30 분, 65 °C에서 60 분, 94 °C에서 3 분, 4 °C에서 유지합니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 폴리아크릴아미드 비드의 부피를 포함하여 대략 26.4 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. 안전한 정지 지점: 재사용 가능한 단일 세포를 4°C에서 보관하여 최대 1일 동안 여기에서 실험을 중지합니다. - 상층액(약 20μL)을 수집하여 PCR 튜브로 옮깁니다.
- 수집된 상등액을 -80°C에서 보관한다.
- 재사용 가능한 단일 세포( 표 1 참조)가 포함된 PCR 튜브에 0.05% Tween 20/0.1x TE 버퍼 20μL/튜브를 추가하고 재사용 가능한 단일 세포를 4°C에서 밤새 배양합니다. 안전한 정지 지점: 배양 시간을 연장하여 며칠 동안 실험을 중단합니다.
- 상청액을 수집하고 상청액을 13.5단계에서 수집된 샘플과 결합합니다.
- 13.7-13.8단계를 한 번 더 반복합니다. 재사용 가능한 단일 세포를 50% 글리세롤/5mM EDTA/0.5% BSA/0.05% Tween20/TBS 완충액에 담그고 오비탈 셰이커(4°C, 600rpm)에서 30분 동안 배양합니다. 재사용 가능한 단세포를 다음 실험까지 -20°C에서 보관한다.
- 40 μL의 Exo-마스터 믹스 (표 1 참조)를 추가하고 튜브를 열 순환기에 놓고 다음 프로그램을 실행하십시오 : i) 95 °C에서 5 분, ii) 95 °C에서 30 초, iii) 60 °C 30 초, iv) 72 °C에서 30 초, v) 단계 ii-iv를 19 회 반복, vi) 72 °C에서 5 분, vii) 4°C에서 유지한다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 폴리아크릴아미드 비드의 부피를 포함하여 대략 45 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. 안전한 정지 지점: 샘플을 -80°C에서 보관하여 여기에서 최소 며칠 동안 실험을 중지할 수 있습니다.
14. 페놀-클로로포름 정제 및 폴리에틸렌글리콜 침전
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 1.5시간
- 생성물을 0.5mL DNA 저결합 튜브에 옮기고 100μL의 페놀:클로로포름:이소아밀 알코올을 추가합니다.
참고: 페놀:클로로포름:이소아밀 알코올은 자극을 유발하고 접촉에 의해 화상을 입을 수 있습니다. 장갑, 보안경 및 실험복을 착용하십시오. 환기가 잘 되는 곳에서만 사용하거나 적절한 호흡보호구를 착용하십시오. 기관 안전 지침을 따르십시오. 사용한 실험기구는 기관 지침에 따라 폐기하십시오. - 손으로 30초 동안 흔들고 12,000× g 에서 4°C에서 10분 동안 원심분리합니다.
- 수성상(80μL)을 0.5mL DNA 저결합 튜브에 수집하고 40.84μL/튜브의 선형 아크릴아미드/MgCl2 혼합물을 추가합니다( 표 1 참조).
- 50%(w/v) PEG8000(RNase-free)의 47.06μL/tube를 추가하고 피펫팅으로 혼합합니다.
- 실온에서 20분 동안 배양하고 실온에서 240× g 에서 10분 동안 원심분리합니다.
- 상청액을 제거하고 80% 에탄올(EtOH)의 튜브당 400μL를 추가합니다.
- 80% EtOH로 세척하고, 흡인기로 상층액을 제거하고, 펠릿을 자연 건조시킨다.
- 펠릿을 20μL의 1mM EDTA/10mM Tris-HCl, pH 7.4 완충액으로 현탁하고 용액을 -80°C에서 보관합니다.
참고: 이중 가닥 DNA 특이적 삽입기 염료를 사용하여 DNA 농도를 측정합니다( 재료 표 참조). 안전한 정지 지점: 최소 일주일 동안 실험을 안전하게 중단할 수 있습니다.
15. 시험관 전사
알림: 다음 절차는 DNase 및 RNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 소요시간: 5시간
- 단일 세포 유래 산물의 DNA를 해동하고(단계 14에서) DNA 산물의 세포 2μL/셀(총 부피 20μL)을 혼합하여 단일 세포 유래 산물의 혼합 라이브러리를 준비합니다.
- 26 μL의 In vitro transcription 마스터 믹스( 재료 표 및 제조업체의 프로토콜 참조)를 추가하고 피펫팅으로 혼합합니다.
- PCR 튜브를 열 순환기에 놓고 37°C에서 4시간 동안 배양합니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 46 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. - 5 μL의 10x DNase I 완충액을 추가하고(재료 표 참조) 4 μL의 DNase I(RNase-free, 4 U, 재료 표 참조)을 추가합니다.
- 37°C에서 15분 동안 혼합 및 인큐베이션하고 샘플을 0.5mL 튜브로 옮깁니다.
- Guanidinium thiocyanate-phenol-chloroform의 300 μL / tube ( 재료 표 참조)를 넣고 부드럽게 와동 처리하여 혼합합니다.
알림: 구아니디늄 티오시아네이트-페놀-클로로포름은 접촉에 의해 심각한 화학적 화상을 유발할 수 있습니다. 장갑, 보안경 및 실험복을 착용하십시오. 환기가 잘 되는 곳에서만 사용하거나 적절한 호흡보호구를 착용하십시오. 기관 안전 지침을 따르십시오. 사용한 실험기구는 기관 지침에 따라 폐기하십시오. - R.T.에서 5분 동안 배양한 후 -80°C에서 최대 3일 동안 샘플을 보관합니다.
참고: 안전한 정지 지점: 실험은 여기에서 최대 3일 동안 안전하게 중지할 수 있습니다.
16. RNA 정제
알림: 다음 절차는 DNase 및 RNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 소요시간: 2시간
- 15.7단계의 샘플에 80μL/튜브의 클로로포름을 추가하고 15초 동안 손으로 튜브를 세게 흔듭니다.
- 실온에서 2-15분 동안 배양하고 샘플을 4°C에서 15 분 동안 12,000×g에서 원심분리합니다.
- 샘플의 수상(~200μL)을 수집하여 새 1.5mL 튜브로 옮깁니다.
- Guanidinium thiocyanate-phenol-chloroform의 600 μL / tube를 추가하고 샘플을 1.5 mL 튜브로 옮깁니다.
- 클로로포름 180μL/튜브를 넣고 튜브를 손으로 15초 동안 세게 흔듭니다.
- 시료를 12,000 × g 에서 4°C에서 10분 동안 원심분리합니다.
- 샘플의 수상(~450μL)을 수집하여 1.5mL 튜브로 옮깁니다.
- 선형 아크릴아미드 60μL/튜브(5μg/μL)를 추가하고 100% 이소프로판올 400μL/튜브를 수상에 추가합니다.
- 튜브를 실온에서 10분 동안 인큐베이션하고 4°C에서 10분 동안 12,000× g 에서 원심분리합니다.
- 상층액을 조심스럽게 제거하십시오.
- RNA 펠릿을 200μL의 75% 에탄올(EtOH/RNase가 없는 물)로 3회 세척하고 상층액을 제거하고 RNA 펠릿을 자연 건조합니다.
알림: 펠릿이 용해도를 잃을 수 있으므로 RNA가 완전히 건조되지 않도록 하십시오. - RNAse 억제제(1μL/20μL)가 포함된 RNase가 없는 물 20μL에 RNA 펠릿을 재현탁하고 피펫팅으로 펠릿을 용해합니다.
- 260nm에서 흡광도를 측정합니다.
17. 역전사
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 소요시간: 1시간
- 7μL/튜브의 역전사 프라이머 + dNTP 혼합물(표 1 및 표 3 참조)을 추가하고 튜브를 열 순환기에 놓습니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 27 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. - 65°C에서 5분 동안 가열하고 튜브를 얼음 위에 최소 1분 동안 두십시오.
- 14 μL/tube의 역전사효소 마스터 믹스( 표 1 참조)를 추가하고 피펫팅으로 혼합합니다.
- 튜브를 열 순환기에 놓고 55°C에서 10분 동안 배양한 다음 80°C에서 10분 동안 배양합니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 60 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다.
18. 두 번째 가닥 합성
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 2.5시간
- 튜브당 초순수 40μL를 넣고 100μL 용액을 두 개의 0.2mL PCR 튜브(50μL/튜브)로 나눕니다.
- 60μL/튜브의 두 번째 가닥 합성 혼합물( 표 1 참조)을 추가하고 튜브를 열 순환기에 놓고 다음 프로그램을 실행합니다: i) 95분 동안 5°C, ii) 95초 동안 30°C, iii) 60초 동안 30°C, iv) 72초 동안 30°C, v) ii-iv 단계를 20회 반복하고 vi) 4°C에서 유지합니다.
참고: 튜브 크기는 0.2mL입니다. 용액의 부피는 110 μL이다. 열 순환기 뚜껑의 온도는 105°C입니다. - 0.5M EDTA(최종 20mM)의 튜브당 4.4μL를 추가하고 -80°C에서 하룻밤 동안 보관합니다.
참고: 안전한 정지 지점: 실험은 여기에서 최대 며칠 동안 안전하게 중지할 수 있습니다. - 페놀-클로로포름 정제 및 폴리에틸렌 글리콜 침전(단계 14에 기술됨)에 의해 DNA를 정제합니다.
참고: 안전한 정지 지점: 최소 1주일 동안 여기에서 실험을 안전하게 중지할 수 있습니다.
19. 제한효소 소화 및 크기 선택
알림: 다음 절차는 DNase 오염을 방지하기 위해 깨끗한 후드 아래에서 수행됩니다. 시간: 3시간(19.1-19.7단계)
- 260 nm에서 흡광도를 측정하여 정제된 DNA의 DNA 농도를 측정합니다(단계 18.4로부터).
- 6μg의 DNA를 PCR 튜브에 옮기고 30μL의 10x 소화 완충액을 넣고 초순수로 부피를 294μL로 조정합니다.
- 6 μL의 BciVI 제한 효소를 첨가하고 37 °C에서 1 시간 동안 배양합니다.
- 선형 폴리아크릴아미드로 EtOH 침전을 수행합니다.
- 60 μL/튜브의 3 M 아세트산나트륨(pH 5.2)을 추가한 다음 40 μL/튜브의 선형 아크릴아미드(5 mg/mL, 재료 표 참조)를 추가합니다.
- 튜브당 400μL의 EtOH를 넣고 -20°C에서 하룻밤 동안 배양합니다.
참고: 안전한 정지 지점: 실험은 여기에서 하루 동안 안전하게 중지할 수 있습니다. - 12,000 × g 을 4°C에서 10분 동안 원심분리하고 상층액을 제거한다.
- 펠릿을 80% EtOH로 두 번 세척하고 펠릿을 건조시킵니다.
- 펠릿을 20μL의 1xTE 완충액으로 녹이고 4μL/튜브의 신선한 6x 젤 로딩 완충액을 추가합니다.
- 샘플을 5% 아가로스 겔/0.5x TAE 버퍼에 넣고 전기영동을 수행합니다(50V 40분).
- 50bp 이상의 겔을 절단 및 수집하고( 그림 6 참조) 겔 추출 키트를 사용하여 DNA를 추출합니다.
참고: 안전한 정지 지점: 최소 1주일 동안 여기에서 실험을 안전하게 중지할 수 있습니다. - DNA 라이브러리 준비 키트를 사용하여 시퀀싱 라이브러리를 구성합니다(재료 표 참조)16,17.
결과
K562 단일 세포는 단계 8에 기술된 프로토콜을 사용하여 생성되었다( 도 5 참조). 단일세포는 폴리아크릴아미드 비드의 외층에 포매되었다. 세포 DNA를 염색하고 DNA 염색을 위해 인터칼레이터 염료를 사용하여 시각화했습니다.

그림 5: 생성...
토론
이 글은 재사용 가능한 단일세포를 이용한 최근 보고된 single-cell multiepigenomic 분석에 대한 단계별 프로토콜을 설명한다7. 다음 단락에서는 프로토콜의 잠재적 한계를 강조하면서 중요한 사항에 대해 논의합니다.
프로토콜 전반에 걸쳐 중요한 점 중 하나 (7.2-13 단계에서)는 DNase 오염을 피하는 것입니다. 단일 세포에는 게놈 DNA 사본이 두 개뿐입니다. 따라서 ?...
공개
오누키 박사와 토사토 박사는 "재사용 가능한 단일 세포를 제조하는 방법 및 단일 세포의 후성유전체, 전사체 및 게놈을 분석하는 방법"(EP3619307 및 US20200102604)이라는 제목의 특허에 대한 공동 발명자입니다. 특허 출원은 부분적으로 현재 원고에 설명 된 기술과 관련된 예비 결과를 기반으로 제출되었습니다. 이 특허 출원에 기술되고 청구된 발명 또는 발명은 발명가가 미국 정부의 정규직 직원이었을 때 만들어졌습니다. 따라서 45 Code of Federal Regulations Part 7에 따라 이 특허 출원에 대한 모든 권리, 소유권 및 이익은 법률에 따라 미국 정부에 양도되었거나 양도되어야 합니다. 미국 정부는 15 U.S. Code § 3710c에 따라 받는 로열티의 일부를 직원 발명가에게 전달합니다.
감사의 말
프로젝트의 개념화 단계에서 의견을 주신 David Sanchez-Martin 박사와 Christopher B. Buck 박사에게 감사드립니다. 또한 예비 실험에 도움을 주신 Genomics Core, Center for Cancer Research, National Cancer Institute, National Institutes of Health, 그리고 전산 분석에 대한 조언을 해주신 Collaborative Bioinformatics Resource, CCR, NCI, NIH에 감사드립니다. 이 방법에 사용되는 DNA 중합효소의 최적화를 도와준 Ms. Anna Word에게 감사드립니다. 이 작업은 NIHHPC Biowulf 클러스터(http://hpc.nih.gov)의 계산 리소스를 활용했습니다. 이 프로젝트는 암 연구 센터, 국립 암 연구소, 국립 보건원의 교내 프로그램, NCI 이사 혁신상(#397172) 및 계약 번호 HHSN261200800001E에 따라 국립 암 연구소의 연방 기금의 지원을 받습니다. 생산적인 의견을 주신 Drs. Tom Misteli, Carol Thiele, Douglas R. Lowy 및 Laboratory of Cellular Oncology의 모든 구성원에게 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 10x CutSmart buffer | New England BioLabs | B6004 | 10x Digestion buffer |
| 200 proof ethanol | Warner-Graham Company | 200 proof | Ethanol |
| 5-Hydroxymethylcytosine (5-hmC) Monoclonal Antibody [HMC/4D9] | Epigentek | A-1018-100 | Anti-5hmC |
| Acridine Orange/Propidium Iodide Stain | Logos Biosystems | F23001 | Cell counter |
| Acrylamide solution, 40% in H2O, for molecular biology | MilliporeSigma | 01697-500ML | 40% acrylamide solution |
| All-in-One Fluorescence Microscope BZ-X710 | Keyence | BZ-X710 | Scanning microscope |
| Amicon Ultra-0.5 Centrifugal Filter Unit | MilliporeSigma | UFC510024 | Ultrafiltration cassette |
| Ammonium persulfate for molecular biology | MilliporeSigma | A3678-100G | Ammonium persulfate powder |
| Anhydrous DMF | Vector laboratories | S-4001-005 | Anhydrous N,N-dimethylformamide (DMF) |
| Anti-RNA polymerase II CTD repeat YSPTSPS (phospho S5) antibody [4H8] | Abcam | ab5408 | Anti-Pol II |
| Anti-TRAP220/MED1 (phospho T1457) antibody | Abcam | ab60950 | Anti-Med1 |
| BciVI | New England BioLabs | R0596L | BciVI |
| Bovine Serum Albumin solution, 20 mg/mL in H2O, low bioburden, protease-free, for molecular biology | MilliporeSigma | B8667-5ML | 20% BSA (Table 7) |
| Bst DNA Polymerase, Large Fragment | New England BioLabs | M0275L | Bst DNA polymerase |
| BT10 Series 10 µl Barrier Tip | NEPTUNE | BT10 | P10 low-retention tip |
| CellCelector | Automated Lab Solutions | N/A | Automated single cell picking robot |
| CellCelector 4 nl nanowell plates for single cell cloning, Plate S200-100 100K, 24 well,ULA | Automated Lab Solutions | CC0079 | 4 nL nanowell plate |
| Chloroform | MilliporeSigma | Chloroform | |
| Corning Costar 96-Well, Cell Culture-Treated, Flat-Bottom Microplate | Corning | 3596 | Flat-bottom 96-well plates |
| Deep Vent (exo-) DNA Polymerase | New England BioLabs | M0259L | Exo- DNA polymerase |
| DNA LoBind Tubes, 0.5 mL | Eppendorf | 30108035 | 0.5 mL DNA low-binding tube |
| DNA Oligo, 1st random primer | Integrated DNA Technologies | N/A, see Table 3 | 1st random primer |
| DNA Oligo, 2nd random primer Cell#01 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#02 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#03 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#04 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#05 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#06 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#07 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#08 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#09 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#10 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#11 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd random primer Cell#12 | Integrated DNA Technologies | N/A, see Table 3 | 2nd random primer |
| DNA Oligo, 2nd synthesis primer | Integrated DNA Technologies | N/A, see Table 3 | 2nd synthesis primer |
| DNA Oligo, Ligation Adaptor | Integrated DNA Technologies | N/A, see Table 3 | Ligation Adaptor |
| DNA Oligo, Reverse Transcription primer | Integrated DNA Technologies | N/A, see Table 3 | Reverse Transcription primer |
| DNase I (RNase-free) | New England BioLabs | M0303L | DNase I (RNase-free, 4 U). |
| DNase I Reaction Buffer | New England BioLabs | B0303S | 10x DNase I buffer (NEB) |
| dNTP Mix (10 mM each) | Thermo Fisher | R0192 | 10 mM dNTPs |
| Fetal Bovine Serum, USA origin, Heat-inactivated | MilliporeSigma | F4135-500ML | Fetal bovine serum |
| HiScribe T7 High Yield RNA Synthesis Kit | New England BioLabs | E2040S | In-vitro-transcription master mix |
| Histone H3K27ac antibody | Active motif | 39133 | Anti-H3K27ac |
| Histone H3K27me3 antibody | Active motif | 39155 | Anti-H3K27me3 |
| IgG from rabbit serum | Millipore Sigma | I5006-10MG | Control IgG |
| Iron oxide(II,III) magnetic nanopowder, 30 nm avg. part. size (TEM), NHS ester functionalized | MilliporeSigma | 747467-1G | NHS ester functionalized 30 nm iron oxide powder |
| K-562 | American Type Culture Collection (ATCC) | CCL-243 | cells |
| Linear Acrylamide (5 mg/mL) | Thermo Fisher | AM9520 | Linear Acrylamide |
| LUNA-FL Dual Fluorescence Cell Counter | Logos Biosystems | L20001 | Cell counter |
| LUNA Cell Counting Slides, 50 Slides | Logos Biosystems | L12001 | Cell counter |
| Mineral oil, BioReagent, for molecular biology, light oil | MilliporeSigma | M5904-500ML | Mineral oil |
| N,N,N′,N′-Tetramethylethylenediamine for molecular biology | MilliporeSigma | T7024-100ML | N,N,N′,N′-Tetramethylethylenediamine |
| NaCl (5 M), RNase-free | Thermo Fisher | AM9760G | 5M NaCl |
| NanoDrop Lite | Thermo Fisher | 2516 | Microvolume spectrophotometer |
| NEST 2 mL 96-Well Deep Well Plate, V Bottom | Opentrons | N/A | 2 mL deep well 96-well plate |
| Non-skirted 96-well PCR plate | Genesee Scientific | 27-405 | 96-well PCR plate |
| NuSive GTG Agarose | Lonza | 50081 | Agarose |
| OmniPur Acrylamide: Bis-acrylamide 19:1, 40% Solution | MilliporeSigma | 1300-500ML | 40%Acrylamide/Bis-acrylamide |
| OT-2 lab robot | Opentrons | OT2 | Automated liquid handling robot |
| Paraformaldehyde, EM Grade, Purified, 20% Aqueous Solution | Electron Microscopy Sciences | 15713 | 20% Pararmaldehyde |
| PBS (10x), pH 7.4 | Thermo Fisher | 70011044 | 10x PBS |
| PIPETMAN Classic P1000 | GILSON | F123602 | A P1000 pipette |
| Protein LoBind Tubes, 1.5 mL | Eppendorf | 925000090 | 1.5 mL Protein low-binding tube |
| QIAgen Gel Extraction kit | Qiagen | 28706 | A P1000 pipette |
| Quant-iT PicoGreen dsDNA Assay | Thermo Fisher | P11495 | dsDNA specific intercalator dye |
| Quick Ligation kit | New England BioLabs | M2200L | T4 DNA ligase (NEB) |
| RNaseOUT Recombinant Ribonuclease Inhibitor | Thermo Fisher | 10777019 | RNAse inhibitor |
| S-4FB Crosslinker (DMF-soluble) | Vector laboratories | S-1004-105 | Succinimidyl 4-formylbenzoate (S-4FB) |
| S-HyNic | Vector laboratories | S-1002-105 | Succinimidyl 6-hydrazinonicotinate acetone hydrazone (S-HyNic) |
| Sodium Acetate, 3 M, pH 5.2, Molecular Biology Grade | MilliporeSigma | 567422-100ML | 3M Sodium acetate (pH 5.2) |
| Sodium bicarbonate, 1M buffer soln., pH 8.5 | Alfa Aesar | J60408 | 1M sodium bicarbonate buffer, pH 8.5 |
| Sodium phosphate dibasic for molecular biology | MilliporeSigma | S3264-250G | Na2HPO4 |
| Sodium phosphate monobasic for molecular biology | MilliporeSigma | S3139-250G | NaH2PO4 |
| SuperScript IV reverse transcriptase | Thermo Fisher | 18090050 | Reverse transcriptase |
| SYBR Gold Nucleic Acid Gel Stain (10,000x Concentrate in DMSO) | Thermo Fisher | S11494 | An intercalator dye for DNA |
| T4 DNA Ligase Reaction Buffer | New England BioLabs | B0202S | 10x T4 DNA ligase reaction buffer |
| ThermoPol Reaction Buffer Pack | New England BioLabs | B9004S | 10x TPM-T buffer (Tris-HCl/Pottasium chloride/Magnesium sulfate/Triton X-100) |
| TRIzol LS reagent | Thermo Fisher | 10296-028 | Guanidinium thiocyanate-phenol-chloroform extraction |
| TruSeq Nano DNA library prep kit | Illumina | 20015965 | A DNA library preparation kit (see also the manufacturer's instruction) |
| Ultramer DNA Oligo, Anti-5hmC_Ab#005 | Integrated DNA Technologies | N/A, see Table 3 | An amine-modified DNA probe for antibody |
| Ultramer DNA Oligo, Anti-H3K27ac_Ab#002 | Integrated DNA Technologies | N/A, see Table 3 | An amine-modified DNA probe for antibody |
| Ultramer DNA Oligo, Anti-H3K27me3_Ab#003 | Integrated DNA Technologies | N/A, see Table 3 | An amine-modified DNA probe for antibody |
| Ultramer DNA Oligo, Anti-Med1_Ab#004 | Integrated DNA Technologies | N/A, see Table 3 | An amine-modified DNA probe for antibody |
| Ultramer DNA Oligo, Anti-Pol II_Ab#006 | Integrated DNA Technologies | N/A, see Table 3 | An amine-modified DNA probe for antibody |
| Ultramer DNA Oligo, Control IgG_Ab#001 | Integrated DNA Technologies | N/A, see Table 3 | An amine-modified DNA probe for control IgG |
| UltraPure 0.5 M EDTA, pH 8.0 | Thermo Fisher | 15575020 | 0.5M EDTA, pH 8.0 |
| UltraPure DNase/RNase-Free Distilled Water | Thermo Fisher | 10977023 | Ultrapure water |
| Zeba Splin Desalting Columns, 7K MWCO, 0.5 mL | Thermo Fisher | 89882 | Desalting column |
참고문헌
- Perkel, J. M. Single-cell analysis enters the multiomics age. Nature. 595 (7868), 614-616 (2021).
- Clark, S. J., et al. scNMT-seq enables joint profiling of chromatin accessibility DNA methylation and transcription in single cells. Nature Communications. 9 (1), 781 (2018).
- Ma, S., et al. Chromatin potential identified by shared single-cell profiling of RNA and Chromatin. Cell. 183 (4), 1103-1116 (2020).
- Zhu, C., et al. An ultra high-throughput method for single-cell joint analysis of open chromatin and transcriptome. Nature Structural & Molecular Biology. 26 (11), 1063-1070 (2019).
- Zhu, C., et al. Joint profiling of histone modifications and transcriptome in single cells from mouse brain. Nature Methods. 18 (3), 283-292 (2021).
- Mimitou, E. P., et al. Scalable, multimodal profiling of chromatin accessibility, gene expression and protein levels in single cells. Nature Biotechnology. 39 (10), 1246-1258 (2021).
- Ohnuki, H., Venzon, D. J., Lobanov, A., Tosato, G. Iterative epigenomic analyses in the same single cell. Genome Research. 31 (10), 1819-1830 (2021).
- Tosato, G., Ohnuki, H. . Methods of preparing a re-usable single cell and methods fro analyzing the epigenome, transcriptome, and genome of a single cell. , (2021).
- Harada, A., et al. A chromatin integration labelling method enables epigenomic profiling with lower input. Nature Cell Biology. 21 (2), 287-296 (2019).
- Egelhofer, T. A., et al. An assessment of histone-modification antibody quality. Nature Structural & Molecular Biology. 18 (1), 91-93 (2011).
- Marina, R. J., et al. TET-catalyzed oxidation of intragenic 5-methylcytosine regulates CTCF-dependent alternative splicing. EMBO Journal. 35 (3), 335-355 (2016).
- Weast, R. C., Weast, R. C., Astle, M. J., Beyer, W. H., et al. . Handbook of chemistry and physics: a ready-reference book of chemical and physical data. 56th edn. , (1975).
- Aydin, S. A short history, principles, and types of ELISA, and our laboratory experience with peptide/protein analyses using ELISA. Peptides. 72, 4-15 (2015).
- Gan, S. D., Patel, K. R. Enzyme immunoassay and enzyme-linked immunosorbent assay. Journal of Investigative Dermatology. 133 (9), 12 (2013).
- Porstmann, T., Kiessig, S. T. Enzyme immunoassay techniques. An overview. Journal of Immunological Methods. 150 (1-2), 5-21 (1992).
- Chao, H. P., et al. Systematic evaluation of RNA-Seq preparation protocol performance. BMC Genomics. 20 (1), 571 (2019).
- Song, Y., et al. A comparative analysis of library prep approaches for sequencing low input translatome samples. BMC Genomics. 19 (1), 696 (2018).
- Rotem, A., et al. Single-cell ChIP-seq reveals cell subpopulations defined by chromatin state. Nature Biotechnology. 33 (11), 1165-1172 (2015).
- Ku, W. L., et al. Single-cell chromatin immunocleavage sequencing (scChIC-seq) to profile histone modification. Nature Methods. 16 (4), 323-325 (2019).
- Carter, B., et al. Mapping histone modifications in low cell number and single cells using antibody-guided chromatin tagmentation (ACT-seq). Nature Communications. 10 (1), 3747 (2019).
- Maskell, D. P., et al. Structural basis for retroviral integration into nucleosomes. Nature. 523 (7560), 366-369 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유