Method Article
SARS-CoV-2 변이체 및 중화 항체의 신속한 정량화를 위한 Ha-CoV-2 슈도바이러스 적용
요약
이 프로토콜은 SARS-CoV-2 변이체의 감염성과 중화 항체에 대한 민감도를 신속하게 정량화하기 위한 플랫폼으로 새로운 하이브리드 알파바이러스-SARS-CoV-2 슈도바이러스(Ha-CoV-2)의 적용을 설명합니다.
초록
코로나바이러스 질병 2019 팬데믹(COVID-19)은 신종 SARS-CoV-2 변이체의 감염성과 바이러스 변이체에 대한 백신 유도 중화 항체의 효과를 정확하게 측정하기 위한 신속한 분석의 필요성을 강조했습니다. 이러한 분석은 팬데믹 감시와 백신 및 변이별 부스터 샷 검증에 필수적입니다. 이 원고는 SARS-CoV-2 변종 감염성 및 바이러스 변종에 대한 백신 유도 중화 항체의 빠른 정량화를 위해 새로운 하이브리드 알파바이러스-SARS-CoV-2 슈도바이러스(Ha-CoV-2)의 적용을 보여줍니다. Ha-CoV-2는 바이러스 구조 단백질(S, M, N, E)과 알파바이러스인 셈리키 숲 바이러스(SFV)에서 유래한 빠르게 발현되는 RNA 게놈으로 구성된 SARS-CoV-2 바이러스 유사 입자입니다. Ha-CoV-2는 또한 녹색 형광 단백질(GFP)과 루시페라아제 리포터 유전자를 모두 포함하고 있어 바이러스 감염도를 빠르게 정량화할 수 있습니다. 예를 들어, SARS-CoV-2 델타(B.1.617.2) 및 오미크론(B.1.1.529) 변이의 감염도를 정량화하고 중화 항체(27VB)에 대한 민감도도 측정합니다. 이러한 예는 SARS-CoV-2 변이체와 중화 항체에 대한 감수성의 신속한 정량화를 위한 강력한 플랫폼으로서 Ha-CoV-2의 큰 잠재력을 보여줍니다.
서문
2023년 5월 현재 COVID-19 확진자는 7억 6,600만 명을 넘어섰습니다1. 전 세계적인 예방 접종 캠페인에도 불구하고 SARS-CoV-2는 델타(B.1.617.2) 및 오미크론(B.1.1.529)과 같은 새로운 변종의 출현으로 인해 지속적으로 순환하고 사람들을 감염시킵니다 2,3,4. SARS-CoV-2가 지속적으로 진화하고 있다는 점을 감안할 때 새로운 변이의 감염성과 이러한 변이에 대한 백신 유도 중화 항체의 효과를 정확하게 측정할 수 있는 빠른 분석을 개발하는 것이 중요합니다. 이러한 분석은 팬데믹 감시와 백신 및 변이 바이러스별 부스터의 효능을 결정하는 데 필수적입니다.
SARS-CoV-2의 전염성이 높기 때문에 질병통제예방센터(CDC)는 SARS-CoV-2 및 그 변종에 대한 연구를 생물안전 수준(BSL) 3 시설 5,6에서 수행할 것을 요구합니다. 이 BSL-3 요구 사항은 일반 연구 및 임상 실험실에서 바이러스 변이체 및 중화 항체의 감염성을 정량화하기 위해 살아있는 바이러스의 사용을 제한합니다. 또한, 복제가 가능한 살아있는 바이러스를 사용하는 플라크 또는 세포병증 효과 기반 분석법과 같은 기존의 SARS-CoV-2 중화 분석법은 시간이 많이 걸리고 긴 잠복기가 필요하다7. 중화 항체 8,9,10,11,12의 효과를 정량화하기 위해 여러 스파이크(S) 단백질 유사형 SARS-CoV-2 유사바이러스가 개발되었습니다. SARS-CoV-2에서 S 단백질은 바이러스 진입을 매개하는 주요 단백질입니다13, SARS-CoV-2 백신 9,10,14,15,16에 사용되는 주요 항원입니다. 수포성 구내염 바이러스(VSV-G) 또는 렌티바이러스와 같은 S 단백질 유사형 비리온은 중화 항체 17,18,19의 정량화에 사용되었습니다. 그럼에도 불구하고, 렌티바이러스 기반 유사 바이러스는 보고자 신호를 정량화하기 위해 일반적으로 2-3일의 감염이 필요합니다. VSV 기반 유사 바이러스 시스템에는 잔류 VSV 바이러스가 포함되어 있는 경우가 많으며, 이로 인해 위양성 결과가 발생할 수 있으며 일반적으로 24시간 동안 감염이 필요합니다20.
새로운 SARS-CoV-2 유사바이러스 시스템인 하이브리드 알파바이러스-SARS-CoV-2 유사바이러스(Ha-CoV-2)가 최근 Hetrick etal 12에 의해 개발되었습니다. Ha-CoV-2는 일반적인 BSL-2 실험실에서 바이러스 감염률과 중화 항체에 대한 바이러스 민감도를 신속하게 정량화할 수 있는 새로운 도구를 제공합니다. 구조적으로 Ha-CoV-2는 SARS-CoV-2 비리온 입자와 유사하며, S 단백질(S), 막(M), 뉴클레오캡시드(N) 및 외피(E)를 포함한 SARS-CoV-2 구조 단백질로 구성되어 있으며 다른 바이러스의 구조 단백질은 없습니다. 또한 Ha-CoV-2 입자는 세포에서 빠른 리포터 발현을 위해 알파바이러스의 빠르게 발현되는 RNA 게놈을 포함합니다. Ha-CoV-2는 백신 접종을 받은 사람 및 회복기 환자의 혈청에서 항체의 중화 활성을 빠르게 측정하는 것으로 나타났다12. Hetrick et al.에 의해 입증된 바와 같이, 시간 경과 분석에서 렌티바이러스 기반 SARS-CoV-2 유사 바이러스와 비교했을 때, Ha-CoV-2는 감염 후 2-4시간 이내에 Luc 리포터를 발현한 반면, 렌티바이러스-유사 바이러스는 24시간 후 Luc를 발현했습니다12. 또한, 중화 항체를 정량화하기 위한 Ha-CoV-2 변이체의 잠재적 응용은 표준 단클론 중화 항체인 27BV를 사용하여 추가로 입증됩니다( 보충 그림 1 참조)12. 이 연구에서는 델타(B.1.617.2) 및 오미크론(B.1.1.529) 변종을 예로 들어 SARS-CoV-2 변종의 감염력을 신속하게 정량화하기 위해 Ha-CoV-2 플랫폼을 사용하는 방법을 자세히 설명합니다. 또한, 중화 항체를 정량화하기 위한 Ha-CoV-2 변이체의 잠재적 응용은 표준 단클론 중화 항체인 27BV12를 사용하여 추가로 입증됩니다.
프로토콜
1. 바이러스 및 바이러스 입자 조립
- 벡터: SARS-CoV-2 M, E 또는 N과 SARS-CoV-2 S(Wild-type,Wt), Delta(B.1.617.2) 및 Omicron(B.1.1.529)에 대한 발현 벡터를 상업적으로 구매합니다.
참고: 발현 벡터의 단백질 서열은 보충 파일 1에 제공된다. 이러한 표현식 벡터의 공급업체는 재료 테이블에서도 찾을 수 있습니다. - 세포 및 세포 배양: 10% 열 비활성화 소 태아 혈청(FBS), 50단위/mL의 페니실린 및 50μg/mL의 스트렙토마이신을 함유한 Dulbecco's modified Eagle's medium(DMEM)에서 HEK293T 세포를 유지합니다.
참고: 모든 세포 배양 작업은 층류 생물 안전 작업대에서 수행해야 합니다. 폴리에틸렌이민(PEI) transfection은 일반적으로 5-6시간의 배양이 필요합니다. 시작 시간은 사전에 신중하게 고려해야 합니다. - 바이러스 조립 및 PEI 기반 cotransfection: HEK293T 세포의 cotransfection을 통해 Ha-CoV-2 입자를 조립합니다. cotransfection 전날 10mL의 완전한 DMEM 배지에 10cm 세포 배양 페트리 접시(접시당 4-5 x 106 개 세포)에 세포를 종자합니다. 이 연구에서는 세 가지 페트리 접시를 사용하여 각각 Ha-CoV-2 야생형, 델타 및 오미크론의 조립을 위한 세포를 파종합니다.
- 페트리 접시를 37°C의 CO2 인큐베이터에서 밤새 배양합니다. 다음날 아침 접시를 확인하여 세포가 80% 합류하는지 확인하십시오. 완전한 배지를 제거하고 9mL의 DMEM 무혈청 배지로 교체합니다.
- 각 접시에 대해 SARS-CoV-2 구조 단백질 발현 벡터(N, E, M) 각각 2.5μg, 10μg pAlphaPro-Luc-GFP-PreΨ(HaCoV2 게놈) 및 2.5μg의 S 단백질 발현 벡터(Delta 또는 Omicron S 변이체) 및 45μL의 PEI 기반 transfection 시약으로 cotransfection 혼합물을 준비합니다. cotransfection 혼합물이 13분 동안 배양하여 복합체를 형성하도록 합니다(30분 이상 배양하지 마십시오).
- 배양 후 cotransfection 혼합물을 각 Petri 접시에 천천히 한 방울씩 추가합니다. 접시를 37°C의 CO2 인큐베이터 안에 6시간 동안 놓습니다. 6시간 후 무혈청 DMEM을 제거하고 완전한 DMEM 배지로 교체합니다. cotransfection 후 48-60 시간에 바이러스를 수확합니다.
- 바이러스 포획 및 보관: cotransfection 후 48시간에 입자를 포획합니다. 단층 표면을 반복적으로 피펫팅하여 세포를 분리하고 각 접시에서 세포를 수집하여 15mL 원심분리 튜브에 넣고 400 x g 에서 5분 동안 원심분리합니다. 상층액을 모아 0.22μM 필터를 통과시킵니다. Ha-CoV-2 유사 바이러스를 -80°C에서 보관합니다.
2. 바이러스 감염 분석
- 세포 및 세포 배양: 10% 열 비활성화 FBS, 50단위/mL의 페니실린 및 50μg/mL의 스트렙토마이신을 함유한 Dulbecco's modified Eagle's medium(DMEM)에서 HEK293T(ACE2/TMPRSS2) 세포를 유지합니다.
- HEK293T(ACE2/TMPRSS2) 세포 파종: 바이러스 감염도 분석 전날 50μL의 완전한 DMEM 배지에 있는 96웰 플레이트에 HEK293T(ACE2/TMPRSS2) 세포를 파종합니다. 각 96웰 플레이트에 대해 각 웰에 2.5 x 104 세포를 시드하고 한 플레이트에 총 2.5 x 106 세포가 필요합니다. 96웰 플레이트를 37°C의 CO2 인큐베이터에 밤새 넣습니다.
- HEK293T(ACE2/TMPRSS2) 감염: Ha-CoV-2 변이체 입자를 사용하여 HEK293T(ACE2/TMPRSS2) 세포를 감염시킵니다. 감염 당일 아침, 미리 파종된 96웰 플레이트에서 50μL의 DMEM을 제거합니다. 배지를 37°C에서 18시간 동안 50μL의 Ha-CoV-2 야생형, 델타 또는 오미크론으로 교체합니다.
참고: 감염이 배양 18시간에 도달하고 플레이트가 Luciferase Assay를 통해 분석될 준비가 될 때까지 프로토콜을 중단할 수 있습니다. 감염의 성공 여부는 감염된 세포에서 발현된 루시페라아제 리포터 유전자로 인한 루시페라아제 분석에 의해 결정되므로 더 많은 신호가 생성될수록 Ha-CoV-2 변이체의 감염이 더 성공적입니다. - 루시페라아제 분석: 18시간 배양 후 7.5μL의 세포 용해 완충액을 각 웰에 직접 추가하고 2분 동안 궤도 진탕으로 혼합합니다. 실온에서 최소 5분 동안 용해 완충액의 세포를 용해합니다.
- D-루시페린 용액과 반딧불이 루시페라아제 분석 용액을 1:50 비율로 혼합하여 Firefly 루시페라아제 분석 용액을 준비합니다. 전체 96웰 플레이트의 경우 3mL의 루시페라아제 기질 용액과 60μL의 D-루시페린 용액을 Firefly 루시페라아제 완충 용액 2940μL와 결합합니다.
- 25μL의 Firefly 루시페라아제 분석 용액을 세포 용해물에 추가하고 1분 동안 궤도 흔들림으로 플레이트를 혼합합니다. 상용 루시페라아제 마이크로플레이트 리더를 사용하여 루시페라아제 활성을 분석합니다.
3. Ha-CoV-2의 RNA 추출 및 정량적 역전사 효소 PCR(RT-qPCR)
- 바이러스 RNA 추출: 제조업체의 지침에 따라 상용 바이러스 RNA 추출 키트를 사용하여 Ha-CoV-2 야생형 및 Ha-CoV-2 델타 및 오미크론 변이 입자에서 바이러스 RNA를 추출합니다. 추출된 바이러스 RNA를 -80°C에서 보관하거나 RT-qPCR에 즉시 사용하십시오.
- RT-qPCR: 원스텝 마스터 믹스를 사용하여 바이러스 RNA에 RT-qPCR을 수행합니다. 상용 PCR 기계에서 반응을 수행한다. 증폭 대상은 Ha-CoV-2의 게놈 RNA입니다. Ha-CoV-2 벡터 DNA를 표준물질로 사용하여 표준 곡선을 만들고 각 변이체의 RNA 복제 수를 계산합니다.
4. 중화항체 분석
- HEK293T(ACE2/TMPRSS2) 세포 파종: 분석 전날 50μL의 완전한 DMEM 배지에 있는 96웰 플레이트에 HEK293T(ACE2/TMPRSS2) 세포를 파종합니다. HEK293T(ACE2/TMPRSS2) 전지는 상업적으로 구매됩니다.
- 세포 계수를 위해 HEK293T(ACE2/TMPRSS2) 세포가 들어 있는 T75 플라스크에서 20μL 세포를 얻고 20μL의 트리판 블루 용액과 혼합합니다. 이 혼합물 20μL를 세포 계수 챔버에 추가하고 mL당 세포 수를 계산합니다. 감염을 위해 96웰 플레이트를 파종하려면 웰당 2.5 x 104 세포를 사용하고 총 2.5 x 106 세포가 필요합니다. 96 웰 플레이트를 37°C의 CO2 인큐베이터에 밤새 놓습니다.
- 중화 항체 분석: 멸균 폴리프로필렌 96웰 플레이트에서 표준 27BV 중화 항체와 Ha-CoV-2 혼합물을 준비합니다. 8μL의 27BV(45mg/mL)를 플레이트에 추가하고 6μL의 무혈청 DMEM으로 항체를 연속 희석합니다.
참고: 웰 이송 간에 피펫 팁을 교환하고 항체와 무혈청 배지가 완전히 혼합되어 정확한 결과를 얻을 수 있는지 확인하십시오. - 연속적으로 희석된 항체에 54μL의 Ha-CoV-2 입자를 추가하고 바이러스와 항체를 혼합합니다. 연속적으로 희석 된 27BV로 Ha-CoV-2 입자를 37 ° C, 5 % CO2 에서 1 시간 동안 사전 배양합니다. 1시간 배양 후 전날 파종한 HEK293T(ACE2/TMPRSS2) 세포(웰당 2.5 x 104 개 세포)가 포함된 96웰 플레이트에 항체와 Ha-CoV-2 혼합물 50μL를 적용합니다.
- 대조군의 경우 HEK293T(ACE2/TMPRSS2) 셀만 포함하는 웰을 3개 이상 남겨 둡니다. 이 웰에 50μL의 완전한 배지를 추가하여 루시페라아제 분석 판독값의 배경 신호에 대한 비감염 웰 역할을 합니다.
참고: 감염이 37°C에서 18시간 배양에 도달할 때까지 프로토콜을 중지할 수 있으며, 그 후 루시페라아제 분석을 통해 플레이트를 분석할 준비가 됩니다. - 루시페라아제 분석: 18시간 배양 후 7.5μL의 용해 완충액을 각 웰에 직접 추가하고 2분 동안 궤도 쉐이킹으로 혼합합니다. 실온에서 최소 5분 동안 용해 완충액의 세포를 용해합니다.
- D-루시페린 용액과 반딧불이 루시페라아제 분석 용액을 1:50 비율로 혼합하여 Firefly 루시페라아제 분석 용액을 준비합니다. 전체 96웰 플레이트의 경우 3mL의 루시페라아제 기질 용액과 60μL의 D-루시페린 용액을 반딧불이 루시페라아제 완충 용액 2940μL와 결합합니다.
- 25μL의 Firefly 루시페라아제 분석 용액을 세포 용해물에 추가하고 1분 동안 궤도 흔들림으로 플레이트를 혼합합니다. 상용 루시페라아제 마이크로플레이트 리더를 사용하여 루시페라아제 활성을 분석합니다.
5. 정량화 및 통계 분석
- 데이터 수집: 표시된 대로 감염 및 루시페라아제 분석을 세 번에 걸쳐 수행합니다(그림 1). 루시페라아제 분석 판독값으로 루시페라아제 발현을 정량화합니다. 평균은 세 가지 루시페라아제 분석 판독값의 평균값입니다. 감염되지 않은 웰의 배경 신호 판독값은 이 평균값에서 뺍니다. 표준 편차(SD)는 루시페라아제 분석 판독값의 평균값에서 결정됩니다.
- 데이터 분석: 상용 그래프 소프트웨어를 사용하여 항체 중화 활성을 플롯하고 ID50 (50% 억제 용량) 값을 계산합니다. ID50 값은 HEK293T(ACE2/TMPRSS2) 세포의 감염이 50% 감소(루시페라아제 분석 판독값 기준)되는 항체 억제 희석액으로 정의됩니다.
결과
Ha-CoV-2 입자는 HEK293T 세포에서 Ha-CoV-2 RNA 게놈과 SARS-CoV-2의 구조 단백질(M, N, E, S)을 발현하는 5개의 서로 다른 DNA 벡터를 사용하여 조립되었습니다. S 단백질 벡터는 S 변이체에 따라 달라집니다. 원래 Ha-CoV-2 우한 균주(야생형, Wt)의 S 단백질을 양성 대조군으로 사용했으며, 다른 두 변종인 델타(B.1.617.2) 또는 오미크론(B.1.1.529) 각각의 S 단백질과 함께 조립했습니다. 동일한 M, N, E가 모든 변형에 사용되었습니다. Ha-CoV-2(Wt) 및 변이체 입자는 cotransfection 48시간 후에 수집된 후 HEK293T(ACE2/TMPRSS2) 세포를 감염시키는 데 사용되었습니다. 감염성은 감염 후 18시간에 루시페라아제의 발현에 의해 측정되었습니다. 이 시스템에서 루시페라아제 신호의 발현 수준이 높을수록 Ha-CoV-2에 의한 세포 감염이 더 높다는 것을 나타냅니다. 루시페라아제 신호는 각 변이체에 대해 RT-qPCR에 의해 게놈 RNA 카피로 정규화되었습니다. 그림 1에서 볼 수 있듯이 Ha-CoV-2 오미크론 변종은 원래 Ha-CoV-2(Wt)보다 4배에서 10배 더 높은 신호를 생성하여 더 높은 전염성을 시사합니다.
또한 HaCoV-2(Wt), 델타 및 오미크론 변종을 중화하는 27BV의 능력을 정량화했습니다. 27BV는 SARS-COV-2 S1 단백질의 RBD 도메인에 대해 개발된 토끼 단클론 항체입니다. 중화 분석을 위해 27BV의 연속 희석을 96웰 플레이트에서 수행하고 Ha-CoV-2로 사전 배양한 다음 HEK293T(ACE2/TMPRSS2) 표적 세포에 추가했습니다. 그 결과 27BV는 테스트된 모든 변이체에 대해 중화 활성을 보였다(그림 2). 흥미롭게도, 오미크론에 대한 27VB의 ID50은 Ha-CoV-2(WT) 및 Ha-CoV-2(Delta; 그림 2). 이러한 결과는 Ha-COV-2 플랫폼이 새로운 변이에서 백신 유도 중화 항체를 정량화하는 신속한 방법으로 사용될 수 있음을 보여줍니다.
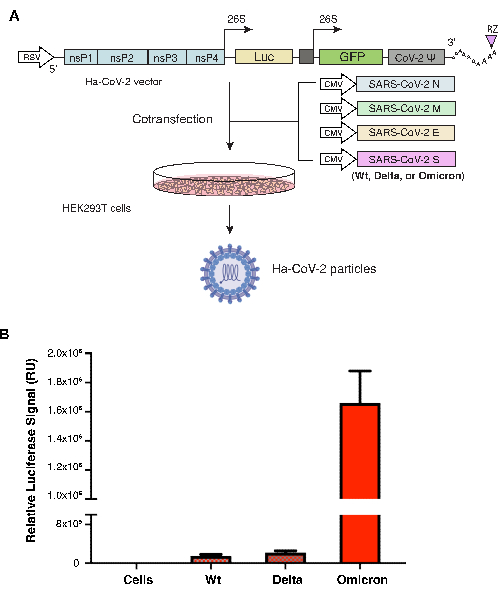
그림 1. Ha-CoV-2 변이체의 조립 및 정량화. (A) Ha-CoV-2 및 변이 입자의 조립 그림. Ha-CoV-2 리포터 게놈과 구조 단백질(M, S, N, E)을 발현하는 벡터는 HEK293T 세포에서 cotransfection됩니다. 입자는 cotransfection 48시간 후에 수거되었습니다(비리온 입자 및 HEK293T 세포의 이미징은 Biorender.com 로 생성됨). (B) Ha-CoV-2 변이체의 감염성 정량화. 두 변이(델타 및 오미크론)의 상대적 감염성은 개별 Ha-CoV-2(Luc) 변이체의 게놈 RNA 사본을 사용하여 정량화되고 정규화됩니다. 야생형은 Ha-COV-2(Wt)로 비교를 위한 대조군으로 사용됩니다. 감염 및 루시페라아제 분석은 3회 수행되었습니다. RU, 상대 단위. 평균 및 표준 편차(SD)가 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
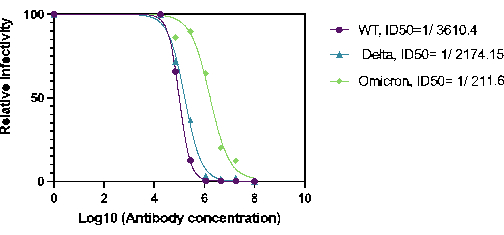
그림 2. Ha-CoV-2(Luc) 변이체에 대한 27BV 중화 활성의 정량화 27BV의 중화 활성은 HEK293T(ACE2/TMPRSS2) 세포의 감염 후 18시간 후에 분석되었습니다. ID50 은 상대 감염률(루시페라아제 활성) 대 27BV 농도를 사용하여 계산되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
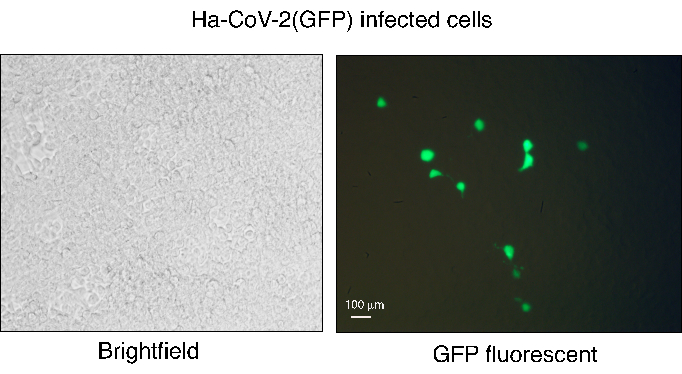
그림 3. HEK293T(ACE2/TMPRSS2)와 Ha-CoV-2(GFP) 감염. Ha-CoV-2(GFP) 입자를 조립한 다음 HEK293T(ACE2/TMPRSS2) 세포를 감염시키는 데 사용했습니다. GFP 발현은 형광 현미경을 사용하여 감염 후 48시간에 관찰되었습니다. 감염된 세포의 흰색 필드가 왼쪽에 표시되고 GFP 이미징이 오른쪽에 표시됩니다. 흰색 막대는 100μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1. 그래픽 초록. Ha-CoV-2 유사 바이러스 구조 및 응용 프로그램. Biorender.com 로 만든 이미지입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1. 단백질 서열. SARS-CoV-2 S, M, N 및 E 단백질의 염기서열 목록. S 단백질 염기서열에는 SARS-CoV-2 변이인 오미크론(B.1.1.529)과 델타(B.1.617.2)도 포함됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
Ha-CoV-2 플랫폼은 바이러스 변이체를 정량화하고 항체를 중화하기 위한 빠르고 강력하며 간단한 워크플로우를 제공합니다. 그러나 주의가 필요한 몇 가지 중요한 단계가 있습니다. Ha-CoV-2 유사 바이러스의 생산은 생존력이 높은 HEK293T 세포를 사용하여 수행해야 합니다. cotransfection 효율은 Ha-CoV-2 게놈의 GFP 리포터 유전자를 사용하여 transfection 후 24시간 동안 모니터링할 수 있습니다. Ha-CoV-2 게놈은 2개의 리포터(GFP 및 Luc)를 포함할 수 있으며, GFP는 표적 세포의 cotransfection 및 Ha-CoV-2 감염 후 발현될 수있다 12. 감염으로 인한 GFP+ 세포는 일반적으로 낮은 비율(1%에서 5%)이지만 감염된 각 세포는 강력한 GFP 신호를 나타냅니다(그림 3). 이 낮은 GFP 백분율은 감염된 세포의 전체적인 인구를 정량화하는 Luc 보고자와 비교된 항체 중화를 정량화하기를 위한 튼튼한 독서로 GFP의 사용을, 제한할지도 모릅니다.
중화 분석을 수행할 때 웰 이송 간에 피펫 팁을 변경하고 항체와 무혈청 배지가 완전히 혼합되어 정확한 결과를 얻을 수 있도록 하는 것이 중요합니다. 또한 루시페라아제 분석 프로토콜을 수행할 때 세포의 완전한 용해와 루시페라아제 효소의 방출을 보장하기 위해 최소 3분 동안 세포를 완전히 용해해야 합니다. 이렇게 하면 분석의 정확성이 보장됩니다. 또한, Firefly 루시페라아제 분석 용액이 광학 백색벽 96웰 플레이트에 추가되면, 초기 광 방출이 높지만 ATP가 고갈됨에 따라 시간이 지남에 따라 감소하기 때문에 플레이트를 10분 이내에 분석해야 합니다21.
더 많은 SARS-CoV-2 변이가 계속 진화함에 따라 Ha-CoV-2와 같은 플랫폼이 변이 감염성 및 백신 유도 중화 항체에 대한 변이 민감도를 신속하게 스크리닝해야 할 필요성이 증가하고 있습니다. Ha-CoV-2 플랫폼은 기존 유사 바이러스 기반 중화 분석에 비해 더 빠른 속도, 더 높은 신호 대 잡음비 및 간단한 프로토콜을 제공합니다 8,9,10,11. Ha-CoV-2 플랫폼은 또한 BSL-2 실험실에서 사용할 수 있고 BSL-3 시설을 사용할 필요가 없다는 이점을 제공합니다. 이를 통해 SARS-CoV-2는 일반 연구 및 임상 실험실에서 연구를 진행할 수 있습니다. 또한 Ha-CoV-2 플랫폼은 다른 시스템에 비해 빠른 결과를 제공합니다. 예를 들어, 전염성 SARS-CoV-2 바이러스에 대한 중화 항체 연구는 종종 플라크 감소 중화 테스트(PRINT)22를 사용합니다. PRINT는 신뢰할 수 있는 결과를 생성하지만, 플라크 형성 단위(PFU)의 수동 계수는 느리고 결과를 얻는 데 3-5일이 소요됩니다 23,24. 렌티바이러스-슈도바이러스(lentivirus-pseudovirus)와 같은 다른 유사형 시스템은 검출 가능한 리포터 신호(12)를 생성하기 위해 24-72시간이 필요하다. 이에 비해 Ha-CoV-2 중화 분석은 18시간 이내에 결과를 생성할 수 있습니다. Ha-CoV-2는 바이러스 변이체의 신속한 스크리닝 및 정량화와 팬데믹 모니터링을 위한 중화 항체를 위한 편리한 도구를 제공합니다.
SARS-CoV-2의 감염성 모니터링은 더 많은 우려 변이(VOC)가 계속 등장함에 따라 필수적입니다. Ha-CoV-2는 VOC의 감염성을 신속하게 결정할 수 있는 이점을 제공합니다. 이전 연구에서는 인공 지능(AI) 기반 모델링을 사용하여 오미크론 하위 변종과 델타 변종25와 같은 다른 SARS-CoV-2 변종의 감염력을 정량적으로 분석했습니다. 이 연구는 오미크론 변이가 원래 바이러스보다 전염성이 더 강하고 중화항체를 회피할 가능성이 더 높다는 것을 보여주었다25. 이 연구에서 Ha-CoV-2를 사용하여 유사한 표현형이 관찰되었습니다. 또한 항체 중화 분석에서 오미크론 변이는 우한 및 델타 균주보다 27BV에 의해 중화될 가능성이 10배 낮습니다. 이러한 결과는 또한 수용체 결합 도메인(RBD)에 최소 15개의 돌연변이가 있는 오미크론 변이의 전염성이 더 높다고 보고된 것과 일치하며, ACE2 수용체에 대한 바이러스 결합 친화도를 향상시켜 더 높은 전염성과 더 큰 면역 회피를 가능하게 할 가능성이 있다26.
공개
George Mason University에서 특허를 출원했으며 제품 개발을 위해 Virongy Biosciences Inc.에 라이선스를 부여했습니다. Y.W.는 Virongy Biosciences의 창립자이자 자문위원회 위원입니다. B. H는 현재 Virongy Biosciences의 CEO 겸 최고 과학 책임자입니다. 저자는 다른 이해 상충이 없습니다.
감사의 말
이 연구는 조지 메이슨 대학교 내부 연구 기금의 지원을 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 27VB1 20 µg SARS-CoV-2 Standard Neutralizing Antibody | Virongy Biosciences | 27VBI-01 | |
| 500 mL - US Origin FBS | Neuromics | FBS001 | |
| AB Mixing Plate: Olympus 96-Well PCR Plate, Non-Skirted UltraThin Wall, Natural, 25 Plates/Unit | Genesee Scientific | Cat# 24-300 | |
| Allegra 6R Centrifuge | Beckman Coulter | 2043-30-1158 | |
| DMEM (1x) | ThermoFisher | 11995-073 | |
| GenClone 25-209, TC Treated Flasks, 250ml, Vent Growth Area: 75.0cm2, 5 per Sleeve, 100 Flasks/Unit | Genesee Scientfic | 25-209 | |
| GlowMax Discover Microplate reader | Promega | GM3000 | |
| Ha-CoV-2 E Vector | Virongy Biosciences | pCoV2_E | |
| Ha-CoV-2 M Vector | Virongy Biosciences | pCoV2_M | |
| Ha-CoV-2 N Vector | Virongy Biosciences | pCoV2_N | |
| Ha-CoV-2 WT S Vector | Virongy Biosciences | pCoV2_WT S | |
| Hek293T cells | ATCC | CRL-3214 | |
| Illumination Firefly Luciferase Enhanced Assay Kit 1000 assays | Gold Bio | I-930-1000 | |
| Infection Plate: 96-Well Tissue Culture Plate, Greiner Bio-One (With Lid, μClear White Flat Round, Chimney) | VWR | Cat# 82050-758 | |
| pAlphaPro-Luc-GFP-PreΨ (Ha-CoV-2 Genome) Vector | In house | ||
| PEI-based Transfection Reagent | Virongy Biosciences | Transfectin | |
| Penicillin-Streptomycin-Glutamine (100X) | Invitrogen | 10378016 | |
| Polyethylenimine, branched | Millipore Sigma | 408727-100ML | |
| QuantStudio 7 Pro Real-Time PCR System | ThermoFisher | A43163 | |
| Ready to use (HEK293T)(ACE2/TMPRSS2) Cells | Virongy Biosciences | Ready-To-Use-Cells | |
| SARS-CoV-2 S Omicron (B.1.1.529) Vector | Virongy Biosciences | pCoV2-B.1.1.529 | |
| SARS-CoV-2 S Delta (B.1.617.2) Vector | Virongy Biosciences | pCoV2- B.1.617.2 | |
| Syringe Filters, PES, 0.22µm | Genesee Scientfic | 25-244 | |
| TaqMan Fast Virus 1-Step Master Mix | ThermoFisher | 4444432 | |
| Trypan Blue Solution, 0.4% | ThermoFisher | 15250061 |
참고문헌
- World Health Organization. Weekly epidemiological update on COVID-19. 143, 1(2023).
- Dhama, K., et al. Global emerging Omicron variant of SARS-CoV-2: Impacts, challenges and strategies. Journal of Infection and Public Health. 16 (1), 4-14 (2023).
- Dhama, K., et al. Coronavirus Disease 2019-COVID-19. Clinical Microbiology Reviews. 33 (4), e00028-e00020 (2020).
- El-Shabasy, R. M., et al. Three waves changes, new variant strains, and vaccination effect against COVID-19 pandemic. International Journal of Biological Macromolecules. 204, 161-168 (2022).
- CDC. Interim laboratory biosafety guidelines for handling and processing specimens associated with coronavirus disease 2019 (COVID-19). , https://www.cdc.gov/coronavirus/2019-nCoV/lab/lab-biosafety-guidelines.html (2021).
- Kaufer, A., Theis, T., Lau, K., Gray, J., Rawlinson, W. Laboratory biosafety measures involving SARS-CoV-2 and the classification as a Risk Group 3 biological agent. Pathology. 52 (7), 790-795 (2020).
- Vanderheiden, A., et al. Development of a Rapid Focus Reduction Neutralization Test Assay for Measuring SARS-CoV-2 Neutralizing Antibodies. Current Protocols in Immunology. 131 (1), e116(2020).
- Dieterle, M. E., et al. A Replication-Competent Vesicular Stomatitis Virus for Studies of SARS-CoV-2 Spike-Mediated Cell Entry and Its Inhibition. Cell Host & Microbe. 28 (3), 486-496 (2020).
- Nie, J., et al. Quantification of SARS-CoV-2 neutralizing antibody by a pseudotyped virus-based assay. Nature Protocols. 15 (11), 3699-3715 (2020).
- Nie, J., et al. Establishment and validation of a pseudovirus neutralization assay for SARS-CoV-2. Emerging Microbes & Infections. 9 (1), 680-686 (2020).
- Yang, R., et al. Development and effectiveness of pseudotyped SARS-CoV-2 system as determined by neutralizing efficiency and entry inhibition test in vitro. Biosafety and Health. 2 (4), 226-231 (2020).
- Hetrick, B., et al. Development of a hybrid alphavirus-SARS-CoV-2 pseudovirion for rapid quantification of neutralization antibodies and antiviral drugs. Cell reports methods. 2 (3), 100181(2022).
- Jackson, C., Farzan, M., Chen, B., Choe, H. Mechanisms of SARS-CoV-2 entry into cells. Nature Reviews. Molecular Cell Biology. 23 (1), 3-20 (2022).
- Jackson, L. A., et al. An mRNA Vaccine against SARS-CoV-2 - Preliminary Report. The New England Journal of Medicine. 383 (20), 1920-1931 (2020).
- Polack, F. P., et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. The New England Journal of Medicine. 383 (27), 2603-2615 (2020).
- Li, F. Structure, function, and evolution of coronavirus spike proteins. Annual Review of Virology. 3 (1), 237-261 (2016).
- Donofrio, G. A Simplified SARS-CoV-2 Pseudovirus Neutralization Assay. Vaccines. 9 (4), 389(2021).
- Crawford, K. H. D., et al. Protocol and Reagents for Pseudotyping Lentiviral Particles with SARS-CoV-2 Spike Protein for Neutralization Assays. Viruses. 12 (5), 513(2020).
- Zettl, F., et al. Rapid Quantification of SARS-CoV-2-Neutralizing Antibodies Using Propagation-Defective Vesicular Stomatitis Virus Pseudotypes. Vaccines. 8 (3), 386(2020).
- Li, Q., Liu, Q., Huang, W., Li, X., Wang, Y. Current status on the development of pseudoviruses for enveloped viruses. Reviews in Medical Virology. 28 (1), e1963(2018).
- Lundin, A. Optimization of the firefly luciferase reaction for analytical purposes. Advances in Biochemical Engineering/Biotechnology. 145, 31-62 (2014).
- Deshpande, G. R., et al. Neutralizing antibody responses to SARS-CoV-2 in COVID-19 patients. The Indian Journal of Medical Research. 152 (1 & 2), 82-87 (2020).
- Chen, C., et al. Research progress in methods for detecting neutralizing antibodies against SARS-CoV-2. Analytical Biochemistry. 673, 115199(2023).
- Manischewitz, J., et al. Development of a novel vaccinia-neutralization assay based on reporter-gene expression. The Journal of Infectious Diseases. 188 (3), 440-448 (2003).
- Chen, J., Wang, R., Gilby, N., Wei, G. Omicron Variant (B.1.1.529): Infectivity, Vaccine Breakthrough, and Antibody Resistance. Journal of Chemical Information and Modeling. 62 (2), 412-422 (2022).
- Saxena, S. K., et al. Characterization of the novel SARS-CoV-2 Omicron (B.1.1.529) variant of concern and its global perspective. Journal of Medical Virology. 94 (4), 1738-1744 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유