É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Quantificar Yeast Life Span cronológica por conseqüência de células envelhecidas
Neste Artigo
Resumo
Envelhecimento cronológico em levedura refere-se à perda de viabilidade celular associada ao tempo na fase estacionária. Aqui nós descrevemos um método de alto rendimento para determinar quantitativamente fermento esperança de vida cronológica.
Resumo
A levedura de brotamento
Protocolo
Parte 1: Preparação das culturas de envelhecimento
- Cepas raia de interesse dos estoques congelados em placas de ágar YEPD (extrato de levedura 1%, 2% Bacto-peptona, agar 2%, 2% de glicose).
- Incubar as células em 30 ˚ C durante 48 horas ou até colônias única aparecer.
- Escolha colônias única e inocular em 5 mL de meio líquido YEPD (extrato de levedura 1%, 2% Bacto-peptona, 2% de glicose) em tubos de ensaio.
- Crescer culturas durante a noite a 30 ˚ C, mantendo agitação constante utilizando um shaker ou tambor do rolo.
- Inocular 5 mL de meio sintético (SC) completa (Tabela 1) com 50 mL da cultura durante a noite. Geralmente três culturas SC estão preparados para cada cepa para fornecer replicação triplicado biológica da análise de ciclo de vida de cada cepa sendo examinada.
- Manter as culturas em 30 ˚ C com agitação constante em um monocilíndrico de todo o experimento (geralmente 2 ou mais semanas).
Parte 2: Tomando um ponto de viabilidade idade
Após dois dias de cultura em SC media, as células devem estar em fase estacionária e os primeiros anos de ponto está pronto para ser tomada. Subseqüentes idade pontos devem ser tomadas a cada 2-3 dias por um mínimo de duas semanas. Para cada ponto de idade:
- Prepare o Bioscreen 100 placas bem Honeycomb para inoculação preenchendo cada poço com 145 mL de YEPD. Certifique-se de deixar pelo menos um poço cheio de só YEPD e ausência de células para análise de dados mais tarde.
- Remove as culturas de envelhecimento da incubadora.
- Vortex brevemente a primeira cultura a ser inoculado na placa do favo de mel, tomando cuidado para não derramar da cultura.
- Retire 5 mL da cultura mista e pipeta-lo no primeiro poço da placa do favo de mel. Chama boca de cada tubo de ensaio, antes e após a remoção da alíquota 5 mL.
- Repita esse procedimento para cada cultura de envelhecimento sendo certo anotar a posição bem correspondentes a cada cultura. Idênticas posições bem deve ser usado para cada idade subseqüentes ponto durante todo o experimento.
- Substituir as culturas para a 30 ˚ C incubadora quando terminar com a vacinação.
Parte 3: Carregando o Bioscreen C máquina MBR
- Expor o compartimento incubadora, levantando a tampa e retire a tampa para a bandeja de amostra.
- Inserir a placa recém-inoculados Honeycomb na bandeja de amostra (usar o slot da esquerda se você estiver apenas uma leitura da placa).
- Recoloque a tampa para a bandeja de amostra e menor a tampa do compartimento de incubadora.
- Verifique se o fluido de transferência de calor está acima do nível mínimo de preenchimento. Se baixo, adicionar mais usando uma pipeta de 1000 mL com o fluido de transferência de calor fornecido.
- Usando o software Bioscreen "EZExperiment", defina os parâmetros a seguir para obter as curvas de crescimento adequado para Saccharomyces cerevisiae:
- Número de amostras: Digite o número de poços com a mídia ou 200
- Filter: 420-580nm, Wideband
- Temperatura: 30 ˚ C
- Comprimento experimento: um dia, 0 horas, 0 segundos
- Intervalo de medição: 30 minutos
- Agitação: On, agitação contínua, de alta
- Clique em "Iniciar" para iniciar as leituras.
Parte 4: Análise de Dados
Tipicamente, seis idade pontos são tomadas ao longo de duas semanas. Os pontos de idade são tomadas nos dias 2, 4, 6, 9, 11 e 13. Dependendo do desenho experimental e tensões que está sendo testado, pode ser desejável para tomar idade pontos mais ou menos freqüentemente ou por mais de duas semanas. É importante carregar a placa do favo de mel na mesma ordem para todas as idades ponto tal que cada cultura envelhecimento corresponde à mesma posição em todas as idades bem-ponto, pois isso fará com que a análise de dados muito mais fácil.
- Obter os arquivos de saída da máquina Bioscreen MBR C. O software "EZExperiment" irá mostrar os dados Bioscreen como um arquivo delimitado por tabulação que é compatível com Microsoft Excel, assim como outros softwares. A primeira coluna mostra em que momento da medição OD foi tomada durante o experimento, com colunas subseqüentes representando cada poço nas placas Bioscreen Honeycomb (Figura 1).
- Excluir a leitura OD primeiro de cada coluna. Esta leitura é "ruído".
- Normalizar os dados, subtraindo o valor da OD bem com YEPD sozinho de todos os valores de OD em cada coluna. Isso remove a absorvância de fundo pela mídia.
- Plot as curvas conseqüência. As curvas mudará em função da idade (Figura 2). Por exemplo, traçando as curvas de crescimento da coluna 1 (poço 1 da placa do favo de mel) ao longo dos seis pontos do tempo, há uma nítida mudança para a direita das curvas ao longo do tempo.
- Calcular o tempo de duplicação (δ) para cada poço com base na cinética de crescimento de dois dias a idade-ponto. A equação utilizada para calcular tempo de duplicação is:

onde OD 1 e 2 representam OD OD medições sucessivas e t 1 e t 2 é o tempo entre as medições. Calcule duplicação vezes apenas entre os valores OD de 0,2 para 0,5. A média desses valores é o tempo de duplicação para o bem. Calcule duplicação vezes apenas entre os valores OD de 0,2 para 0,5. A média desses valores é o tempo de duplicação para o bem. A maioria das estirpes do tipo selvagem levedura deve dar um valor de tempo de duplicação entre 85 a 90 minutos. - Para cada idade ponto, calcular a mudança de tempo (Dt) nas curvas de crescimento em relação à idade inicial de ponto (dia 2). Uma maneira fácil de fazer isso é determinar a diferença na duração do tempo que levou para cada poço para chegar a um OD de 0,3 entre os anos iniciais de ponto e cada subseqüente idade ponto. O tempo que um determinado poço atingiu uma OD de 0,3 pode ser calculado a partir da equação de regressão linear correspondente a ln (OD) em função do tempo entre os dois pontos temporais bracketing OD = 0,3.
- Calcular a fração sobrevivente em cada idade ponto, a fim de gerar uma curva de sobrevivência (Figura 3). Definir o ponto inicial idade (dia 2) a ser viabilidade de 100%. Para cada idade sucessiva ponto-calcular a sobrevivência por cento usando a equação:
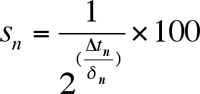
s onde n é a porcentagem de sobrevivência, Dt n é a mudança da hora, e n δ é o tempo de duplicação. - Gerar curvas de sobrevida (Figura 3B), como desejado para cada bem (ou poços replicar) traçando a fração (ou percentual) de células viáveis em função da idade.
- Calcular a sobrevivência integral (SI) para cada poço. SI é definida como a área sob a curva de sobrevivência e pode ser estimado pela fórmula:

onde a idade n é a idade-ponto (eg 2, 4, 6, 9, 11 e 13) e s n é o valor de sobrevivência nessa idade ponto. - Determinar os parâmetros estatísticos de poços replicar a partir dos dados do SI e sobrevivência. Comum parâmetros estatísticos de interesse incluem mediana, média e variância para cada conjunto de fatores biológicos repetições. A t-teste ou análise similar pode ser usado para comparação de pares de SI para fins experimentais e grupos controle. Também pode ser desejável para gerar curvas de sobrevivência, como descrito em 4.8 de média biológica repetições.
Parte 5: Os resultados representativos
Ao término do experimento, você terá traçado da curva de sobrevivência e realizada a análise de dados suficientes para determinar o potencial de envelhecimento cronológico de várias estirpes diferentes ou condições. Se realizada corretamente, as curvas de crescimento obtidas a partir da máquina Bioscreen MBR C deve ser semelhante ao mostrado na Figura 2 e as curvas de sobrevivência resultante deve ser semelhante aos mostrados na Figura 3. Geralmente, do tipo selvagem células cultivadas nas condições descritas aqui terão uma duração de vida média da ordem cronológica de 7 dias. Variação substancial na sobrevida é observado em cepas diferentes e sob algumas condições, tais como o crescimento em meios de glicose 0,05%, a sobrevida mediana pode exceder 30 dias.

Figura 1. Saída de dados do Bioscreen programa "EZExperiment". A coluna mostra o momento em que uma leitura de absorbância foi tirada. Sucessivas colunas representam os poços da placa do favo de mel inoculados com células retiradas de culturas de envelhecimento.
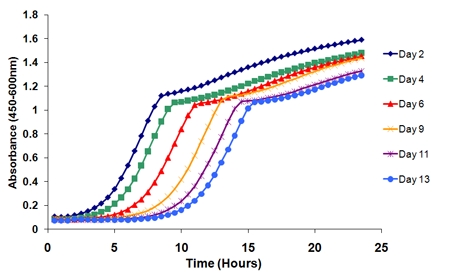
Figura 2. Curvas de crescimento a partir de um único replicar biológica ao longo de uma experiência. Há uma clara mudança nas curvas ao longo do tempo como as células do envelhecimento na cultura perdem a viabilidade. O período de tempo entre o ponto de tempo inicial (dia 2) e um ponto de tempo sucessivos determina viabilidade nessa idade particular.
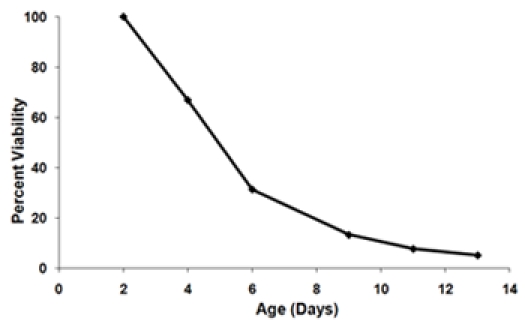
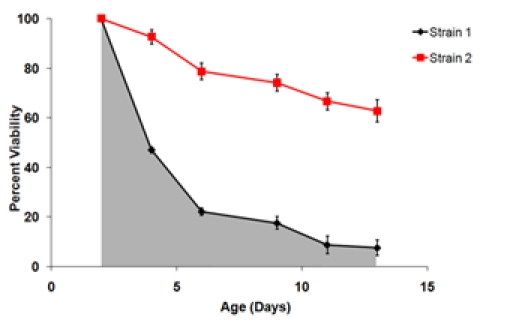
Figura 3. A) A curva de sobrevida usando os dados gerados conseqüência da Figura 1. No dia tempo 2 é definido como o ponto de viabilidade de 100%. B) curvas de sobrevivência final de duas cepas testadas no mesmo experimento. Essas curvas representam as viabilidades de sobrevivência média de três repetições para cada biológica tensão. Barras de erro representam o desvio padrão dentro biológica repetições. A área sombreada sob a curva de sobrevivência representa a sobrevivência integral (SI) para a cepa 1.
| Tabela 1. Médio Definido sintético usado para estudos de envelhecimento cronológico (cepa background BY4743) | |
| Componente | Concentração (g / L) |
| D-glucose | 20 |
| Base de levedura de nitrogênio (-AA/AS) | 1,7 |
| (NH 4) 2 SO 4 | 5,0 |
| Adenina | 0,04 |
| L-Arginina | 0,02 |
| Ácido L-aspártico | 0,1 |
| Ácido L-glutâmico | 0,1 |
| L-Histidina | 0,1 |
| L-leucina | 0,3 |
| L-Lisina | 0,03 |
| L-Metionina | 0,02 |
| L-Fenilalanina | 0,05 |
| L-Serina | 0,375 |
| L-Treonina | 0,2 |
| L-Triptofano | 0,04 |
| L-Tirosina | 0,03 |
| L-valina | 0,15 |
| Uracil | 0,1 |
Nota: Esta receita é responsável por auxotrophies em linhagem diplóide BY4743. Auxotrophies aminoácido deve ser compensado pela adição de uma concentração 5X final para o meio sintético completo.
Discussão
O alto rendimento cronológica ensaio expectativa de vida aqui descrito é um método eficaz para quantificar o potencial de envelhecimento de um grande número de cepas com alta precisão e de precisão. O principal avanço deste método em relação aos métodos clássicos de determinação de sobrevivência através da contagem de unidades formadoras de colônia (por exemplo, ver 3) é o uso de um dispositivo de leitura shaker / incubadora / placa, como a máquina Bioscreen MBR C para obtenção de curvas ...
Agradecimentos
Este trabalho foi financiado pelo NIH Grant 1R21AG031965-01A1. MK é um Ellison Medical Foundation Scholar novo no Envelhecimento.
Materiais
| Name | Company | Catalog Number | Comments | |
| Bacto Peptone | Reagent | BD Biosciences | 211677 | |
| Bacto Yeast Extract | Reagent | BD Biosciences | 288620 | |
| Difco Agar | Reagent | BD Biosciences | 214530 | |
| Yeast Nitrogen Base w/o A.A. and A.S. | Reagent | MidSci | J630-500G | |
| Amino Acids | Reagent | Sigma-Aldrich | ||
| Ammonium Sulfate | Reagent | Spectrum | AM185 | |
| Dextrose | Reagent | Fisher Scientific | D16-10 | |
| Bioscreen C MBR machine | Tool | Growth Curves USA | 5101370 | |
| Bioscreen 100-well Honeycomb plate | Tool | Growth Curves USA | 9502550 |
Referências
- Steinkraus, K. A., Kaeberlein, M., Kennedy, B. K. Replicative aging in yeast: the means to the end. Annu Rev Cell Dev Biol. 24, 29 (2008).
- Kaeberlein, M., Conn, P. M. . Handbook of models for human aging. , 109 (2006).
- Fabrizio, P., Longo, V. D. The chronological life span of Saccharomyces cerevisiae. Aging Cell. 2 (2), 73 (2003).
- Murakami, C. J., Burtner, C. R., Kennedy, B. K., Kaeberlein, M. A method for high-throughput quantitative analysis of yeast chronological life span. J Gerontol A Biol Sci Med Sci. 63 (2), 113 (2008).
- Piper, P. W., Harris, N. L., MacLean, M. Preadaptation to efficient respiratory maintenance is essential both for maximal longevity and the retention of replicative potential in chronologically ageing yeast. Mech Ageing Dev. 127 (9), 733 (2006).
- Fabrizio, P., et al. Superoxide is a mediator of an altruistic aging program in Saccharomyces cerevisiae. J Cell Biol. 166 (7), 1055 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados