É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Espectroscopia de Ressonância Magnética de viver Drosophila melanogaster Usando Angle Spinning Magia
Neste Artigo
Resumo
Esta técnica permite o uso de alta resolução, ângulo mágico de prótons girando MR espectroscopia (HRMAS 1H-MRS) para a caracterização molecular de viver Drosophila melanogaster Com um espectrômetro convencional 14,1 tesla equipado com uma sonda HRMAS.
Resumo
Alta Resolução Angle Spinning Magia (HRMAS) espectroscopia de prótons por ressonância magnética (
Protocolo
Parte 1: Preparando-se para Drosophila Medidas HRMAS
- Usando o padrão flylab procedimentos 1, recolher recém eclosing moscas durante 3 dias e transferi-los para voar frascos contendo alimentos fly fresco. Incubar as moscas coletadas por 5 dias para que as moscas se tornará 5-8 dias de idade um pouco antes do experimento. Apenas um sexo (geralmente machos) é usada para experimentos.
- Use saudável, do tipo selvagem intacta voa para comparar com tratados por exemplo, traumatizados ou moscas geneticamente alterados 1.
- Lugar moscas única em tubos de 2ml contendo um pedaço (~ 0,2 ml) de mosca de alimentos 24 horas antes do experimento. Estes tubos têm um furo no copo tubo feito usando uma agulha de insulina chama-aquecido.
- Pesar os tubos imediatamente antes e após a inserção voar utilizando uma balança de alta precisão e definir o peso de cada fly s subtraindo-se o primeiro valor do segundo. A única mosca macho pesa geralmente 0,7-1 mg.
Parte 2: Preparação HRMAS Rotor.
- Coloque um único tubo em gelo por menos de um minuto para anestesiar o interior voar.
- Lay a mosca em uma camada de papel alumínio colocado sobre o gelo e empurre a voar delicadamente no espaço semi-esférica oca da inserção rotor NMR utilizando uma escova macia para garantir a inserção voar completa, evitando lesões voar.
- Coloque a inserir no óxido de zircônio (ZrO 2) tubo de rotor (4 mm de diâmetro, 50 ul) para localizar as moscas entre o rotor e inserir na parte inferior do rotor (ver figura 1).
- Feche a inserção com um parafuso e cobri-lo com parafilme (ver figura 1) para evitar o contato entre a mosca eo TSP solução-padrão (TSP: trimetilsilil-propiônico-2 ,2,3,3-d4 ácido, Mw = 172, δ = 0,00 ppm, 50 mM em água deuterada-D 2 O, que funcionam como uma referência tanto para deslocamento químico ressonância e quantificação).
- Adicionar 8 mL de solução padrão TSP em cima do insert rotor. (Ver figura 1).
- Aperte bem todo o conjunto em que os rotores com uma tampa superior (ver figura 1).
Parte 3: HRMAS Aquisição de Dados
- Introduzir o rotor na sonda HRMAS e posicioná-la no ângulo mágico 54,7 ° (ver figura 1).
- Ajuste de temperatura de 4 ° C por uma unidade de BTO-2000 em conjunto com a unidade pneumática MAS. Moscas são mantidos a 4 ° C, enquanto no espectrômetro para manter a anestesia.
- Definir a taxa de HRMAS 1 H MRS girando em 2 MAS kHz.
- Estabilizar a freqüência de rotação MAS de 2,0 ± 0,001 kHz por um controlador de velocidade MAS (freqüência de rotação).
- Para a preparação de ímã: sintonia e combinar a bobina para um melhor desempenho e calço o ímã para ótima qualidade de espectros.
- Adquirir uma dimensão um espectro de H usando rotor sincronizado Carr-Purcell-Meiboom-Gill (CPMG) spin echo seqüência de pulsos 2, [90 ° - (τ-180 ° - τ) n-aquisição], que funciona como um filtro para 2 T remover o alargamento espectral 1 H RMN único voar para adquirida unidimensional dados sobre todas as amostras. Sincronizar o atraso inter-pulso (τ = 500μs) para a frequência de rotação MAS (2 kHz). Definir o número de transientes em 256 com 32,768 (32k) pontos de dados. Aquisição em tempo 9 min.
- Aquisição de duas dimensões (2D) 1 H-1 H RMN HRMAS único voar em todas as amostras usando uma seqüência TOBSY com pulsos adiabáticos 3. Parâmetros de aquisição são: pontos de dados de dimensão 2k direta (11 ppm largura espectral), a água 1 s pré-saturação durante o atraso de relaxamento, 8 varreduras por incremento, 128 incrementos, o tempo de 2 s repetição total, 45 ms de tempo de mistura, e um total de aquisição tempo de 29 min.
Parte 4: Processamento de Dados / Análise
- Analisar a MRspectra de espécimes usando MestReC software (Mestrelab Research, www.mestrec.com)
- Use uma linha de alargamento função apodização de 0,5 Hz e se aplicam a todos os 1 HRMAS FIDs H antes da transformação de Fourier.
- Referência o espectro MR em relação ao TSP em δ = 0,0 ppm (padrão externo).
- Fase de espectros manualmente e aplicar um estimador base Whittaker para subtrair os componentes ampla da linha de base antes de cálculos de área de pico.
- Estimativa de áreas dos picos usando software MestReC. Escala de alturas de pico em relação a TSP para cada espectro adquirido (altura do pico TSP = 1). Use t-testes (bicaudal, p <0,05) para comparação dentro do grupo-a entre-grupos rácios.
- Parâmetros de processo 2D TOBSY são: QSINE = função de janela 2 em ambas as dimensões, FT com 2k pontos na dimensão diretos e zero-enchimento para 1k na segunda dimensão, correção de fase em ambas as dimensões e correção de linha de base na segunda dimensão.
- Produzir os espectros 2D utilizando Sparky programa (TD Goddard e DG Kneller, SPARKY 3, USCF, http://www.cgl.ucsf.edu/home / sparky /)
Parte 5: Spectra Representante do Live moscas Drosophila melanogaster
Os procedimentos descritos acima permitem coletar espectros reprodutíveis das moscas Drosophila melanogaster ao vivo. Figuras 2 e 3 mostram representante MR espectros adquiridos no tipo selvagem (wt) Oregon-R moscas. A Figura 2 apresenta 1D 1 H HRMAS espectros CPMG. Principais componentes lipídicos [H 3 C (0,89 ppm), (C H 2) n (1,33 ppm), C H 2 C-CO (1.58ppm), C H 2 C = C (2,02 ppm), H 2 C = C O (2,24 ppm), C = C H H (5,33 ppm)] glicerol, (1,3-C H 4,10 ppm e 4,30 ppm; 2-CH 2 5,24 ppm), e metabólitos pequeno: β-alanina (Ala-β , 2,57 ppm), acetato (Ac, 1,97 ppm), fosfocolina (PC, 3,22 ppm) e phophoetanolamine (PE, 3.23ppm) foram detectadas e atribuídas de acordo com relatórios anteriores 4, 5. Sinais em 2,02 ppm foram atribuídos aos prótons de metileno do H2-CH = CH C porção de mono-ácidos graxos insaturados (ie palmitoléico). Os ácidos insaturados foram identificados por um sinal em 5,33 ppm produzidas por prótons do-CH = CH-metade. Metabólitos de pequeno porte que não poderia ser atribuído ou não eram visíveis a utilização do espectro 1D foram detectadas utilizando 2D 1 H-1 H TOBSY HRMAS (ver figura 3).

Figura 1. Experimental criação de in vivo HRMAS 1H MRS para a investigação de viver Drosophila em 14,1 T. externo padrão trimetilsilil-propiônico-2 ,2,3,3-ácido d4 em água deuterada (TSP / D 2 O). Na praça: a posição do rotor no ângulo mágico em HRMAS sonda.
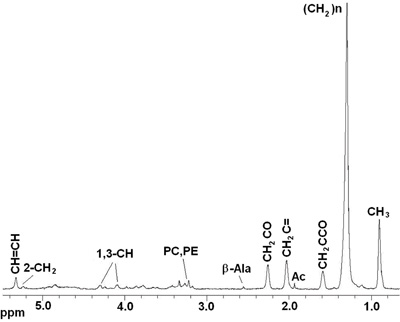
Figura 2. In vivo 1D 1 H HRMAS espectros CPMG de uma mosca Drosophila melanogaster ao vivo wt. Componentes lipídicos: C H 3 (0,89 ppm), (C H 2) n (1,33 ppm), C H 2 C-CO (1.58ppm), acetato (Ac), C H 2 C = C (2,02 ppm), C H 2 C = O glicerol (2,24 ppm), β-alanina (β-Ala), fosfocolina (PC) e phophoetanolamine (PE), (1,3-C H 4,10, 4,30 ppm; 2-H 2 C 5,22 ppm) , C H H = C (5,33 ppm).
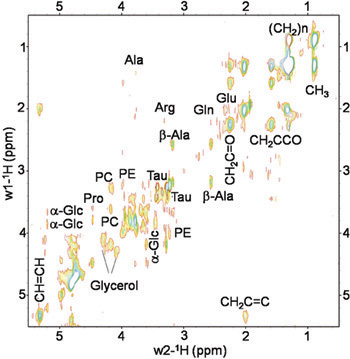
Figura 3. In vivo 2D 1H-1H TOBSY HRMAS espectro de uma mosca Drosophila melanogaster ao vivo em peso a 14,1 metabólitos T. Pequenas e componentes lipídicos foram identificados. Metabolitos: alanina (Ala), β-alanina (β-Ala), arginina (Arg), glutamina (Gln), glutamato (Glu), PC fosfocolina (PC), phophoetanolamine (PE), taurina (Tau), α-glicose (α-Glc) e glicerol. Lipídios componentes: C H 3 (0,89 ppm), (C H 2) n (1,33 ppm), C H 2 C-CO (1,58 ppm), C H 2 C = C (2,02 ppm), C H 2 C = O (2,24 ppm), C = C H H (5,33 ppm).
Discussão
Com exceção do recente relatório sobre a viabilidade de ressonância magnética in vivo em moscas de fruta 6, in vivo MRS estudos em Drosophila ainda não foram relatados. No protocolo, descrevemos a implementação de um romance in vivo HRMAS uma abordagem H-MRS para a detecção de moléculas biologicamente importantes. Especificamente, nós detectamos lipídios e metabólitos em pequena viver Drosophila voa a 14,1 T em aproximadamente 45 min, o que...
Divulgações
Agradecimentos
Este trabalho foi financiado em parte por um Instituto Nacional de Saúde (NIH) para conceder AI063433 Laurence G. Rahme, um Instituto Nacional Institutes of Health (NIH) Centro de Grant (P50GM021700) para Ronald G. Tompkins (A. Aria Tzika, Diretor de o núcleo de RMN), e um Hospital Shriners para Crianças Bolsa de Investigação (# 8893) para A. Aria Tzika. Agradecemos a Dionyssios Mintzopoulos Ph.D. de assistência nas fases iniciais de desenvolvimento deste protocolo e Ovidiu C. Andronesi Ph.D. de assistência com a seqüência de pulso TOBSY.
Materiais
| Name | Company | Catalog Number | Comments | |
| Deuterium oxide | Reagent | Sigma-Aldrich | 7789-20-0 | |
| 3-(trimethylsilyl)propionic-2,2,3,3-d4 acid | Reagent | Sigma-Aldrich | 24493-21-8 | |
| agar, sucrose, yeast, cornmeal | Food | Genesee Scientific | http://www.flystuff.com/ | |
| Oregon RS or Canton-S flies | Adult fly lines | Bloomington Stock center | http://flystocks.bio.indiana.edu/ | |
| Paintbrush | Equipment | (size 0) | ||
| 2ml tubes | Equipment | Fisher Scientific | K749521-1590 | |
| Fly incubators | Equipment | high humidity capacity (60-75%), adjustable temperature, and a 12 h:12 h light: dark cycle. | ||
| Bruker Bio-Spin Avance NMR spectrometer (600.13 MHz) 4mm triple resonance (1H, 13C, 2H) HRMAS probe | Equipment | Bruker Corporation | ||
| BTO-2000 unit in combination with a MAS pneumatic unit | Equipment | Bruker Corporation | ||
| 4mm zirconium oxide rotor (capacity 50 ul) | Equipment | Bruker Corporation | B3829 (Bruker store) | |
| MestReC (Mestrelab Research) | Software | 1D NMR spectra analysis http://mestrelab.com/ | ||
| SPARKY 3, USCF | Software | 2D NMR spectraanalysis http://www.cgl.ucsf.edu/home/sparky/ |
Referências
- Apidianakis, Y., Rahme, L. G. Drosophila melanogaster as a model host for studying Pseudomonas aeruginosa infection. Nat Protoc. 4, 1285-1294 (2009).
- Meiboom, S., Gill, D. Modified spin-echo method for measuring nuclear relaxation time. Rev Sci Instrum. 29, 688-691 (1958).
- Andronesi, O. C., Mintzopoulos, D., Struppe, J., Black, P. M., Tzika, A. A. Solid-state NMR adiabatic TOBSY sequences provide enhanced sensitivity for multidimensional high-resolution magic-angle-spinning 1H MR spectroscopy. J Magn Reson. 193, 251-258 (2008).
- Astrakas, L. G. Proton NMR spectroscopy shows lipids accumulate in skeletal muscle in response to burn trauma-induced apoptosis. Faseb J. 19, 1431-1440 (2005).
- Fan, T. W. M. Metabolite profiling by one- and two dimensional NMR analysis of complex mixtures. Prog Nuc Magn Reson Spec. 28, 161-219 (1996).
- Null, B., Liu, C. W., Hedehus, M., Conolly, S., Davis, R. W. High-resolution, in vivo magnetic resonance imaging of Drosophila at 18.8 Tesla. PLoS One. 3, e2817-e2817 (2008).
- Zektzer, A. S. Improved signal to noise in high-resolution magic angle spinning total correlation spectroscopy studies of prostate tissues using rotor-synchronized adiabatic pulses. Magn Reson Med. 53, 41-48 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados