É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Microscopia de Força Atômica para Estudo das Propriedades Físicas de Células Epidérmicas de Raízes Vivas de Arabidopsis
Neste Artigo
Resumo
O protocolo de indentação por microscopia de força atômica oferece a possibilidade de dissecar o papel das propriedades físicas da parede celular de uma determinada célula de um tecido ou órgão durante o crescimento normal ou restrito (ou seja, sob déficit hídrico).
Resumo
Um método é descrito aqui para caracterizar as propriedades físicas da parede celular de células epidérmicas de raízes vivas de Arabidopsis através de nanoindentações com um microscópio de força atômica (AFM) acoplado a um microscópio óptico de fluorescência invertida. O método consiste em aplicar forças controladas à amostra enquanto mede sua deformação, permitindo quantificar parâmetros como o módulo aparente de Young das paredes celulares em resoluções subcelulares. Requer uma cuidadosa imobilização mecânica da amostra e seleção correta de indenters e profundidades de recuo. Embora possa ser usado apenas em tecidos externos, este método permite caracterizar mudanças mecânicas nas paredes celulares das plantas durante o desenvolvimento e permite a correlação dessas alterações microscópicas com o crescimento de um órgão inteiro.
Introdução
As células vegetais são circundadas por uma parede celular que é uma estrutura complexa composta por redes interativas de polissacarídeos, proteínas, metabólitos e água que varia em espessura de 0,1 a vários μm, dependendo do tipo celular e da fase de crescimento 1,2. As propriedades mecânicas da parede celular desempenham um papel essencial no crescimento das plantas. Baixos valores de rigidez da parede celular têm sido propostos como uma pré-condição para o crescimento celular e a expansão da parede celular, e há evidências crescentes de que todas as células sentem forças mecânicas para desempenhar suas funções. No entanto, ainda é debatido se as alterações nas propriedades físicas da parede celular determinam o destino celular 2,3,4. Como as células vegetais não se movem durante o desenvolvimento, a forma final de um órgão depende de quão longe e em que direção uma célula se expande. Assim, a raiz de Arabidopsis é um bom modelo para estudar o impacto das propriedades físicas da parede celular na expansão celular, pois diferentes tipos de expansão ocorrem em diferentes regiões da raiz. Por exemplo, a expansão anisotrópica é evidente na zona de alongamento e, particularmente, nas células epidérmicas5.
O método aqui descrito foi utilizado para caracterizar as propriedades físicas da parede celular de células epidérmicas em nanoescala de raízes vivas de Arabidopsis utilizando um Microscópio de Força Atômica (AFM) acoplado a um microscópio de fase de fluorescência invertida6. Para uma extensa revisão da técnica AFM, leia 7,8,9.
Este protocolo descreve um método básico de preparação de amostras e um método geral para medições de elasticidade baseadas em AFM de paredes celulares de plantas.

Figura 1: Visão geral esquemática do experimento de indentação de força em raízes de Arabidopsis usando microscopia de força atômica (AFM). O esquema fornece uma visão geral das etapas de um experimento de Força-Indentação desde a preparação do substrato para imobilizar a amostra radicular firmemente (1-2), confirmação da viabilidade radicular através da coloração de iodeto de propídio (3), posicionamento do cantilever na superfície de uma célula epidérmica alongada da raiz primária (4-5), medição de curvas de força (6) e processamento de curva de força para calcular o módulo aparente de Young (7-8). EZ: zona de alongamento. Por favor, clique aqui para ver uma versão maior desta figura.
Protocolo
1. Preparação do material vegetal e condições de crescimento
- Para gerar o material vegetal necessário, esterilize as sementes do tipo selvagem Arabidopsis e linhas mutantes de interesse.
NOTA: Neste protocolo, utilizou-se o seguinte: ttl1: linhas de inserção de T-DNA Salk_063943 (para TTL1; AT1G53300) - Columbia-0 (Col-0) tipo selvagem; o mutante Procuste1 (prc1-1), que consiste em uma mutação knock-out (Q720stop) no gene CESA6 (AT5G64740), conforme descrito anteriormente em10,11; e ttl1 x prc1-1 duplo mutante.- Coloque um volume aproximado de 50 μL de sementes em um microtubo. Adicionar 500 μL de etanol a 70% + solução de interpolação a 0,01% à temperatura ambiente. Misture e incube por 7 min.
- Deite a solução de etanol e adicione 500 μL de hipoclorito de sódio a 20%. Misture e incube por 7 min.
- Despeje a solução de hipoclorito de sódio e lave as sementes três a quatro vezes com água estéril.
- Chapeamento
- Preparar antecipadamente o meio basal Murashige e Skoog (MS)12 + 1,5% de sacarose + 1% de ágar (pH 5,7) (ver Tabela de Materiais). Autoclave o meio. Prepare um exaustor de fluxo laminar para trabalhar em um ambiente estéril e rotule as placas de Petri quadradas necessárias para o experimento. Despeje o meio nas placas de Petri e deixe o meio se solidificar.
- Pratique as sementes esterilizadas usando pontas de pipeta estéreis em placas de Petri quadradas contendo o meio. Distribua as sementes uniformemente em duas linhas. Quando as sementes estiverem secas, feche as tampas e sele as placas. Estratificar as sementes a 4 °C no escuro durante 4 dias.
NOTA: A estratificação é necessária para sincronizar a germinação. - Colocar as placas verticalmente na câmara de crescimento em regime de dia longo (16 h de luz/8 h de escuro) com intensidade de luz de 25 μmol m2 s−1 e 23 °C (dia/noite). Cultive as mudas por 7 dias.
2. Tratamento de estresse osmótico (opcional)
NOTA: Esta seção fornece detalhes sobre o crescimento das raízes de Arabidopsis em potencial osmótico de -1,2 MPa, conforme estimado pelo osmômetro crioscópico (Tabela de Materiais). Esta parte pode ser omitida ou alterada dependendo da questão experimental em questão.
- Preparar meio MS basal + sacarose a 1,5% + manitol a 400 mM + ágar a 1% (pH 5,7). Autoclave o meio. Despeje o meio em placas de Petri quadradas no exaustor de fluxo laminar e deixe o meio solidificar.
- Com pinça (Tabela de Materiais), coloque mudas de 5 dias pré-cultivadas em meio basal MS + 1,5% de sacarose em placas de Petri quadradas contendo o meio suplementado com manitol de 400 mM. Colocar as placas verticalmente na câmara de crescimento nas mesmas condições que na etapa 1.2.3. Cultive as mudas sob esta condição de estresse osmótico por 7 dias.
NOTA: Para avaliar a adaptação do crescimento radicular da raiz primária durante estresse osmótico severo, sugere-se a utilização de plântulas 5 dias após a germinação cultivadas em condições controladas para garantir que o tamanho do meristema radicular já esteja estabelecido13. Alternativamente, a análise pode ser realizada em cada estágio de desenvolvimento para determinar o efeito no desenvolvimento da ação do estresse osmótico.
3. Experimentos de nanoindentação por microscopia de força atômica (AFM)
- Preparação da amostra para experiências de nanoindentação
NOTA: Este é um passo crucial para a aplicação do AFM ao estudo de amostras biológicas vivas. A amostra deve estar firmemente fixada ao substrato para ser mecanicamente estável durante as medições de recuo. Ao mesmo tempo, as qualidades estruturais da amostra devem ser preservadas. Uma estratégia eficaz para estabilizar uma grande amostra para AFM é usar adesivos. O adesivo deve secar rapidamente e não deve ser tóxico ou reativo com o meio circundante. Neste protocolo, placas de Petri de poliestireno foram utilizadas como substrato e cola de silicone não ácida (Tabela de Materiais) foi utilizada para ligar as plântulas de Arabidopsis.- Espalhe uma fina camada de cola de silicone na placa de Petri com uma tampa. Deixe a cola no ar por 45 s.
- Com a pinça, coloque a muda na cola, orientando-a em uma direção que evite o contato entre as partes salientes da muda e o balanço. Em seguida, pressione a raiz suavemente na camada de cola de silicone para ligá-la firmemente. Deixe a muda em contato com a cola por 45 s antes de continuar com os próximos passos do protocolo.
- Incubar as plântulas aderidas com 2 μg/mL de iodeto de propídio (PI; Tabela de Materiais) por 5 min no escuro e lave-os cuidadosamente três vezes com 1x solução salina tamponada com fosfato (PBS) (Tabela de Materiais).
- Coloque as plântulas incubadas PI em um microscópio de fluorescência invertida acoplado ao AFM. Para observar a fluorescência, defina os comprimentos de onda de excitação e emissão em 572 nm e 617 nm, respectivamente. A ausência de fluorescência no interior das células epidérmicas confirma a viabilidade das raízes.
- Cubra a plântula com 1x solução salina tamponada com fosfato (PBS).
- Protocolo de recuo
NOTA: Efectuar todas as medições do AFM no prazo de 1 h após a imobilização da amostra no seu suporte à temperatura ambiente. A sala onde o AFM está localizado deve ser mantida a 25 °C com um ar condicionado. A solução de PBS deve estar à mesma temperatura.- Monte um cantilever de nitreto de silício padrão com uma ponta piramidal (consulte Tabela de Materiais) no suporte da sonda AFM para fluido (Tabela de Materiais).
- Alinhe o laser no cantilever perto da posição da ponta. Em seguida, mova o fotodiodo para colocar o ponto laser no centro do detector.
- Para calibrar a sensibilidade à deflexão, posicione uma placa de Petri de poliestireno com 1x PBS sob o AFM.
Observação : esta etapa é necessária para calcular o recuo. Quando uma medição de força é feita em uma superfície dura, não há recuo na superfície, de modo que qualquer alteração no deslocamento do scanner z corresponde à deflexão do cantilever. Portanto, é muito importante calibrar a sensibilidade de deflexão em uma superfície dura. O uso de uma superfície macia superestimará a sensibilidade à deflexão, o que resultará em constantes de mola muito baixas. - Ajuste o fotodetector de modo que a deflexão sem contato esteja próxima de 0 V. Calibre a sensibilidade de deflexão realizando um recuo (curva de força), com um tamanho de rampa de 3 μm, uma taxa de recuo e retração de 0,6 μm/s e um limiar de gatilho de 0,5 V.
- Para calibrar a constante de mola do balanço, use o utilitário Thermal Tune do software AFM (Table of Materials) recomendado para sondas com constantes de mola menores que aproximadamente 5 N/m ou use o método descrito na referência14. Antes de ativar o Thermal Tune no software, certifique-se de que a sonda não interaja com a amostra.
- Digite a temperatura do cantilever. Clique em Calibrar > Thermal Tune ou no ícone Thermal Tune na barra de ferramentas do NanoScope . Selecione uma faixa de frequência (1-100 Hz).
- Clique em Adquirir dados no painel Ajuste térmico . Aguarde até que o AFM adquira dados e, em seguida, clique no botão Oscilador Harmônico Simples (Fluido ).
- Ajuste a largura média do filtro para 3. Ajuste a largura do compartimento PSD para reduzir o ruído nos dados adquiridos por meio da média dos dados. Defina limites de ajuste em torno do primeiro pico de ressonância.
- Clique em Calcular Constante de Mola k e, em seguida, clique em Sim na janela pop-up perguntando se o usuário deseja usar esse valor.
- Repita as etapas descritas acima três vezes e pegue manualmente uma média de valores constantes de mola. Insira esse valor médio na caixa Constante de mola na lista de parâmetros de rampa na visualização PicoForce . A calibração termina neste ponto.
- Usando o microscópio óptico invertido na ampliação da ocular de 10x, 20x e 40x, posicione a sonda AFM na superfície da quarta célula epidérmica alongada da raiz primária, certificando-se de posicioná-la no centro da célula.
- Com o valor da constante de mola calculado (passo 3.2.5.5), obtenha-se curvas de força com um tamanho de rampa de 3 μm, um limiar de gatilho de 11 nN e uma taxa de recuo e retração de 0,6 μm/s em pontos selecionados.
NOTA: Trabalhos anteriores15,16 constataram que a baixa frequência de recuo e retração ajuda a minimizar a histerese e a força de arrasto. - Obter curvas de força de três células por raiz para cada tratamento (use três repetições biológicas por tratamento). Capture pelo menos 150 curvas de força para cada raiz.
4. Meça o módulo aparente de Young
- Ajuste cada curva de força ao seguinte modelo para indenters piramidais17:
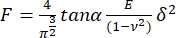 , onde E é o módulo de Young aparente da amostra, é o módulo de Poisson da amostra,
, onde E é o módulo de Young aparente da amostra, é o módulo de Poisson da amostra, 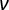 e α é o semiângulo para o vértice. Descarte os ajustes com um coeficiente de correlação (r2) < 0,99. Considere a razão de Poisson para material totalmente incompressível:
e α é o semiângulo para o vértice. Descarte os ajustes com um coeficiente de correlação (r2) < 0,99. Considere a razão de Poisson para material totalmente incompressível: 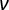 = 0,5 e a geometria do indenter dada pelos fabricantes.
= 0,5 e a geometria do indenter dada pelos fabricantes.
NOTA: Utilizar os primeiros 100 nm a partir do ponto de contacto da curva de carga para que o encaixe seja o mais sensível possível à mecânica da parede celular e reduza o impacto da pressão do turgor nos valores aparentes do módulo de Young8. O ajuste foi feito usando um programa MATLAB personalizado (disponível mediante solicitação pessoal escrevendo para J. C. B) que permite definir uma profundidade de recuo específica a partir do ponto de contato da curva de carregamento. - Crie um histograma normalizado com os dados aparentes do módulo de Young e encaixe-o com uma distribuição gaussiana. Descartar pontos de dados fora do intervalo de confiança de 95% e recalcular o histograma e o ajuste gaussiano. Calcular e relatar a média e o desvio padrão do módulo aparente de Young.
- Determine a significância das comparações entre grupos por testes de comparação múltipla, como ANOVA.
Resultados
Experimentos de Força-Indentação
O texto a seguir apresenta alguns resultados esperados quando um experimento de recuo de força é conduzido para mostrar a saída típica a ser esperada quando o protocolo é bem executado.
Curvas de deslocamento de força
As parcelas representativas de recuo de força que foram obtidas recuando amostras vivas em uma posição colocada no centro da célula da zona de alongamento radicular são apresentadas na
Discussão
A mecânica celular e da parede celular está se tornando cada vez mais relevante para obter informações sobre como a mecânica afeta os processos de crescimento. À medida que as forças físicas se propagam por distâncias consideráveis nos tecidos sólidos, o estudo das mudanças nas propriedades físicas da parede celular e como elas são sentidas, controladas, ajustadas e impactam o crescimento da planta estão se tornando um importante campo de estudo 2,3,8
Divulgações
Os autores não têm conflitos de interesse. O script MATLAB usado para ajustar os dados está disponível mediante solicitação pessoal, escrevendo para J. C. B.
Agradecimentos
Esta investigação foi financiada pelo CSIC I+D 2018, bolsa n.º 95 (Mariana Sotelo Silveira).; CSIC Grupos (Omar Borsani) e PEDECIBA.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 x Phosphate-Buffered Saline (PBS) | Include sodium chloride and phosphate buffer and is formulated to prevent osmotic shock and maintain water balance in living cells. | ||
| AFM software | Bruker, Billerica, MA, USA | ||
| Atomic force microscopy (AFM) | BioScope Catalyst, Bruker, Billerica, MA, USA | ||
| Catalyst Probe holder-fluid | Bruker, Billerica, MA, USA | CAT-FCH | A probe holder for the Bioscope Catalyst, designed for fluid operation in contact or Tapping Mode. Also compatible with air operation. |
| Cryoscopic osmometer; model OSMOMAT 030 | Gonotech, Berlin, Germany | ||
| Murashige & Skoog Medium | Duchess Biochemie | M0221 | Original concentration, (1962) |
| Optical inverted microscope coupled to the AFM | Olympus IX81, Miami, FL, USA | ||
| PEGAMIL | ANAEROBICOS S.R.L., Buenos Aires, Argentina | 100429 | Neutral, non acidic silicone glue |
| Petri dishes | Deltalab | 200201.B | Polystyrene, 55 x 14 mm, radiation sterile. |
| Propidium iodide | Sigma | P4170 | For root viability test. |
| Silicon nitride probe, DNP-10, cantilever A | Bruker, Billerica, MA, USA | DNP-10/A | For force modulation microscopy in liquid operation. Probe tip radius of 20-60 nm. 175-μm-long triangular cantilever, with a spring constant of 0.35 N/m. |
| Tweezers | Sigma | T4537 |
Referências
- Anderson, C. T., Kieber, J. J. Dynamic construction, perception, and remodeling of plant cell walls. Annual Review of Plant Biology. 71, 39-69 (2020).
- Roeder, A. H. K., et al. Fifteen compelling open questions in plant cell biology. The Plant Cell. 34 (1), 72-102 (2022).
- Zhang, B., Gao, Y., Zhang, L., Zhou, Y. The plant cell wall: Biosynthesis, construction, and functions. Journal of Integrative Plant Biology. 63 (1), 251-272 (2021).
- Hamant, O., Haswell, E. S. Life behind the wall: Sensing mechanical cues in plants. BMC Biology. 15 (59), 1-9 (2017).
- Scheres, B., Benfey, P., Dolan, L. Root development. The Arabidopsis Book. 1, 0101 (2002).
- Cuadrado-Pedetti, M. B., et al. The arabidopsis tetratricopeptide thioredoxin-like 1 gene is involved in anisotropic root growth during osmotic stress adaptation. Genes. 12 (2), 236 (2021).
- Milani, P., Braybrook, S. A., Boudaoud, A. Shrinking the hammer: micromechanical approaches to morphogenesis. Journal of Experimental Botany. 64 (15), 4651-4662 (2013).
- Braybrook, S. A. Measuring the elasticity of plant cells with atomic force microscopy. Methods in Cell Biology. 125, 237-254 (2015).
- Bidhendi, A. J., Geitmann, A. Methods to quantify primary plant cell wall mechanics. Journal of Experimental Botany. 70 (14), 3615-3648 (2019).
- Desnos, T., et al. Procuste1 mutants identify two distinct genetic pathways controlling hypocotyl cell elongation, respectively in dark- and light-grown Arabidopsis seedlings. Development. 122 (2), 683-693 (1996).
- Fagard, M., et al. Procuste1 encodes a cellulose synthase required for normal cell elongation specifically in roots and dark-grown hypocotyls of arabidopsis. The Plant Cell. 12 (12), 2409-2423 (2000).
- Murashige, T., Skoog, F. A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum. 15 (3), 473-497 (1962).
- Perilli, S., Sabatini, S. Analysis of root meristem size development. Methods in Molecular Biology. 655, 177-187 (2010).
- Sader, J. E., et al. A virtual instrument to standardise the calibration of atomic force microscope cantilevers. Review of Scientific Instruments. 87 (9), 093711 (2016).
- Collinsworth, A. M., Zhang, S., Kraus, W. E., Truskey, G. A. Apparent elastic modulus and hysteresis of skeletal muscle cells throughout differentiation. American Journal of Physiology - Cell Physiology. 283 (4), 1219-1227 (2002).
- Mathur, A. B., Collinsworth, A. M., Reichert, W. M., Kraus, W. E., Truskey, G. A. Endothelial, cardiac muscle and skeletal muscle exhibit different viscous and elastic properties as determined by atomic force microscopy. Journal of Biomechanics. 34 (12), 1545-1553 (2001).
- Sirghi, L., Ponti, J., Broggi, F., Rossi, F. Probing elasticity and adhesion of live cells by atomic force microscopy indentation. European Biophysics Journal. 37 (6), 935-945 (2008).
- Peaucelle, A. AFM-based mapping of the elastic properties of cell walls: At tissue, cellular, and subcellular resolutions. Journal of Visualized Experiments: JoVE. (89), e51317 (2014).
- Peaucelle, A., et al. Pectin-induced changes in cell wall mechanics underlie organ initiation in Arabidopsis. Current Biology. 21 (20), 1720-1726 (2011).
- Fernandes, A. N., et al. Mechanical properties of epidermal cells of whole living roots of Arabidopsis thaliana: An atomic force microscopy study. Physical Review E. 85 (2), 21916 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados