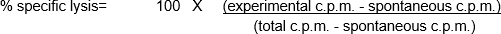Ensaio para Morte Celular: Ensaio de Liberação de Cromo para Avaliar a Capacidade Citotóxica
Visão Geral
Fonte: Frances V. Sjaastad1,2, Whitney Swanson2,3e Thomas S. Griffith1,2,3,4
1 Programa de Pós-Graduação em Microbiologia, Imunologia e Biologia do Câncer, Universidade de Minnesota, Minneapolis, MN 55455
2 Centro de Imunologia, Universidade de Minnesota, Minneapolis, MN 55455
3 Departamento de Urologia, Universidade de Minnesota, Minneapolis, MN 55455
4 Centro de Câncer Maçônico, Universidade de Minnesota, Minneapolis, MN 55455
Uma das principais funções das células do sistema imunológico é remover células-alvo que foram infectadas com vírus ou passaram por transformação em células tumorais. Ensaios in vitro para medir a capacidade citotóxica das células imunes têm sido um grampo em laboratórios por muitos anos. Esses ensaios têm sido usados para determinar a capacidade de células T, células NK ou qualquer outra célula imune para matar células-alvo de forma específica de antígeno ou -inespecífica. Ligantes de morte (por exemplo, ligante fas ou TRAIL), citocinas (por exemplo, IFNg ou TNF), ou grânulos citotóxicos (ou seja, perforina/granzyme B) expressos por células effectoras são algumas maneiras pelas quais a morte celular alvo pode ser induzida. Com a explosão na pesquisa de imunoterapia tumoral nos últimos anos, há um crescente interesse em encontrar agentes para aumentar a atividade citotóxica das células imunes para melhorar os resultados dos pacientes. Por outro lado, algumas doenças são marcadas pela atividade excessivamente exuberante da atividade citotóxica das células imunes, resultando em esforços para identificar agentes para temperar essas respostas. Assim, ter um ensaio no qual o usuário pode facilmente integrar qualquer número de células efeitos, células-alvo e/ou modificadores de resposta no design experimental pode servir como um meio valioso de avaliar rapidamente a capacidade citotóxica das células effectoras e/ou a capacidade de resposta da célula alvo.
Esses ensaios in vitro envolvem a mistura de diferentes populações celulares, bem como o uso de um número relativamente baixo de células-alvo e efeitos. Assim, uma necessidade do ensaio é rotular as células-alvo de uma maneira que possa ser facilmente detectada e quantitada, permitindo ao usuário determinar então a "por cento de lise específica" mediada pelas células effectoras. A radioatividade - especialmente, o cromo 51 (51Cr) na forma de Na251CrO4- é uma maneira barata de rotular rapidamente e sem especificação proteínas celulares dentro das células-alvo (1). Os tempos de rotulagem curta e ensaio total reduzem o potencial de mudanças significativas no número e/ou fenótipo das células-alvo, o que poderia influenciar o resultado do ensaio. Após a perda da integridade da membrana das células-alvo como resultado da atividade citotóxica das células effectoras, as proteínas celulares rotuladas por Cr de 51Cr dentro das células-alvo são liberadas na cultura sobrenante, tornando-se disponíveis para quantitação. Como em qualquer ensaio que examine a função das células imunes in vitro,há uma série de considerações importantes para considerar melhorar o desempenho do experimento. Uma das características mais críticas é usar células de efeito saudável (para atividade citotóxica máxima) e alvo (para resposta máxima e morte espontânea mínima/ liberação de51Cr). É necessário contato com o efeito e a célula alvo (levando ao uso comum de placas de fundo redondo de 96 poços para incentivar o contato celular) (2). Por fim, a análise dos dados depende da inclusão de populações celulares alvo de controle positivo e negativo.
O protocolo a seguir delineará as etapas para a realização de um ensaio de liberação padrão de 51Cr para medir a capacidade citotóxica de uma população de células efeitos, embora uma versão nãoradioativa usando europium tenha sido recentemente desenvolvida. 51 Cr é um poderoso emissor de radiação γ. Consequentemente, o uso deste ensaio requer treinamento adequado de segurança de radiação, espaço de laboratório dedicado, um contador gama e descarte de amostras radioativas.
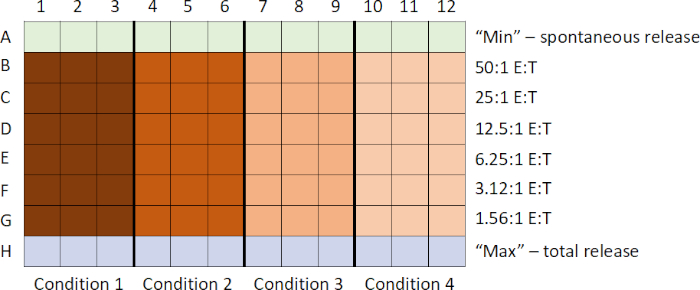
A sequência geral de eventos neste ensaio são: 1) preparar 51alvos rotulados por Cr; 2) preparar células de efeitos e adicionar à placa enquanto as células-alvo estiverem rotulando; 3) adicionar alvos rotulados à placa; 4) placa incubadora; 5) supernastas de colheita; e 6) analisar dados após a execução de amostras no balcão. As amostras são comumente preparadas em triplicado, e então mediadas para explicar quaisquer diferenças sutis de pipetação.
O EPI adequado é importante para este ensaio. Especificamente, o usuário deve usar um jaleco e luvas. Os óculos de segurança podem ser necessários com base no laboratório ou instituição. Deve haver ampla proteção de chumbo para armazenamento seguro e uso do 51Cr durante todas as etapas. Por fim, deve haver espaço de laboratório dedicado e equipamentos reservados para o uso de 51Cr, incluindo toda a sinalização adequada para indicar onde as amostras com 51Cr estão sendo mantidas e um contador Geiger equipado com sonda gama para examinar o espaço para possível contaminação.
Neste exercício de laboratório, determinaremos a capacidade das células mononucleares de sangue periféricos humanos (PBMCs), (CpG estimuladas vs. não estimuladas) para matar células de melanoma, usando a linha celular de melanoma humano WM793 como modelo e o ensaio de liberação de cromo.
Procedimento
Visão geral do procedimento
O típico ensaio de liberação de 51CR para medir a morte celular envolve as seguintes etapas:
- Primeiro, as células-alvo são rotuladas com Na2[51Cr]O4. Isso as distingue das células efeitos no ensaio.
- Enquanto as células-alvo estão rotulando, as células effectoras são coletadas e, usando a técnica de diluição serial, uma titulação decrescente das células de efeito é gerada em uma placa de
Resultados
Neste exemplo, células efeitosas estimuladas com CpG (Figura 1, círculos negros) mataram as células-alvo de forma mais eficaz, à medida que a proporção de células efeitos ou células-alvo aumentava. Esse aumento não foi observado nos PBMCs não estimulados (círculos brancos),indicando que a estimulação do CPG é necessária para o aumento observado da lise celular-alvo.
Log in or to access full content. Learn more about your institution’s access to JoVE content here
Aplicação e Resumo
O ensaio descrito aqui tem uma flexibilidade considerável, pois uma variedade de células-alvo e efeitos podem ser usadas dependendo da pergunta que está sendo feita. Por exemplo, a especificidade celular efeito ou celular pode ser determinada usando diferentes células-alvo ou o mecanismo de matança celular efeitoor pode ser determinado usando células deficientes em proteínas específicas ou usando inibidores específicos de proteínas. Um grande problema com o ensaio de liberação de 51Cr é o potencia...
Referências
- Brunner, K. T., Mauel, J., Cerottini, J. C. and Chapuis. B. Quantitative assay of the lytic action of immune lymphoid cells on 51Cr-labelled allogeneic target cells in vitro; inhibition by isoantibody and by drugs. Immunology, 14 (2):181-196, (1968).
- Kemp, T. J., B. D. Elzey, and T. S. Griffith. Plasmacytoid dendritic cell-derived IFN-alpha induces TNF-related apoptosis-inducing ligand/Apo-2L-mediated antitumor activity by human monocytes following CpG oligodeoxynucleotide stimulation. The Journal of Immunology, 171 (1): 212-218, (2003).
Pular para...
Vídeos desta coleção:

Now Playing
Ensaio para Morte Celular: Ensaio de Liberação de Cromo para Avaliar a Capacidade Citotóxica
Immunology
151.4K Visualizações

Citometria de Fluxo e Separação de Células Ativadas por Fluorescência (FACS): Isolamento de Linfócitos B Esplênicos
Immunology
93.1K Visualizações

Seleção de Células Ativadas por Magnetismo (MACS): Isolamento de Linfócitos T Tímicos
Immunology
22.9K Visualizações

Ensaios ELISA: Indireto, Sanduíche e Competitivo
Immunology
238.9K Visualizações

Ensaio ELISPOT: Detecção de Esplenócitos Secretores de IFN-γ
Immunology
28.5K Visualizações

Imunohistoquímica e imunocitoquímica: imageamento de tecidos via microscopia de luz
Immunology
79.1K Visualizações

Geração de anticorpos: produzindo anticorpos monoclonais usando hibridomas
Immunology
43.6K Visualizações

Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Immunology
53.9K Visualizações

Microscopia confocal de fluorescência: uma técnica para determinar a localização de proteínas em fibroblastos de camundongos
Immunology
43.3K Visualizações

Técnicas Baseadas em Imunoprecipitação: Purificação de Proteínas Endógenas Usando Esferas de Agarose
Immunology
87.8K Visualizações

Análise do Ciclo Celular: Avaliação da Proliferação de Células T CD4 e CD8 Após Estimulação Usando Coloração CFSE e Citometria de Fluxo
Immunology
24.3K Visualizações

Transferência de células adotivas: introduzindo esplenócitos de camundongos doadores para um camundongo hospedeiro e avaliando o sucesso via FACS
Immunology
22.5K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados