Análise do Ciclo Celular: Avaliação da Proliferação de Células T CD4 e CD8 Após Estimulação Usando Coloração CFSE e Citometria de Fluxo
Visão Geral
Fonte: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unidade de Linfísia, Departamento de Imunologia, Instituto Pasteur, Paris, França
2 INSERM U1223, Paris, França
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, França
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Pasteur Institute, Paris, França
O ciclo celular é um processo universal de vida. Durante o ciclo celular, uma célula sofre várias modificações para se dividir em duas células filhas. Esse mecanismo ocorre ao longo da vida de um organismo em resposta às suas necessidades. Divisões celulares e desenvolvimento embrionário produzem um organismo completo a partir de um zigoto unicelular. Durante a idade adulta, o ciclo celular é central para muitos processos biológicos críticos, como reparos teciduais.
Mecanismos de divisão celular são eventos fortemente controlados onde a célula sofre modificações stepwise antes da divisão final. As células que ainda não estão no ciclo são descritas como estando na fase Gap 0 (G0). Durante esta fase, a célula é considerada quiescente. Quando a célula começa a pedalar, quatro fases distintas são reconhecidas: Gap 1 (G1),Síntese (S), Gap 2 (G2) e Mitosis (M). A fase G1 é um ponto de verificação para os recursos necessários pela célula para a síntese de DNA. Em seguida, ocorre a fase S, e a replicação do DNA começa, seguida pela interfase G2, outro ponto de verificação que controla todos os elementos necessários para que a célula se divida. Finalmente, a célula entra na mitose e se divide em duas células filhas.
A divisão celular é um parâmetro altamente informativo em muitos sistemas biológicos diferentes. No campo da imunologia, a análise da proliferação de leucócitos pode indicar o mecanismo da resposta imune. Outros domínios da investigação também se baseiam na análise do ciclo celular. Por exemplo, a análise do ciclo celular durante o desenvolvimento do tumor melhorou nossa compreensão do câncer.
Muitos corantes fluorescentes estão agora disponíveis para rastrear a proliferação celular. Estes corantes diferem em suas propriedades químicas e espectrais. Existem duas classes diferentes de corantes: corantes proteicos se combinam permanentemente com proteínas formando uma ligação covalente, e corantes de membrana intercalam-se dentro das membranas celulares através de fortes associações hidrofóbicas. Estudos in vitro e in vivo de proliferação de células imunes por citometria de fluxo estão entre as aplicações mais comuns de ambas as classes de corantes de rastreamento celular (1, 2).
CFSE (Carboxyfluorescein succinimidyl é um corante fluorescente que marca células divisórias. Inicialmente, todas as células recebem a mesma quantidade de corante; dividindo células uniformemente dividir o corante que receberam entre suas duas células filhas. Consequentemente, o ciclo celular pode ser seguido pela diminuição progressiva da intensidade do corante nas células. A coloração do CFSE é seguida pela citometria de fluxo multiparamétrico convencional, uma tecnologia baseada em fluorescência de alto rendimento que permite caracterização fenotípica e funcional das células com base no seu grau de coloração de CFSE (3).
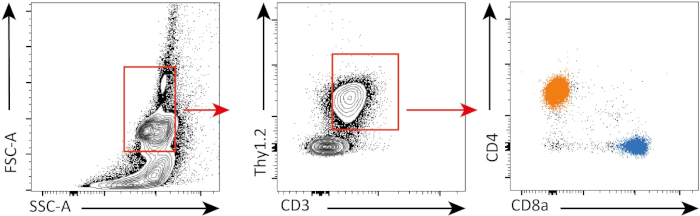
No experimento a seguir, avaliamos a proliferação de células CD4+ e CD8+ T in vitro,seguindo a estimulação do CD3, utilizando coloração de CFSE e citometria de fluxo.
Procedimento
1. Preparação
- Antes de começar, coloque luvas de laboratório e as roupas de proteção apropriadas.
- Esterilize todas as ferramentas de dissecção, primeiro com um detergente e depois com 70% de etanol e depois limpe-as completamente.
- Prepare 50 mL da solução de sal balanceada da Hank (HBSS) contendo 2% de soro fetal de bezerro (FCS).
2. Dissecção
- Usando um sistema de entrega de dióxido de carbono, eutanize o rato por
Resultados
Neste experimento, acompanhamos a proliferação de células BAçosa CD4+ e CD8+ T na cultura in vitro. Após 3 dias, não vimos forte proliferação em células CD4+ e CD8+ T com ou sem estimulação. Isso pode ser visto no painel superior da Figura 2 onde os picos de CSFE não estão diminuindo. No entanto, após 5 dias, começamos a ver proliferação em ambas as populações, o que é evidente a partir ...
Aplicação e Resumo
Ensaios de proliferação são frequentemente usados em diferentes campos, como a imunologia, para determinar o grau de ativação das células. Também é realizado no diagnóstico oncológico para determinar a agressividade tumoral em pacientes. A coloração de CFSE é uma técnica útil para acompanhar a proliferação das populações de células imunes ao longo do tempo. Outros métodos permitem a caracterização do ciclo celular. BrdU, um equivalente de CFSE é incorporado apenas em células divisórias. O modelo...
Referências
- Lyons, A. B. and Parish, C. R. Determination of lymphocyte division by flow cytometry. Journal of Immunological Methods. 171 (1): 131-37, (1994).
- Lyons, A. B. Analyzing cell division in vivo and in vitro using flow cytometric measurement of CFSE dye dilution. Journal of Immunological Methods. 243 (1-2), 147-154, (2000).
- Quah, B. J., Warren H. S., and Parish, C. R. Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester. Nature Protocols. 2 (9): 2049-56, (2007).
Pular para...
Vídeos desta coleção:

Now Playing
Análise do Ciclo Celular: Avaliação da Proliferação de Células T CD4 e CD8 Após Estimulação Usando Coloração CFSE e Citometria de Fluxo
Immunology
24.3K Visualizações

Citometria de Fluxo e Separação de Células Ativadas por Fluorescência (FACS): Isolamento de Linfócitos B Esplênicos
Immunology
93.1K Visualizações

Seleção de Células Ativadas por Magnetismo (MACS): Isolamento de Linfócitos T Tímicos
Immunology
22.9K Visualizações

Ensaios ELISA: Indireto, Sanduíche e Competitivo
Immunology
238.9K Visualizações

Ensaio ELISPOT: Detecção de Esplenócitos Secretores de IFN-γ
Immunology
28.5K Visualizações

Imunohistoquímica e imunocitoquímica: imageamento de tecidos via microscopia de luz
Immunology
79.1K Visualizações

Geração de anticorpos: produzindo anticorpos monoclonais usando hibridomas
Immunology
43.6K Visualizações

Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Immunology
53.9K Visualizações

Microscopia confocal de fluorescência: uma técnica para determinar a localização de proteínas em fibroblastos de camundongos
Immunology
43.3K Visualizações

Técnicas Baseadas em Imunoprecipitação: Purificação de Proteínas Endógenas Usando Esferas de Agarose
Immunology
87.8K Visualizações

Transferência de células adotivas: introduzindo esplenócitos de camundongos doadores para um camundongo hospedeiro e avaliando o sucesso via FACS
Immunology
22.5K Visualizações

Ensaio para Morte Celular: Ensaio de Liberação de Cromo para Avaliar a Capacidade Citotóxica
Immunology
151.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados