Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Visão Geral
Fonte: Thomas Chaffee1, Thomas S. Griffith2,3,4, e Kathryn L. Schwertfeger1,3,4
1 Departamento de Medicina de Laboratório e Patologia, Universidade de Minnesota, Minneapolis, MN 55455
2 Departamento de Urologia, Universidade de Minnesota, Minneapolis, MN 55455
3 Centro de Câncer Maçônico, Universidade de Minnesota, Minneapolis, MN 55455
4 Center for Imunology, University of Minnesota, Minneapolis, MN 55455
Análises patológicas de seções teciduais podem ser utilizadas para obter uma melhor compreensão da estrutura tecidual normal e contribuir para a compreensão dos mecanismos da doença. Biópsias teciduais, seja de pacientes ou de modelos in vivo experimentais, são frequentemente preservadas por fixação em formalina ou paraformaldeído e incorporação em cera de parafina. Isso permite que o armazenamento a longo prazo e os tecidos sejam seccionados. Os tecidos são cortados em seções finas (5 μm) usando um microtome e as seções são aderidas a lâminas de vidro. As seções teciduais podem ser manchadas com anticorpos, que permitem a detecção de proteínas específicas dentro das seções teciduais. A coloração com anticorpos conjugados a fluoroforos (também conhecidos como fluorochromes) - compostos que emitem luz em comprimentos de onda específicos quando excitados por um laser - é conhecida como imunofluorescência. A capacidade de detectar proteínas dentro de uma seção pode fornecer informações como heterogeneidade do tipo celular dentro do tecido, ativação de vias específicas de sinalização e expressão de biomarcadores. Dependendo dos fluoroforos utilizados e do tipo de microscópio disponível para análise, podem ser utilizadas múltiplas cores, o que permite a análise multiplexada dos alvos.
O protocolo a seguir descreve as etapas básicas envolvidas na coloração da imunofluorescência das seções de tecido incorporado parafina. É importante notar que este protocolo não incluirá detalhes sobre a fixação de tecido, processo de incorporação de parafina ou secção dos tecidos. Uma vez que os tecidos são seccionados e colocados em lâminas de vidro, eles são reidratados através de uma série de incubações de etanol classificado (EtOH). As seções são incubadas com um reagente bloqueador para reduzir a ligação não específica de anticorpos à seção tecidual. As seções são então incubadas com um anticorpo primário que pode ou não ser rotulado diretamente com um fluoróforo. Se o anticorpo primário não for rotulado diretamente, as seções são então incubadas com um anticorpo secundário rotulado com um fluoróforo. Diferentes anticorpos podem exigir diferentes condições de coloração, assim estão incluídas sugestões de otimização de anticorpos. Após a lavagem para remover todos os anticorpos desvinculados, os slides são montados com mídia contendo DAPI para rotular fluorescentemente o núcleo. Uma vez que a mídia de montagem secou, os slides podem ser imagens usando um microscópio com lasers que podem detectar os diferentes fluoroforos.
Procedimento
1. Configuração
- O protocolo de coloração típico envolve as seguintes etapas:
- Re-hidratando as seções teciduais nas lâminas usando uma série de etanols classificados.
- Incubando as seções teciduais com um tampão de bloqueio, o que ajudará a bloquear a ligação não específica de anticorpos ao tecido e reduzir a fluorescência de fundo.
- Removendo o tampão de bloqueio e incubando a seção em anticorpos primários, momento em que o anticorpo ligará seu alvo peptídeo.
Resultados
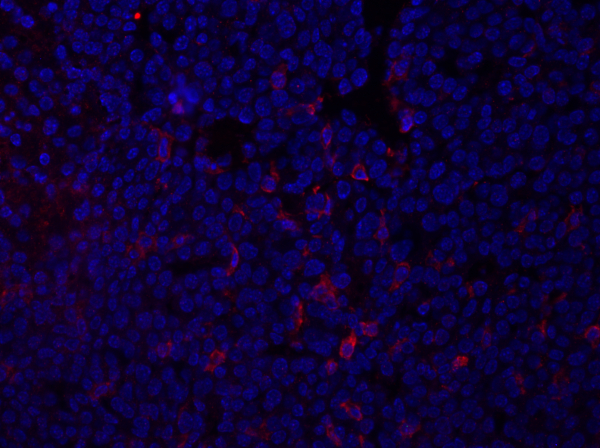
Figura 1: Mancha F4/80 de uma seção de tumor mamário. Após a fixação, um tumor mamário do rato foi seccionado e manchado com anti-F4/80 e montado usando uma mídia de montagem contendo DAPI. A coloração é mostrada pela mancha f4/80 da superfície celular em vermelho. Clique aqui ...
Aplicação e Resumo
A imunofluorescência permite a investigação da expressão proteica e localização no contexto de uma seção tecidual. Essa técnica pode ser usada para entender como os tecidos mudam no contexto da doença, examinando a localização de proteínas ou número celular em tecidos normais e doentes. Alterações na localização ou nos padrões de expressão podem ser determinadas e ligadas a atributos específicos das amostras.
Referências
- Im K, Mareninov S., Diaz MFP, Yong WH. An Introduction to Performing Immunofluorescence Staining. Yong W. (eds) Biobanking. Methods in Molecular Biology. 1897, Humana Press, New York, NY (2019)
- Ramos-Vara JA. Principles and Methods of Immunohistochemistry. Gautier JC. (eds) Drug Safety Evaluation. Methods in Molecular Biology. 1641, Humana Press, New York, NY (2017)
- Donaldson JG. Immunofluorescence Staining. Current protocols in Cell Biology. 69 (1):1 4.3.1-4.3.7. (2015)
Pular para...
Vídeos desta coleção:

Now Playing
Microscopia de imunofluorescência: Coloração por imunofluorescência de secções de tecido embebidos em parafina
Immunology
53.9K Visualizações

Citometria de Fluxo e Separação de Células Ativadas por Fluorescência (FACS): Isolamento de Linfócitos B Esplênicos
Immunology
93.1K Visualizações

Seleção de Células Ativadas por Magnetismo (MACS): Isolamento de Linfócitos T Tímicos
Immunology
22.9K Visualizações

Ensaios ELISA: Indireto, Sanduíche e Competitivo
Immunology
238.9K Visualizações

Ensaio ELISPOT: Detecção de Esplenócitos Secretores de IFN-γ
Immunology
28.5K Visualizações

Imunohistoquímica e imunocitoquímica: imageamento de tecidos via microscopia de luz
Immunology
79.1K Visualizações

Geração de anticorpos: produzindo anticorpos monoclonais usando hibridomas
Immunology
43.6K Visualizações

Microscopia confocal de fluorescência: uma técnica para determinar a localização de proteínas em fibroblastos de camundongos
Immunology
43.3K Visualizações

Técnicas Baseadas em Imunoprecipitação: Purificação de Proteínas Endógenas Usando Esferas de Agarose
Immunology
87.8K Visualizações

Análise do Ciclo Celular: Avaliação da Proliferação de Células T CD4 e CD8 Após Estimulação Usando Coloração CFSE e Citometria de Fluxo
Immunology
24.3K Visualizações

Transferência de células adotivas: introduzindo esplenócitos de camundongos doadores para um camundongo hospedeiro e avaliando o sucesso via FACS
Immunology
22.5K Visualizações

Ensaio para Morte Celular: Ensaio de Liberação de Cromo para Avaliar a Capacidade Citotóxica
Immunology
151.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados