Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Автоматизированный анализ Шолл оцифрованных нейронов морфологии в различных масштабах
В этой статье
Резюме
Мы разработали компьютерную программу для анализа нейронной морфологии. В сочетании с двумя существующими открытыми инструменты анализа источников, наша программа выполняет Шолл анализа и определяет количество невриты, точек ветвления и аксонов советы. Анализы выполняются так, что локальные изменения в морфологии аксонов можно наблюдать.
Аннотация
Neuronal morphology plays a significant role in determining how neurons function and communicate1-3. Specifically, it affects the ability of neurons to receive inputs from other cells2 and contributes to the propagation of action potentials4,5. The morphology of the neurites also affects how information is processed. The diversity of dendrite morphologies facilitate local and long range signaling and allow individual neurons or groups of neurons to carry out specialized functions within the neuronal network6,7. Alterations in dendrite morphology, including fragmentation of dendrites and changes in branching patterns, have been observed in a number of disease states, including Alzheimer's disease8, schizophrenia9,10, and mental retardation11. The ability to both understand the factors that shape dendrite morphologies and to identify changes in dendrite morphologies is essential in the understanding of nervous system function and dysfunction.
Neurite morphology is often analyzed by Sholl analysis and by counting the number of neurites and the number of branch tips. This analysis is generally applied to dendrites, but it can also be applied to axons. Performing this analysis by hand is both time consuming and inevitably introduces variability due to experimenter bias and inconsistency. The Bonfire program is a semi-automated approach to the analysis of dendrite and axon morphology that builds upon available open-source morphological analysis tools. Our program enables the detection of local changes in dendrite and axon branching behaviors by performing Sholl analysis on subregions of the neuritic arbor. For example, Sholl analysis is performed on both the neuron as a whole as well as on each subset of processes (primary, secondary, terminal, root, etc.) Dendrite and axon patterning is influenced by a number of intracellular and extracellular factors, many acting locally. Thus, the resulting arbor morphology is a result of specific processes acting on specific neurites, making it necessary to perform morphological analysis on a smaller scale in order to observe these local variations12.
The Bonfire program requires the use of two open-source analysis tools, the NeuronJ plugin to ImageJ and NeuronStudio. Neurons are traced in ImageJ, and NeuronStudio is used to define the connectivity between neurites. Bonfire contains a number of custom scripts written in MATLAB (MathWorks) that are used to convert the data into the appropriate format for further analysis, check for user errors, and ultimately perform Sholl analysis. Finally, data are exported into Excel for statistical analysis. A flow chart of the Bonfire program is shown in Figure 1.
протокол
1. Перед началом работы:
1) E18 крысы вскрытия:
Стандартные методы вскрытия E18 нейроны гиппокампа были ранее описаны 13. Для того чтобы использовать Костер программу для анализа морфологических характеристик невриты, 8 бит. TIF изображения отдельных нейронов должно быть получено. Это может быть достигнуто в ряде способами в зависимости от экспериментального протокола вы следуете. Нейроны могут быть покрыты при достаточно низкой плотности, так что отдельных нейронов появляются в поле микроскопа. Кроме того, чтобы изображение отдельных нейронов, которые выращены в плотной культуре, нейронов может быть трансфекции с использованием различных методов трансфекции плазмидой, кодирующей флуоресцентного белка.
2) Требования к программному обеспечению и установке:
- Плагин NeuronJ для программного обеспечения ImageJ от НИЗ и NeuronStudio оба должны быть установлены для того, чтобы запустить программу Костер. Программных пакетов можно найти на следующих сайтах:
ImageJ - http://rsbweb.nih.gov/ij/
NeuronJ - http://www.imagescience.org/meijering/software/neuronj/
NeuronStudio - http://research.mssm.edu/cnic/tools-ns.html - Костер программы можно найти на http://lifesci.rutgers.edu/ ~ Firestein. Руководство Костер пользователя также доступны на этом сайте. Кроме того, первоначальное описание Костер можно найти в Langhammer и др., цитометрии 2010 года. Все наши данные были проанализированы с использованием операционной системы Windows.
3) Разрешение изображения Изменение:
Вам нужно будет настроить Костер программу, основанную на изображение разрешение изображения, которые вы хотите проанализировать. В bonfire_parameters часть Костер программу, замените текущее значение переменной pix_conv со значением разрешения изображения (мкм / пиксель) ваших изображений.
2. Структура файла:
Для того, чтобы костер для анализа данных, файлы должны быть организованы в этой специфической структуры (рис. 2). Вас ждут:
- Мастер папки
- Вложенные папки (содержащих каждый из ваших различных условиях)
- Сотовые файлов изображений (filename.tif файлы), содержащиеся в различных папках состояние
- Костер папку, содержащую Костер Matlab mfiles (в том числе содержащихся в главной папке)
3. Трассировка Нейроны NeuronJ:
- Подготовка изображения для трассировки
- Откройте изображение, выбрав "Открыть" на панели инструментов NeuronJ и выбрав изображение, которое вы хотели бы вести.
- Изменение размера изображения, выбрав 'максимально' кнопку.
- Отрегулируйте яркость и контрастность изображения, так что вы можете визуализировать все невриты, выбрав пункт "Изображение" на панели инструментов NeuronJ выбрав "Настройка яркости / контраста.
- Трассировка тела клетки в NeuronJ и идентифицировать следы как "Тип 06"
- Выберите кнопку «Добавить Следы" на панели инструментов NeuronJ.
- Трассировка по всему периметру тела клетки.
- Выберите кнопку "Этикетка обводка» на панели инструментов NeuronJ.
- Выберите "N1" из "отслеживание ID 'выпадающего меню.
- "Тип 06" Выберите в NeuronJ: Атрибуты окна и выберите "OK".
- Трассировка нейритов в NeuronJ
- Выберите кнопку «Добавить Следы" на панели инструментов NeuronJ.
- Добавить следов вдоль каждой нейритов отрасли. Вы можете выбрать только дендриты или аксона, в зависимости от вашего эксперимента.
- Мы полагаем, что сегменты вы рисуете останавливаться на каждой точки ветвления, с каждой точкой дочь ветвь, начиная с этого момента, как новый след.
- Выберите кнопку "Сохранить обводка» на панели инструментов NeuronJ.
- Сохранить трассировки вы только что создали в той же папке, что и исходный файл изображения.
- Экспорт файлов трассировки и файл трассировки идентификатор из NeuronJ
Два типа файлов должны быть экспортированы из NeuronJ и сохраняются в соответствующие папки состояние вместе с. TIF и. NDF файлов.- Выберите кнопку «Экспорт трассировки" на панели инструментов NeuronJ.
- Выберите "Tab-deliminated текстовых файлов: отдельный файл для 'на' каждого трассировки NeuronJ: Экспорт" диалогового окна и выберите "OK".
- Разрешить NeuronJ выбрать имена файлов и место сохранения.
- Выберите кнопку "Мера обводка» на панели инструментов NeuronJ.
- Выберите "Показать трассировку измерения 'на' NeuronJ: Измерения" окна и выберите пункт "Выполнить".
- Выберите "Файл" в "NeuronJ: обводка» окна.
- Выберите "Сохранить как" и сохраните файл как filename_info. 'Имя_файла' должно в точности совпадать с именем исходного файла образа (включая капитализацию), а затем _info и не должен содержать 3-буквенный файл-расширения. Например, для оригинального Cell20.tif имя изображения, этот файл будет называться "Cell20_info. Убедитесь, что компьютер не добавляет автоматически. XLS расширения файла. Если это произойдет, расширение файла должно быть удалены вручную.
4. Используйте Костер построить Предварительные SWC файлов с данными NeuronJ.:
- Реорганизация папки с помощью 'bonfire_load'
- Открытое Matlab, дважды щелкнув по значку.
- Нажмите на кнопку "" в верхнем правом окне командной строки.
- Выберите 'Костер' папки в папку в мастер "Обзор папок" окно.
- Тип 'bonfire_load "в окне Matlab команду и нажмите клавишу ВВОД.
- Выберите условие папку, которую вы хотите проанализировать "Обзор папок" окна и выберите "OK".
- Это позволит реорганизовать структуру папок путем создания ячейки вложенные папки, содержащие все данные для каждой отдельной клетки.
- Создать filename_prelim.swc файлы с помощью "bonfire_ndf2swc '
- "Bonfire_ndf2swc 'Введите в окно командной строки и нажмите клавишу ввода.
- Выберите одну папку условии вы просто реорганизован с 'bonfire_load "в поле" Обзор папок "окна и выберите" OK ".
- Это создаст. SWC файл в каждой ячейке папку для выбранных условий. Каждая ячейка папки теперь содержит 5 файлов;. TIF оригинального изображения, NDF файл, _info идентификатор файла трассировки, текстовые файлы и SWC файл....
5. Используйте NeuronStudio завершить SWC файлов.:
- Открытые и калибровать нейрона изображений в NeuronStudio
- Открытое NeuronStudio программы.
- Выберите Файл → Открыть на панели инструментов NeuronStudio.
- Найти. TIF образ нейрона вы хотите изменить и откройте его.
- Выберите Run → Настройки и ввести '1 'в каждый из 3 (X, Y, Z) коробки в "окно Voxel Размер".
- Выберите Файл → Импорт SWC. Выберите подходящий. SWC файл. Файл изображения теперь будет с наложением следов изображения. Клетка сома должна быть обложен красным кругом.
- Используйте NeuronStudio связать нейритов
- Использование инструментов в NeuronStudio, чтобы правильно определить точки ветвления и конечные точки (мы рекомендуем вам ознакомиться с особенностями NeuronStudio и ярлыки, прежде чем анализировать ваши данные).
- В частности, использование "нейритов инструмент", чтобы присоединиться узлы так, чтобы:
- Каждая точка ветвления (желтый узлов) может создавать только два филиала
- Все следы непрерывных сомы (только один красный узел)
- Экспорт данных из NeuronStudio
- Выберите File → Save невриты (сохранить как имя по умолчанию).
- Проверьте наличие ошибок в. SWC файлы, используя 'bonfire_trace_check'
- "Bonfire_trace_check 'Введите в окно Mathlab команду и нажмите клавишу ВВОД.
- Выберите папку, содержащую условие данные, которые вы только что обработаны в "Обзор папок" окна и выберите "OK".
- Если Есть ошибки в одном из изображений в папке программы вывода изображения, где отображается ошибка находится.
- Исправления ошибок в NeuronStudio
- Откройте изображение, файл, сохраненный на экспорт шаг.
- Найдите и исправить проблему (ы).
- В меню Файл → Сохранить невриты.
- Повторите эти действия для других изображений, которые должны быть исправлены.
- Повторите 'bonfire_trace_check' (5,4).
6. Используйте 'костра' для извлечения данных из Морфологические SWC файлов.:
- "Костер" ввести в окно командной строки и нажмите клавишу ввода.
- Выберите условие папку, которая содержит данные, которые необходимо проанализировать в "Обзор папок" окна и выберите "OK".
- Костер анализа выдаст окно для каждого из нейронов, анализируются, в котором она графы нейронные морфологии, наряду с Шолл кольцах, используемых в анализе. Кроме того, команда "костер" будет генерировать. Коврик файл, который содержит все морфологические данные, которые были получены из анализа.
7. Используйте 'bonfire_results "для просмотра данных:
- Тип 'bonfire_results "в окно командной строки Matlab.
- Выберите папку для условий условие, которое вы хотите просмотреть в "Обзор папок" окна и выберите "OK".
- "Обзор папок" окно закроется временно и снова открыть, позволяющий выбрать дополнительные условия, вы хотели бы посмотреть.
- Когда вы закончили выбирать состояние папок выберите "Отмена" для выхода из процесса отбора.
- "Bonfire_results" выведет в том числе сводных диаграмм йэлектронных данных из условия выбранных вами папках.
8. Используйте 'bonfire_export' для экспорта данных в Excel:
- Тип 'bonfire_export "в окне командной строки.
- Выберите папку, содержащую условие данные, которые вы хотели бы экспортировать в "Обзор папок" окна и выберите "OK". Bonfire_export создаст Excel файлов морфологические данные и помещать их в состояние папку, которая была выбрана.
9. Представитель Результаты:
Пример данных, полученных в костер программы набор данных, содержащий два условия показано на рисунке 3. В данном примере условие 1 нейроны содержат больше нейритов дистальнее тела клетки. Это явление можно наблюдать на примере изображения (рис. 3В), а также в Шолл кривой общего дендритных беседки (рис. 3А) и в графе число конечных точек (рис. 3С). Кроме того, поскольку Костер Программа также выполняет Шолл анализ субрегионов изображений, мы можем определить более конкретно личность невриты, которые увеличили. И общее число пересечений порядка 3-й или более невриты (рис. 3F), а общее число как посредника и терминал невриты (рис. 3G) увеличиваются дистальнее тела клетки. Эти тенденции можно наблюдать и на рисунках 3D и 3E.

Рисунок 1:. Блок-схема программы Костер Нейроны прослежены с помощью ImageJ. Данные затем экспортируются и преобразуется Костер программу в предварительный характер. SWC файлов. NeuronStudio используется для определения подключения невриты. Костер проверяет на наличие ошибок, а затем вычисляет Шолл кривых, числа начальных, средних и высших нейритов порядке, и число точек ветвления аксонов и советы. Наконец, данные экспортируются в Excel для статистического анализа.
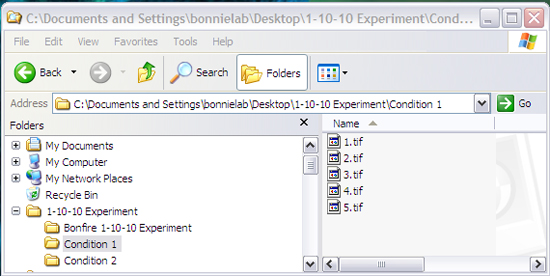
Рисунок 2: Структура файла, необходимые для Костер анализ структуры файла должно соответствовать той или программа не будет работать правильно.. Имена папок и файлов и количество папок и файлов могут быть изменены.
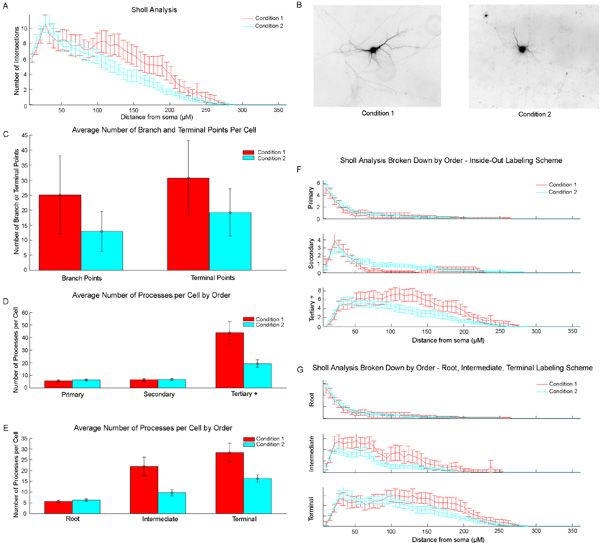
Рисунок 3: Пример вывода данных из программы Костер) Всего кривые Шолл.. B) Пример инвертированные изображения обоих условий. С) Среднее число точек ветвления и конечной точек / клетку. D) Среднее число процессов / ячейку для первичного, вторичного и третичного или больше невриты. E) Среднее число процессов / элемент для корневых, промежуточных и терминальных невриты. F) Сегмент личности конкретного анализа кривых Шолл. Сегменты сгруппированы как первичного, вторичного или третичного или выше. G) Сегмент личности конкретного анализа кривых Шолл. Сегменты сгруппированы как корень сегментов, промежуточные сегменты, или терминального сегмента.
Обсуждение
Костер программа полуавтоматической программа для анализа дендритов и аксонов морфологии. Это значительно повышает эффективность и точность анализа Шолл за выполнение анализа вручную. Кроме того, Костер Программа сохраняет данные на каждом шаге процесса, что позволяет проводить ауд...
Раскрытие информации
Авторы заявляют нет конкурирующих интересов. Финансовые учреждения не имели научную роль в развитии Костер.
Благодарности
Эта работа была частично поддержана Busch биомедицинских Грант, NSF гранта IBN-0548543, NSF гранта IBN-0919747, март Dimes фонд Грант 1-FY04-107, марте Dimes фонд Грант 1-FY08-464 (для BLF). МКК и CGL были поддержаны NIH биотехнологии Обучение Грант T32 GM008339-20, и CGL была также поддержана NJ Комиссии по исследованию спинного мозга Predoctoral стипендий 08-2941-SCR-E-0.
Материалы
| Name | Company | Catalog Number | Comments |
| NeuronJ plugin | http://www.imagescience.org/meijering/software/neuronj/ | ||
| ImageJ software | http://rsbweb.nih.gov/ij/ | ||
| Bonfire program | http://lifesci.rutgers.edu/~firestein | ||
| NeuronStudio | http://research.mssm.edu/cnic/tools-ns.html | ||
| MatLab Program | Mathworks |
Ссылки
- Elston, G. N. Pyramidal cells of the frontal lobe: all the more spinous to think with. J Neurosci. 20, (2000).
- Koch, C., Segev, I. The role of single neurons in information processing. Nat Neurosci. , 1171-1177 (2000).
- Poirazi, P., Mel, B. W. Impact of active dendrites and structural plasticity on the memory capacity of neural tissue. Neuron. 29, 779-796 (2001).
- Schaefer, A. T., Larkum, M. E., Sakmann, B., Roth, A. Coincidence detection in pyramidal neurons is tuned by their dendritic branching pattern. J Neurophysiol. 89, 3143-3154 (2003).
- Vetter, P., Roth, A., Hausser, M. Propagation of action potentials in dendrites depends on dendritic morphology. J Neurophysiol. 85, 926-937 (2001).
- Hausser, M., Spruston, N., Stuart, G. J. Diversity and dynamics of dendritic signaling. Science. 290, 739-744 (2000).
- Brette, R. Simulation of networks of spiking neurons: a review of tools and strategies. J Comput Neurosci. 23, 349-398 (2007).
- Arendt, T., Zvegintseva, H. G., Leontovich, T. A. Dendritic changes in the basal nucleus of Meynert and in the diagonal band nucleus in Alzheimer's disease--a quantitative Golgi investigation. Neuroscience. 19, 1265-1278 (1986).
- Harrison, P. J. The neuropathology of schizophrenia. A critical review of the data and their interpretation. Brain. 122, 593-624 (1999).
- Lewis, D. A., Glantz, L. A., Pierri, J. N., Sweet, R. A. Altered cortical glutamate neurotransmission in schizophrenia: evidence from morphological studies of pyramidal neurons. Ann N Y Acad Sci. 1003, 102-112 (2003).
- Kaufmann, W. E., Moser, H. W. Dendritic anomalies in disorders associated with mental retardation. Cereb Cortex. 10, 981-991 (2000).
- Georges, P. C., Hadzimichalis, N. M., Sweet, E. S., Firestein, B. L. The yin-yang of dendrite morphology: unity of actin and microtubules. Mol Neurobiol. 38, 270-284 (2008).
- Firestein, B. L. Cypin: a cytosolic regulator of PSD-95 postsynaptic targeting. Neuron. 24, 659-672 (1999).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены