Method Article
Сплит BioID — Протеомного анализа контекстно зависимых белковых комплексов в их родной среде сотовой
В этой статье
Резюме
Мы предоставляем пошаговые протокол для Сплит BioID, фрагменты дополнения assay протеина, основанный на близость маркировка технику BioID. Активирован на взаимодействии двух данного белков, он позволяет протеомики анализ контекстно зависимые белковых комплексов в их родной среде сотовой. Метод простой, экономически эффективных и только требует стандартного лабораторного оборудования.
Аннотация
В дополнение к существующим очищение сродства (AP) подходит для идентификации белок белковых взаимодействий (PPI), введены ферменты, которые позволяют маркировки близости зависимых белков в живых клетках. Один из таких фермента, бира * (используется в BioID подход), опосредует biotinylation белков в диапазоне приблизительно 10 Нм. Следовательно когда сливается с протеином интереса и выразил в клетках, он позволяет маркировки проксимальной белков в их родной среде. В отличие от AP, которая опирается на очищение собрал белковых комплексов BioID обнаруживает белки, которые были отмечены в пределах ячейки независимо от того, ли они по-прежнему взаимодействовать с протеина интереса когда они изолированы. Поскольку это biotinylates проксимального белков, Кроме того можно капитализировать исключительных схожести стрептавидина биотина очень эффективно изолировать их. Хотя BioID выполняет лучше, чем AP для выявления временных или слабого взаимодействия, оба AP - и BioID масс спектрометрии подходы обеспечивают обзор всех возможных взаимодействий, у данного белка. Однако они не представить информацию о контексте каждого выявленных PPI. Действительно большинство белков, обычно являются частью нескольких комплексов, соответствующий собственный созревания шаги или различных функциональных подразделений. Для решения этой общей ограничения обоих методов, мы инженерии пробирного комплементарности фрагменты белков, основанный на фермент бира *. В этот assay два неактивных фрагменты Бира * можно собрать в активный фермент когда принес в непосредственной близости от двух взаимодействующих белков, к которым они сплавлены. Таким образом, итоговый Пробирная Сплит BioID позволяет маркировки белков, которые собирают вокруг пары взаимодействующих белков. Условии, что эти два взаимодействовать только в заданном контексте, Сплит BioID затем позволяет анализ конкретных контекстно зависимом функциональных подразделений в их родной среде сотовой. Здесь мы предоставляем пошаговые протокол для тестирования и применять Сплит BioID к паре взаимодействующих белков.
Введение
Как наиболее клеточной функции выполняются белки, которые динамически собрать макромолекулярных комплексов, идентификации белок белковых взаимодействий (PPI) стремится основных в биомедицинских исследований. Действительно PPI часто дерегулирование в болезни и представляют собой потенциальные цели для терапии1. Наиболее широко используемый метод для идентификации PPI является сродства очищения (AP) подход, при котором, после лизиса клеток, протеин интереса специально очищенная на матрицу и связанные протеины впоследствии идентифицируются по масс-спектрометрии (МС). В то время как AP-МС представляет собой мощный подход, он обычно не хорошо работать на слаборастворимых белковых комплексов, очень переходных взаимодействия или PPI, которые требуют нетронутыми субцеллюлярные структуры. Кроме того интерпретация данных может быть осложнено динамичный характер сетей PPI, как один белок часто является частью нескольких различных белковых комплексов.
Близость маркировки методы, такие как BioID2 или3,APEX24 недавно были разработаны для решения некоторых ограничений AP-MS подходов. В BioID фермент Бира * (соответствующий к G115R варианту фермента дикого типа E. coli ) катализирует образование лабильной biotinyl-AMP (био AMP) которые могут реагировать с первичных аминов. В отличие от дикого типа фермента, который сохраняет био AMP в его активным центром, бира * выпускает био AMP, позволяя ее распространения его соседние среды. Следовательно когда сливается с протеином интереса и выразил в клетках, проксимальной белков может быть биотинилированным в пределах диапазона примерно 10 Нм5. Эти отмеченные проксимальной белки затем изолируются пулдаун стрептавидина и выявленные МС. В отличие от AP-MS BioID требуется выражение синтез белка. Он может таким образом применяться только к протеинам, чьи функции не препятствует пометки. Кроме того, скорость маркировки медленно, обычно 6 – 24 h2,6, делая сложным обнаружение короткоживущих белков. Тем не менее, по сравнению с AP-MS, BioID-MS предлагает несколько ключевых преимуществ: во-первых, его захватывает взаимодействия в их родной клеточной среды; Во-вторых, обозначенные протеины, вместо того, чтобы собранные комплексы изолированы после лизиса клеток; в-третьих стрептавидина pulldowns позволяют использовать денатурируя буферов и суровых Стиральная условий. Следовательно метод является более чувствительным, чтобы обнаружить переходных или слабого взаимодействия7 или взаимодействия, которые происходят на конкретную и трудно изолировать субцеллюлярные структуры8.
Однако большинство белки обычно являются частью более крупных комплексов, которые можно реконструировать зависимости клеточных сигналов или функции, которую необходимо выполнить. Следовательно один белок обычно является частью нескольких комплексов, соответствующих отдельных функциональных подразделений, с участием различных и/или перекрывающихся PPI. Оба подхода дать обзор всех ассоциаций, у данного белка, но они не выступить контексте отдельных PPI. Чтобы увеличить разрешение последнего, мы разработали фрагменты белка дополнения анализа (СПС) в которой две неактивные фрагменты Бира * (NBirA *, содержащий каталитического домена, и CBirA *, который можно рассматривать как повторной активации домена) могут собрать в активный фермент когда принес в непосредственной близости от двух взаимодействующих белки9. Близость зависимой biotinylation итоговый Пробирная Сплит BioID посвящен белки, которые собрать вокруг пары взаимодействующих белков и таким образом позволяет определить контекст зависимых белков сборок. Недавно мы продемонстрировали выдающиеся разрешающая способность Сплит BioID путем урегулирования двух различных белковых комплексов, участвующих в путь Мирна опосредованного подавления экспрессии гена9.
В общей сложности в единый и простой assay, Сплит BioID позволяет открывать и специально назначать определенные функциональные единицы, в которых данный белок является участие, при условии, что дополнительный протеин соответствующего белка комплекс известен PPI.
протокол
Примечание: На рисунке 1показан обзор метода.
1. Планирование клонирования стратегии
- Выберите два предположительно взаимодействующих белки для проверки.
Примечание: Каждый из двух белков будет сливается в один фрагмент Сплит BioID: NBirA * или CBirA *. Как отрицательный контроль, протеины сплавливания CBirA * будет испытываться с NBirA * сливается с Зеленый флуоресцентный белок (NBirA *-ГФП). Как дополнительный элемент управления NBirA * сплавливания может испытываться отдельно, без родственных CBirA * фьюжн или в сочетании с CBirA * сливается с несвязанными белка. Это не целесообразно использовать CBirA *-GFP как отрицательный контроль, как это было показано неизменно приведет к основной фон при сочетании для любого NBirA * синтеза белка9. Причиной этого наблюдения может быть уровень экспрессии CBirA *-GFP, намного выше, чем любой другой CBirA * протеины сплавливания мы использовали до сих пор, которые могут привести к значительным всех с фрагмента NBirA. -
После того, как выбраны две белки, проверьте литературы найти ли оба уже были успешно помечены в функциональных исследований (например, GFP-тегами синтез белка).
- Если такие исследования существует, отметить положение тега (в N - или C-конечная) и использовать ту же ориентацию для протеинов интереса с фрагментами Сплит BioID.
- Если нет такого исследования существует, план конструкции кодирования для обоих белков меткой в N - и C-конечная и план assay для тестирования функциональности синтез белков (например, спасение эксперимент в линии клетки истощены для белка WT).
Примечание: При сопряжении двух протеины сплавливания с помощью плазмидов, описанные на рис. 2 , которые кодируют длинные гибкие компоновщики, ориентация синтез белков (Бира * фрагменты плавленого вверх или вниз по течению от протеинов интереса) обычно не имеет значения . Действительно, с помощью FRB и FKBP как модель белки, было показано, что все четыре возможных итераций (обоих фрагментов на N-Термини, как на C-Термини, один в N-го и другой C-окончание и наоборот) дают сопоставимые biotinylation9.
- Дизайн праймеров для того чтобы усилить ORFs двух протеинов интереса для клонирования в Сплит BioID плазмиды. Обратите внимание, что перевод кадры являются так же, как фрагменты бира *. Если плазмид, описанные на рис. 2, используйте энзимы ограничения PmeI и Голд для построения CBirA * фьюжн и ферменты ЛАСЦ и MluI для синтеза NBirA *.
Примечание: Плазмиды, изображенный на рисунке 2 нести двунаправленным тет отзывчивым элемент, обрамленная F3/FRT рекомбинации сайтов. Это позволяет регулируемых Сопредседатель выражение примерно на том же уровне как синтез белков из же плазмида10и возможность быстро построить стабильных клеточных линий в рекомбинации опосредованной кассеты exchange (RMCE). В эти плазмиды NBirA * имеет тег myc при CBirA * имеет тег флаг. Конечно же ORFs можно клонировать на индивидуальных плазмиды с учредительным промоутеров.
Критически важный шаг: При тестировании двух взаимодействующих белков, рекомендуется сравнить NBirA * сливается с протеин 1 в сочетании с CBirA * сливается с белка 2, и NBirA * сливается с белка 2 в сочетании с CBirA * сливается с протеин 1. Действительно это часто наблюдается, что одна итерация работает лучше, чем другие.
2. клонирование ORFs генов интерес в плазмиду Сплит BioID
Примечание: В этом примере рассматриваются две белки, которые могут быть помечены в N-terminus. Четыре условия будут проверены и по сравнению с не transfected клеток (Таблица 1).
- Использование полимеразной цепной реакции (ПЦР) для того чтобы усилить ORFs двух белков тестирование с соответствующей грунтовки. Дизайн грунты, которые вводят ЛАСЦ и MluI места ограничения для синтеза белков NBirA * и Голд и PmeI сайты для синтеза белков CBirA *.
Примечание: ПЦР может выполняться с любых коммерческих, преференциально корректуры, ДНК-полимеразы. Следуйте стандартным протоколом от руководства и адаптировать его к температуры плавления праймеров и длина ORF быть усилена в соответствии с рекомендациями производителя. -
Subclone первый ORF
- Дайджест плазмида (около 2 мкг) и ПЦР усиливается ORF1 (чтобы быть сливается с NBirA *) с ClaI и MluI. Выполнять пищеварение реакции с использованием 1 мкл каждого фермента, смешанного с соответствующим объемом буфера ДНК и реакция в общем объеме 20 мкл в 1,5 мл трубку в течение 1 ч при 37 ° C.
- Запустите оба пищеварение образцы на 1% гель агарозы ТЭ ДНК. Акцизный полосы, соответствующие переваривается плазмиды и ORF1 с чистой скальпель и передачи для 1.5 мл пробирок.
- Очищайте обе полосы, с помощью стандартного комплекта экстракции ДНК.
- Перевязать переваривается плазмиды и ORF1 с использованием стандартных реагентов.
- Если с помощью комплекта лигирование указано в Таблица материалов, перевязать 100 нг ДНК, содержащего три-пять раз Молярная избыток вставить над плазмида в общем объеме 4,5 мкл. Добавьте 5 мкл 2 x T4 лигаза буфера и 0,5 мкл T4 ДНК лигаза из комплекта перевязки. Выполните реакции перешнуровки в 1,5 мл на 10 мин при комнатной температуре (RT).
- Преобразуйте в стандартные DH-5α E. coli сведущие клетки (подготовлен согласно Иноуэ метод11).
- Mix 3 мкл реакции перешнуровки с 50 мкл компетентных клеток в 1,5 мл трубки на льду и Инкубируйте 30 мин передачи клетки тепла блокировать набор до 42 ° C за 30-45 s и затем инкубировать обратно на льду 2 мин добавить 250 мкл подогретым (37 ° c) lysogeny бульон (LB) среднего и пластины 100 мкл клеток на плите ампициллин содержащих LB-агар подогретым (37 ° C). Инкубировать клетки на ночь на 37 ° C.
- На следующий день выбрать четыре-шесть колоний и инкубировать их при 37 ° C, 180 об/мин, ночевка в 3 мл LB носитель, содержащий 100 ампициллин-1 μg⋅mL в 15 мл.
- Изолируйте плазмиды от взял колоний, с использованием стандартного комплекта алкалический ДНК.
- Проверьте правильность плазмид Сэнгером виртуализации с помощью обратного грунтовка 2 кассеты (Таблица 2).
- После того, как была обнаружена плазмида, содержащий первый ORF, subclone второй ORF в этом плазмида, после же шаги, что шаг 2,2, но используя ферменты PmeI и Голд.
- Последовательность результате плазмид, используя обратный грунтовка кассеты 1 (Таблица 2).
3. Тестирование синтеза белков
Примечание: Приведенные ниже инструкции предназначены для двойной индуцибельной выражение плазмид (рис. 2) и HeLa-11ht клеток, subclonal линия клетки HeLa-CCL2, стабильно выражая обратной транскрипции, контролируемые тетрациклин активатор rtTA м2 и содержащие Локус RMCE12. Среднего роста для этих клеток является Дульбекко изменение орла среднего (DMEM) содержащий 10% свободной тетрациклин плода бычьим сывороточным (ФБС). При использовании другого типа клеток, точного высева условий и среднего роста будет нужно быть адаптированы.
-
Переходных Трансфекция
- Клетки семян в концентрации 1 х 105 клеток в 2 мл на хорошо шести ну плиты за день до transfection и инкубации клеток на ночь при 37 ° C, 5% CO2 в инкубатор культуры клеток.
- В день трансфекции удалить среды каждой скважины и заменить 2 мл свежей среды.
- Подготовьте четыре трансфекции реакции согласно таблице 1. Для каждой скважины для transfect добавьте 6 мкг polyethylenimine 3 мкг плазмидной ДНК в 1,5 мл стерильной пробирке и заполнить до 500 мкл с среде DMEM без сыворотки.
- Инкубируйте каждый трансфекции микс по крайней мере 5 минут при комнатной температуре перед добавлением падение мудрый в каждой скважине. Инкубируйте клетки на ночь при 37 ° C, 5% CO2.
-
Индукция и близость маркировки
- На следующий день после трансфекции, удалите среды и замените среднего, дополненная биотина в 50 мкм для стимулирования biotinylation и доксициклин в 200 ng⋅mL−1 побудить выражение синтеза белков. Инкубируйте клетки для по крайней мере 20 ч при 37 ° C, 5% CO2.
- Чтобы сделать Стоковый раствор биотина, распустить биотина в 50 mg⋅mL-1 (соответствуют ca. 200 мм) в 2 М Гидроксид аммония. После того, как он полностью не растворится, разбавляют до 50 мм, 500 мм Hepes, рН 7,4, а затем скорректировать рН 7,4 с HCl. Алиготе и хранить полученный 1000 x Стоковый раствор при температуре-20 ° C. Растворите доксициклин в 10 mg⋅mL-1 в 70% этиловом спирте и в магазине в колпачок Микропробирка при-20 ° C в темноте.
- На следующий день после трансфекции, удалите среды и замените среднего, дополненная биотина в 50 мкм для стимулирования biotinylation и доксициклин в 200 ng⋅mL−1 побудить выражение синтеза белков. Инкубируйте клетки для по крайней мере 20 ч при 37 ° C, 5% CO2.
-
Подготовка lysate клетки
- Вымойте клетки один раз с 1 мл холодного (4 ° C) фосфат амортизированное saline (PBS).
- Для каждой скважины 100 мкл буфера lysis (50 мм трис рН 7,4, 150 мм NaCl, 2 ЭДТА, 0,5% NP-40, 0.5 мм DTT и ингибиторы протеазы).
- Урожай клетки с ячейки скребков и передачи для 1.5 мл пробирок.
- Центрифугуйте образцы на 14 000 x g 10 мин при 4 ° C для удаления мусора ячейки.
- Передать supernatants свежий трубы и место на льду.
- Определение белка сумм с assay Брадфорд.
-
Электрофорез геля полиакриламида SDS (страница) и Западный blotting
- Подготовка геля SDS-полиакриламида.
- Для каждого очищается lysate, подготовить образец страницы 30 мкг (минимум 15 мкг) белка в общей сложности 30 мкл буфера SDS-загрузки. Затем загрузить равные суммы на геле полиакриламида SDS каждого образца (20 мкл/а) и провести электрофорез.
- После электрофореза передать низкий флуоресценции блот PVDF мембрану, используя любой стандартный протокол фракционированный белков.
Примечание: Для анализа белка biotinylation, время передачи 10 мин с «высокой МВт» программы быстрого переноса полусухое, которую западной blotting устройства обычно хорошо работает. - После передачи блокировать мембрану в сухое молоко 5% в PBS для 30 мин на RT.
- Проинкубируйте мембрану на 30 – 60 минут на RT с флуоресцентные стрептавидина конъюгата разбавленных 1:15,000 в PBS, содержащий 2% BSA и 0,1% Tween-20.
- Промойте мембрану три раза, каждый за 10 мин, PBS, содержащие 0,1% Tween-20, а затем один раз больше с PBS.
- Проверьте мембрану в системе флуоресценции сканер изображений.
Примечание: A типичной западной помарке показана на рисунке 3. Вышеуказанная процедура описывает обнаружение на основе люминесцентных, но на основе свечения обнаружения, с помощью HRP-сочетании стрептавидина работает одинаково хорошо.
4. Сплит BioID для протеомики исследований
Критическое Примечание: Для окончательного анализа масс-спектрометрических, все следующие шаги должны быть выполнены в кератин свободных условиях, все материалы и реагенты должны быть как кератин свободной, насколько возможно.
- Переходных Трансфекция
- За день до трансфекции, семян три или четыре 10 см пластины для каждого условия в концентрации клеток5 8 x 10 в 10 мл на тарелку и инкубации клеток на ночь при 37 ° C, 5% CO2 в инкубатор культуры клеток.
- На следующий день, готовят смесь мастер трансфекции для каждого трансфекции условия: для трех пластин на условие, 36 мкг polyethylenimine и 18 мкг плазмидной ДНК растворяют в 900 мкл DMEM сыворотки бесплатно. Инкубировать каждый мастер смесь для по крайней мере 5 минут на RT.
- В то же время, замените свежим среднего среднего каждое блюдо, а затем добавьте 300 мкл каплю смеси трансфекции, мудрый для каждой пластины.
- Инкубируйте клетки на ночь при 37 ° C, 5% CO2.
- Индукция и близость маркировки
- На следующий день после трансфекции, передачи клетки до 15 см блюд. Для каждого блюдо Снимите носитель, вымыть клетки с 7 мл PBS, добавить 1,5 мл раствора трипсина ЭДТА и Инкубируйте 5 мин на RT. Добавить 3,5 мл роста средних Ресуспензируйте клетки и передачи суспензию клеток на 15 см блюдо, заполнены с 20 мл среднего роста дополненная биотина в 50 мкм для стимулирования biotinylation и доксициклин в 200 ng⋅mL−1 (окончательный концентрации) чтобы побудить выражение синтеза белков.
- Инкубируйте клетки для по крайней мере 20 ч при 37 ° C, 5% CO2.
- Заготовки и хранения клеток
- Вымыть клетки дважды с PBS, затем добавить 1,5 мл PBS на каждой пластине и урожай клетки с скребков.
- Передача заготовленных клеток, соответствует одно условие в 15 мл трубку и собирать их центрифугированием на 1200 x g, 5 мин., 4 ° C.
- Удаление supernatants и оснастки заморозить гранулы в жидкий азот, а затем хранить при 80 ° C до дальнейшей обработки.
Примечание: в качестве альтернативы, клетки могут также быть разделенные trypsinization, собирают в среднего роста, переданы 15 мл и промывают три времени с PBS до замораживания.
- Подготовка lysates клетки
- Ресуспензируйте гранулы клеток в 1 мл буфера lysis (50 мм трис рН 7,4, 500 мм NaCl, 0,4% SDS, 5 мм ЭДТА, 1 мм DTT, 1 x ингибитор протеазы полный) RT. перевал клетки 10 – 20 раз (5-10 ударов) через иглу 25 G.
- Sonicate образцы с устройством озвучивания.
Примечание: С устройством озвучивания, указанных в Таблице материалов, следующая программа может использоваться: четыре цикла при высокой интенсивности, 30 s за цикл в холодной (4 ° C) водяной бане. Любое другое устройство озвучивания подходит, но возможно, потребуется соответствующим образом скорректировать параметры. - Добавить X-100 Тритон для восстановления sonicated lysate до конечной концентрации 2% (как правило, добавить 100 мкл 20% Тритон X-100 до 900 мкл sonicated lysate клетки) и затем 2.3 мл 50 мм трис, рН = 7,4 на 1 мл lysate регулировка концентрации NaCl до 150 мм до b ЗЫСКАНИЕ сочетании стрептавидина бисером.
Критическое Примечание: Более высокие концентрации соли часто приводит к гораздо менее эффективной привязки к бисеру. - Распространить скорректированный лизатов в 1,5 мл пробирок (ca. 1,1 мл три пробирки) и центрифуги их на 16000 x g, 10 мин, 4 ° C.
- Передача supernatants (ca. 3,2 мл) 15 мл трубки, и держать 50 – 100 мкл в качестве ввода материала.
- Измерить концентрацию каждого образца с assay Брадфорд и использовать эквивалент содержание 3-3,5 мг белка для стрептавидина пулдаун.
- Стрептавидина пулдаун
Примечание: Обзор процедуры пулдаун показана на рисунке 4. Он практически идентичен оригинальный протокол, опубликованной2ру и коллег. Впервые проводится пулдаун, образцы потока через и вымыть 1 – 4 может быть отложить в сторону для Западный анализ помаркой для обеспечения процедура работала правильно (рис. 5).- Для каждого условия передачи 200 мкл сочетании стрептавидина магнитной бусины подвеска в 1,5 мл трубку. Трубы на магнитные стойки, ждать до тех пор, пока бисер палку на стороне трубы (ca. 1 мин) и удалить буфер хранения.
- Вымойте бисер, аккуратно смешивая с 1 мл раствора уравновешивания буфера (50 мм трис рН 7-4, 150 мм NaCl, 0,05% Тритон X-100 и 1 мм DTT).
- Направить уравновешенной бусины в равном количестве в необходимое количество трубок (обычно когда начиная с 3-3,5 мг белка контента, лизатов от каждого состояния могут быть доставлены в два-четыре 1,5 мл пробирок) и место обратно на магнитные стойки.
- Удалить в буфер уравновешивания и Ресуспензируйте каждый набор из бисера с равное количество соответствующего lysates клетки от шага 4.4.7. Инкубируйте на ночь при 4 ° C на вращающееся колесо.
- На следующий день место 1.5 мл пробирок на магнитные стойки, подождать, пока бисер палку в сторону трубы и передать supernatants 15 мл трубки помечены как поток через.
Примечание: Теперь все шаги выполняются при комнатной температуре если не указано иное. - Ресуспензируйте бисер в каждой тюбике с 200 мкл буфера мытья 1 (2% SDS в воде) и объединить каждый набор ресуспензированы бусы, соответствует одно условие в 1,5 мл пробирок.
- Вымойте бусины дважды за 8 минут на вращение колесо с 1 мл раствора мыть буфера 1.
- Мыть бусины дважды за 8 минут на вращение колесо с 1 мл раствора мыть буфера 2 (50 мм HEPES рН 7,4, 1 мм ЭДТА, 500 мм NaCl, 1% тритон X-100, 0.1% Na Дезоксихолат).
- Мыть бусины дважды за 8 минут на вращение колесо с 1 мл буфера мытья 3 (10 мм трис рН 8, 250 мм LiCl, 1 ЭДТА, 0,5% NP-40 и 0,5% Na Дезоксихолат).
- Мыть бусины дважды за 8 минут на вращение колесо с 1 мл раствора мыть буфера 4 (50 мм трис рН 7,4, 50 мм NaCl, 0.1% NP-40).
- Чтобы убедиться, что мыть буфер полностью удаляется после того, как последний шаг вымыть, удалить большую часть супернатанта и затем уменьшается образцы. Положил их обратно на магнитные стойки, подождать, пока бисер палку в сторону трубы и затем удалите оставшиеся буфера.
- Добавить 30 мкл буфера (10 мм трис рН 7,4, SDS 2%, 5% β-меркаптоэтанол и 2 мм биотин) корда. Инкубируйте на 98 ° C в течение 15 минут, а затем немедленно удалить бусы на магнитные стойки.
- Передать eluted образца свежей трубки и хранить при температуре от-20 ° C до дальнейшей обработки.
- SDS-PAGE и Западный blotting
Примечание: Перед анализом масс-спектрометрии, рекомендуется оценить успех biotinylation и выпадающих SDS-PAGE и западную помарку. Если шаблон не biotinylation наблюдается, что можно считать что dox или биотин не был добавлен к средству или что один из двух акций решений находится под угрозой.- Для каждого образца Подготовьте смешиванием равных количеств белка образца с соответствующим объемом 3 x SDS-загрузки буфера в общей сложности 28 мкл пример страницы. Подготовка страницы образцов путем смешивания 5 мкл каждого образца элюирование с 2,5 мкл 3 x SDS-загрузки буфера.
- Загрузите образцы (25 мкл/хорошо для входов, 7 мкл/хорошо для элюции образцов) на геле полиакриламида SDS. Перейти к электрофореза и Западный blotting, как описано в разделе 3.4.
- Если выполнение выпадающих в первый раз, подготовить страницы образцы для каждого шага пулдаун (вход, поток через, мыть 1 – 4, элюирование) путем смешивания 20 мкл каждого образца (вход, поток через, мыть 1 – 4) с 10 мкл 3 x SDS-загрузки буфера или 5 мкл (элюции) с 2,5 мкл 3 x S DS-загрузки буфера и перейти на шаг 4.6.4 (рис. 5).
- SDS-PAGE для анализа MS
Примечание: Для сведения к минимуму потенциального загрязнения кератин, сборный гели и коммерческого образца загрузки буфера может использоваться.- Добавьте 6,25 мкл 4 x пример буфера 18,75 мкл каждого образца элюции и запустить образцы на сборный 4 – 20% SDS-гель, до тех пор, пока они мигрируют 2-3 см в гель.
- Пятно гель с коллоидной Кумасси блестящий синий G250 пятнать13 в чашке Петри 15 см.
- Используйте чистый скальпель акцизных всей полосы для каждого образца, за исключением группы стрептавидина (работает на ca. 17 кДа, рис. 6) и передачи подакцизным полос для 1.5 мл пробирок.
- Отправьте эти образцы в протеомике учреждение для дальнейшего анализа.
Примечание: Типичный MS результаты можно увидеть в ссылке 9 (рис. 3 и рис. 7и дополнительные таблицы). Все наборы данных доступны на хранилище гордость (присоединение номер PXD005005).
Результаты
Чтобы проиллюстрировать, как работает этот метод, открытом чтения фреймов (ORFs) белков, давности2, TNRC6C и Dicer (все вовлечены в гене Мирна опосредованной глушителей путь) были клонированы в Сплит BioID плазмиды. Давности2 как известно взаимодействуют с TNRC6C в Мирна-комплекс (miRISC), подавляет перевод и стимулировать распад целевой mRNAs14. До их собрать miRISC, давности2 взаимодействуют с Dicer, фермент, который производит зрелых адаптивной, в пределах комплекса, в котором он может получить загружен с Мирна15. Поэтому Сплит BioID был применен к давности2 Блокорезки пары или пара давности2/TNRC6C. Для каждой пары протестированных белков давности2 был либо сливается с NBirA * или CBirA * используя наши Сплит BioID плазмид (рис. 2), и Dicer и TNRC6C для соответствующего родственных Бира * фрагмент. Кроме того, каждый белок был сливается с CBirA * и в паре с NBirA *-фьюжн GFP как отрицательный контроль. Это приводит в тестировании четыре итерации для каждой пары протестированных белка (Таблица 1).
Чтобы проверить ли Сплит BioID активируется после взаимодействия пары протестированных белков, мы следовали схема, изображенная на рисунке 1. Плазмиды были временно transfected в линии совместимый клеток HeLa тет системы. Выражение синтез белков был индуцированных с доксициклин (dox) и biotinylation была простимулирована путем добавления избыточных биотина среднего роста. После 20 h время инкубации с dox и биотин клетки лизированы и проанализирован Западный blotting, используя конъюгированных стрептавидина для обнаружения биотинилированного белков. В клетках млекопитающих две основных группы обычно обнаруживаются конъюгированные стрептавидина в образце untransfected (рис. 3, звёзды) и соответствуют к эндогенно биотинилированным белкам (наиболее вероятно митохондриальной carboxylases). Эти две группы присутствуют во всех пробах и может быть удобно использовать как внутренние загрузки элементов управления, таким образом, обнаружение уборки белка для управления загрузкой сумм, равных белка является излишним. Типичная для BioID/Сплит BioID эксперимента, дополнительных основных групп, которые могут наблюдаться являются синтез белков, которые получил self биотинилированным. Даже если видели не другим биотинилированным белок, обнаружения biotinylation синтез белков на данном этапе уже показывает, что два проверенных белки взаимодействовали в клетках. В эксперименте, изображенные на рисунке 3, это ясно, что наличие NBirA *-давности2 синтез белка в паре с CBirA * сплавливания TNRC6C или Dicer является более эффективным, чем противоположным комбинации, в которой CBirA *-давности2 в паре с NBirA * слияния двух других белки (рис. 3, верхняя панель, сравнение интенсивностей полос 2-3 полосы 6-7). Кроме того, активация была конкретные, как ни один из CBirA * сплавливания может активировать NBirA *-GFP управления синтез белка до заметных уровней (рис. 3, сравнить дорожки 1, 4-5 переулок 8, который соответствует untransfected клеток). Поскольку в нашем плазмиды, NBirA * имеет тег myc и CBirA * имеет тег флаг (рис. 2), уровни выражения каждого синтез белка могут быть проанализированы с антителами против этих двух тегов (рис. 3, Нижняя панель).
Когда наблюдается взаимодействие индуцированной biotinylation, эксперимент можно вычислить по маштабу, и биотинилированным белки, изолированные на сочетании стрептавидина бусы как указано в пункте 4 протокола (рис. 4). При выполнении изоляции впервые, все этапы очистки могут быть проанализированы западных blotting (рис. 5). Как правило привязка к бисер должен быть почти количественных и практически нет утечки через должны соблюдаться в стирок. Предварительной обработки образцов для масс-спектрометрии, мы рекомендуем западную помарку для обеспечения что протеины сплавливания высказывались и индуцированных biotinylation работает, как ожидалось. Отсутствие экспрессии белков Фьюжн является либо из-за плохой трансфекции эффективности или неисправный dox индукции. Если были высказаны синтез белков, но не biotinylation наблюдается, проверьте если избыток биотин (50 мкм) на самом деле был добавлен к средству и что фондовый биотин по-прежнему активен. Когда eluted материала анализируются на окрашенных Кумасси белка гель (рис. 6), как правило, сильнейший группа должна наблюдаться работает на около 17 кДа и соответствует мономерных стрептавидина. Могут также наблюдаться полосы, соответствующие эндогенного биотинилированным белков и синтез белков. Мы обычно акцизных области полосу образца выше полосе стрептавидина до загрузки хорошо (рис. 6). Подакцизным группы можно хранить в 1,5 мл трубку и отправлен в центр масс-спектрометрии. В качестве альтернативы связанных белков может также быть переваривается трипсина на сочетании стрептавидина бусины и переваривается пептиды этого eluted сформировать столбец. Мы регулярно использовать программное обеспечение MaxQuant16 (с использованием главным образом параметры по умолчанию и добавление лизина biotinylation в качестве возможного столб-поступательные изменения, смотрите ссылку 9 для получения более подробной информации и типичные результаты MS) для анализа исходных данных MS и Персей люкс17 для последующего статистического анализа, оба являются свободным программным обеспечением. Образцы, как правило выполняются в три биологических реплицирует. С помощью метки бесплатно количественной оценки, специально обогащенного белки могут быть определены над условиями управления. Для фильтрации для эндогенно биотинилированным белков и белки, которые помечены неспецифически Бира * фермента, мы рассматривать только белки, которые значительно обогатили над хиты из шести наборов данных, созданных с шестью несвязанных белков. Кроме того, мы рассмотрим только хитов, которые обогащаются за набор Сплит BioID, в котором были заменены протеины сплавливания NBirA * NBirA *-GFP. Особенно с помощью стабильных изотопов маркировки с аминокислоты в клеточной культуре (SILAC) для количественных протеомики18были предложены другие стратегии анализа данных. Кроме того были описаны различные стратегии для прямого изоляции биотинилированным пептиды с помощью стрептавидина вариант с ослабленной сродством к биотина18, Специальный элюции условий с использованием органических растворителей19 или биотин конкретных антитела,2021. Хотя не обязательно приводит к открытию больше белков, определение участков biotinylation добавить больше уверенности относительно специфики хитов и это полезно при решении топология взаимодействия.
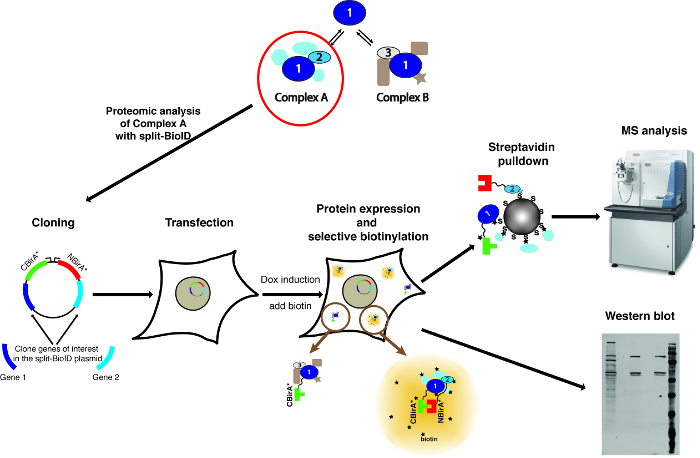
Рисунок 1: обзор процедуры Сплит BioID. Протеин 1 взаимодействует с белка 2 в рамках сложных A, или протеин 3 частью комплекса B. Конкретно зонда в состав сложных A, Сплит BioID может применяться к протеинам 1 и 2. Под лицензией Creative Commons Attribution-доля так 3.0 Unported и фотографии масс-спектрометр был загружен с https://commons.wikimedia.org с именем файла ThermoScientificOrbitrapElite.JPG. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
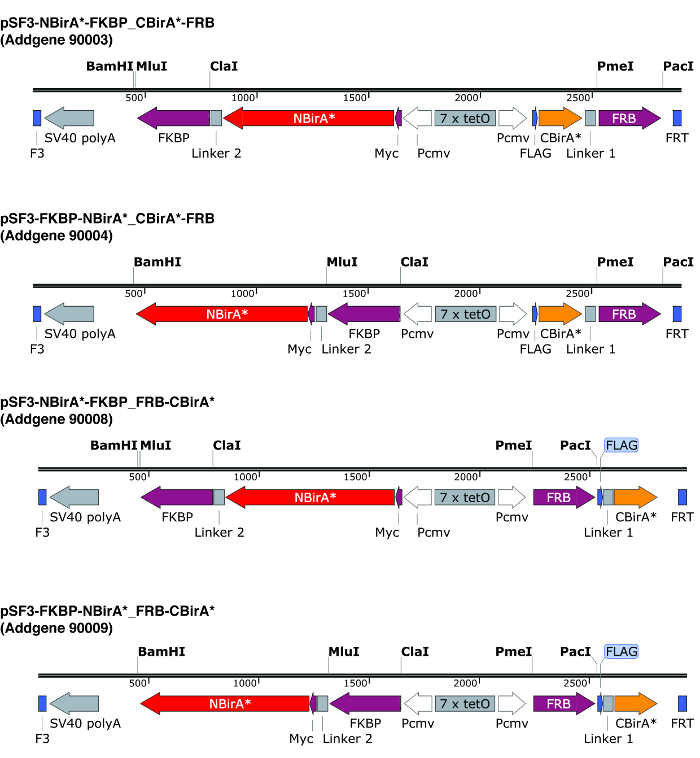
Рисунок 2: выражение кассеты плазмид Сплит BioID. Мы предлагаем четыре плазмиды позволяют тестирование всех комбинаций NBirA * и CBirA * синтеза белков. Плазмиды и полной карты доступны в addgene.org под указанные номера. Плазмиды тет отзывчивым элемент (7 x Тето) и должны быть использованы в клеточная линия, которая совместима с системой выражение тет. Также, обратите внимание, что в всех плазмид ORFs FKBP и FRB сплавлены к NBirA * и CBirA * фрагменты соответственно. Эти два белка взаимодействуют только в присутствии rapamycin и следовательно плазмид может использоваться для быстрого тестирования системы в наличие или отсутствие этого химического9. Указанные ограничения сайтов являются уникальными. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
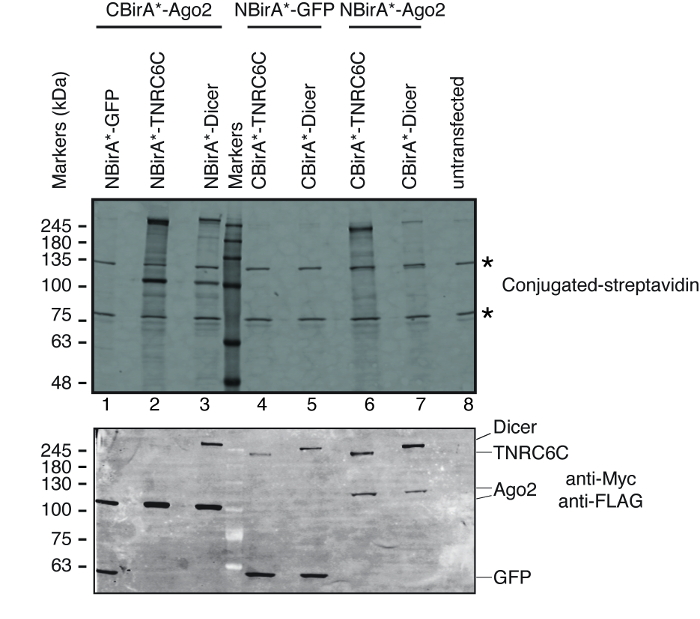
Рисунок 3: типичной западной помарке для эксперимента Сплит BioID. Верхняя панель: обнаружение биотинилированным белков с дневно обозначенные стрептавидина. Нижняя панель: обнаружение синтез белков с анти Myc и анти флаг антител. Были протестированы две пары белков: давности2/TNRC6C и давности2 Блокорезки. В строках 2 и 3 давности2 было приложено к фрагмента CBirA. В строках 6 и 7 давности2 было приложено к фрагмента NBirA. Значительный сигнал не наблюдалось, когда любой из трех белков были объединены с NBirA *-ГФП (дорожки 1, 4-5). Звезды указывают полосы соответствует эндогенно биотинилированным белков, которые могут служить в качестве внутренней загрузки элементов управления. Эта цифра заимствован из Рисунок 5B Шопп и др. 9 под лицензией Creative Commons Attribution 4.0 международного. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
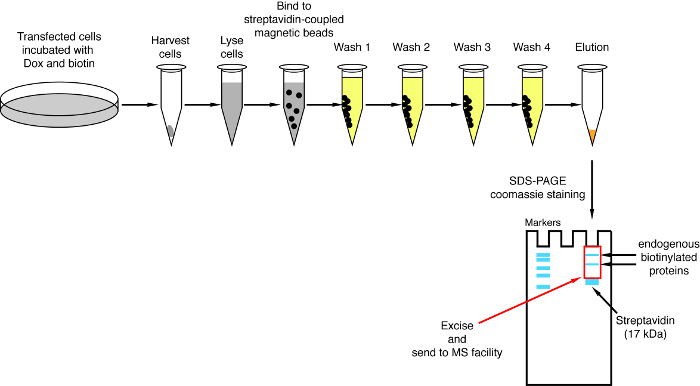
Рисунок 4: обзор процедуры пулдаун стрептавидина. Изображены основные шаги для изоляции биотинилированным белков для анализа масс-спектрометрии. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
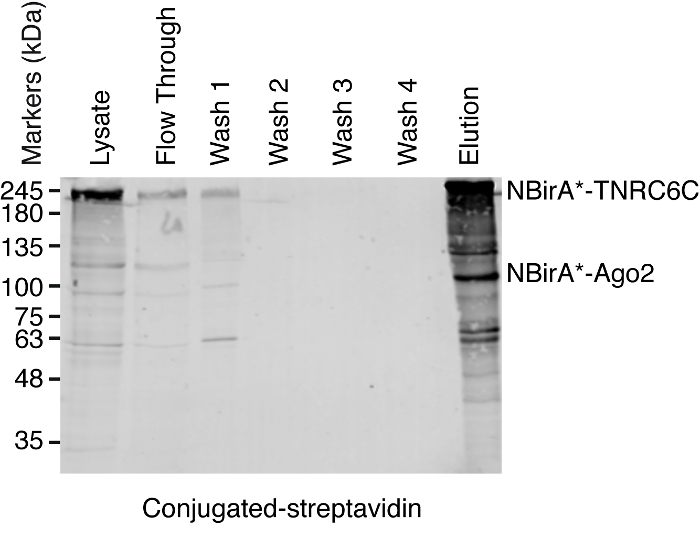
Рисунок 5: типичной западной помарке для эксперимента пулдаун стрептавидина. Равное количество каждого указанного образца были загружены на геле полиакриламида SDS. После Западный blotting, биотинилированным белки были обнаружены с ПХ сочетании стрептавидина. Диапазоны, соответствующие NBirA *-TNRC6C и CBirA-давности2 указаны. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
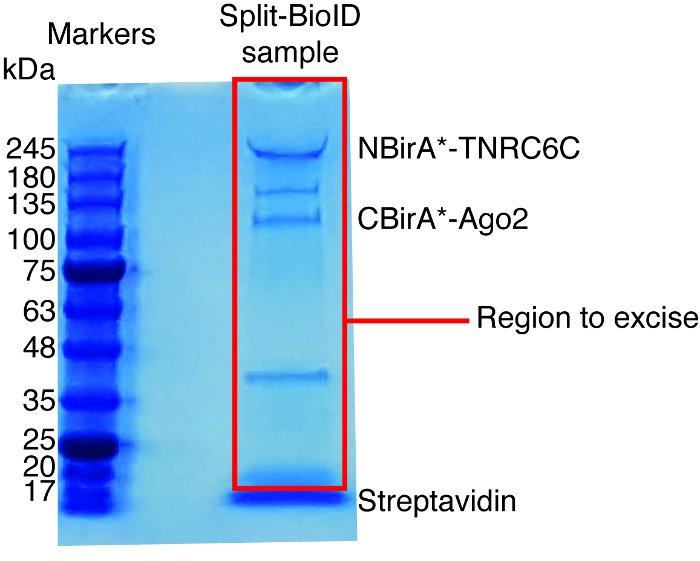
Рисунок 6: типичный Кумасси-окрашенных белка гель для анализа масс-спектрометрия. Eluted образец из бисера в сочетании стрептавидина был загружен на геле сборного белка и запустить до тех пор, пока образец перенос 2-3 см. Основные группы видели на около 17 кДа — стрептавидина. Непосредственно над этой группы является подакцизным и отправлен в центр масс-спектрометрии. Диапазоны, соответствующие NBirA *-TNRC6C и CBirA-давности2 указаны. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| Трансфекция образец | Условия испытания | ||
| 1 | NBirA *-protein1 / CBirA *-protein2 | ||
| 2 | CBirA *-protein1 / NBirA *-protein2 | ||
| 3 | NBirA *-GFP / CBirA *-protein1 | ||
| 4 | NBirA *-GFP / CBirA *-protein2 | ||
| 5 | не Трансфекция | ||
Таблица 1: Обычно проверку условий при применении Сплит BioID две белки.
| Секвенирование грунтовка | последовательность |
| Кассета 1 обратный грунт (CBirA * фьюжн) | TATACTTTCTAGAGAATAGGAAC |
| Кассета 2 обратный грунт (NBirA * фьюжн) | GTGGTTTGTCCAAACTCATC |
Таблица 2: Виртуализация Праймеры для Сплит BioID плазмиды.
Обсуждение
Изложил процедура описывает способ клонирования генов интерес в Сплит BioID плазмид, как для тестирования взаимодействия индуцированной biotinylation и как изолировать биотинилированным белков для анализа масс-спектрометрии. Мы опишем здесь процедура, основанная на переходных transfection. В то время как выражение синтез белков могут быть настроены на величину dox, добавлен в средство, переходных transfection может привести к не однородных белков с некоторых клеток, которые грубо overexpress синтез белков по сравнению с эндогенного партнерами. Это может привести к искажениям соответствующего interactomes и PPI, не точно отражают взаимодействий, которые включают эндогенного белков. Таким образом обычно рекомендуется для построения стабильных клеточных линий после Сплит BioID был создан с временной системы. Плазмиды совместимы с системой ФЛП опосредованной рекомбинации и место оба генов интерес под регулирование тет отзывчивым и тот же элемент. Если необходимо и при использовании с совместимыми mammalian клеток, они позволяют легко создавать стабильные индуцибельной клеточных линий. Например мы используем линии HeLa-ЭМ2-11, которая выражает активатор транскрипции тетрациклин активированный rtTA и уникальный ориентации геномной локус, из которого тетрациклин опосредованной ген выражение может быть жестко регулируемых12. С помощью этой линии клеток и Flp опосредованной рекомбинации, стабильных клеточных линий, которые содержат только одну копию трансген можно получить в течение двух-трех недель. Кроме того также можно использовать текущих методов редактирования генома представить Бира * фрагменты в родной геномной локусов генов интерес.
Как и любой assay который полагается на пометки белок необходимо рассмотреть, если результирующая протеины сплавливания функциональных. Имеющихся данных, в которой были помечены протеинов интереса (например, с GFP для изображений исследования) и функционально тестирование полезно решить, если фрагменты Бира * должно быть клонированы вверх или вниз по течению гены интереса. Если такие данные не доступны, один следует проверить N-неизлечимо или C-неизлечимо tagged белков в функционального анализа. Например может испытываться активности синтеза белков в ячейки строки в котором эндогенного белка был постучал из и по сравнению с дикого типа ситуации. Если протеинов интереса терпеть как N - и C-терминала теги, оба должны быть проверены. Действительно в BioID эксперименты, ориентация синтез белка может повлиять на эффективность маркировки22. Кроме того мы наблюдали что при применении Сплит BioID пара белков, какой из двух белков добавляется либо NBirA * или CBirA * фрагмент также на влияние эффективности маркировки9. В Сплит BioID плазмид 16 аминокислот длиной глицин/сериновые богатые линкеры муфты протеинов интереса к Бира * фрагменты были взяты из другого PCA23 и работал для нас для всех взаимодействующих белки мы протестировали так далеко. Однако следует учитывать, что некоторые пары белков может работать лучше с линкеры короче или длиннее. На Последнее замечание другой пробирного был описан Боллен группы24. В этот assay Бира * делится на другом сайте (E140/Q141) чем ours (E256/G257). Мы проверили Оба Сплит BioID вкусов бок о бок и обнаружил, что E256/G257, указанных в настоящем Протоколе, приводит к сильной повторной активации при сочетании двух взаимодействующих белки9.
Один общий недостаток этого метода является низкая скорость маркировки. Как правило время инкубации 6-24 ч с биотина необходима для получения ощутимого biotinylation6, исключающих использование этой технологии для изучения динамических ремоделирования белковых комплексов. Хотя этот assay частично решает этот нюанс, как он активируется только при взаимодействии двух белков, медленная скорость маркировки исключает его использования для изучения ответ весьма динамических процессов или для анализа недолго белков. Инженерных пероксидазы APEX2 известно для содействия эффективной маркировки проксимальной белков в течение 1 мин3. PCA, основанные на APEX2 таким образом можно было бы рассмотреть ограничения маркировки скорости BioID производные анализов. Исследование доказательств принцип описал такой25Сплит APEX2 анализа. Однако хотя homodimerizing белок успешно биотинилированным, ли assay может также использоваться для обозначения и определения белков, которые собирают вокруг пары взаимодействующих белков остается быть продемонстрирована. Совсем недавно направленной эволюции был использован для создания TurboID и miniTurbo, два варианта Бира * с расширенной деятельности которые позволяют намного короче меток времени windows, вплоть до 10 мин26. Сплит BioID для этих новых вариантов адаптации будет расширить использование этого метода для широкой области применения.
Раскрытие информации
Авторы не имеют ничего сообщать.
Благодарности
Эта работа финансировалась инициативе немецкого мастерства (CellNetworks DFG-EXC 81) и частичное финансирование совместного исследовательского центра SFB638, немецкого исследовательского совета (DFG).
Материалы
| Name | Company | Catalog Number | Comments |
| Acetic acid (glacial) | VWR | 20104.298 | To make TAE buffer |
| Agarose | Sigma | A9539 | Take TAE-agarose gels for DNA analysis and extraction |
| Ammonia solution 25% NH3 | Bernd Kraft | 6012 | To dissolve biotin |
| Ampicillin | Sigma | A9518 | To select transformed bacteria |
| Bioruptor plus sonification device | Diagenode | B01020001 | Other sonification devices are also ok |
| Biotin | Sigma | B4639 | To be added to the growth medium to stimulate efficient biotinylation |
| Bovine serum albumin fraction V | Carl Roth | 8076 | Used in Western blot buffers and a protein standard in Bradford assays |
| Bradford Ultra reagent | Expedeon | BFU05L | Any other method/kit for protein determination is fine, this particular reagent is more tolerant to detergent than other Bradford reagents |
| Cell scrappers | TPP | 99002 | Any other model is also fine |
| ClaI | New England Biolabs | R0197 | Restriction enzyme for cloning into the split-BioID plasmids (NBirA* fusion) |
| DMEM medium | Sigma | D6046 | If using another cell line, use the corresponding optimal growth medium |
| DNA miniprep kit | Sigma | PLN350 | Any other kit is also fine |
| Doxycycline | Applichem | A2951 | Dox is light sensitive |
| DTT | Applichem | A2948 | Make 1M stock solution, store at -20 °C and always use fresh |
| DyLight 680-conjugated streptavidin | Thermo scientific | 21848 | to use with a LiCor Western blot scanning device |
| Dynabeads MyOne Streptavidin C1 | Invitrogen | 65002 | The C1 beads are not BSA coated which is preferable for downstream MS applications (no leakthrough of BSA in the final elution) |
| EDTA | Applichem | A5097 | Make a 500 mM stock, adjust pH to 8 while dissolving the EDTA powder |
| Ethanol | Sigma | 32205 | Make a 70% stock solution in which Doxycycline can be dissolved at 10 mg.mL-1 |
| Fastgene Gel/PCR DNA Extraction Kit | Nippon Genetics | FG-91302 | Any other kit is also fine |
| HCl 37% | Merck | 1.00317.1000 | To adjust pH of biotin stock solution |
| HEPES | Carl Roth | 6763 | Make a 500 mM stock solution, adjust the pH to 7.4 |
| Immobilon-FL PVDF membrane, 0.45 µm | Millipore | IPFL00010 | This membrane shows minimal autofluorescence when used with a LiCor Western blot scanning device |
| LiCl | Grüssing GmbH | 12083 | Make a 5M stock solution |
| Odyssey CLx imaging system | LI-COR | N/A | To scan Western blot membrane decorated with fluorophore-labeled antibody |
| Linear polyethylenimine (PEI) | Polysciences | 23966-2 | Any other transfection reagent is also fine |
| Milk powder | Carl Roth | T145 | To block Western blot membranes |
| MluI-HF | New England Biolabs | R3198 | Restriction enzyme for cloning into the split-BioID plasmids (NBirA* fusion) |
| Na-deoxycholate | Sigma | 30970 | Make a 10% (w/v) stock solution |
| NaCl | Sigma | 31434 | Make a 5M stock solution |
| NP-40 (Nonidet P40 substitute) | Sigma | 74385 | Make a 20% (v/v) stock solution |
| PacI | New England Biolabs | R0547 | Restriction enzyme for cloning into the split-BioID plasmids (CBirA* fusion) |
| Phosphate buffer saline (PBS) | Sigma | 806552 | To wash cells before scrapping |
| PmeI | New England Biolabs | R0560 | Restriction enzyme for cloning into the split-BioID plasmids (CBirA* fusion) |
| Protease inhibitor cocktail | Roche | 4693132001 | Added to the lysis buffer to prevent protein degradation |
| pSF3-Flag-CBir-FRB_Myc-NBir-FKBP | Addgene | 90003 | Split-BioID plasmid, mediates the co-expression of NBirA*-FKBP and CBirA*-FRB, FKBP and FRB can be replaced by two other ORFs |
| pSF3-Flag-CBir-FRB_FKBP-Myc-Nbir | Addgene | 90004 | Split-BioID plasmid, mediates the co-expression of FKBP-NBirA* and CBirA*-FRB, FKBP and FRB can be replaced by two other ORFs |
| pSF3-Flag-FRB-Cbir_Myc-NBir-FKBP | Addgene | 90008 | Split-BioID plasmid, mediates the co-expression of NBirA*-FKBP and FRB-CBirA*, FKBP and FRB can be replaced by two other ORFs |
| pSF3-Flag-FRB-Cbir_FKBP-Myc-Nbir | Addgene | 90009 | Split-BioID plasmid, mediates the co-expression of FKBP-NBirA* and FRB-CBirA*, FKBP and FRB can be replaced by two other ORFs |
| Q5 High-Fidelity PCR kit | New England Biolabs | E0555S | To amplify the ORF coding for the proteins to be tested. Any other thermostable DNA polymerase is fine. |
| Quick ligation kit | New England Biolabs | M2200S | To ligate DNA fragments into the split-BioID plasmids, any other DNA ligation system is fine. |
| RunBlue 4-20% SDS precast gels | Expedeon | BCG42012 | To use when running samples for MS analysis |
| RunBlue LDS Sample Buffer | Expedeon | NXB31010 | Running buffer for the RunBlue precast gels |
| SDS | Sigma | 5030 | Comes as a 20% stock solution |
| tet-free serum | Biowest | S181T | we use tet-free serum to minimize basal expression of the fusion proteins |
| Trans-Blot Turbo Transfer system | Bio-Rad | 1704150 | High speed Western blotting transfer system, any other transfer system is also fine |
| Tris | Carl Roth | 4855 | Make 1M stock solutions with adequate pH (7.4 and 8) |
| Triton X-100 | Applichem | A4975 | Make a 20% (v/v) stock solution |
| Tween-20 | Carl Roth | 9127 | Used in Western blot buffers, Tween 20 leads to high background fluorescence and should be omitted in the blocking and last wash step |
Ссылки
- Scott, D. E., Bayly, A. R., Abell, C., Skidmore, J. Small molecules, big targets: drug discovery faces the protein-protein interaction challenge. Nat Rev Drug Discov. 15 (8), 533-550 (2016).
- Roux, K. J., Kim, D. I., Raida, M., Burke, B. A promiscuous biotin ligase fusion protein identifies proximal and interacting proteins in mammalian cells. J Cell Biol. 196 (6), 801-810 (2012).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12 (1), 51-54 (2015).
- Rhee, H. W., et al. Proteomic mapping of mitochondria in living cells via spatially restricted enzymatic tagging. Science. 339 (6125), 1328-1331 (2013).
- Kim, D. I., et al. Probing nuclear pore complex architecture with proximity-dependent biotinylation. P Natl Acad Sci USA. 111 (24), E2453-E2461 (2014).
- Kim, D. I., et al. An improved smaller biotin ligase for BioID proximity labeling. Mol Biol Cell. 27 (8), 1188-1196 (2016).
- Lambert, J. P., Tucholska, M., Go, C., Knight, J. D., Gingras, A. C. Proximity biotinylation and affinity purification are complementary approaches for the interactome mapping of chromatin-associated protein complexes. J Proteomics. 118, 81-94 (2015).
- Morriswood, B., et al. Novel bilobe components in Trypanosoma brucei identified using proximity-dependent biotinylation. Eukaryot Cell. 12 (2), 356-367 (2013).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, (2017).
- Béthune, J., Artus-Revel, C. G., Filipowicz, W. Kinetic analysis reveals successive steps leading to miRNA-mediated silencing in mammalian cells. EMBO Rep. 13 (8), 716-723 (2012).
- Inoue, H., Nojima, H., Okayama, H. High efficiency transformation of Escherichia coli with plasmids. Gene. 96 (1), 23-28 (1990).
- Weidenfeld, I., et al. Inducible expression of coding and inhibitory RNAs from retargetable genomic loci. Nucleic Acids Res. 37 (7), e50 (2009).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Jonas, S., Izaurralde, E. Towards a molecular understanding of microRNA-mediated gene silencing. Nat Rev Genet. 16 (7), 421-433 (2015).
- MacRae, I. J., Ma, E., Zhou, M., Robinson, C. V., Doudna, J. A. In vitro reconstitution of the human RISC-loading complex. P Natl Acad Sci USA. 105 (2), 512-517 (2008).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nat Methods. 13 (9), 731-740 (2016).
- Opitz, N., et al. Capturing the Asc1p/Receptor for Activated C Kinase 1 (RACK1) Microenvironment at the Head Region of the 40S Ribosome with Quantitative BioID in Yeast. Mol Cell Proteomics. 16 (12), 2199-2218 (2017).
- Mackmull, M. T., et al. Landscape of nuclear transport receptor cargo specificity. Mol Syst Biol. 13 (12), 962 (2017).
- Kim, D. I., et al. BioSITe: A Method for Direct Detection and Quantitation of Site-Specific Biotinylation. J Proteome Res. , (2017).
- Udeshi, N. D., et al. Antibodies to biotin enable large-scale detection of biotinylation sites on proteins. Nat Methods. 14 (12), 1167-1170 (2017).
- Chapat, C., et al. Cap-binding protein 4EHP effects translation silencing by microRNAs. P Natl Acad Sci USA. 114 (21), 5425-5430 (2017).
- Luker, K. E., et al. Kinetics of regulated protein-protein interactions revealed with firefly luciferase complementation imaging in cells and living animals. P Natl Acad Sci USA. 101 (33), 12288-12293 (2004).
- De Munter, S., et al. Split-BioID: a proximity biotinylation assay for dimerization-dependent protein interactions. FEBS Lett. 591 (2), 415-424 (2017).
- Xue, M., et al. Optimizing the fragment complementation of APEX2 for detection of specific protein-protein interactions in live cells. Sci Rep. 7 (1), 12039 (2017).
- Branon, T. C., et al. Directed evolution of TurboID for efficient proximity labeling in living cells and organisms. bioRxiv. , (2017).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены