Method Article
그들의 네이티브 셀룰러 환경에서 상황에 맞는 단백질 복합물의 분할-BioID-Proteomic 분석
요약
우리는 분할-BioID, 근접 라벨 기술 BioID에 따라 단백질 조각-보완성 분석 결과 대 한 단계별 프로토콜을 제공 합니다. 두 주어진된 단백질의 상호 작용 활성화, 그것은 그들의 네이티브 셀룰러 환경에서 맞는 단백질 복합물의 proteomics 분석을 수 있습니다. 간단 하 고 비용 효율적인 메서드와 표준 실험실 장비에만 필요 합니다.
초록
기존 친 화력 정화 (AP)를 보완 하기 위해 단백질 단백질 상호 작용 (PPI)의 식별에 대 한 접근, 효소는 살아있는 세포에 있는 단백질의 근접-종속 라벨 수 있도록 도입 되었습니다. 하나 같은 효소, BirA * (BioID 접근에서 사용), 중재 약 10의 범위 내에서 단백질의 biotinylation nm. 그러므로, 관심사의 단백질을 융합 하 고 셀에 표현, 그것은 그들의 네이티브 환경에서 근 단백질의 라벨 수 있습니다. 조립된 단백질 복합물의 정화에 의존 하는 AP, 반대로 BioID 아무리 여부 그들은 여전히와 상호 작용 하 관심사의 단백질 들은 고립 된 세포 내에서 표시 된 단백질을 감지 합니다. 이후 biotinylates 근 단백질, 하나 그들을 매우 효율적으로 biotin에 streptavidin의 뛰어난 선호도에 투자 또한 수 있습니다. BioID 식별 과도 또는 약한 상호 작용에 대 한 AP 보다 더 나은 수행 하는 동안 두 AP 및 BioID 질량 분석 방법 주어진된 단백질이 있을 수 있습니다 모든 가능한 상호 작용에 대 한 개요를 제공 합니다. 그러나, 그들은 각 확인 된 PPI의 맥락에서 정보를 제공 하지 않습니다. 실제로, 대부분의 단백질 일반적으로 뚜렷한 성숙 단계 나 다른 기능 단위에 해당 하는 여러 단지의 일부입니다. 두 방법의 일반적인 제한이를 해결 하기 위해 우리 BirA * 효소에 따라 단백질 조각 보완성 분석 결과 설계 했습니다. 이 분석 결과에 BirA *의 2 개의 비활성 파편 수 때 가까운 근접에서 있는 그들은 융합 하는 두 개의 상호 작용 단백질에 의해 활성 효소로 재조 립. 결과 분할 BioID 분석 결과 따라서 단백질 단백질 상호 작용의 한 쌍의 주위에 조립의 라벨 수 있습니다. 이 두 가지는 주어진 컨텍스트에서 상호, 제공 분할 BioID 그들의 네이티브 셀룰러 환경에서 특정 컨텍스트에 종속 기능 단위 분석을 다음 수 있습니다. 여기, 우리는 테스트 하 고 분할-BioID 상호 작용 단백질의 쌍에 적용 하는 단계별 프로토콜을 제공 합니다.
서문
대부분 세포 기능 동적으로 조립 고분자 복합물 단백질에 의해 수행 됩니다, 단백질 단백질 상호 작용 (PPI)의 식별 생물 의학 연구에서 주요 노력 이다. 실제로, PPI 자주 질병에 폐지 하 고 치료제1에 대 한 잠재적인 목표를 나타냅니다. 가장 널리 사용 되는 메서드 PPI의 식별, 친 화력 정화 (AP) 접근을 위한 세포 세포의 용 해, 관심사의 단백질은 특히 행렬에 정화 하 고 관련된 단백질 질량 분석에 의해 확인 이후에 (MS)입니다. AP-MS는 강력한 접근, 그것은 일반적으로 수행 하지 않습니다 가난 하 게 녹는 단백질 복합물, 아주 일시적인 상호 작용 또는 subcellular 구조를 필요로 하는 PPI에 잘. 또한, 데이터의 해석 단일 단백질은 종종 여러 가지 단백질 복합물의 부분으로 PPI 네트워크의 동적 특성에 의해 복잡 될 수 있습니다.
BioID2 APEX23,4 등 근접 라벨 기술은 최근 AP MS 접근의 제한 사항 중 일부를 해결 하기 위해 개발 되었다. BioID에서 효소 BirA * (에 해당 하는 야생 타입 대장균 효소의 G115R 이체) catalyzes 정한 biotinyl-앰프 (바이오-앰프) 주 아민과 반응의 형성. 야생 타입 효소, 바이오-앰프의 활성 중심에 유지, 반대로 BirA * 해제 바이오 앰프 주변 환경에의 확산을 허용 합니다. 그러므로, 관심사의 단백질을 융합 하 고 셀에 표현, 근 단백질 biotinylated 10 nm5의 예상된 범위 내에서 될 수 있습니다. 이러한 근 위 표시는 다음 streptavidin 풀 다운에 의해 고립 된 단백질과 MS로 식별. AP-MS, 반대로 BioID 융합 단백질의 식이 필요합니다. 그것은 따라서만 적용할 수 있습니다 단백질 누구의 기능 태그 방해 하지. 또한, 라벨의 속도 느린, 일반적으로 6-24 h2,6, 도전 짧은 단백질의 탐지를 만들기. 아직, AP-MS에 비해, BioID MS 제공 합니다 여러 주요 장점: 첫 번째, 그 캡처 그들의 네이티브 셀룰러 환경에서 상호 작용 두 번째, 레이블이 단백질 보다는 조립된 단지 세포 세포의 용 해; 다음 격리 됩니다. 셋째, streptavidin pulldowns 변성 버퍼 및 거친 세척 상태를 사용 하 여 허용 합니다. 따라서, 방법은 더 과도 또는 약한 상호 작용7 또는 특정에서 발생 하는 상호 작용에 민감하고 subcellular 구조8을 하드입니다.
그러나, 대부분의 단백질 보통 세포 신호 또는 수행 해야 하는 함수에 개장 수 큰 단지의 일부입니다. 따라서, 단일 단백질은 일반적으로 여러 단지, 뚜렷한 기능 단위에 대응, 고유 포함 및 PPI 중복의 부분 이다. 두 방법 모두 게 주어진된 단백질이 있을 수 있습니다, 모든 협회의 개요를 제공 하지만 그들은 개별 PPI의 상황을 해결 하기 위해 실패 합니다. 후자의 해상도 높이기 위해 설계 된 단백질 조각을 보완성 분석 결과 (PCA)는 2 개의 비활성 파편 BirA * (촉매 도메인에 포함 된 NBirA *, 그리고 CBirA * 재 활성화 도메인으로 볼 수 있는)의 수에 재어셈블 때 가까이에 두는 활성 효소로 단백질9상호 작용. 결과 분할 BioID 분석 결과는 단백질 상호 작용 단백질의 쌍의 주위에 조립 및 따라서 컨텍스트 식별 종속 단백질 어셈블리에 근접 종속 biotinylation을 집중 한다. 우리는 최근 중재 하는 miRNA 유전자 침묵 통로9에 관련 된 두 가지 단백질 복합물을 해결 하 여 분할-BioID의 뛰어난 해상도 파워를 시연.
전부, 단일 및 간단한 분석 결과, 분할 BioID 수 있습니다 발견 하 고 구체적으로 정의 된 기능 단위는 주어진된 단백질 관련, 해당 단백질 복잡 한의 추가 상호 작용 단백질 알려져 제공에 PPI를 할당.
프로토콜
참고: 방법의 개요는 그림 1에 표시 됩니다.
1. 복제 전략 계획
- 테스트할 두 상 상호 작용 단백질을 선택 합니다.
참고: 각 두 가지 단백질의 한 분할 BioID 조각에 융합 될 것입니다: NBirA * 또는 CBirA *. 부정적인 컨트롤로 CBirA * 퓨전 단백질 NBirA * 녹색 형광 단백질을 융합으로 시험 될 것 이다 (NBirA *-GFP). 추가 제어로 NBirA * 융해 수 있습니다 테스트, 동족 CBirA * 퓨전 없이 또는 함께 CBirA * 없는 단백질을 융합. 그것은 사용 하 여 CBirA * 권장-GFP 그것으로 부정적인 통제로 일관 되 게 어떤 NBirA * 퓨전 단백질9결합 될 때 주요 배경으로 이어질 표시 했다. 이 관측의 원인의 CBirA * 식 수준에 있을 수 있습니다-GFP, 어떤 다른 CBirA * 퓨전 단백질 우리가 지금까지 사용한 중요 한 재연결 NBirA * 조각으로 이어질 수 있습니다 보다 훨씬 높다. -
일단 두 가지 단백질을 선택 확인 여부를 둘 다 이미 성공적으로 태그가 되었습니다 기능 연구에서 (예를 들어 태그 GFP 융해 단백질)로 찾을 수 문학.
- 이러한 연구 결과 있으면 태그 (에 N-또는 C-말단)의 위치 및 동일한 방향 분할 BioID 조각으로 관심사의 단백질을 태그를 사용 하 여.
- 이러한 연구 있으면 두 단백질에 대 한 코딩 계획 구조 태그에 N-와 C-말단 하 고 (예: WT 단백질에 대 한 소진 셀 라인에서 구조 실험) 융해 단백질의 기능을 테스트 하는 시험 계획.
참고: 때 긴 유연한 링커를 인코딩 그림 2 에 설명 된 플라스 미드를 사용 하 여 두 개의 융합 단백질을 페어링, 융합 단백질 (BirA * 조각 상류 융합 또는 관심사의 단백질의 하류)의 방향 일반적으로 중요 하지 않습니다. . 실제로 사용 하 여 FRB와 FKBP 모델 단백질으로, 그것은 표시 했다 그 모든 4 개의 가능한 반복 (N-테르미니, N-말단과 C-말단, 다른에 하나씩 C-테르미니에서 둘 다에 두 조각 반대로) 비교 biotinylation9항복.
- 분할-BioID 플라스 미드로 복제에 대 한 관심의 두 가지 단백질의 ORFs를 증폭 하는 뇌관 디자인. 주의 번역 프레임 BirA * 단편으로 동일 하다는 것. 그림 2에서 설명 하는 플라스 미드를 사용 하는 경우 PmeI 및 paci의 금지 효소를 사용 하 여 CBirA * 퓨전와 NBirA * 퓨전에 대 한 효소 ClaI 및 MluI.
참고: 그림 2 플라스 미드 양방향 tet 응답 요소 F3/FRT 재결합 사이트에 의해 형벌을 나 른 다. 동일한 플라스 미드10, 그리고 빠르게 재조합 중재 카세트 교환 (RMCE)에 의해 안정적인 세포를 생성 하는 가능성에서 두 퓨전 단백질의 약 동일한 수준에서 규제 공동 식 수 있습니다. 이 플라스 미드 NBirA *에 myc 태그 CBirA *는 플래그 태그 합니다. ORFs 수 있습니다 물론 또한 수 복제 제정 발기인 개별 플라스 미드에.
중요 한 단계: 두 상호 작용 단백질 테스트 것이 좋습니다 비교 NBirA * 융합 단백질 1와 CBirA * 융합 단백질 2 결합 하 고 NBirA * 융합 단백질 2와 함께 CBirA * 단백질 1 융합 하. 실제로, 그것은 자주 반복 다른 것 보다 더 나은 작품을 관찰 됩니다.
2. 분할 BioID 플라스 미드에 관심의 유전자의 ORFs 복제
참고:이 예제에서는 두 개의 단백질 N-말단에 태그가 있을 수 있습니다 간주 됩니다. 4 개의 조건은 테스트 하 고 비 페 셀 (표 1)에 비해 것입니다.
- 연쇄 반응 (PCR)를 사용 하 여 적절 한 뇌관으로 테스트 하는 두 단백질의 ORFs를 증폭. NBirA * 융합 단백질, MluI과 ClaI 제한 사이트 및 CBirA * 융합 단백질에 대 한 PacI 및 PmeI 사이트를 소개 하는 뇌관 디자인.
참고: PCR 수행할 수 있습니다 어떤 상업으로 우선적으로 교정, DNA 중 합 효소. 수첩에서 표준 프로토콜을 따라 하 고 뇌관의 용융 온도 제조업체 지침에 따라 증폭을 ORF의 길이에 그것을 적응. -
첫 번째 ORF subclone
- 플라스 미드 (약 2 μ g)과 ClaI와 MluI (NBirA *에 융합 될)에 PCR 증폭 ORF1 소화. 소화 반응 DNA와 반응 버퍼 37 ° c.에 1 시간에 1.5 mL 튜브에 20 μ의 총 볼륨에서의 적절 한 양으로 혼합 각 효소의 1 μ를 사용 하 여 수행
- 1 %agarose 태 DNA 젤에 모두 소화 샘플을 실행 합니다. 깨끗 한 메스와 1.5 mL 튜브에 소화 플라스 미드와 ORF1에 해당 하는 밴드 삭제하시오
- 표준 DNA 추출 키트를 사용 하 여 두 대역을 정화.
- 선 소화 플라스 미드와 ORF1 표준 시 약을 사용 하 여.
- 결 찰 키트를 사용 하 여 테이블의 자료에 표시, 선 100 ng의 DNA 포함 3 ~ 5 시간 어 금 니 과잉 4.5 μ의 전체 볼륨에 플라스 미드에 삽입 된. 결 찰 키트에서 2 x T4 리가 버퍼의 5 μ와 T4 DNA 리가의 0.5 μ를 추가 합니다. 결 찰 반응 실내 온도 (RT)에 10 분 동안 1.5 mL 튜브에 수행 합니다.
- 표준 DH-5 대장균 유능한 세포 (이노우에 방법11에 따라 준비)으로 변환.
- 1.5 mL에 유능한 세포의 50 μ와 결 찰 반응의 혼합 3 μ 얼음에 튜브와 30 분 전송 열을 셀 30-45에 대 한 42 ° C로 설정 차단 하 고 다시 미리 따뜻하게 (37 ° C)의 2 분 추가 250 μ에 대 한 얼음에 품 어에 대 한 품 어 lysogeny 국물 (파운드) 매체와 플레이트 100 μ 미리 따뜻하게 (37 ° C) 암 피 실린 포함 된 파운드-한 접시에 셀의. 37 ° c.에 하룻밤 셀을 품 어
- 다음 날, 4 ~ 6 식민지 선택 37 ° C, 180 rpm에서 그들을 품 어, 15 mL 튜브에 암 하는 100 피 한 μg⋅mL-1 실린을 포함 하는 파운드 매체의 3 mL에서 하룻밤.
- 표준 DNA MiniPrep 키트를 사용 하 여 선택한 식민지에서 플라스 미드를 분리.
- 생어 시퀀싱 카세트 2 역 뇌관 (표 2)를 사용 하 여 플라스 미드의 정확성을 확인 합니다.
- 첫 번째 ORF를 포함 하는 플라스 미드를 파악 단계 2.2와 같은 단계를 따라 하지만 PmeI과 PacI 효소를 사용 하 여 그 플라스 미드에서 두 번째 ORF subclone.
- 카세트 1 역 뇌관 (표 2)를 사용 하 여 결과 플라스 미드를 시퀀스.
3. 융합 단백질의 테스트
참고: 다음 지침은입니다 듀얼 유도할 수 있는 식 플라스 미드 (그림 2) 헬러 11ht 셀, subclonal 헬러 CCL2 셀 라인, 항생물질 제어 반전 녹음 방송 활성 제 rtTA-m 2를 안정적으로 표현 및 포함 하는 RMCE12대 한 로커 스입니다. 이 셀에 대 한 성장 매체 Dulbecco의 수정이 글 중간 (DMEM) 10% 태아 항생물질 무료 소 혈 청 (FBS)를 포함 하는. 다른 세포 유형을 사용할 때는 정확한 시드 조건 및 성장 매체 적응 해야 합니다.
-
일시적인 transfection
- 1 x 105 의 농도에서 종자 세포 transfection 전날 6 잘 플레이트의 당 2 mL에 세포 고 37 ° C, 5% CO2 셀 문화 인큐베이터에서 하룻밤 사이에 세포를 품 어.
- Transfection 당일 각의 매체를 제거 하 고 신선한 매체의 2 개 mL를 바꿉니다.
- 표 1에 따라 4 개의 transfection 반응 준비. 각 잘 transfect, 무 균 튜브 1.5 mL 혈 청 하지 않고 DMEM 매체와 500 µ L 채우기에 플라스 미드 DNA의 3 µ g에 polyethylenimine의 6 µ g을 추가 합니다.
- 각 잘 드롭 현명한 추가 하기 전에 실내 온도에 적어도 5 분 동안 각 transfection 믹스를 품 어. 37 ° C, 5% CO2에서 하룻밤 셀을 품 어.
-
유도 및 근접 라벨
- Transfection, 후 일 매체를 제거 하 고 biotinylation 자극 하 50 µ M에 biotin와 아목시실린과 200 ng⋅mL−1 융합 단백질의 표현을 유도 하에서 보충 하는 매체를 바꿉니다. 37 ° C, 5% CO2에서 적어도 20 h에 대 한 셀을 품 어.
- Biotin의 재고 솔루션으로 만들기 위해 50 mg⋅mL-1 에 biotin 해산 ( ca에 해당. 200 m m) 2 M 수산화 암모늄에에서. 일단 완전히 해산 50 m m 500 mM Hepes, pH 7.4, 희석 HCl. 약 수와 pH 7.4에 조정 그리고 저장-20 ° c.에 재고 솔루션 x 결과 1000 70% 에탄올에 10 mg⋅mL-1 어둠 속에서-20 ° C에서 나사 모자 microtube에 저장소에서 doxycycline 디졸브.
- Transfection, 후 일 매체를 제거 하 고 biotinylation 자극 하 50 µ M에 biotin와 아목시실린과 200 ng⋅mL−1 융합 단백질의 표현을 유도 하에서 보충 하는 매체를 바꿉니다. 37 ° C, 5% CO2에서 적어도 20 h에 대 한 셀을 품 어.
-
세포 lysate 준비
- 감기 (4 ° C)의 인산 염 버퍼 1 mL 식 염 수 (PBS)와 한 번 셀을 씻어.
- 각 잘 하려면 (50 mM Tris pH 7.4, 150 m m NaCl, 2 mM EDTA 0.5 %NP-40, 0.5 m m DTT, protease 억제제) 세포의 용 해 버퍼의 100 µ L를 추가 합니다.
- 셀 scrapper와 1.5 mL 튜브에 세포를 수확.
- 14000 x g 세포 파편을 제거 하 4 ° C에서 10 분에 샘플 원심
- 신선한 튜브는 supernatants 전송 하 고 얼음에 놓습니다.
- Bradford 분석 실험과 단백질 양을 확인 합니다.
-
SDS polyacrylamide 젤 전기 이동 법 (페이지)와 서 부 럽
- SDS polyacrylamide 젤을 준비 합니다.
- 대 한 각 lysate 허가, SDS-로딩 버퍼의 30 µ L의 총에서 30 µ g (최소 15 µ g) 단백질의 페이지 샘플을 준비. SDS polyacrylamide 젤에 동일한 양의 각 샘플 (20 µ L/잘) 로드 하 고 전기 이동 법을 진행 합니다.
- 전기 이동 법, 후 모든 표준 프로토콜을 사용 하 여 낮은 형광 PVDF 오 점 막에 분류 한 단백질을 전송 합니다.
참고: 단백질 biotinylation 분석에 대 한 빠른의 "높은 MW" 프로그램과 10 분 전송 시간 일반적으로 장치를 더럽혀 서 잘 작동 하는 세미 드라이 전송 합니다. - 송금 후 실시간에서 30 분 PBS에 5% 건조 우유에 막 차단
- 2 %BSA 0.1%를 포함 하는 PBS에 형광 streptavidin 어원이 희석된 1:15,000와 RT에 30-60 분 막 품 어 트윈 20.
- 0.1% 트윈 20, 및 다음 한 번 더 PBS PBS 막 10 분, 각각 세 번 씻어.
- 형광 스캐너 이미징 시스템에 막 스캔.
참고: A 일반적인 서쪽 오 점은 그림 3에 표시 됩니다. 위의 절차 설명 형광 기반 탐지 하지만 발광 기반 탐지 streptavidin HRP 결합을 사용 하 여 동일 하 게 잘 작동.
4입니다. 단백질 연구에 대 한 분할-BioID.
중요 한 참고: 다음 단계는 각 질 없는 조건에서 수행 되어야 하는 모든 최종 대량 spectrometric 분석에 대 한 모든 재료 및 시 약 이어야 한다로 각 질이 가능한 무료.
- 일시적인 transfection
- Transfection, 전날 씨 3 ~ 4 10 cm 8 × 105 셀 접시, 당 10 mL의 농도에서 각 조건에 대 한 판 하 고 37 ° C, 5% CO2 셀 문화 인큐베이터에서 하룻밤 사이에 세포를 품 어.
- 다음 날, 각 transfection 조건에 대 한 마스터 transfection 혼합 준비: 조건 당 3 접시, polyethylenimine의 36 µ g 및 플라스 미드 DNA의 18 µ g 900 µ L에 녹아 DMEM 혈 청 무료. 각 마스터 믹스 실시간에 적어도 5 분 동안 품 어
- 한편, 신선한 매체와 각 접시의 매체를 대체 하 고 각 플레이트에 현명한 transfection 혼합물 드롭의 300 µ L를 추가 합니다.
- 37 ° C, 5% CO2에서 하룻밤 셀을 품 어.
- 유도 및 근접 라벨
- Transfection, 후 하루 15 cm 요리 셀을 전송 합니다. 각 요리에 대 한 매체를 제거, 7 mL의 PBS로 세포 세척, 트립 신-EDTA 솔루션의 1.5 mL를 추가 하 고 셀 resuspend를 성장 매체의 20 mL 가득 15cm 접시에 세포 현 탁 액을 전송 성장 매체의 실시간 추가 3.5 mL에 5 분 동안 품 어 biotinylation 자극 하 50 µ M에 biotin과 doxycycline 200 ng⋅mL− 1 (최종 농도) 융해 단백질의 표현을 유도 하에서 보충 하는.
- 37 ° C, 5% CO2에서 적어도 20 h에 대 한 셀을 품 어.
- 수확 및 저장 세포의
- PBS, 두 번 셀을 씻어 다음 각 접시에 PBS의 1.5 mL를 추가 하 고는 scrapper로 세포를 수확.
- 15 mL 튜브에 하나의 조건에 해당 하는 수확된 셀을 전송 하 고 1200 x g, 5 분, 4 ° C에서 원심 분리 하 여 그들을 수확합니다
- 제거는 supernatants 및 스냅 처리까지 액체 질소, 다음 80 ° C에 게 알 약을 동결.
참고: 또는 셀 수 또한 될 trypsinization에 의해 분리, 성장 매체에 수확, 15 mL 튜브에 전송 하 고 동결 하기 전에 PBS 가진 3 시간을 세척.
- 세포 lysates의 준비
- Resuspend 실시간 패스에서 세포의 용 해 버퍼 (50 mM Tris pH 7.4, 500 mM NaCl, 0.4 %SDS, 5 mM EDTA, 1mm DTT, 1 완전 한 protease 억제제 x)의 1 mL에 셀 펠 릿 세포 10-20 시간 (5 ~ 10 선) 25g 바늘을 통해.
- Sonification 장치 샘플을 sonicate.
참고: sonification 장치 재료의 테이블에에서 표시 된, 다음과 같은 프로그램 사용할 수 있습니다: 높은 강도, 30에서 4 사이클 주기 감기 (4 ° C) 당 s 물 목욕. 다른 sonification 장치는 적합 하지만 매개 변수를 적절 하 게 조정 해야 할 수 있습니다. - 추가 하는 복구 된 트라이 톤 X-100 sonicated lysate 2%의 최종 농도 도달 하 (일반적으로 100 μ 추가 20%의 트라이 톤 X-100 900 μ에 세포 lysate sonicated), 다음 2.3 ml 50 mm Tris, pH = 7.4 b 앞 150 m m NaCl 농도 조정 lysate의 1 mL 당 구슬 streptavidin 결합을 inding.
중요 한 참고: 높은 소금 농도 구슬에 훨씬 덜 효율적인 바인딩에서 수시로 유래한 다. - 1.5 mL 튜브에 조정된 lysates 배포 (ca. 3 관에서 1.1 mL)와 16000 x g, 10 분, 4 ° C에서 원심
- supernatants 전송 (ca. 3.2 mL) 15 mL 튜브 및 입력 자료로 계속 50-100 μ.
- Bradford 분석 실험과 각 샘플의 농도 측정 하 고 3에서 3.5 mg 단백질 함량의 상응 streptavidin 풀 다운 사용 합니다.
- Streptavidin 풀 다운
참고: 풀 다운 절차의 개요는 그림 4에 표시 됩니다. 그것은 원래 프로토콜 루와 동료2에 의해 거의 동일 합니다. 처음으로 풀 다운 메뉴 수행 통해 흐름과 세척 1-4의 샘플 넣어 수 있습니다 제쳐두고 되도록 서쪽 오 점 분석에 대 한 제대로 작동 절차 (그림 5).- 각 조건에 대해 1.5 mL 튜브에 결합 하는 streptavidin 자석 구슬 서 스 펜 션의 200 μ를 전송 합니다. 마그네틱 선반에 튜브를 두십시오, 구슬 튜브의 측면에 충실 될 때까지 기다립니다 (ca. 1 분) 저장소 버퍼를 제거 하 고.
- 부드럽게 평형 버퍼 (50 mM Tris pH 7-4, 150 mM NaCl, 0.05% 트라이 톤 X-100 그리고 1 mM DTT)의 1 mL와 혼합 하 여 구슬을 씻어.
- 마그네틱 선반에 다시 필요한 수 관 (보통 때 시작 3-3.5 mg 단백질 콘텐츠, 각 조건에서 lysates 2 ~ 4 1.5 mL 튜브에 파견 될 수 있다)와 장소에서에서 동일한 금액에 equilibrated 구슬 파견.
- 재래식 버퍼를 제거 하 고 단계의 4.4.7 해당 세포 lysates의 동등한 양의와 구슬의 각 세트를 resuspend. 회전 바퀴에 4 ° C에서 밤새 품 어.
- 다음 날, 1.5 mL 튜브 자석 선반에, 구슬 튜브의 측에 충실 하 고 15 mL 튜브를 통해 흐름으로 분류 하는 supernatants 전송 될 때까지 기다립니다.
참고: 이제 부터는, 모든 단계는 수행 실 온에서 달리 명시 되지 않는 한. - 워시 버퍼 1 (물에 2 %SDS), 200 μ와 각 튜브에 구슬 resuspend을 1.5 mL 튜브에 하나의 조건에 해당 하는 resuspended 구슬의 각 집합을 결합 합니다.
- 8 분 동안 두 번 구슬 회전 바퀴 워시 버퍼 1의 1 mL에 씻는 다.
- 8 분 동안 두 번 구슬 회전 바퀴 워시 버퍼 2의 1 mL에 세척 (50 mM HEPES pH 7.4, 1 mM EDTA, 500 mM NaCl, 1% 트라이 톤 X-100, 그리고 0.1% 나 deoxycholate).
- 8 분 동안 두 번 구슬 회전 바퀴 워시 버퍼 3의 1 mL에 세척 (10 mM Tris pH 8, 250 m m LiCl, 1 mM EDTA, 0.5 %NP-40, 그리고 0.5% 나 deoxycholate).
- 8 분 동안 두 번 구슬 회전 바퀴 워시 버퍼 4의 1 mL에 세척 (50 mM Tris pH 7.4, 50 mM NaCl, 0.1 %NP-40).
- 마지막 세척 단계 후 워시 버퍼 완전히 제거 되었는지 확인 하는 상쾌한의 대부분을 제거 하 고 샘플 아래로 회전. 마그네틱 선반에 다시 넣어, 구슬 튜브의 측면에 충실 한 다음 나머지 버퍼 제거 될 때까지 기다립니다.
- 추가 차입 버퍼의 30 μ (10 mM Tris pH 7.4, 2 %SDS, 5% β-mercaptoethanol와 2 mM Biotin) 구슬에. 15 분 동안 98 ° C에 품 어 다음 자석 선반에 비즈를 즉시 제거 합니다.
- 추가 처리까지 신선한 튜브를-20 ° C에서 저장소 eluted 샘플을 전송 합니다.
- SDS 페이지와 서 부 럽
참고: 질량 분석 분석 이전이 좋습니다 biotinylation 및 풀 다운의 성공을 평가 하기 위해 SDS 페이지와 서쪽 오 점. Biotinylation 패턴 하나를 고려할 수 있습니다 관찰 되는 경우 dox 또는 biotin에 매체에 추가 되지 않은 또는 두 재고 솔루션의 한 손실이 크다.- 각 입력된 샘플에 대 한 총 28 μ에서에서 3 x SDS 로딩 버퍼의 적절 한 볼륨으로 같은 양의 단백질 견본을 혼합 하 여 페이지 샘플을 준비 합니다. 3 x SDS 로딩 버퍼의 2.5 µ L를 각 차입 샘플의 5 µ L를 혼합 하 여 페이지 샘플을 준비 합니다.
- SDS polyacrylamide 젤에 샘플 (25 µ L/잘 입력, 차입 샘플 7 µ L/잘)을 로드 합니다. 전기 및 서양 blotting 섹션 3.4에에서 설명 된 대로 진행 합니다.
- 처음으로 풀 다운을 수행 하는 경우 준비 페이지 풀 다운 메뉴 (입력, 워시 1-4, 차입을 통해 흐름)의 각 단계에 대 한 샘플 SDS 로딩 버퍼 또는 5 µ L (차입) 3의 2.5 µ L x 3의 10 µ L 각 샘플 (입력, 통해, 워시 1-4)의 20 µ L를 혼합 하 여 x S DS-로딩 버퍼 및 단계 4.6.4 (그림 5)에 진행.
- MS 분석에 대 한 SDS 페이지
참고: 잠재적인 각 질 오염을 최소화 하기 위해 캐스트 젤 및 상업 샘플 로딩 버퍼 사용할 수 있습니다.- 각 차입 샘플의 18.75 μ를 4 x 샘플 버퍼의 6.25 μ를 추가 하 고 2-3 cm는 젤으로 마이그레이션할 때까지 4-20% 캐스트 SDS 젤에는 샘플을 실행.
- 콜 로이드 Coomassie 화려한 블루 G250와 젤13 15 cm 배양 접시에 얼룩 얼룩.
- 깨끗 한 메스를 사용 하 여 삭제할 streptavidin 밴드 (ca. 17 kDa, 그림 6에서 실행)를 제외 하 고 각 샘플에 대 한 전체 차선 및 삭제 밴드 1.5 mL 튜브에 전송.
- 이러한 샘플 추가 분석에 대 한 proteomics 시설에 보내기.
참고: 일반적인 MS 결과 참조 9 (그림 3 및 그림 7및 보조 테이블)에서 볼 수 있습니다. 프라이드 저장소 (승인 번호 PXD005005)에서 전체 데이터 집합을 사용할 수 있습니다.
결과
어떻게이 방법은, Ago2, 단백질의 열려있는 독서 프레임 (ORFs) 설명 하기 위해 TNRC6C 및 Dicer (모든 통로 입을 미르 중재 하는 유전자에 관련 된) 분할 BioID 플라스 미드에 복제 되었다. Ago2는 미르 유도 입을 단지 내 (miRISC)를 번역 명과 TNRC6C 상호 작용 및 대상 mRNAs14의 자극으로 알려져 있다. MiRISC, Ago2를 조립 하기 전에 Dicer, 성숙한 miRNAs는 그것 미르15로드 받을 수 있습니다 단지 내를 생성 하는 효소와 상호 작용. 따라서 분할 BioID Ago2/Dicer 쌍 또는 Ago2/TNRC6C 쌍에 적용 되었습니다. 테스트 단백질의 각 쌍에 대 한 Ago2 중 NBirA * 또는 CBirA * 우리의 분할 BioID 플라스 미드 (그림 2)를 사용 하 여 융합 Dicer와 TNRC6C는 해당 동족 BirA *를 조각 했다. 또한, 각 단백질에 CBirA * 융합 되었고와 NBirA *-부정적인 컨트롤로 GFP 융해. 이 테스트 단백질 (표 1)의 각 쌍에 대 한 4 개의 반복 테스트 결과.
분할 BioID 테스트 단백질의 쌍의 상호 작용에 따라 활성화 되어 있는지 여부를 테스트 하려면 우리는 그림 1에 표시 된 구성표를 따 랐 다. 플라스 미드는 tet 시스템 호환 HeLa 세포 라인에 페 뚜렷이 했다. 융해 단백질의 표정 doxycycline (dox)와 유도 되었다 그리고 biotinylation 성장 매체를 초과 biotin을 추가 하 여 자극 했다. Dox와 biotin 20 h 보육 시간, 다음 셀 lysed 되었고 서 부 럽 활용된 streptavidin를 사용 하 여 biotinylated 단백질을 검출 하 여 분석. 포유류 세포에서 두 주요 밴드 활용된 streptavidin untransfected 샘플 (그림 3, 별)에 의해 일반적으로 검색 하 고 endogenously biotinylated 단백질 (대부분의 아마 미토 콘 드 리아 carboxylases)에 해당. 이 두 밴드가 모든 샘플에는 내부 로드 컨트롤으로 편리 하 게 사용할 수 있습니다, 그리고 따라서, 동일한 단백질의 로딩을 제어 하는 가사 단백질의 검출은 불필요. BioID/분할-BioID 실험에 대 한 일반적인, 관찰 될 수 있다 추가 주요 밴드는 자체 biotinylated 있어 융해 단백질. 다른 biotinylated 단백질을 볼 경우에 이미이 단계에서 융합 단백질의 biotinylation를 감지 두 테스트 단백질 세포에 상호 작용을 나타냅니다. 그림 3에 표시 하는 실험에서 그것은 NBirA *는 데 분명-CBirA * TNRC6C 또는 Dicer 융해와 Ago2 융합 단백질에는 CBirA * 반대 조합 보다 더 효율적입니다-Ago2 NBirA * 다른 2의 융해를 결합 하 여 단백질 (그림 3, 위쪽 패널, 차선 2-3 차선 6-7의 농도 비교). 또한, 활성화 했다 특정 CBirA * 융해의 없음 활성화 수 NBirA *-GFP 제어 융합 단백질 감지할 수 수준 (그림 3, 비교 레인 1, 4-5 untransfected 세포에 해당 하는 8 레인). 와 있기 때문에 우리의 플라스 미드 NBirA * myc 태그 CBirA * 플래그 태그 (그림 2)는, 이러한 두 태그 (그림 3, 하단 패널)에 대 한 항 체와 각 융해 단백질의 표정 수준은 분석할 수 있습니다.
상호 작용 유도 biotinylation, 관찰 실험, 조정 될 수 있다 고 biotinylated 단백질 프로토콜 (그림 4)의 제 4에에서 표시 된 대로 streptavidin 결합 된 구슬에 격리. 처음으로 격리를 수행할 때 서쪽 더 럽 히 (그림 5) 정화의 모든 단계를 분석할 수 있습니다. 일반적으로, 바인딩 구슬에는 거의 양적 고 거의 통해 아무 누출은 세척 관찰 한다. 이전 질량 분석을 위한 샘플 처리, 유도-biotinylation 예상 대로 작동 하 고 융합 단백질 표현 되었다 서쪽 오 점 실행 권장 합니다. 표현의 융해 단백질의 부족 가난한 transfection 효율 또는 결함이 dox 유도 중 하나 이다. 융해 단백질 표현 되었다 그러나 아무 biotinylation 관찰, 경우 초과 biotin (50 μ M) 매체에 실제로 추가 했다 하 고 주식 biotin 여전히 활성 상태 인지 확인 합니다. Eluted 소재 Coomassie 스테인드 단백질 젤 (그림 6)에 일반적으로 분석은, 관찰 될 강한 밴드 약 17 kDa에 실행 하 고 해당 단위체 streptavidin 하. 밴드 내 생 biotinylated 단백질 및 융합 단백질에 해당 하는 또한 관찰 될 수 있습니다. 우리는 일반적으로 streptavidin 밴드 잘 로딩 (그림 6)까지 위의 샘플 레인의 영역을 삭제할. 삭제 밴드 1.5 mL 튜브에 저장 하 고 질량 분석 시설에 보낼 수 있습니다. 또는 바운드 단백질 결합 하는 streptavidin 구슬에 트립 신 소화 수도 있습니다 하 고 열을 형성 하는 eluted 소화 펩 티 드. 우리가 일상적으로 MaxQuant 소프트웨어16 (주로 기본 매개 변수를 사용 하 여 및 참조 9 및 일반적인 MS 결과 대 한 자세한 내용은 참조 가능한 포스트 번역 상 수정 추가 리 biotinylation,)를 사용 하 여 MS 원시 데이터를 분석 하 고 페르세우스 스위트17 후속 통계 분석을 위해 모두 자유 소프트웨어. 샘플 3 개의 생물 복제에 일반적으로 실행 됩니다. 레이블 없는 정량화를 사용 하 여, 특히 농축된 단백질 제어 상태에 확인할 수 있습니다. Endogenously biotinylated 단백질 및 단백질 비 특히 BirA * 효소에 의해 표시를 필터링 하려면 우리만 크게 6 없는 단백질 생성 된 6 개의 데이터 집합에서 히트 이상의 농축 단백질을 고려 하십시오. 또한, 우리는 NBirA * 퓨전 단백질 대체 되었다 NBirA * 분할 BioID 데이터 집합을 통해 풍성 하 게 안타 고려-GFP. 특히 세포 배양 (SILAC) 양이 많은 proteomics18아미노산 안정 동위 원소 라벨을 사용 하 여 다른 데이터 분석 전략 제안 되었습니다. 또한, 다양 한 전략의 biotinylated 펩 티 드를 사용 하 여 streptavidin 변종 약화 선호도 biotin18, 유기 용 제19 또는 biotin을 사용 하 여 특별 한 차입 조건을 직접 격리에 대 한 설명 되었습니다. 항 체20,21. 반드시 더 많은 단백질의 발견에 지도, 하는 동안 안타의 특이성으로 더 많은 자신감을 추가 하는 biotinylation 사이트의 식별 하 고 유용 때 상호 작용의 토폴로지를 주소입니다.
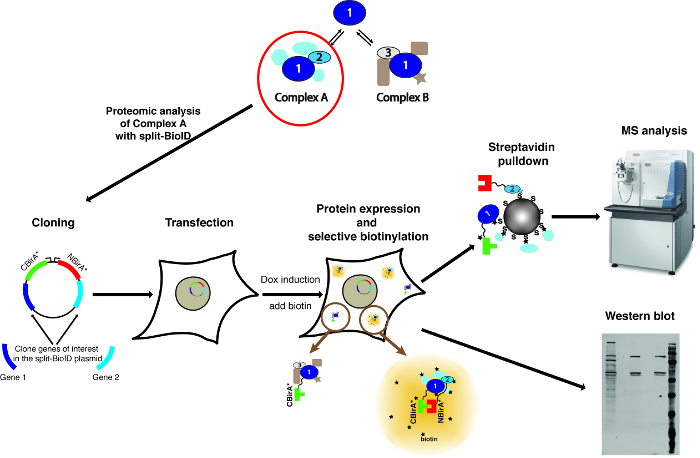
그림 1: 분할 BioID 절차의 개요. 단백질 1 상호 작용 단백질 2 복잡 한 A의 한 부분으로 또는 복잡 한 b.의 한 부분으로 단백질 3 특별히 복잡 한 A의 구성, 분할 BioID 단백질 1와 2에 적용할 수 있습니다. 질량 분석기의 사진 크리에이 티브 코몬즈 저작자 표시-공유 모두 3.0 Unported 라이센스 이며 https://commons.wikimedia.org ThermoScientificOrbitrapElite.JPG의 파일 이름에서 다운로드 한. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
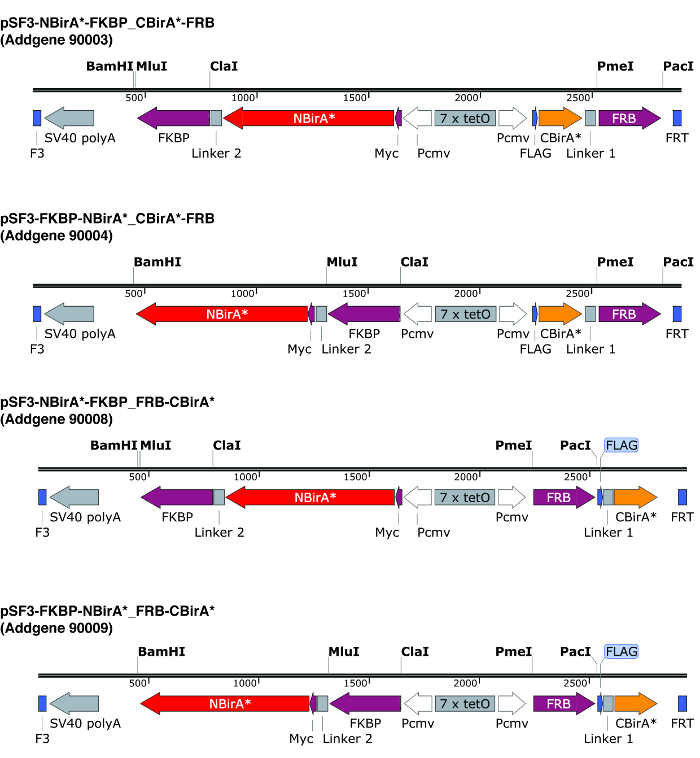
그림 2: 분할 BioID 플라스 미드의 식 카세트. 4 개의 플라스 미드 NBirA * 및 CBirA * 융해 단백질의 모든 조합을 테스트할 수 있도록 제공 합니다. 플라스 미드 및 완전 한 지도 표시 번호 addgene.org에서 사용할 수 있습니다. 플라스 미드 tet 응답 요소 (7 x tetO) 및 tet 식 시스템과 호환 되는 셀 라인에 사용 해야. 또한 모든 플라스 미드에 ORFs의 FKBP와 FRB는 융합 NBirA * 및 CBirA * 조각 각각 note. Rapamycin의 존재만이 두 가지 단백질 작용 하 고 따라서 신속 하 게이 화학9의 유무에 시스템을 테스트 하는 플라스 미드를 사용할 수 있습니다. 표시 제한 사이트 독특합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
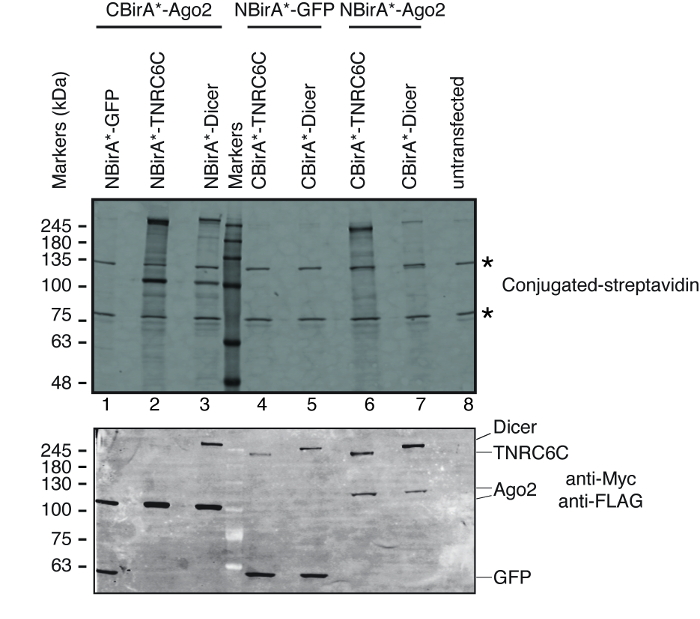
그림 3: 분할 BioID 실험에 대 한 전형적인 서쪽 오 점. 상단 패널: 붙일 레이블된 streptavidin와 biotinylated 단백질의 검출. 하단 패널: 안티 Myc 및 반대로 플래그 항 체 융합 단백질의 검출. 단백질의 2 개 쌍에서 시험 되었다: Ago2/TNRC6C 및 Ago2/Dicer. 2 & 3 차선에서 Ago2 CBirA * 조각에 추가 했다. 레인 6 & 7, Ago2 NBirA * 조각에 추가 했다. 중요 한 신호 때 세 가지 단백질의 결합 했다 NBirA * 관찰 되었다-GFP (레인 1, 4-5). 별 내부 로드 컨트롤로 사용할 수 있는 endogenously biotinylated 단백질에 해당 하는 밴드를 나타냅니다. 이 그림은 그림 5B Schopp 외 의에서 적응 크리에이 티브 코몬즈 저작자 표시 4.0 국제 라이센스 하에서 9 . 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
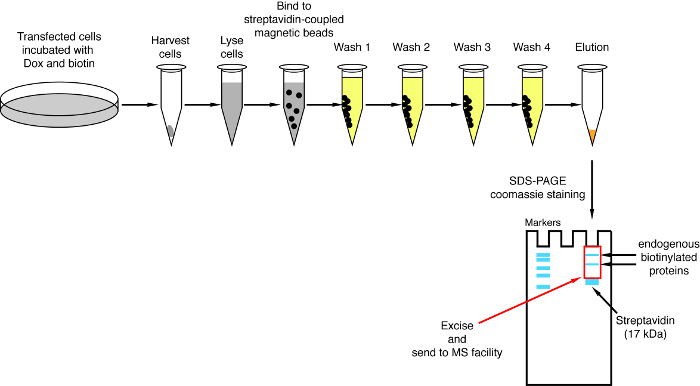
그림 4: streptavidin 풀 다운 절차의 개요. 질량 분석 분석에 대 한 biotinylated 단백질의 격리에 대 한 주요 단계 묘사 된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
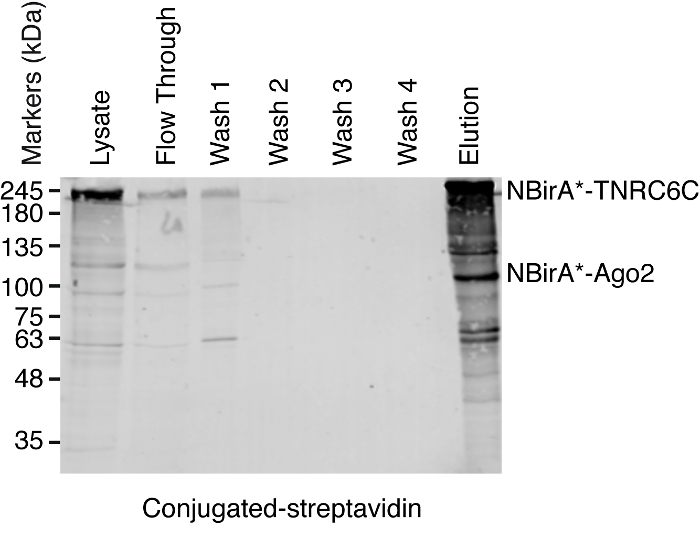
그림 5: streptavidin 풀 다운 실험에 대 한 전형적인 서쪽 오 점. 표시 된 각 샘플의 볼륨을 동등 했다 SDS polyacrylamide 젤에 로드 된. 부 럽, 다음 biotinylated 단백질 결합 하는 HRP streptavidin과 감지 했다. NBirA *에 해당 하는 밴드-TNRC6C 및 CBirA *-Ago2 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
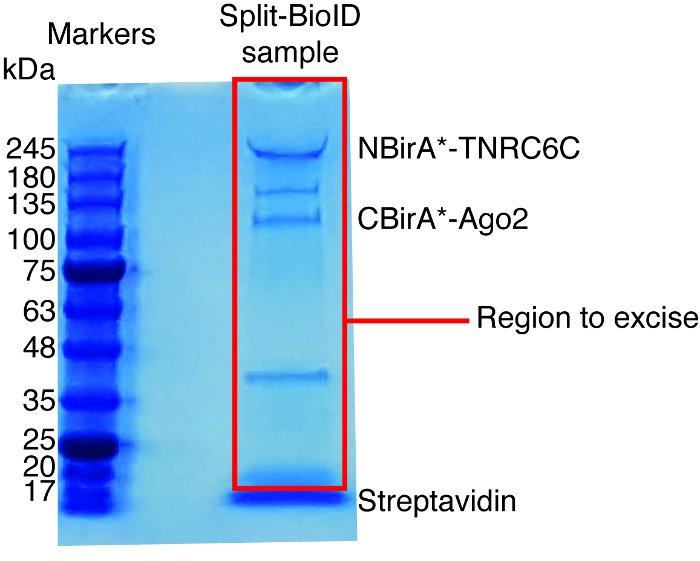
그림 6: 질량 분석 분석에 대 한 일반적인 Coomassie 스테인드 단백질 젤. 결합 하는 streptavidin 구슬에서 eluted 샘플 캐스트 단백질 젤에 로드 하 고 샘플 2-3 cm를 마이그레이션할 때까지 실행 했다. 약 17 kDa에서 본 주요 밴드 streptavidin 이다. 바로 그 밴드 위에 지역 excised 이며 질량 분석 시설에 보낸. NBirA *에 해당 하는 밴드-TNRC6C 및 CBirA *-Ago2 표시 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| Transfection 샘플 | 테스트 조건 | ||
| 1 | NBirA *-protein1 / CBirA *-protein2 | ||
| 2 | CBirA *-protein1 / NBirA *-protein2 | ||
| 3 | NBirA *-GFP / CBirA *-protein1 | ||
| 4 | NBirA *-GFP / CBirA *-protein2 | ||
| 5 | 아니 transfection | ||
표 1: 일반적으로 2 개의 단백질에 분할-BioID를 적용할 때 조건을 테스트.
| 시퀀싱 뇌관 | 시퀀스 |
| 카세트 1 역 뇌관 (CBirA * 퓨전) | TATACTTTCTAGAGAATAGGAAC |
| 카세트 2 역 뇌관 (NBirA * 퓨전) | GTGGTTTGTCCAAACTCATC |
표 2: 시퀀싱 분할 BioID 플라스 미드를 위한 뇌관.
토론
개요 절차 플라스 미드, biotinylation 상호 작용 유도 대 한 테스트 하는 방법 및 질량 분석 분석에 대 한 biotinylated 단백질을 분리 하는 방법 분할 BioID에 관심사의 유전자를 복제 하는 방법을 설명 합니다. 여기 과도 transfection에 따라 절차를 설명 합니다. 융해 단백질의 표정은 dox 매체에 추가 금액에 의해 조정 될 수 있다, 그러나 과도 transfection 조잡 한 overexpress 융합 단백질은 내 생에 비교 될 때 일부 셀과 비 균질 단백질 식으로 이어질 수 있습니다. 대조 물입니다. 이 해당 interactomes의 왜곡 하 고 충실 하 게 내 인 성 단백질을 포함 하는 상호 작용을 반영 하지 않는 PPI로 이어질 수 있습니다. 그것은 따라서 일반적으로 분할 BioID 과도 시스템으로 설정 된 후 안정 된 세포를 구성 하는 것이 좋습니다. 플라스 미드 Flp 중재 재결합 시스템과 호환 되며 동일한 tet 응답 요소의 규정의 두 유전자 장소. 필요한 경우, 그리고 호환 포유류 세포와 함께 사용 하는 경우, 안정적인 유도할 수 있는 세포의 쉽게 만들을 수 있습니다. 예를 들어 우리 rtTA 항생물질 활성화 녹음 방송 활성 제와 항생물질 중재 하는 유전자 발현 단단히 규제12수 있는 독특한 대상 게놈 소재 시를 표현 하는 헬러-EM2-11 줄을 사용 합니다. 이 세포 선 및 재결합 Flp 중재를 사용 하 여, 2-3 주 이내는 transgene의 복사본을 하나만 포함 하는 안정적인 셀 라인을 얻을 수 있습니다. 또는, 하나 또한 관심사의 유전자의 네이티브 게놈 loci에 BirA * 조각 소개 현재 게놈 편집 기술을 사용할 수 있습니다.
태그는 단백질에 의존 하는 모든 분석 결과에서 하나 결과 융해 단백질 기능 인지 고려 해야 합니다. 사용할 수 있는 데이터는 관심사의 단백질 (GFP 이미징 연구에 대 한)와 예 태그 기능 테스트는 유용 BirA * 조각 한다 결정을 복제 상류 또는 하류 관심의 유전자. 이러한 데이터를 사용할 수 있는 하나 N 말기 테스트 해야 또는 C 말기 단백질 기능 분석 결과에 태그. 예를 들어 있는 생 단백질 노크 아웃 되었고 야생 타입 상황에 비해 셀 라인에서 융해 단백질의 활동을 테스트할 수 있습니다. 관심사의 단백질 모두 N 및 C 터미널 태그 경우, 둘 다 시험 되어야 한다. 실제로, BioID 실험, 융해 단백질의 방향22라벨의 효율성을 좌우할 수 있다. 또한, 우리는 관찰 그 때 분할 BioID 단백질의 쌍에 적용, 두 단백질의는 추가 중 하나는 NBirA * CBirA * 조각 또한 영향9라벨의 효율성. 분할-BioID 플라스 미드에는 16 아미노산 긴 글리신/떠들고 풍부한 링커 BirA * 조각에 관심사의 단백질을 결합 했다 다른 PCA23 에서 촬영 하 고 모든 상호 작용 단백질에 대 한 우리를 위해 일했다 테스트 했습니다 지금까지. 그러나, 하나는 일부 단백질 쌍 짧은 지 또는 긴지를 링커 함께 잘 작동 수 있습니다 고려해 야 합니다. 최종적인 노트의 또 다른 분석 결과 Bollen 그룹24에 의해 설명 되었다. 이 분석 결과에 BirA * 우리 (E256/G257) 보다 다른 사이트 (E140/Q141)에서 분할 됩니다. 우리 모두 분할 BioID 맛 측면-의해-측면 테스트 한 E256/G257,이 프로토콜에 설명 된 두 개의 상호 작용 단백질에 결합 될 때 더 강한 재 활성화를 이끌어 발견9.
이 방법의 1 개의 일반적인 결점은 라벨의 느린 속도. 일반적으로 6 ~ 24 h 보육 시간 biotin 감지할 수 biotinylation6, 단백질 복합물의 동적 개장 공부에 대 한이 기술의 사용을 제외를 얻을 필요가 있다. 이 분석 결과 부분적으로 상호 작용 하는 두 단백질 활성화만이 경고를 해결, 하는 동안 라벨의 저속 응답 매우 동적 프로세스 또는 짧은 단백질 분석 공부에 대 한 그것의 사용을 배제. 설계 된 과산화 효소 APEX2 1 분3이내 근 단백질의 효율적인 라벨 홍보로 알려져 있다. APEX2에 따라 PCA BioID 파생 분석 실험의 느린 표시 속도 한계를 주소 따라서 수 있습니다. 증거의 원리 연구 같은는 분할 APEX2 분석 결과25설명. 그러나, homodimerizing 단백질은 성공적으로 biotinylated, 증명 남아 여부 분석 결과 또한 사용할 수 있습니다 레이블 및 단백질 단백질 상호 작용의 한 쌍의 주위에 조립 확인 하. 최근 감독된 진화 했다 TurboID 그리고 miniTurbo, 10 분26으로 훨씬 짧은 표시 시간 창을 허용 하는 향상 된 활동의 BirA * 2 개의 이체를 만드는 데 사용 됩니다. 분할-BioID이 새로운 변종에 적응 추가 애플 리 케이 션의 광범위 한 분야에이 기술의 사용을 확장할 것입니다.
공개
저자는 공개 없다.
감사의 말
이 작품은 독일 우수 이니셔티브 (CellNetworks DFG 실 81)와 공동 연구 센터 SFB638 부분 회계를 통해 독일 연구 위원회 (DFG)에 의해 융자 되었다.
자료
| Name | Company | Catalog Number | Comments |
| Acetic acid (glacial) | VWR | 20104.298 | To make TAE buffer |
| Agarose | Sigma | A9539 | Take TAE-agarose gels for DNA analysis and extraction |
| Ammonia solution 25% NH3 | Bernd Kraft | 6012 | To dissolve biotin |
| Ampicillin | Sigma | A9518 | To select transformed bacteria |
| Bioruptor plus sonification device | Diagenode | B01020001 | Other sonification devices are also ok |
| Biotin | Sigma | B4639 | To be added to the growth medium to stimulate efficient biotinylation |
| Bovine serum albumin fraction V | Carl Roth | 8076 | Used in Western blot buffers and a protein standard in Bradford assays |
| Bradford Ultra reagent | Expedeon | BFU05L | Any other method/kit for protein determination is fine, this particular reagent is more tolerant to detergent than other Bradford reagents |
| Cell scrappers | TPP | 99002 | Any other model is also fine |
| ClaI | New England Biolabs | R0197 | Restriction enzyme for cloning into the split-BioID plasmids (NBirA* fusion) |
| DMEM medium | Sigma | D6046 | If using another cell line, use the corresponding optimal growth medium |
| DNA miniprep kit | Sigma | PLN350 | Any other kit is also fine |
| Doxycycline | Applichem | A2951 | Dox is light sensitive |
| DTT | Applichem | A2948 | Make 1M stock solution, store at -20 °C and always use fresh |
| DyLight 680-conjugated streptavidin | Thermo scientific | 21848 | to use with a LiCor Western blot scanning device |
| Dynabeads MyOne Streptavidin C1 | Invitrogen | 65002 | The C1 beads are not BSA coated which is preferable for downstream MS applications (no leakthrough of BSA in the final elution) |
| EDTA | Applichem | A5097 | Make a 500 mM stock, adjust pH to 8 while dissolving the EDTA powder |
| Ethanol | Sigma | 32205 | Make a 70% stock solution in which Doxycycline can be dissolved at 10 mg.mL-1 |
| Fastgene Gel/PCR DNA Extraction Kit | Nippon Genetics | FG-91302 | Any other kit is also fine |
| HCl 37% | Merck | 1.00317.1000 | To adjust pH of biotin stock solution |
| HEPES | Carl Roth | 6763 | Make a 500 mM stock solution, adjust the pH to 7.4 |
| Immobilon-FL PVDF membrane, 0.45 µm | Millipore | IPFL00010 | This membrane shows minimal autofluorescence when used with a LiCor Western blot scanning device |
| LiCl | Grüssing GmbH | 12083 | Make a 5M stock solution |
| Odyssey CLx imaging system | LI-COR | N/A | To scan Western blot membrane decorated with fluorophore-labeled antibody |
| Linear polyethylenimine (PEI) | Polysciences | 23966-2 | Any other transfection reagent is also fine |
| Milk powder | Carl Roth | T145 | To block Western blot membranes |
| MluI-HF | New England Biolabs | R3198 | Restriction enzyme for cloning into the split-BioID plasmids (NBirA* fusion) |
| Na-deoxycholate | Sigma | 30970 | Make a 10% (w/v) stock solution |
| NaCl | Sigma | 31434 | Make a 5M stock solution |
| NP-40 (Nonidet P40 substitute) | Sigma | 74385 | Make a 20% (v/v) stock solution |
| PacI | New England Biolabs | R0547 | Restriction enzyme for cloning into the split-BioID plasmids (CBirA* fusion) |
| Phosphate buffer saline (PBS) | Sigma | 806552 | To wash cells before scrapping |
| PmeI | New England Biolabs | R0560 | Restriction enzyme for cloning into the split-BioID plasmids (CBirA* fusion) |
| Protease inhibitor cocktail | Roche | 4693132001 | Added to the lysis buffer to prevent protein degradation |
| pSF3-Flag-CBir-FRB_Myc-NBir-FKBP | Addgene | 90003 | Split-BioID plasmid, mediates the co-expression of NBirA*-FKBP and CBirA*-FRB, FKBP and FRB can be replaced by two other ORFs |
| pSF3-Flag-CBir-FRB_FKBP-Myc-Nbir | Addgene | 90004 | Split-BioID plasmid, mediates the co-expression of FKBP-NBirA* and CBirA*-FRB, FKBP and FRB can be replaced by two other ORFs |
| pSF3-Flag-FRB-Cbir_Myc-NBir-FKBP | Addgene | 90008 | Split-BioID plasmid, mediates the co-expression of NBirA*-FKBP and FRB-CBirA*, FKBP and FRB can be replaced by two other ORFs |
| pSF3-Flag-FRB-Cbir_FKBP-Myc-Nbir | Addgene | 90009 | Split-BioID plasmid, mediates the co-expression of FKBP-NBirA* and FRB-CBirA*, FKBP and FRB can be replaced by two other ORFs |
| Q5 High-Fidelity PCR kit | New England Biolabs | E0555S | To amplify the ORF coding for the proteins to be tested. Any other thermostable DNA polymerase is fine. |
| Quick ligation kit | New England Biolabs | M2200S | To ligate DNA fragments into the split-BioID plasmids, any other DNA ligation system is fine. |
| RunBlue 4-20% SDS precast gels | Expedeon | BCG42012 | To use when running samples for MS analysis |
| RunBlue LDS Sample Buffer | Expedeon | NXB31010 | Running buffer for the RunBlue precast gels |
| SDS | Sigma | 5030 | Comes as a 20% stock solution |
| tet-free serum | Biowest | S181T | we use tet-free serum to minimize basal expression of the fusion proteins |
| Trans-Blot Turbo Transfer system | Bio-Rad | 1704150 | High speed Western blotting transfer system, any other transfer system is also fine |
| Tris | Carl Roth | 4855 | Make 1M stock solutions with adequate pH (7.4 and 8) |
| Triton X-100 | Applichem | A4975 | Make a 20% (v/v) stock solution |
| Tween-20 | Carl Roth | 9127 | Used in Western blot buffers, Tween 20 leads to high background fluorescence and should be omitted in the blocking and last wash step |
참고문헌
- Scott, D. E., Bayly, A. R., Abell, C., Skidmore, J. Small molecules, big targets: drug discovery faces the protein-protein interaction challenge. Nat Rev Drug Discov. 15 (8), 533-550 (2016).
- Roux, K. J., Kim, D. I., Raida, M., Burke, B. A promiscuous biotin ligase fusion protein identifies proximal and interacting proteins in mammalian cells. J Cell Biol. 196 (6), 801-810 (2012).
- Lam, S. S., et al. Directed evolution of APEX2 for electron microscopy and proximity labeling. Nat Methods. 12 (1), 51-54 (2015).
- Rhee, H. W., et al. Proteomic mapping of mitochondria in living cells via spatially restricted enzymatic tagging. Science. 339 (6125), 1328-1331 (2013).
- Kim, D. I., et al. Probing nuclear pore complex architecture with proximity-dependent biotinylation. P Natl Acad Sci USA. 111 (24), E2453-E2461 (2014).
- Kim, D. I., et al. An improved smaller biotin ligase for BioID proximity labeling. Mol Biol Cell. 27 (8), 1188-1196 (2016).
- Lambert, J. P., Tucholska, M., Go, C., Knight, J. D., Gingras, A. C. Proximity biotinylation and affinity purification are complementary approaches for the interactome mapping of chromatin-associated protein complexes. J Proteomics. 118, 81-94 (2015).
- Morriswood, B., et al. Novel bilobe components in Trypanosoma brucei identified using proximity-dependent biotinylation. Eukaryot Cell. 12 (2), 356-367 (2013).
- Schopp, I. M., et al. Split-BioID a conditional proteomics approach to monitor the composition of spatiotemporally defined protein complexes. Nat Commun. 8, (2017).
- Béthune, J., Artus-Revel, C. G., Filipowicz, W. Kinetic analysis reveals successive steps leading to miRNA-mediated silencing in mammalian cells. EMBO Rep. 13 (8), 716-723 (2012).
- Inoue, H., Nojima, H., Okayama, H. High efficiency transformation of Escherichia coli with plasmids. Gene. 96 (1), 23-28 (1990).
- Weidenfeld, I., et al. Inducible expression of coding and inhibitory RNAs from retargetable genomic loci. Nucleic Acids Res. 37 (7), e50(2009).
- Dyballa, N., Metzger, S. Fast and sensitive colloidal coomassie G-250 staining for proteins in polyacrylamide gels. J Vis Exp. (30), (2009).
- Jonas, S., Izaurralde, E. Towards a molecular understanding of microRNA-mediated gene silencing. Nat Rev Genet. 16 (7), 421-433 (2015).
- MacRae, I. J., Ma, E., Zhou, M., Robinson, C. V., Doudna, J. A. In vitro reconstitution of the human RISC-loading complex. P Natl Acad Sci USA. 105 (2), 512-517 (2008).
- Cox, J., Mann, M. MaxQuant enables high peptide identification rates, individualized p.p.b.-range mass accuracies and proteome-wide protein quantification. Nat Biotechnol. 26 (12), 1367-1372 (2008).
- Tyanova, S., et al. The Perseus computational platform for comprehensive analysis of (prote)omics data. Nat Methods. 13 (9), 731-740 (2016).
- Opitz, N., et al. Capturing the Asc1p/Receptor for Activated C Kinase 1 (RACK1) Microenvironment at the Head Region of the 40S Ribosome with Quantitative BioID in Yeast. Mol Cell Proteomics. 16 (12), 2199-2218 (2017).
- Mackmull, M. T., et al. Landscape of nuclear transport receptor cargo specificity. Mol Syst Biol. 13 (12), 962(2017).
- Kim, D. I., et al. BioSITe: A Method for Direct Detection and Quantitation of Site-Specific Biotinylation. J Proteome Res. , (2017).
- Udeshi, N. D., et al. Antibodies to biotin enable large-scale detection of biotinylation sites on proteins. Nat Methods. 14 (12), 1167-1170 (2017).
- Chapat, C., et al. Cap-binding protein 4EHP effects translation silencing by microRNAs. P Natl Acad Sci USA. 114 (21), 5425-5430 (2017).
- Luker, K. E., et al. Kinetics of regulated protein-protein interactions revealed with firefly luciferase complementation imaging in cells and living animals. P Natl Acad Sci USA. 101 (33), 12288-12293 (2004).
- De Munter, S., et al. Split-BioID: a proximity biotinylation assay for dimerization-dependent protein interactions. FEBS Lett. 591 (2), 415-424 (2017).
- Xue, M., et al. Optimizing the fragment complementation of APEX2 for detection of specific protein-protein interactions in live cells. Sci Rep. 7 (1), 12039(2017).
- Branon, T. C., et al. Directed evolution of TurboID for efficient proximity labeling in living cells and organisms. bioRxiv. , (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유