Method Article
Количественные методы изучения активности белка аргининметилтрансферазы 1-9 в клетках
В этой статье
Резюме
Эти протоколы предоставляют методологию, используемую для оценки ферментативной активности отдельных членов семейства белков аргининметилтрансферазы (PRMT) в клетках. Описаны подробные рекомендации по оценке активности PRMT с использованием эндогенных и экзогенных биомаркеров, антител, распознавающих метиларгинин, и ингибиторных инструментальных соединений.
Аннотация
Протеинметилтрансферазы (PRMT) катализируют перенос метильной группы в аргининовые остатки субстратных белков. Семейство PRMT состоит из девяти членов, которые могут монометилировать или симметрично/асимметрично диметилировать остатки аргинина. Имеется несколько антител, распознающих различные типы метилирования аргинина различных белков; таким образом, предоставляя инструменты для разработки анализов биомаркеров активности PRMT. Анализы на основе антител PRMT являются сложными из-за перекрывающихся субстратов и специфичности антител на основе мотивов. Обсуждаются эти вопросы и экспериментальная установка для исследования метилирования аргинина, вносимого отдельными PRMT. Благодаря тщательному отбору репрезентативных субстратов, которые являются биомаркерами для восьми из девяти PRMT, была разработана панель анализов активности PRMT. Здесь представлены протоколы клеточных анализов, количественно измеряющих ферментативную активность отдельных членов семейства PRMT в клетках. Преимуществом описанных методов является их простая производительность в любой лаборатории с клеточной культурой и флуоресцентным западным пятном. Специфичность субстрата и надежность выбранных антител были полностью подтверждены с помощью подходов нокдауна и сверхэкспрессии. В дополнение к подробным рекомендациям по анализу биомаркеров и антител, также представлена информация об использовании ингибитора сбора соединений инструмента для PRMT.
Введение
Метилирование аргинина является важной постпрогляционной модификацией, которая регулирует взаимодействие белка с белком и белком и белка с РНК, тем самым играя важную роль в различных клеточных процессах, таких как сплайсинг премрнК, повреждение ДНК, реакция транскрипции и опосредованная фактором роста трансдукция1,2. Аргинин метилируется белками аргининметилтрансферазами (PRMT), в результате чего получается монометиларгинин (Rme1), асимметричный диметиларгинин (Rme2a) или симметричный диметиларгинин (Rme2s)3. На основе типа метилирования PRMT классифицируются на три группы: тип I (PRMT1, 2, 3, 4, 6 и 8), которые катализируют моно- и асимметричное диметилирование; Тип II (PRMT5 и PRMT9), которые катализируют моно- и симметричное диметилирование; и тип III (PRMT7), который может только монометилировать аргинин3.
Из-за растущего числа коммерчески доступных антител, специфичных для метилирования аргинина, активность PRMT может быть измерена с использованием западного блоттинга. Флуоресцентное вестерн-блот является предпочтительным методом по сравнению с хемилюминесцентным обнаружением из-за большего динамического диапазона и линейности, более высокой чувствительности и возможности мультиплексирования4. Для количественной оценки уровней метилирования белка требуется нормализация сигнала метилирования до общих уровней белка. Выбирая антитела для общего и метилированного белка, выращенные у разных видов хозяев (например, у мышей и кроликов), можно использовать вторичные антитела, меченные различными флуорофорами, и сигнал для обоих антител может быть определен в одной и той же полосе образцов. Антитела к метил-аргинину были разработаны для идентификации и характеристики монометилированных, асимметричных или симметрично диметилированных белков, где метил-аргинин встречается в определенном контексте. Поскольку большинство PRMT богатых метилатом глицином и аргинином мотивов в своих субстратах5,несколько антител были подняты для пептидов, содержащих монометиловые или асимметричные, симметричные диметил-аргинин-глициновые повторы, такие как D5A12, ASYM24 или ASYM25 и SYM11, соответственно. Другие метиларгининовые антитела генерировали против библиотеки пептидов, содержащей асимметричный, симметричный диметил- и монометиларгинин в повторяющемся контексте, облегчающих обнаружение метил-аргинина в этих конкретных контекстах6. Существует также растущее число антител, которые распознают специфический знак аргинина на одном белке, которые позволяют селективно обнаруживать метилирование, такое как гистон H4R3me2a или BAF155-R1064me2a.
Существует несколько коммерчески доступных ингибиторов PRMT, которые могут быть использованы в качестве инструментов для клеточных анализов PRMT. Однако не все из них тщательно характеризуются избирательностью и нецелевыми эффектами, и некоторые из них следует использовать с осторожностью. Структурный геномный консорциум в сотрудничестве с академическими лабораториями и фармацевтическими партнерами разработал хорошо охарактеризованные мощные, селективные и клеточно-проницаемые ингибиторы PRMT (химические зонды), которые могут использоваться без ограничений со стороны научного сообщества. Информацию об этих ингибиторах можно найти на https://www.thesgc.org/chemical-probes/epigenetics и https://www.chemicalprobes.org/. Химические зонды представляют собой ингибиторы малых молекул с in vitro IC50 или Kd < 100 нМ, более чем 30-кратной селективностью по отношению к белкам того же семейства и значительной клеточной активностью при 1 мкМ. Кроме того, каждый химический зонд имеет близкий химический аналог, который неактивен против предполагаемойцели 7,8,9,10,11,12.
Целью этого протокола является измерение клеточной активности отдельных членов семьи PRMT с использованием метода флуоресцентного вестерн-блотта. Здесь представлена подробная информация о проверенных биомаркерах анализа, антителах и мощных клеточно-активных ингибиторах, а также ценные стратегии для успешного проведения анализа.
протокол
1. Культивирование и покрытие клеток
ПРИМЕЧАНИЕ: Культивируйте клетки с рекомендуемой средой и регулярно проверяйте на загрязнение микоплазмой. В качестве примеров были выбраны клетки HEK293T, MCF7 и C2C12, поскольку эти клеточные линии были успешно использованы в анализах PRMT.
- Культуру HEK293T, MCF7 и C2C12 в ДМЭМ дополняют 10% фетальной бычим сывороткой (FBS), пенициллином (100 Ел−1)и стрептомицином (100 мкг мл−1)в 10 см тканевых культур (ТС) блюдах.
- Для анализа PRMT8 выращивают индуцируемые нокдаун-клетки PRMT1 HEK293T в средах, содержащих доксициклин (2 мкг/мл), в течение 3 дней до начала анализа.
- Чтобы нанести ячейки, удалите и выбросьте носители с пластины.
- Добавьте 10 мл PBS (без ионов Ca+2 и Mg+2) промыть клетки и выбросить раствор.
- Добавить 1 мл трипсина-ЭДТА (0,25%), инкубировать в течение 1 мин при комнатной температуре (RT), а затем выбросить раствор. Инкубировать до тех пор, пока клетки не станут круглыми, и отсоедить от пластины. При необходимости нажмите на пластину, чтобы отсоедать ячейки. Для труднопроницаемых клеток, таких как C2C12, инкубируют пластину в течение 1-2 мин при 37 °C.
ПРИМЕЧАНИЕ: Избегайте воздействия раствора трипсина на клетки в течение более длительных периодов времени (>10 мин), так как это снизит жизнеспособность клеток. - Добавьте 1 мл предварительной проваренной среды на пластину и осторожно пипетки клеток вверх и вниз, чтобы разрушить сгустки клеток. Переложите ячейки в трубку 15 мл и добавьте 3-5 мл среды.
- Чтобы измерить количество клеток, смешайте 10 мкл клеток с 10 мкл трипанового синего и перенесите 10 мкл на гемоцитометр или используйте любой другой метод подсчета клеток.
- Разбавьте ячейки до рекомендуемой плотности клеток и поместите 500 мкл/скважину в 24-скважинные пластины TC(таблица 1). Для эндогенных анализов (PRMT1, PRMT4, PRMT5, PRMT7 и PRMT9) перейдите к шагу 3.1.
2. Трансфекция клеток
- Для экзогенных анализов (PRMT3, PRMT6, PRMT8) трансфектирует клетки HEK293T с рекомендуемым количеством ДНК (таблица 2). Ячейки HEK293T легко трансфектируются, поэтому можно использовать любой трансфекционный реагент в соответствии с инструкцией производителя.
3. Обработка компаундов
ПРИМЕЧАНИЕ: Не превышать 0,1% концентрации конечного диметилсульфоксида (ДМСО) в культуральных средах. Держите одинаковую концентрацию ДМСО в каждой скважине. Селективные ингибиторы PRMT (химические зонды) и их тесно связанные неактивные аналоги можно найти в таблице 3.
- Для эндогенных анализов (PRMT1, PRMT4, PRMT5, PRMT7 и PRMT9) удаляют меа из клеток и заменяют 500 мкл среды только соединением или ДМСО (контроль).
ПРИМЕЧАНИЕ: Обычно требуется 2 дня, чтобы наблюдать более 80% снижения уровня метилирования R. - Для экзогенных анализов (PRMT3, PRMT6, PRMT8) удаляют жи через 4 ч после трансфекции, добавляют 500 мкл среды с соединением или ДМСО в одиночку (контроль) и инкубируют в течение 20-24 ч.
4. Приготовление клеточного лисата
- Удалите все среды из скважин, промыть 100 мкл PBS для удаления остаточных сред и добавить 60 мкл лизисного буфера (20 мМ Tris-HCl pH 8, 150 мМ NaCl, 1 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 10 мМ MgCl2,0,5% тритона X-100, 12,5 Е мл−1 бензоназы, полный коктейль ингибитора протеазы без ЭДТА) в каждую скважину.
- Инкубируют менее 1 мин на RT, раскачивая пластину, чтобы распределить буфер лизиса по клеткам. Затем добавляют 3 мкл 20% мас./об.додецилсульфата натрия (SDS) до конечной 1% концентрации и смешивают, осторожно встряхивая. Переложите лизат в микроцентрифужные трубки и держите его на льду.
ПРИМЕЧАНИЕ: Перед употреблением добавьте бензоназу и коктейль из ингибитора белка в свежем виде. Добавление бензоназы быстро гидролизует нуклеиновые кислоты, что снижает вязкость клеточного лизата.
- Инкубируют менее 1 мин на RT, раскачивая пластину, чтобы распределить буфер лизиса по клеткам. Затем добавляют 3 мкл 20% мас./об.додецилсульфата натрия (SDS) до конечной 1% концентрации и смешивают, осторожно встряхивая. Переложите лизат в микроцентрифужные трубки и держите его на льду.
- Определить концентрацию белка в образцах с помощью BCA Protein Assay Kit или использовать любой другой метод, который переносит 1% SDS в растворе.
- Добавьте 2 мкл лизата и белковых эталонов (0, 1, 2, 4 и 8 мкг/мл BSA в буфере лизиса) в скважины прозрачной пластины из 96 скважин.
- Смешайте реагент А с реагентом В в соотношении 50:1 и добавьте 200 мкл на скважину. Инкубировать в течение 20 мин при 37 °C и считывать всасываемость.
- Отрегулируйте концентрацию белка с помощью буфера лизиса, чтобы она была одинаковой по образцам.
- Добавьте 20 мкл 4x нагрузочного буфера к 60 мкл клеточного лизата и нагревайте при 95 °C в течение 5 мин. После тепловой денатурации лизаты можно хранить при -20 °C.
5. Анализ вестерн-блот
- Загрузите 5-20 мкг общего клеточного лизата для анализа гистоновых белков и 20-100 мкг для других белков в 4-12% белковый гель Bis-Tris.
- Запускайте гель в буфере MOPS SDS (50 мМ MOPS, 50 мМ Tris Base, 0,1% SDS w/v, 1 мМ ЭДТА, рН 7,7) в течение примерно 2 ч при 100 В или до тех пор, пока передняя часть красителя не достигнет дна геля.
- При выполнении влажной переноски соберите сэндвич с переносом в ледяной буфер переноса Трис-Глицина (25 мМ Трис, 192 мМ Глицина, 20% v/v метанола и 0,05% мас./об SDS).
- Поместите губки, фильтровальную бумагу, мембрану PVDF и гель в соответствии с инструкциями производителя. Активируйте мембрану PVDF путем замачивания в метаноле и уравновешивайте гель в буфере переноса в течение 30 с перед сборкой.
ПРИМЕЧАНИЕ: Используйте рекомендуемую PVDF вестерн-блоттинговую мембрану, поскольку она имеет низкую автофлуоресценцию и пригодность для низкомолекулярных белков, таких как гистоны(Таблица материалов).
- Поместите губки, фильтровальную бумагу, мембрану PVDF и гель в соответствии с инструкциями производителя. Активируйте мембрану PVDF путем замачивания в метаноле и уравновешивайте гель в буфере переноса в течение 30 с перед сборкой.
- Перенос белков из геля в PVDF-мембрану в буфере переноса Трис-Глицина при 70 В в течение 1,5 ч на льду.
- Блокировать мембрану в течение 30 мин в блокирующем буфере (5% мас./об. молока в фосфатно-буферном физиологическом растворе, PBS). Промыть промывочным буфером (PBST: 0,1% v/v Tween-20 в PBS) и инкубировать с первичными антителами в растворе бытового сывороточного альбумина (BSA) (5% BSA в PBST) в течение ночи при 4 °C(таблица 3).
ПРИМЕЧАНИЕ: Для более длительного хранения стерилизуют раствор BSA с фильтром, добавляют 0,02% мас./об.азида натрия и держат при 4 °C. - Промывка мембраны 3 x 5 мин с PBST. Затем инкубируют с антителами против козы против кролика (IR800) и ослика против мыши (IR680) в рекомендуемом блокирующембуфере (Таблица материалов, таблица 3)в течение 30 мин при RT и промывают 3 х 5 мин ПБСТ.
- Считывание сигнала на флуоресцентном западном блот-томообразователье на 800 и 700 нм. Предпочтительно использовать прибор, который позволяет четко визуализировать сильные и слабые полосы в одном изображении с высокой чувствительностью и динамическим диапазоном, высоким отношением сигнал/шум, предупреждением при достижении насыщенности изображения, а также мультиплексированием двух флуоресцентных цветов в одной полосе выборки.
- Определите интенсивность полосы для анализа вестерн-блот с помощью соответствующего программного обеспечения для флуоресцентной западной визуализации.
Результаты
Ниже приведены примеры результатов вестерн-блотт для клеточных анализов отдельных PRMT. Подробная информация об анализах также приведена в таблице 4.
Анализ PRMT1
PRMT1 является основным источником асимметричного диметилирования гистина 4 аргинина 3 (H4R3me2a) в клетках13. При потере активности PRMT1 глобальные уровни Rme1 и Rme2s значительно увеличиваютсяна 13. Как показано на рисунках 1A и 1B,несколько антител могут быть использованы для мониторинга глобальных изменений rme1, Rme2a, Rme2s, а также H4R3me2a. Значительное снижение глобальных уровней Rme2a и H4R3me2a и увеличение Rme1 и Rme2s можно наблюдать после 3 дней нокдауна PRMT1 (рисунок 1A,B). Клеточные линии отличаются базальным сигналом H4R3me2a, поэтому для облегчения мониторинга потери активности PRMT1 могут использоваться клеточные линии, такие как MCF7 с высокими уровнями базального метилирования(рисунок 1C). Оптимальное время для наблюдения эффекта ингибирования PRMT1, например, при лечении ингибитором PRMT I типа MS0238,составляет 2 дня(рисунок 1D,1E). Более длительное лечение приводит к снижению жизнеспособности и роста клеток.
Анализ PRMT3
Для клеточного анализа PRMT3 нет селективных белков-биомаркеров, изменения метилирования которых могут быть обнаружены в вестерн-блотте при нокдауне PRMT3 или сверхэкспрессии. Было показано, что PRMT3 асимметрично диметилат H4R3 in vitro14,однако маркировка преимущественно осаждается PRMT1, и поэтому был разработан экзогенный анализ с сверхэкспрессией PRMT3. В соответствии с выводами in vitro, сверхэкспрессия PRMT3 дикого типа, но не его каталитического мутанта (E338Q), привела к увеличению уровней H4R3me2a(рисунок 2A). Использовались клетки HEK293T, так как они имеют низкое базальное метилирование этой марки(рисунок 1С). Анализ был дополнительно валидирован селективным ингибитором PRMT3 SGC7077,который ингибировал PRMT3-зависимое асимметричное метилирование H4R3(рисунок 2B).
Анализ PRMT4
PRMT4 асимметрично диметилирует BAF155 у аргинина 106415. Поскольку антитело, обнаруживающее BAF165-R1064me2a, является коммерчески доступным, активность PRMT4 в клетках может контролироваться с помощью вестерн-блотинга путем обнаружения изменений в уровнях маркировки R1064me2a. Потеря белка PRMT4 или ингибирование каталитической активности селективным ингибитором PRMT4, TP-06410,приводит к снижению уровней BAF165-R1064me2a(рисунок 3). 2-дневного лечения обычно достаточно, чтобы удалить большую часть сигнала метилирования.
Анализ PRMT5
PRMT5 отвечает за симметричное диметилирование большинства белков аргинина. Ранее сообщалось, что различные сложные белки SMN, включая SmBB', являются субстратами PRMT516. Активность PRMT5 можно контролировать, изучая глобальные уровни симметричного диметилирования аргинина или симметричного диметилирования белков SmBB. Нокдаун PRMT5,но не PRMT1, 3, 4, 6 и 7 приводит к снижению глобальных уровней Rme2s(рисунок 4A). В большинстве клеточных линий лечение клеток селективными ингибиторами PRMT5 LLY-28311 и GSK591 в течение 2-3 дней подавляло большую часть сигнала SmBB'Rme2s(рисунок 4B). Большинство клеток чувствительны к ингибированию PRMT5, что приводит к снижению пролиферации клеток и гибели клеток при длительном воздействии ингибитора.
Анализ PRMT6
Сообщалось, что PRMT6 является основным источником асимметричного диметилирования гистонов H3 аргинина 2 (H3R2me2a) в клетках17. В клетках HEK293T нокдаун PRMT6 в течение 3 дней был недостаточным для наблюдения значительного снижения уровня H3R2me2a. Однако сверхэкспрессия дикого типа PRMT6, но не его каталитического мутанта (V86K/D88A), повышает уровни H3R2me2a, а также H3R8me2a и H4R3me2a(рисунок 5A). Существует несколько ингибиторов, ингибирующих активность PRMT6 с различной потенцией и селективностью: селективный, аллостерический ингибитор PRMT6 SGC687018,ингибитор PRMT типа I MS0238и ингибитор PRMT4/6 MS0499. Все они ингибировали PRMT6-зависимый H3R2(рисунок 5B),а также асимметричное диметилирование H4R3 и H3R8 (данные не показаны).
Анализ PRMT7
PRMT7 монометилаты аргинина 469 как в конститутивной, так и в индуцируемой формах HSP70 (HSPA8 и HSPA1/6 соответственно)12. Хотя нет коммерчески доступных антител, которые обнаруживают уровни HSP70-R469me1, маркировка может быть обнаружена с помощью панмонометиловых антител. Потеря белка PRMT7 или ингибирование каталитической активности селективным ингибитором PRMT7, SGC302712,приводит к снижению уровня HSP70-R469me1(рисунок 6A,B). SGC3027 представляет собой проницаемый для клеток пролекарство, которое в клетках преобразуется редуктазами в селективный ингибитор PRMT7 SGC8158, поэтому клеточная потенция может различаться между клеточными линиями. Несколько линий раковых клеток экспрессируют индуцируемые изоформы HSP70 на высоких уровнях, и метилирование может быть трудно обнаружить из-за перекрывающейся неспецифической полосы ядерного происхождения(рисунок 6C). Поэтому для клеточного анализа PRMT7 рекомендуются клеточные линии, которые экспрессируют в основном HSPA8, такие как C2C12, или, поскольку HSP70 локализуется в основном в цитоплазме, определяют уровни HSP70-R469me1 в цитоплазматической фракции предпочтительных клеточных линий.
Анализ PRMT8
PRMT8 является единственным PRMT с ткане-ограниченным паттерном экспрессии - в значительной степени выраженным в мозге19. Он имеет 80% сходства последовательностей и имеет аналогичное предпочтение субстрата, как PRMT119. Он отличается от PRMT1 главным образом на N-конце, где миристоилирование приводит к ассоциации PRMT8 с плазматической мембраной20. Сообщалось, что PRMT8 вместе с PRMT1 метилирует РНК-связывающий белок EWS21. Поскольку активность PRMT8 низкая в ненейрональных клеточных линиях, а EWS также может быть метилирован PRMT1, был разработан анализ, в котором PMRT8 совместно сверхэкспрессируется вместе с EWS в нокдаун-клетках PRMT1. Поскольку PRMT1 является важным геном и его долгосрочная потеря приводит к гибели клеток, была использована индуцируемая система, в которой PRMT1 сбивается в течение 3 дней перед использованием в анализе PRMT8(рисунок 7A). Коэкспрессия PRMT8 дикого типа, но не каталитически неактивного мутанта (E185Q), вместе с EWS привела к повышению уровня асимметричного диметилирования EWS(рисунок 7B). Было протестировано несколько асимметричных антител к диметиларгинину, и метилирование было обнаружено только с антителом Asym25. Анализ был дополнительно проверен селективным химическим зондом PRMT типа I, MS0238,который уменьшал PRMT8-зависимое асимметричное диметилирование экзогенной EWS(рисунок 7B). Хотя MS023 очень эффективен в ингибировании PRMT8 в анализах in vitro, в клетках требуются высокие концентрации MS023, чтобы увидеть ингибирование метилирования21.
Анализ PRMT9
Было показано, что PRMT9 симметрично диметилирует SAP145 при аргинине 50822. К сожалению, ни одно коммерчески доступное антитело не может распознать метку. Для анализа PRMT9 использовались антитела, которые были любезно подарены доктором Яньчжун Янгом (Научно-исследовательский институт города надежды Бекмана). При сверхэкспрессии мутантный SAP145 дикого типа, но не R508K, метилируется PRMT9(рисунок 8A). Анализ был разработан для мониторинга уровней эндогенных SAP145-R508me2s и был валидирован с помощью соединения X, прототипа ингибитора PRMT9 (работа продолжается, еще не опубликована), который мощно ингибирует PRMT9 in vitro с наномолярной эффективностью. Соединение X снижало уровни SAP145-R508me2s дозозависимым образом(рисунок 8B).
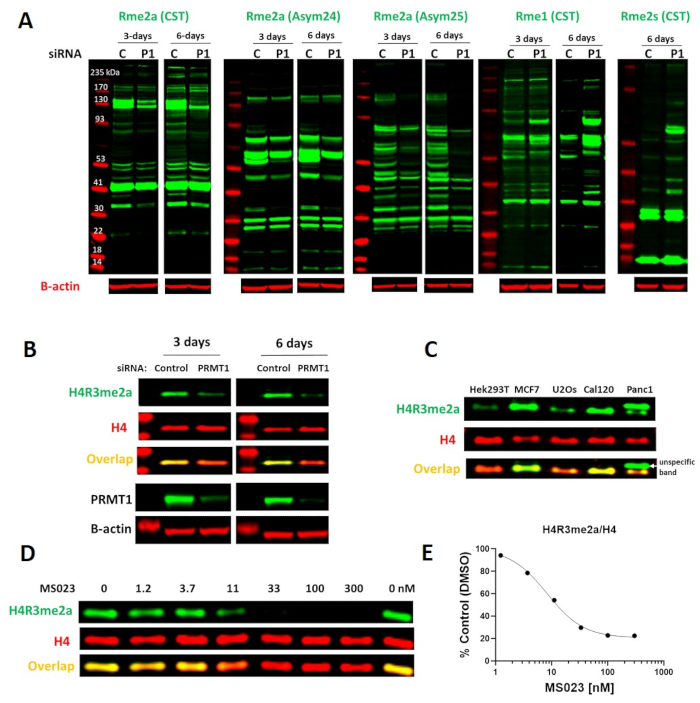
Рисунок 1. Клеточный анализ PRMT1. (A)Нокдаун PRMT1 приводит к снижению глобального асимметричного диметилирования аргинина (Rme2a) и повышению уровней симметричного диметилирования аргинина (Rme2s) и монометилирования (Rme1). Эффективность нокдауна PRMT1 представлена в панели B.(B)PRMT1 нокдаун уменьшает асимметричное диметилирование гистана H4R3 (H4R3me2a). (C) Базальные уровни H4R3me2a различаются по разным клеточным линиям. (D)Ингибитор PRMT типа I MS023 снижает уровни H4R3me2a дозозависимым образом. Клетки MCF7 обрабатывали MS023 в течение 2 дней. (E) График представляет собой нелинейную подгонку интенсивностей сигнала H4R3me2a, нормализованных до общего гистина H4. MS023 IC50 = 8,3 нМ (n=1). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
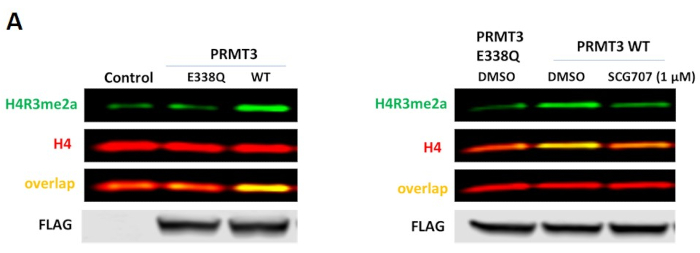
Рисунок 2. Клеточный анализ PRMT3. (A) Сверхэкспрессия каталитического мутанта PRMT3 дикого типа (WT), но не E338Q, повышает уровни H4R3me2a в клетках HEK293T. Клетки были трансфектированы помеченным FLAG PRMT3 в течение 24 ч.(B)селективный ингибитор PRMT3, SGC707, уменьшает эктопическое АСИММЕТРИЧНОЕ ДЕМЕТИЛИРОВАНИЕ H4R3, зависящего от PRMT3 Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
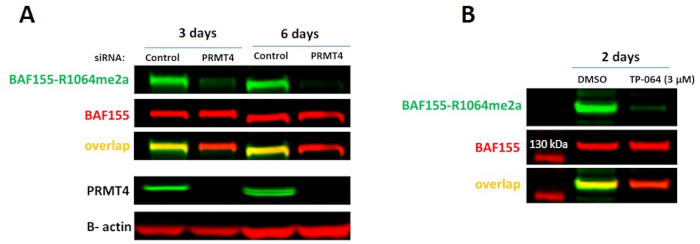
Рисунок 3. Клеточный анализ PRMT4. (A)Нокдаун PRMT4 приводит к снижению асимметричного диметилирования аргинина BAF155-R1064 (клетки HEK293T). (B)Селективный ингибитор PRMT4, TP-064, снижает уровни BAF155-R1064Rme2a. Клетки HEK293T обрабатывали соединением в течение 2 дней. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4. Клеточный анализ PRMT5. (A)Нокдаун PRMT5 приводит к снижению глобальных уровней симметричного диметилирования аргинина (клетки MCF7). (B)Селективные ингибиторы PRMT5 GSK591 и LLY-283 уменьшают симметричное диметилирование аргинина SmBB (зеленый), в то время как общие уровни SmBB' остаются неизменными (красный). Клетки MCF7 обрабатывали соединениями в течение 2 дней. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
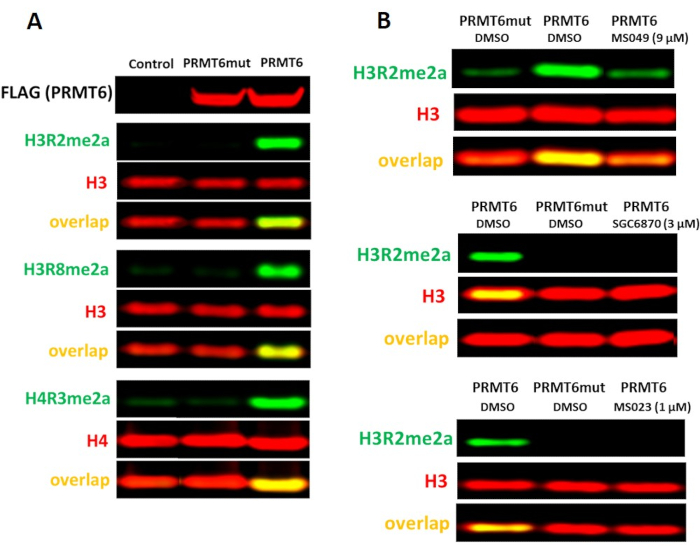
Рисунок 5. Клеточный анализ PRMT6. (A)Сверхэкспрессия дикого типа (WT), но не V86K/D88A каталитического мутанта PRMT6, увеличивает уровни H4R3me2a, H3R2me2a и H3R8me2a в клетках HEK293T. Клетки трансфектировали помеченным ФЛАГОМ PRMT6 в течение 24 ч.(B)селективный ингибитор PRMT6 (SGC6870), ингибитор PRMT типа I (MS023) и ингибитор PRMT4/6 (MS049) снижали уровни PRMT6-зависимый H3R2me2a. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
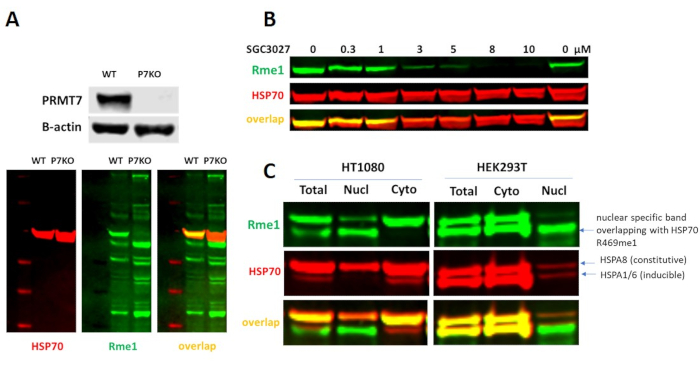
Рисунок 6. Клеточный анализ PRMT7. (A)Нокаут PRMT7 приводит к снижению монометилирования HSP70-R469 (клетки HCT116). (B)Селективные ингибиторы PRMT7, SGC3027, уменьшают монометилирование HSP70-R469 в клетках C2C12. Клетки обрабатывали соединением в течение 2 дней. (C)Обнаружение метилирования HSP70-R469 индуцируемого HSP70 (HSPA1/6) панмонометиларгининовым антителами (Rme1) может быть затруднено из-за перекрытия неспецифической полосы ядерного происхождения. Рекомендуется измерять уровни метилирования HSP70 в цитоплазматической фракции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
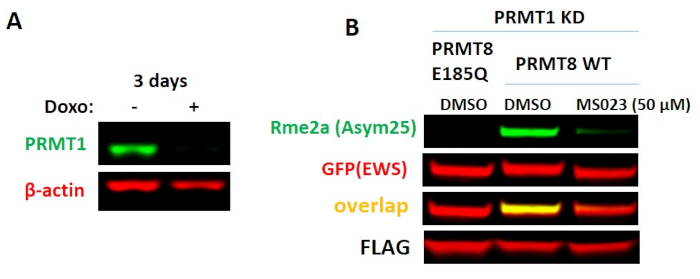
Рисунок 7. Клеточный анализ PRMT8. (A)Метилирование PRMT8 EWS может быть обнаружено, когда активность PRMT1 ингибируется нокдауном. Клетки HEK293T трансдуцировали с помощью индуцируемого нокдауна PRMT1. После 3 дней лечения доксициклином уровни PRMT1 были резко снижены. (B)Когда PRMT1 сбивается, экзогенная EWS асимметрично диметилируется сверхэкспрессированным диким типом PRMT8, но не каталитическим мутантом (E185Q) PRMT8. Метилирование снижается высокой концентрацией ингибитора PRMT типа I (MS023). Клетки HEK293T PRMT1KD ко-трансфектировались с помеченными FLAG-метками PRMT8 дикого типа или каталитическим мутантом и GFP-помеченными EWS и обрабатывались MS023 в течение 20 ч. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
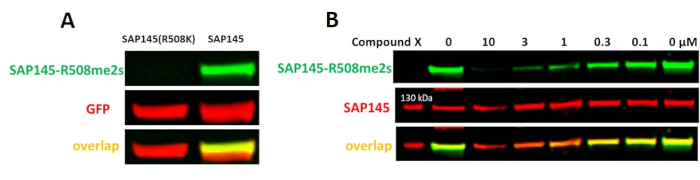
Рисунок 8. Клеточный анализ PRMT9. (A) Дикий тип, но не R508K мутант SAP145 метилируется PRMT9. Клетки HEK293T трансфектировали GFP-меткой SAP145 в течение 1 дня. (B)Прототип ингибитора PRMT9 (соединение X) уменьшает PRMT9-зависимое R508 симметричное диметилирование SAP145 дозозависимым образом. Клетки HEK293T обрабатывали соединением в течение 2 дней. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| ПРМТ | Клетки | Плотность на мл |
| ПРМТ1 | МКФ7 | 1 х 105 |
| ПРМТ3 | ХЕК293Т | 2 х 105 |
| ПРМТ4 | ХЕК293Т | 1 х 105 |
| ПРМТ5 | МКФ7 | 1 х 105 |
| ПРМТ6 | ХЕК293Т | 2 х 105 |
| ПРМТ7 | С2С12 | 1 х 105 |
| ПРМТ8 | HEK293T (PRMT1 KD)* | 2 х 105 |
| ПРМТ9 | ХЕК293Т | 2 х 105 |
| * обработать клетки доксициклином (2 мкг/мл) за 3 дня до нанесения покрытия на анализ PRMT8 | ||
Таблица 1. Типы и плотности клеток, рекомендуемые для анализов PRMT.
| ПРМТ | мкг ДНК/24-яя скважина | Аддген # | Дополнительные примечания |
| ПРМТ3 | 0.5 ФЛАГ-ПРМТ3 | 164695 | |
| или 0.5 FLAG-PRMT3 (E338Q) | 164696 | ||
| ПРМТ6 | 0.5 ФЛАГ-ПРМТ6 | 164697 | |
| или 0.5 FLAG-PRMT6(V86K/D88A) | 164698 | ||
| ПРМТ8 | 0.05 EWS-GFP | 164701 | |
| 0.45 PRMT8-ФЛАГ | 164699 | ||
| или 0.45 PRMT8(E185Q)-ФЛАГ | 164700 | ||
| ПРМТ9 | 0.05 SAP145-GFP | На.А. | подарок от д-ра Яньчжун Янга, Научно-исследовательский институт Города Надежды Бекмана |
| или 0.05 SAP145-R508K-GFP | |||
| 0.45 пустой вектор |
Таблица 2. Концентрация ДНК рекомендована для эксперимента по трансфекции.
| ПРМТ | антитело | Химический зонд (активность клеток IC50) | Отрицательный контроль |
| ПРМТ1 | H4R3me2a (1:2000) | MS023 -PRMT тип I | MS094 |
| Rme1 (1:1000) | (PRMT1, PRMT6, PRMT3, PRMT4 IC50 = 9, 56, 1000, 5000 нМ соответственно) | ||
| Rme2s (1:2000) | |||
| Rme2a (1:2000) | |||
| Rme2a (ASYM24, 1:3000) | |||
| Rme2a (ASYM25, 1:2000) | |||
| H4 (1:2000) | |||
| B-актин (1:500 ) | |||
| ПРМТ3 | H4 (1:2000) | SGC707 (IC50 = 91 нМ) | XY-1 |
| H4R3me2a (1:2000) | |||
| ФЛАГ (1:5000) | |||
| ПРМТ4 | BAF155 (1:200) | ТП-064 (IC50 = 43 нМ) | ТП064Н |
| BAF155-R1064me2a (1:3000) | СКИ-73 (IC50 = 540 нМ)* | СКИ-73Н* | |
| ПРМТ5 | анти-СмББ' (1:100) | LLY-283 (IC50 = 30 нМ) | ЛЛИ-284 |
| Rme2s (#13222, 1:2000) | GSK591 (IC50 = 56 нМ) | СГК2096 | |
| ПРМТ6 | H4R3me2a (1:2000) | SGC6870 (IC50 = 0,9 мкМ) | СГК6870Н |
| H4 (1:2000) | MS023 -PRMT тип I | MS094 | |
| H3R2me2a ( 1:2000) | (PRMT1, PRMT6, PRMT3, PRMT4 IC50 = 9, 56, 1000, 5000 нМ соответственно) | ||
| H3R8me2a (1:2000) | MS049 (PRMT 4, 6 IC50 = 970, 1400 нМ соответственно) | MS049N | |
| H3 ( 1:5000) | |||
| ФЛАГ ( 1:5000) | |||
| ПРМТ7 | Rme1 (1:1000) | SGC3027 (IC50 = 1300 нМ) * | СГК3027Н* |
| Hsp/Hsc70 (1:2000)* | |||
| ПРМТ8 | ГФП (1:3000) | MS023 (50 мкМ) | MS094 |
| Rme2a (ASYM25,1:2000) | |||
| ФЛАГ (1:5000) | |||
| ПРМТ9 | SAP145 (1:1000) | ||
| SAP145-R508me2s - добрый подарок от доктора Яньчжун Янг, Научно-исследовательский институт Города Надежды Бекмана (1:1000) (PIMID: 25737013) | |||
| Вторичные антитела | коза-анти-кролик IgG-IR800 (1:5000) | ||
| ослик антимышка IgG-IR680 (1:5000) | |||
| *- антитело распознает HSPA8, HSPA1 и HSPA6 (протестировано с переэкспрессованными белками, помеченными GFP), *пролекарство - IC50 может отличаться между различными клеточными линиями | |||
Таблица 3. Рекомендуемые антитела и соединения химического зонда PRMT / отрицательного контрольного инструмента.
| ПРМТ | Биомаркер | Считывание анализа | Проверка анализа | Рекомендуемая клеточная линия | См. | ||||||||
| ПРМТ1 | H4R3me2a, Rme1, Rme2s, Rme2a | Уровни H4R3me2a нормализованы до общих H4 глобальных уровней Rme1, Rme2a или Rme2s, нормализованных до B-актина. | Нокдаун PRMT1 снизил базальные уровни H4R3me2a и глобальные уровни Rme2a и увеличил глобальные уровни Rme1 и Rme2s в клетках (рис.1A, B). Химический зонд PRMT типа I MS023 снижал уровни H4R3me2a дозозависимым образом (рис. 1D). | Клетки различаются по базальным уровням H4R3me2a (рис. 1С). Клетки MCF7 имеют высокие базальные уровни H4R3me2a, что делает их предпочтительными для анализа, контролируя снижение активности PRMT1. | 8 | ||||||||
| ПРМТ3 | H4R3me2a | Уровни метилирования H4R3me2a, вызванные экзогенным помеченным FLAG PRMT3 WT или каталитическим мутантом E338Q (фон), нормализованным до общего гистина H4 | Сверхэкспрессия дикого типа PRMT3, но не его каталитического мутанта (E338Q), увеличивала H4R3me2a (рис. 2A). Селективный ингибитор PRMT3 SGC707 уменьшал PRMT3-зависимое повышение уровня H4R3me2a (рис. 2B) | Клетки HEK293T имеют низкие базальные уровни H4R3me2a (рис. 1С), что предпочтительно для мониторинга экзогенной активности PRMT3 | 7 | ||||||||
| ПРМТ4 | БАФ155-Р1064ме2а | Уровни BAF155-R1064me2a нормализованы до общего уровня BAF155 | Нокдаун PRMT4 уменьшал асимметричное диметилирование BAF155 (рис. 3A). 2-дневная обработка селективным химическим зондом PRMT4 (TP-064) уменьшала асимметричное диметилирование BAF155 (рис. 3B). | Любая клеточная линия | 10 | ||||||||
| ПРМТ5 | СмББ'-Рме2с | Уровни SmBB'-Rme2s, обнаруженные с пан-Rme2s антителами (CST), нормализованными до общего SmBB' | Нокдаун PRMT5 привел к снижению уровня симметричного диметилирования SmBB (рис. 4A). 2-дневная обработка селективными химическими зондами PRMT5, GSK591 и LLY285, снижение уровня SmBB'-Rme2s (рис. 4B). | Любая клеточная линия | 11 | ||||||||
| ПРМТ6 | H4R3me2a H3R2me2a H3R8me2a | Уровни метилирования H4R3me2a, H3R2me2a или H3R8me2a повышаются экзогенным помеченным ФЛАГОМ PRMT6 WT, но не каталитическим мутантом V86K, D88A (фон), нормализованным до общего гистина H4 или H3 соответственно | Сверхэкспрессия дикого типа PRMT6, но не его каталитического мутанта (V86K,D88A), повышала уровни H3R2me2a, H3R8me2a и H4R3me2a (рис. 5A). Аллостерический ингибитор PRMT6 (SGC6870), ингибитор PRMT типа I MS023, ингибитор PRMT4/6 MS049 уменьшали PRMT6-зависимое повышение уровней H3R2me2a (рис. 5B). | Клетки HEK293T имеют низкие базальные уровни H4R3me2a, H3R2me2a и H3R8me2a, что предпочтительно для мониторинга экзогенной активности PRMT6 | 8,9 | ||||||||
| ПРМТ7 | HSP70-R469me1 | Уровни метилирования HSP70-Rme1 нормализованы до общего количества HSP70 | Нокаут PRMT7 или нокдаун снижал монометилирование HSP70 (рис. 6А). 2-дневная обработка селективным химическим зондом PRMT7 SGC3027 уменьшала PRMT7-зависимое монометилирование HSP70 дозозависимым образом (рис. 6B). | C2C12, HT180 Несколько линий раковых клеток экспрессируют индуцируемую форму HSP70, сигнал метилирования которой перекрывается с неспецифическим белком ядерного происхождения (рис. 6С). В этом случае мы рекомендуем анализировать уровни метилирования HSP70 в цитоплазматической фракции. | 12 | ||||||||
| ПРМТ8 | EWS-Rme2a | Экзогенные уровни метилирования EWS с тегами GFP, вызванные экзогенным каталитическим мутантом PRMT8 WT или E185Q с тегами FLAG (фон), нормализованные до общего сигнала GFP в клетках PRMT1 KO. | Сверхэкспрессия дикого типа PRMT8, но не каталитическая мутантная метилированная эктопическая EWS дикого типа E185Q только в клетках PRMT1 KD (рис. 7A). Химический зонд PRMT типа I MS023 ингибировал асимметричное диметилирование экзогенной EWS методом PRMT8 (рис. 8B). | HEK293T PRMT1 KD (индуцируемый). Нокдаун PRMT1 приводит к гибели клеток, поэтому мы рекомендуем использовать индуцируемую систему. | 8 | ||||||||
| ПРМТ9 | SAP145-R508me2s | PRMT9-зависимое симметричное диметилирование SAP145 при R508 нормализовано до SAP145 | Потери PRMT9, но не PRMT5, приводят к снижению симметричного диметилирования SAP145. ПОМЕЧЕННЫЙ GFP SAP145 WT, но не SAP145mut (R508K), был метилирован PRMT9 (рис. 8A). 2-дневное лечение Copound X, прототипом ингибитора PRMT9, снижал уровни SAP145-R508me2s дозозависимым образом рис.8B). | Любая клеточная линия | 21 | ||||||||
Таблица 4. Резюме анализов PRMT.
Обсуждение
Здесь описаны подробные протоколы клеточного анализа для членов семейства PRMT, которые используют флуоресцентные методы вестерн-блоттинга. Были выбраны уникальные субстраты, для которых изменения метилирования аргинина могут быть легко обнаружены при индивидуальной потере PRMT или каталитическом ингибировании и не могут быть компенсированы другими членами семьи. Некоторые белки метилируются несколькими PRMT21,23,что предполагает перекрытие в специфичности субстрата, когда некоторые PRMT вносят только небольшое количество клеточной метки в данный белковый субстрат24,25,26,27,например, как PRMT8, так и PRMT1 способствуют метилированию EWS. Поэтому каждый анализ требовал тщательной валидации субстратов и антител с помощью экспериментов с нокдауном и/или сверхэкспрессией и дальнейшей валидации с помощью хорошо охарактеризованных селективных ингибиторов. Были идентифицированы специфические субстраты PRMT, для которых изменения меток метилирования могут быть обнаружены в течение 2-3 дней после потери/ингибирования PRMT, чтобы избежать усугубляющих эффектов снижения жизнеспособности и пролиферации клеток, которые могут косвенно влиять на уровни меток метил-аргинина. Хотя удалось найти уникальные субстраты для PRMT1, 4, 5, 7 и 9; для PRMT3, 6 и 8 необходимо было использовать подход, использующий функцию. Несколько аргининметилспецифических антител были протестированы для различных клеточных мишеней, но ни одно из них не смогло обнаружить значительные изменения в течение 3 дней после нокдауна PRMT3 и PRMT6; поэтому анализы биомаркеров были разработаны с использованием эктопически экспрессированных ферментов вместе с каталитически неактивными мутантами, которые служили контролем для базового метилирования субстрата. PRMT8 является близким гомологом PRMT1 и имеет сходные предпочтения субстрата. Поскольку селективный биомаркер PRMT8 не мог быть идентифицирован, был разработан анализ в нокдаунных клетках PRMT1, где PRMT8 был совместно экспрессирован вместе с EWS. PRMT1 также является основным ферментом, ответственным за асимметричное метилирование H4R3, поэтому для использования H4R3me2a в качестве биомаркера для клеточных анализов PRMT3 и PRMT6 были выбраны клетки с низким базальным уровнем H4R3me2a, а также каталитически неактивные мутанты использовались в качестве фонового контроля. Хотя эндогенные анализы являются предпочтительными, экзогенные анализы оказываются бесценными для тестирования клеточной эффективности нескольких селективных ингибиторов PRMT7,8,9. С ростом знаний о биологии PRMT мы ожидаем улучшить анализы, найдя более специфические белки биомаркеров для PRMT3, PRMT6 и PRMT8.
Использование валидированных антител и соответствующих контрольных элементов имеет решающее значение для эффективности анализа PRMT. Все антитела, рекомендованные здесь, были тщательно проверены экспериментами по нокдауну и сверхэкспрессии, однако различия между партиями, особенно в случае поликлональных антител, все еще могут влиять на их производительность. Поэтому крайне важно использовать генетические методы и химические зонды вместе с их тесно связанными негативными контрольными данными для подтверждения надежности анализа. Кроме того, для анализов PRMT, которые требуют сверхэкспрессии белка, крайне важно использовать каталитически неактивные мутанты вместе с белком дикого типа для определения базальных уровней метилирования.
Эта коллекция количественных анализов для профилирования активности PRMT в клетках может быть широко полезна для научного сообщества, поскольку она может быть быстро и легко реализована с минимальным оборудованием и ограниченным техническим опытом, включая только базовые методы культивирования клеток и флуоресцентного западного блоттинга. Рекомендуемые антитела и химические зонды для PRMT также могут быть использованы для анализа профилирования белка на основе активности (ABPP) для установления пригодности данного зонда ABPP, мониторинга поражения цели и оценки внецелевого воздействия с использованием конкурентного формата ABPP. Подходы к разработке анализов, обсуждаемые здесь, также могут быть экстраполированы для других семейств ферментов, таких как белковые лизин-метилтрансферазы и ацетилтрансферазы.
Раскрытие информации
Авторы не имеют каких-либо конкурирующих финансовых интересов или других конфликтующих интересов, которые можно было бы декларировать.
Благодарности
Консорциум структурной геномики является зарегистрированной благотворительной организацией (нет: 1097737), которая получает средства от AbbVie, Bayer AG, Boehringer Ingelheim, Genentech, Genome Canada через Институт геномики Онтарио [OGI-196], ЕС и EFPIA через совместное предприятие Innovative Medicines Initiative 2 [грант EUbOPEN 875510], Janssen, Merck KGaA (aka EMD в Канаде и США), Pfizer, Takeda и Wellcome Trust [106169/ZZ14/Z].
Материалы
| Name | Company | Catalog Number | Comments |
| 10 cm TC dishes | Greiner bio-one | 664160 | |
| 24-well TC plates | Greiner bio-one | 662160 | |
| 4–12% Bis-Tris Protein Gels | ThermoFisher Scientiffic | NP0323BOX, NP0322BOX,NP0321BOX | |
| Amersham Hybond P PVDF membrane | Millipore-Sigma | 10600021 | |
| anti-Asym 24 | Millipore-Sigma | 07-414 | |
| anti-Asym 25 | Millipore-Sigma | 09-814 | |
| anti-B-actin | Santa Cruz Biotechnologies | sc-47778 | |
| anti-BAF155 | Santa Cruz Biotechnologies | sc-32763 | |
| anti-BAF155-R1064me2a | Millipore-Sigma | ABE1339 | |
| anti-FLAG (#, 1:5000) | Millipore-Sigma | F4799 | |
| anti-GFP | Clontech | 632381 | |
| anti-H3 | Abcam | ab10799 | |
| anti-H3R2me2a | Millipore-Sigma | 04-848 | |
| anti-H3R8me2a | Rockland | 600-401-I67 | |
| anti-H4 | Abcam | ab174628 | |
| anti-H4R3me2a | Active Motif | 39705 | |
| anti-Hsp/Hsc70 | Enzo | ADI-SPA-820 | |
| anti-PRMT1 | Millipore-Sigma | 07-404 | |
| anti-PRMT3 | Abcam | ab191562 | |
| anti-PRMT4 | Bethyl | #A300-421A | |
| anti-PRMT5 | Abcam | ab109451 | |
| anti-PRMT6 | Abcam | ab47244 | |
| anti-PRMT7 | Abcam | ab179822 | |
| anti-Rme1 | CST | 8015 | |
| anti-Rme2a | CST | 13522 | |
| anti-Rme2s | CST | 13222 | |
| anti-Rme2s (ASYM25), Millipore, , 1:2000) | 09-814 | ||
| anti-SAP145 (Abcam, #, 1:1000) | Abcam | ab56800 | |
| anti-SAP145-R508me2s | kind gift from Dr. Yanzhong Yang, Beckman Research Institute of City of Hope | ||
| anti-SmBB’ | Santa Cruz Biotechnologies | sc-130670 | |
| benzonase | PRODUCED IN-HOUSE | ||
| BSA | Millipore-Sigma | A7906 | |
| C2C12 | gift from Dr. Stephane Richard, McGill University | ||
| cOmplete, EDTA-free Protease Inhibitor Cocktail | Millipore-Sigma | 11873580001 | |
| DMEM | Wisent | 319-005-CL | |
| DMSO | Bioshop | DMS666.100 | |
| donkey anti-mouse IgG-IR680 | Licor | 926-68072 | |
| doxycycline | Millipore-Sigma | D9891 | |
| EDTA | Bioshop | EDT111.500 | |
| FBS | Wisent | 80150 | |
| glycine | Bioshop | GLN002.5 | |
| goat-anti-rabbit IgG-IR800 | Licor | 926-32211 | |
| HEK293T | gift from Dr. Sam Benchimol, York University | ||
| Image Studio Software ver 5.2 | Licor | ||
| Loading buffer: NuPAGE LDS Sample Buffer (4x) | ThermoFisher Scientiffic | NP0007 | |
| MCF7 | ATCC® HTB-22™ | ||
| NaCl | Bioshop | SOD001.1 | |
| NuPAGE MOPS SDS Running Buffer | ThermoFisher Scientiffic | NP0001 | |
| Odyssey Blocking Buffer (dilute 4 x with PBST) | Licor | 927-40000 | Intercept (PBS) Blocking Buffer can also be used # 927-70001 |
| Odyssey CLX Imaging System | Licor | model number 9140 | |
| PBS (tissue culture) | Wisent | 311-010-CL | |
| PBS (western blot) | Bioshop | PBS405.4 | |
| penstrep | Wisent | 450-201-EL | |
| Pierce™ BCA Protein Assay Kit | ThermoFisher Scientiffic | 23225 | |
| SDS | Bioshop | SDS001.1 | |
| skim milk powder | Bioshop | SKI400.500 | |
| TC20 automated cell counter | Biorad | 1450102 | |
| Tripsin-EDTA (0.25%) | Wisent | 325-043-EL | |
| Tris | Bioshop | TRS003.5 | |
| Tritton X-100 | Bioshop | TRX506 | |
| trypan blue | GIBCO | 15250-061 | |
| Tween-20 | Bioshop | TWN510.500 |
Ссылки
- Blanc, R. S., Richard, S. Arginine Methylation: The Coming of Age. Molecular Cell. 65 (1), 8-24 (2017).
- Yang, Y., Bedford, M. T. Protein arginine methyltransferases and cancer. Nature Reviews Cancer. 13 (1), 37-50 (2013).
- Bedford, M. T., Richard, S. Arginine methylation an emerging regulator of protein function. Molecular Cell. 18 (3), 263-272 (2005).
- Eaton, S. L., et al. A guide to modern quantitative fluorescent western blotting with troubleshooting strategies. The Journal of Visualized Experiments. (93), e52099 (2014).
- Thandapani, P., O'Connor, T. R., Bailey, T. L., Richard, S. Defining the RGG/RG motif. Molecular Cell. 50 (5), 613-623 (2013).
- Dhar, S., et al. Loss of the major Type I arginine methyltransferase PRMT1 causes substrate scavenging by other PRMTs. Science Reports. 3, 1311 (2013).
- Kaniskan, H. U., et al. A potent, selective and cell-active allosteric inhibitor of protein arginine methyltransferase 3 (PRMT3). Angewandte Chemie International Edition. 54 (17), 5166-5170 (2015).
- Eram, M. S., et al. A Potent, Selective, and Cell-Active Inhibitor of Human Type I Protein Arginine Methyltransferases. ACS Chemical Biology. 11 (3), 772-781 (2016).
- Shen, Y., et al. Discovery of a Potent, Selective, and Cell-Active Dual Inhibitor of Protein Arginine Methyltransferase 4 and Protein Arginine Methyltransferase 6. Journal of Medicinal Chemistry. 59 (19), 9124-9139 (2016).
- Nakayama, K., et al. TP-064, a potent and selective small molecule inhibitor of PRMT4 for multiple myeloma. Oncotarget. 9 (26), 18480-18493 (2018).
- Bonday, Z. Q., et al. LLY-283, a Potent and Selective Inhibitor of Arginine Methyltransferase 5, PRMT5, with Antitumor Activity. ACS Medicinal Chemistry Letters. 9 (7), 612-617 (2018).
- Szewczyk, M. M., et al. Pharmacological inhibition of PRMT7 links arginine monomethylation to the cellular stress response. Nature Communications. 11 (1), 2396 (2020).
- Goulet, I., Gauvin, G., Boisvenue, S., Cote, J. Alternative splicing yields protein arginine methyltransferase 1 isoforms with distinct activity, substrate specificity, and subcellular localization. Journal of Biological Chemistry. 282 (45), 33009-33021 (2007).
- Siarheyeva, A., et al. An allosteric inhibitor of protein arginine methyltransferase 3. Structure. 20 (8), 1425-1435 (2012).
- Stefansson, O. A., Esteller, M. CARM1 and BAF155: an example of how chromatin remodeling factors can be relocalized and contribute to cancer. Breast Cancer Research. 16 (3), 307 (2014).
- Pesiridis, G. S., Diamond, E., Van Duyne, G. D. Role of pICLn in methylation of Sm proteins by PRMT5. Journal of Biological Chemistry. 284 (32), 21347-21359 (2009).
- Guccione, E., et al. Methylation of histone H3R2 by PRMT6 and H3K4 by an mLL complex are mutually exclusive. Nature. 449 (7164), 933-937 (2007).
- Yudao Shen, ., L, F., et al. A First-in-class, Highly Selective and Cell-active Allosteric Inhibitor of Protein Arginine Methyltransferase 6 (PRMT6). BioRxiv. , 1-21 (2020).
- Pahlich, S., Zakaryan, R. P., Gehring, H. Identification of proteins interacting with protein arginine methyltransferase 8: the Ewing sarcoma (EWS) protein binds independent of its methylation state. Proteins. 72 (4), 1125-1137 (2008).
- Lee, J., Sayegh, J., Daniel, J., Clarke, S., Bedford, M. T. PRMT8, a new membrane-bound tissue-specific member of the protein arginine methyltransferase family. Journal of Biological Chemistry. 280 (38), 32890-32896 (2005).
- Kim, J. D., Kako, K., Kakiuchi, M., Park, G. G., Fukamizu, A. EWS is a substrate of type I protein arginine methyltransferase, PRMT8. International Journal of Molecular Medicine. 22 (3), 309-315 (2008).
- Yang, Y., et al. PRMT9 is a type II methyltransferase that methylates the splicing factor SAP145. Nature Communications. 6, 6428 (2015).
- Rakow, S., Pullamsetti, S. S., Bauer, U. M., Bouchard, C. Assaying epigenome functions of PRMTs and their substrates. Methods. 1175, 53-65 (2020).
- Musiani, D., et al. Proteomics profiling of arginine methylation defines PRMT5 substrate specificity. Science Signaling. 12 (575), (2019).
- Musiani, D., Massignani, E., Cuomo, A., Yadav, A., Bonaldi, T. Biochemical and Computational Approaches for the Large-Scale Analysis of Protein Arginine Methylation by Mass Spectrometry. Current Protein and Peptide Science. 21 (7), 725-739 (2020).
- Shishkova, E., et al. Global mapping of CARM1 substrates defines enzyme specificity and substrate recognition. Nature Communications. 8, 15571 (2017).
- Pawlak, M. R., Banik-Maiti, S., Pietenpol, J. A., Ruley, H. E. Protein arginine methyltransferase I: substrate specificity and role in hnRNP assembly. Journal of Cellular Biochemistry. 87 (4), 394-407 (2002).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены