Method Article
Полуавтоматический фенотипический анализ функциональных 3D культур сфероидных клеток
В этой статье
Резюме
Представлен протокол выращивания высоковоспроизводимых сфероидов и их фенотипическая характеристика с использованием захвата изображений и протеомики.
Аннотация
Представлен протокол, описывающий свойства и преимущества использования автономного клиностат-инкубатора для выращивания, обработки и мониторинга 3D-клеточных культур. Клиностат имитирует среду, в которой клетки могут собираться в высоковоспроизводимые сфероиды с низкими силами сдвига и активной диффузией питательных веществ. Мы демонстрируем, что как раковым, так и нераковым гепатоцитам (клеточным линиям HepG2/C3A и THLE-3) требуется 3 недели роста, прежде чем они достигнут функциональности, сопоставимой с клетками печени. Этот протокол подчеркивает удобство использования инкубаторов для 3D-клеток с камерами, отслеживающими рост клеток, поскольку снимки могут быть сделаны для подсчета и измерения сфероидов после обработки. Мы описываем сравнение клеточных линий THLE-3 и HepG2/C3A, показывая, как можно выращивать нераковые клеточные линии, а также иммортализировать раковые клетки. Мы демонстрируем и иллюстрируем, как эксперименты по протеомике могут быть проведены из нескольких сфероидов, которые могут быть собраны без нарушения клеточной сигнализации, т.е. без трипсинизации. Показано, что протеомный анализ может быть использован для мониторинга типичного для печени фенотипа метаболизма дыхательной цепи и продукции белков, участвующих в детоксикации металлов, и описана полуавтоматическая система для подсчета и измерения площади сфероида. В целом, протокол представляет собой набор инструментов, который включает в себя фенотипическую характеристику с помощью захвата изображений и конвейер протеомики для экспериментов на 3D-моделях клеточных культур.
Введение
Было доказано, что культуры клеток in vitro необходимы и бесценны для создания фундаментальных знаний в биологии. Большая часть научных знаний в биологии и, в частности, в раке пришла из двухмерной системы культивирования, которая представляет собой клетки, растущие в монослое. Несмотря на то, что двухмерная культура является доминирующей системой культивирования клеток, она имеет много недостатков, которые потенциально могут задушить дальнейший биологический прогресс. Например, в 2D-культурах отсутствуют межклеточные взаимодействия, важные для клеточной сигнализации и пролиферации1. На сегодняшний день было показано, что 3D-системы культивирования лучше моделируют дифференцировку, реакцию на лекарственные препараты, опухолевую инвазию и биологию 2,3,4,5. 3D-моделирование злокачественных опухолей особенно актуально в связи со старением населения и смертностью от рака. Гепатоцеллюлярная карцинома (ГЦК) является одной из ведущих причин смертности, связанной с раком, во всем мире и часто имеет ужасный прогноз6. Известно, что ГЦК имеет низкую частоту излечения, плохую реакцию на лекарственные препараты и высокую частоту рецидивов 6,7,8. Было разработано несколько 3D-моделей нормальной печени и ГЦК, которые имитируют физиологию in vivo нормальной и злокачественной ткани печени 9,10.
Некоторые из современных 3D-систем включают в себя жидкие накладки, биореакторы, гидрогель, каркасы и 3D-печатные конструкции. Сфероиды, генерируемые в биореакторах, обладают уникальными преимуществами, поскольку они имитируют распределение питательных веществ в опухоли, газообмен и пролиферацию/покой клеток11. Биореакторы особенно подходят для моделей рака из-за их простоты использования, большой масштабируемости, диффузии питательных веществ и доступности11. Кроме того, биореакторы позволяют проводить эксперименты с высокой пропускной способностью, большей воспроизводимостью и меньшим количеством человеческих ошибок. Биореактор, использованный в этом исследовании, уникален тем, что он имитирует систему пониженной гравитации, которая сводит к минимуму разрушительные силы сдвига, применяемые в типичных биореакторах, что обеспечивает лучшую воспроизводимость12. Всенаправленная гравитация и уменьшение сил сдвига позволяют клеткам развиваться более физиологическим образом. В качестве доказательства можно привести то, что клетки HepG2/C3A, выращенные по этой методике, развивают сферические органеллы, которые продуцируют in vivo уровни АТФ, аденилаткиназы, мочевины и холестерина13,14. Кроме того, медикаментозное лечение в этой 3D-системе является более продвинутым и автоматизированным по сравнению с 2D-культурами. В 2D-культурах медикаментозное лечение часто должно иметь короткий временной курс из-за необходимости трипсинизации и поддержания здоровья клеток. Тем не менее, в нашем случае мы можем проводить длительную медикаментозную обработку сфероидов без необходимости нарушать структуру и физиологию клеток. Таким образом, переход от 2D к 3D культурам необходим для лучшего моделирования биологических явлений in vivo и дальнейшего научного развития.
В данной работе представлена методология выращивания высоковоспроизводимых сфероидов (рис. 1 и рис. 2) и показана полуавтоматическая система фенотипической характеристики 3D-структур (рис. 3). На уровне изображения приведена информация о подсчете и измерении площади сфероидов (рис. 3). Используя методы масс-спектрометрии, мы показываем, как протеомика может быть использована для оценки конкретных биологических функций (рис. 4). Собирая и анализируя эти данные, мы надеемся улучшить понимание биологии, лежащей в основе 3D-систем клеточных культур.
протокол
1. Буферы и реагенты
- Питательная среда для клеток HepG2/C3A: Приготовьте модифицированную среду Eagle's Medium (DMEM, 4,5 г/л глюкозы), содержащую 10% фетальной бычьей сыворотки (FBS), заменимые аминокислоты (1% v/v), L-глютамин (1% v/v) и пенициллин/стрептомицин (0,5% v/v). Храните питательную среду при температуре 4 °C.
- Питательная среда для клеток THLE-3: Приготовьте питательную среду для клеток эпителия бронхов [BEGM], содержащую ее добавки (экстракт бычьего гипофиза [BPE], гидрокортизон, эпидермальный фактор роста человека [hEGF], адреналин, трансферрин, инсулин, ретиноевая кислота, трийодтиронин, гентамицин сульфат-амфотерицин [GA]), а также 10% FBS, 5 нг/мл hEGF и 70 нг/мл фосфотаноламина.
- 500 мМ DL-дитиотрейтол (DTT): Для приготовления 10 мл ресуспендируйте 0,771 г DTT в 10 мл воды класса ВЭЖХ. Хранить аликвоты объемом 100 мкл при температуре -20 °C.
- 200 мМ йодоацетамида: Для приготовления 1 мл ресуспендируйте 36 мг йодоацетамида в 1 мл 50 мМ бикарбоната аммония. Не храните ресуспендированный йодоацетамид.
- 5% додецилсульфат натрия (SDS): для приготовления 50 мл ресуспендируйте 2,5 г SDS в 50 мл 50 мМ бикарбоната аммония. Хранить при температуре 4 °C.
- 12% ортофосфорная кислота: Для приготовления 100 мл разведите 14,1 мл 85% фосфорной кислоты в 85,9 мл воды класса ВЭЖХ. Хранить в стеклянной бутылке при комнатной температуре (RT).
- Связывающий буфер: Для приготовления 1 л добавьте 900 мл концентрированного метанола к 100 мл 10 мМ бикарбоната аммония или TEAB.
- 0,1% раствор трифторуксусной кислоты (ТЖК): Добавьте 1 мл концентрированного ТЖК в 999 мл воды класса ВЭЖХ. Хранить при температуре 4 °C.
- 60% раствор ацетонитрила/0,1% ТЖК: добавьте 600 мл ацетонитрила класса ВЭЖХ (60% v/v) в 399 мл воды класса ВЭЖХ. Затем добавьте в этот раствор 1 мл концентрированного ТЖК, затем храните при температуре 4 °C.
- Подвижная фаза А (МПА) - 0,1% муравьиная кислота: Добавьте 1 мл концентрированной муравьиной кислоты к 999 мл воды класса ВЭЖХ и хорошо перемешайте.
- Мобильная фаза B (MPB) - 80% ацетонитрила класса ВЭЖХ + 0,1% муравьиной кислоты: добавьте 800 мл ацетонитрила класса ВЭЖХ в 199 мл воды класса ВЭЖХ. Далее добавьте в этот раствор 1 мл концентрированной муравьиной кислоты и перемешайте.
2. Подготовка сфероидов
ПРИМЕЧАНИЕ: На рисунке 1А показаны начальные этапы подготовки и культивирования 3D-сфероидов из клеточных линий.
- Замороженные клетки HepG2/C3A и THLE-3 размораживают и выращивают в виде монослоя с использованием стандартной питательной среды в колбе или чашке для тканевых культур до тех пор, пока они не достигнут примерно 80% слияния.
ПРИМЕЧАНИЕ: Когда клетки достигнут слияния, проверьте общую клеточную морфологию и характер роста с помощью микроскопа. Не рекомендуется использовать ячейки при больших числах проходов. - Дважды промойте клетки сбалансированным солевым раствором Хэнка (HBSS, используйте 5 млна колбу T75 см 2 или посуду диаметром 10 см).
- Добавьте 5 мл 0,05% трипсина-ЭДТА, разведенного в HBSS (разведение 1:2), и инкубируйте в течение 5 мин при 37 °C с 5% CO2. Используйте микроскоп для оценки отслоения клеток и добавьте 3 мл FBS или питательной среды (содержащей 10% FBS) для нейтрализации реакции трипсина.
- Переложите клеточную суспензию в пробирку объемом 15 мл. Отжим вниз при 270 x g при RT в течение 5 минут.
- Аспирировать надосадочную жидкость и ресуспендировать клетки в 5 мл полной питательной среды.
ПРИМЕЧАНИЕ: Если клеток слишком много, разбавьте клеточную суспензию перед подсчетом. - Подсчитывают количество клеток и разбавляют клеточную суспензию в полной питательной среде до получения 1 х 106 в максимальном объеме 1,5 мл.
- Уравновешивайте 24-луночную круглую нижнюю пластину со сверхнизким креплением, содержащую микролунки.
- Промыть лунки 0,5 мл питательной среды.
- Центрифугируйте планшет при 3 000 x g в течение 5 мин (это удаляет пузырьки воздуха с поверхности лунок).
- Переложите клеточную суспензию (приготовленную на шаге 1.4) в планшет и центрифугу в течение 3 мин при 120 x g.
ПРИМЕЧАНИЕ: Объем клеточной суспензии может варьироваться в зависимости от количества клеток, но важно ограничить его до 1,5 мл. - Инкубируйте планшет в течение 24 ч при 37 °C с 5%CO2 , чтобы начать образование сфероида.
3. Культивирование сфероидов в биореакторы (рис. 2)
ПРИМЕЧАНИЕ: Чтобы сохранить структуру сфероидов, используйте наконечники с широким отверстием при работе с 3D-сферами.
- Уравновесите биореактор, заполнив камеру влажности 25 мл стерильной воды, а камеру клетки 9 мл питательной среды за 24 часа до переноса в нее сфероидов (рис. 2А). Обязательно используйте шприц объемом 10 мл, соединенный с длинной иглой, при заполнении камер влажности и клеток.
- Инкубируйте биореактор, вращающийся (15 об/мин) в 3D-инкубаторе (рис. 2D, F), в течение 24 ч при 37 °C с 5%CO2.
- Используя наконечники с широким отверстием объемом 1 мл, осторожно проведите пипеткой вверх и вниз, чтобы отделить сфероиды от пластины со сверхнизким креплением и переместить сфероиды в чашку для культивирования тканей.
- Промойте сверхнизкую пластину для насадки 0,5 мл предварительно подогретой питательной среды, чтобы захватить оставшиеся сфероиды, и переложите их в ту же чашку, что и на шаге 3.3.
- Оцените размер, компактность и округлость сфероидов с помощью светового микроскопа (4-кратное увеличение) и выберите те, которые достаточно сформированы.
ПРИМЕЧАНИЕ: Клетки достаточно образуются, когда они компактны и не разваливаются при обращении. Также важно, чтобы сфероиды были единым целым, а не слипались друг с другом. Размер сфероида от 100 до 200 мкм предпочтителен при переносе в биореактор. - Перенесите сфероиды в уравновешенный биореактор, заполненный 5 мл свежей питательной среды. После переноса сфероидов полностью заполните биореактор свежей питательной средой и следите за тем, чтобы при заполнении его среды в биореактор не попадали пузырьки.
- Поместите биореактор в 3D-инкубатор и отрегулируйте скорость вращения с помощью блока управления (рис. 2C). Для сфероидов HepG2/C3A установите скорость вращения 10-11 об/мин; для сфероидов THLE-3 установите его на 11-12 об/мин.
ПРИМЕЧАНИЕ: Скорость вращения устанавливается правильно, когда сфероиды равномерно распределены в центре биореактора и не касаются его стенок. На рисунке 2E показан вращающийся биореактор. - Меняйте питательную среду каждые 2-3 дня, удаляя 10 мл старой среды и заменяя ее 10 мл свежей среды; Следите за тем, чтобы не удалять сфероиды при обмене средами (Рисунок 2B).
ПРИМЕЧАНИЕ: Рекомендуется иметь регулярный обмен медиафайлами (например, 48 ч/48 ч/72 ч) и вести подробный учет. - Регулируйте скорость вращения при каждой смене носителя. Увеличивайте скорость по мере увеличения размера и количества сфероидов.
- После 15 дней в культуре разделите сфероиды на два новых биореактора.
ПРИМЕЧАНИЕ: В зависимости от клеточной линии и скорости роста время может варьироваться и должно быть оптимизировано индивидуально. - Через 20 дней сфероиды готовы к сбору.
4. Захват изображений и подсчет сфероидов
ПРИМЕЧАНИЕ: Упрощенный конвейер для подсчета сфероидов показан на рисунке 3A. Для подсчета сфероидов и определения площади (раздел 5) критически важно оценить компактность 3D-структур. Это будет способствовать более усиленному цветовому контрасту, который необходим для того, чтобы метод был точным.
- Откройте 3D-приложение, установленное на планшете.
- Выберите биореактор и сделайте снимок.
ПРИМЕЧАНИЕ: В качестве альтернативы можно сделать снимок. Следует учитывать следующие параметры.- Поместите черный фон позади биореактора (черная опора предусмотрена в коробке биореактора).
- Убедитесь, что свет не отражается на камере ячейки.
- Сделайте снимок как можно ближе к биореактору.
- Откройте одну картинку в FIJI (ImageJ).
- Подготовьте картину для анализа:
- Выберите инструмент «Овал ». Нарисуйте круг вокруг вилки.
- Нажмите «Удалить» на клавиатуре, чтобы сделать все, что находится внутри круга, черным. Нарисуйте круг вокруг камеры клетки. Убедитесь, что все сфероиды находятся внутри круга.
- Запустите макрос для подсчета сфероидов:
- Нажмите «Плагины» > «Запись макроса» >. Скопируйте текст макроса из дополнительного файла 1 в рекордер.
- Нажмите «Создать», и откроется новое окно. Нажмите кнопку «Выполнить», чтобы проанализировать открытую картинку.
- Откроется новое окно с результатами (количество, общая площадь, средний размер и процентная площадь).
- Закройте изображение и повторите шаги 4.4 и 4.5 для каждого изображения, для которого требуется количество сфероидов. Для более простой и быстрой обработки сохраните макрос и запустите его, нажав Плагины > Макрос > Выполнить и выберите сохраненный макрос.
5. Контурное определение площади сфероида
ПРИМЕЧАНИЕ: Упрощенный конвейер для определения площади сфероида показан на рисунке 3B.
- Сделайте снимки, как описано в шаге 3.5.
- Перед началом работы установите глобальную шкалу для измерения площади сфероидов.
- Откройте в FIJI картинку с масштабной линейкой с нужным увеличением. Выберите инструмент «Линия». Нарисуйте масштабную линейку (длина линии должна быть равна длине масштабной линейки).
- Откройте «Анализ > задать масштаб». Запишите известное расстояние (длина линии автоматически вводится в поле Расстояние в пикселях). Не забудьте поставить галочку напротив пункта Глобальный.
- Нажмите кнопку ОК. Теперь задается масштаб картинки, которая будет анализироваться.
- Чтобы начать планиметрическое определение, запустите макрос (Дополнительный файл 2).
- Щелкните Обработать > Пакетная > макрос. Выберите папку, содержащую снимки для анализа. Эта папка будет входным параметром.
- Выберите папку, созданную на шаге 5.3.1, в качестве Выходных данных. Нажмите кнопку Процесс.
- Для проверки качества оцените, соответствует ли измеренная площадь сфероида исходному изображению.
ПРИМЕЧАНИЕ: Макро исключает сфероиды на ребре, где можно измерить только часть сфероида.
6. Коллекция сфероидов
ПРИМЕЧАНИЕ: Настоятельно рекомендуется собирать сфероиды с помощью широких наконечников, чтобы сохранить их 3D-структуру. Сбор может быть выполнен с помощью заглушки в передней части биореактора (рис. 2A).
Размер сфероидов при сборе может варьироваться в зависимости от клеточной линии, начального количества клеток и процесса расщепления (количество дней в культуре, количество сфероидов в биореакторе и коэффициент расщепления).
- Для сбора сфероидов удалите 5 мл среды из биореактора через верхний порт с помощью шприца, соединенного с длинной иглой. Убедитесь, что сфероиды опускаются в нижнюю центральную часть биореактора (рядом с нижним отверстием).
- Откройте передний порт и соберите сфероиды с помощью наконечника шириной 1 мл. Поместите сфероиды в пробирки микроцентрифуги. Центрифугируйте сфероиды при 500 x g в течение 5 мин и выбросьте среду.
- Промойте сфероиды 200 мкл HBSS, чтобы удалить FBS. Центрифугу при 500 x g в течение 5 мин и выбросьте надосадочную жидкость.
- Мгновенно заморозьте гранулу сфероида жидким азотом и храните при температуре -80 °C до переработки.
7. Жизнеспособность сфероидов
ПРИМЕЧАНИЕ: Жизнеспособность сфероида определяли путем измерения активности аденилаткиназы (АК), высвобождаемой поврежденными клетками (рис. 4А). Благодаря градиенту диффузии измерение АК эффективно, когда сфероиды диаметром менее 900 мкм12. Если сфероиды становятся больше, или если есть какие-либо сомнения относительно измерения жизнеспособности, можно провести анализ АТФ15.
- Соберите сфероидную надосадочную жидкость и перелейте 20 мкл в 96-луночную белостенную пластину (с плоским дном прозрачная). Добавьте 100 мкл реагента для обнаружения аденилаткиназы в каждую лунку и гомогенизируйте, осторожно пипетируя вверх и вниз.
- Удаляют пузырьки центрифугированием в вакууме в течение 2 мин при RT. Инкубируют планшеты в течение 20 мин при RT.
- Поместите пластину в люминометр (считыватель пластин, режим люминесценции) и запустите программу. Установите параметры в соответствии с инструкциями производителя комплекта.
ПРИМЕЧАНИЕ: В биолюминесцентном анализе жизнеспособности для расчета клеточного ответа может использоваться прямой световой поток люминометра (обычно RLU). Поскольку аденилаткиназа будет просачиваться только из клеток, целостность клеток которых была нарушена, можно достичь полного контроля аденилаткиназы с помощью лизисного реагента.
8. Экстракция белка
ПРИМЕЧАНИЕ: На рисунке 1B показан рабочий процесс обработки сфероидов и экстракции белка.
- Соберите сфероиды (раздел 6) на 36-й день. Ресуспендируйте сфероиды в 25 мкл 5% SDS для лизировки клеток.
- После добавления 5% SDS гомогенизируйте гранулы, пипетируя вверх и вниз. В некоторых случаях, когда сфероиды трудно лизировать, используют маленький пестик.
- Инкубируют образцы с 20 мМ DTT в течение 1 ч для восстановления белков. Перемешайте, пипетируя вверх и вниз.
- Инкубируют образцы с йодоацетамидом 40 мМ в течение 30 мин, защищенные от света до алкилатных белков. Перемешайте, пипетируя вверх и вниз.
- Добавляют к образцам 12% раствор фосфорной кислоты (10x) в конечной концентрации 1,2%.
- Разведите образцы в шести объемах связующего буфера и аккуратно перемешайте.
- Загрузите образец в фильтрующую пластину S-Trap и отжим при 500 x g в течение 30 с.
ПРИМЕЧАНИЕ: Если общий объем образца на этапе 8.4 превышает объем колонны, загружайте образцы партиями и повторяйте шаг 8.6 до тех пор, пока все не будет пропущено через колонну. - Образцы дважды промывают 150 мкл связующего буфера. После каждой стирки отжимайте при 500 x g в течение 30 секунд и выбросьте поток.
- Инкубируют образцы с 1 мкг трипсина, разбавленного в 50 мМ бикарбоната аммония, в течение ночи при 37 °C.
ПРИМЕЧАНИЕ: В качестве исходного материала для комплексного анализа протеома рекомендуется не менее 20 мкг белка. Для этого 1 мкг трипсина является идеальным количеством для эффективного пищеварения. Удалите все пузырьки между буфером и слоем колонны. - Элюируют пептиды с 40 мкл 50 мМ бикарбоната аммония и собирают в одну и ту же пробирку для сбора.
- Отжим вниз при 500 x g в течение 30 с. Элюируют пептиды с 40 мкл 0,1% ТЖК и объединяют их в одну и ту же пробирку для сбора.
- Отжим вниз при 500 x g в течение 30 с. Элюируют пептиды с помощью 40 мкл 60% ацетонитрила и 0,1% ТЖК и объединяют их в одну пробирку для сбора.
- Отжим вниз при 500 x g в течение 30 с. Сухие объединенные элюируют в быстром вакууме и хранят образцы при -80 °C до обработки.
9. Очистка образца
ПРИМЕЧАНИЕ: Прежде чем приступить к протеомному анализу, необходимо удалить соль, присутствующую в образцах. Соли могут мешать анализу высокоэффективной жидкостной хромато-масс-спектрометрии (ВЭЖХ-МС), поскольку они ионизируются во время электрораспыления, подавляя сигнал от пептидов. Установка для обессоливания, использованная в этом исследовании, была ранее продемонстрирована Джозефом-Чоудхури и коллегами16.
- Перед началом работы убедитесь, что имеется чистая сборная пластина на 96 лунок для сбора потока на следующих этапах. Смешайте смолу C18 (50 мг/мл в 100% ацетонитриле) на магнитной пластине для перемешивания.
- Добавьте 70 мкл суспензии смолы C18 в лунку 96-луночной фильтрующей пластины, сделайте это быстро, чтобы смола C18 не скапливалась на дне пипетки.
- Осторожно включите пылесос, чтобы предотвратить разбрызгивание. Выбросьте проточный раствор, собранный на 96-луночной сборной пластине.
- Промойте смолу 100 мкл 0,1% TFA. Осторожно включите пылесос, чтобы предотвратить разбрызгивание и смешивание образцов, и выбросьте поток.
- Ресуспендант каждого образца в 100 мкл 0,1% ТФК. Проверьте и убедитесь, что pH находится в пределах 2-3.
- Загрузите каждый образец в каждую лунку фильтрующей пластины. Осторожно включите пылесос, чтобы предотвратить разбрызгивание и смешивание образцов, и выбросьте поток.
- Промыть 100 мкл 0,1% ТФК. Осторожно включите пылесос, чтобы предотвратить разбрызгивание и перемешивание образцов. Откажитесь от протекания.
- Замените 96-луночную сборную пластину новой 96-луночной пластиной для сбора обессоленных проб.
- Добавьте 60 мкл ацетонитрила/0,1% ТЖК на лунку. Чтобы удалить образцы из смолы C18, осторожно включите пылесос, чтобы предотвратить разбрызгивание.
- Соберите поток и высушите в быстром вакууме при RT. Перейдите к ЖХ-МС/МС или храните планшет при температуре -80 °C до тех пор, пока он не будет готов к обработке образцов.
10. Протеомный анализ с помощью жидкостной хроматографии в сочетании с масс-спектрометрией
ПРИМЕЧАНИЕ: Для получения данных для данной рукописи была использована система nLC-MS/MS с двухколоночной установкой с внутренним диаметром 300 мкм x 0,5 см C18 и аналитической наноколонкой C18-AQ (3 мкм) размером 75 мкм x 25 см C18-AQ (3 мкм).
- Подготовьте мобильные фазы для выполнения на ВЭЖХ:
Подвижная фаза А (МПА): 0,1% муравьиной кислоты в воде класса ВЭЖХ
Подвижная фаза B (MPB): 0,1% муравьиной кислоты в ацетонитриле класса ВЭЖХ - Программируйте метод ВЭЖХ следующим образом: 4%-34% МПБ за 120 мин, 34%-90% МПБ за 5 мин, изократический 90% МПБ за 5 мин; расход: 300 нл/мин.
- Настройте метод сбора данных MS для выполнения независимого сбора данных (DIA) для генерации спектров MS/MS обнаруженных пептидных сигналов.
- Ресуспендант 1 мкг образцов в 10 мкл 0,1% ТЖК перед помещением образцов в автосамплер nLC.
- Запустите метод nLC-MS, запрограммированный для получения канонической протеомики:
- Установите полное MS-сканирование на 300-1100 м/z на орбитрапе с разрешением 120 000 (при 200 м/з) и целью автоматической регулировки усиления (AGC) 125.
- Установите МС/МС на орбитальном рапе с окном последовательной изоляции 50 м/з с целью АРУ 400 и энергией диссоциации столкновений более высоких энергий (HCD) 30.
11. Анализ данных
- Импортируйте файлы необработанных данных nLC-MS/MS в программное обеспечение для определения пиков, совместимое с используемой платформой MS.
- Выберите подходящую базу данных (человек, мышь и т.д.).
- Установите N-концевое ацетилирование в качестве переменной модификации и карбамидометилцистеин в качестве фиксированной модификации.
- Укажите трипсин в качестве пищеварительного фермента с двумя пропущенными расщеплениями.
- Установите допуск массы в соответствии с масс-анализатором, используемым для получения спектров.
- Экспортируйте анализ в виде электронной таблицы и обрабатывайте данные по мере необходимости.
Результаты
В этом протоколе мы описываем свойства инновационного безстрессового 3D-клеточного инкубатора, системы, разработанной специально для культивирования 3D-сфероидов (рис. 2). Оптимизирован протокол 3D-культивирования клеточных линий THLE-3 и HepG2/C3A. Описанный здесь протокол прост в использовании и обеспечивает воспроизводимость и экономичное культивирование > 100 сфероидов на биореактор. Попадая в биореактор, сфероиды обрабатываются аналогично клеткам, содержащимся в 2D-культуре. Оптимальные условия роста достигаются за счет замены сред два-три раза в неделю (рис. 2B) и регулировки скорости вращения в соответствии с ростом и размером сфероидов (рис. 2C). Эта система, в которой 3D-сфероиды культивируются во вращающихся биореакторах (рис. 2E, F), обеспечивает оптимальную среду роста для 3D-структур, подвергая сфероид равной и очень низкой сдвиговой силе.
Ранее мы показали, как сфероиды могут быть использованы для анализа модификации хроматина16. Здесь мы подробно продемонстрируем, как получить сфероиды печени и как можно проводить эксперименты по протеомике для анализа полного протеома (рис. 1). Вкратце, протокол был инициирован с использованием плоских клеток THLE-3 или HepG2/C3A до тех пор, пока культура не достигла 80% слияния. Для культивирования клеток в виде сфероидов около 2000 клеток помещали в сверхнизкую пластину крепления, содержащую микролунки, чтобы позволить им самоагрегироваться, а затем сформированные сфероиды переносили в биореактор (рис. 1А). Несмотря на то, что они функционально активны через 3 недели в культуре,как было продемонстрировано ранее, мы показываем результаты сфероидов, собранных после 36 дней в культуре для этого протокола. После сбора сфероиды раскручивались, а гранулы и надосадочная жидкость хранились для анализа. Жизнеспособность клеток оценивали по надосадочной жидкости для количественного определения аденилаткиназы, высвобождаемой поврежденными клетками, как описано ранее17. Клеточные белки выделяли из клеточной гранулы, а полный протеом анализировали с помощью масс-спектрометрии высокого разрешения (рис. 1B).
Этот протокол также демонстрирует полуавтоматический метод подсчета сфероидов (рис. 3A) с использованием общедоступной программы обработки изображений FIJI (Fiji Is Just ImageJ)18. Для анализа необходимо сделать качественный снимок сфероида, а также учесть некоторые параметры, упомянутые в разделе 5. Затем, после подготовки картинки к анализу, для подсчета сфероидов используется макроскрипт (Supplementary File 1). Макрос сначала создает папку с именем FIJI Spheroids counting, внутри папки, в которой находятся изображения сфероидов. В этой папке сохраняется вся информация из анализа; Это включает в себя изображение сфероидов, которые были подсчитаны, с идентификационным номером на каждом сфероиде. Он также включает в себя файл Excel, называемый подсчетом сфероидов. Этот файл содержит площадь пикселя и идентификационный номер для каждого подсчитанного сфероида. Данные, соответствующие одной анализируемой картинке, представлены в каждой вкладке файла. Вкладка помечена в соответствии с названием анализируемой картинки. Поскольку размер сфероида может быть нарушен многими факторами, в том числе количеством структур в сосуде и медикаментозной обработкой, также важно контролировать площадь их поверхности (планиметрию). Сценарий макроса, представленный здесь (Дополнительный файл 2), работает путем измерения черных областей, которые соответствуют сфероидам на рисунке (рис. 3B). Выходные данные собираются в файле под названием planimetry.xlsx, который содержит измеренную площадь, периметр и диаметр каждого сфероида. Существует также измерение, называемое Ферет, используемое для вычисления диаметра. Feret — самый длинный возможный диаметр, а minFeret — самый короткий. Диаметр является средним из этих двух. Внутри выходной папки, помимо файла planimetry.xlsx, есть также изображение сфероидов, которые были измерены.
Прежде чем перейти к анализу протеома, была проведена оценка жизнеспособности сфероидов во времени культивирования. Уровни АК повышаются до 17-го дня, достигая примерно 7% клеточной гибели, а затем гибель снижается до уровня ниже 5% (рис. 4А), что согласуется с ранее опубликованной работой17. Этот протокол также показывает полный анализ протеома для мониторинга фенотипа клеток. Во-первых, сравнивали протеомы плоских клеток и сфероидов THLE-3 и HepG2/C3A. При анализе первого главного компонента (ПК1) видно, что существует строгое разделение образцов сфероидов от плоских клеточных культур, и представляется, что корреляция типов клеток (THLE-3 и HepG2/C3A) не имеет значения (рис. 4B). Несмотря на то, что сфероиды THLE-3 и HepG2/C3A не группируются вместе, они имеют схожие профили, согласующиеся с функцией печени. В этом протоколе мы демонстрируем на примере металлотионеинов, которые играют роль в детоксикации металлов, осуществляемой печенью. При протеомном анализе мы идентифицировали 2 изоформы с избыточной экспрессией в сфероидах по сравнению с плоскими клетками (MT1E и MT1X) (рис. 4C). Мы также показываем обогащение генной онтологией (GO) обеих клеточных линий, выращенных в виде сфероидов. Процесс метаболизма углеводов, который включает в себя цикл трикарбоновых кислот (цикл ТСА), цепь переноса электронов (клеточное дыхание) и метаболизм пируватов, является частым термином и обогащен сфероидами HepG2/C3A и THLE-3 (рис. 4D, E). Клеточная детоксикация, метаболизм жирных кислот и холестерина являются другими функциями, обогащенными обоими сфероидами. Известно, что вместе эти функции имеют решающее значение для работы печени.
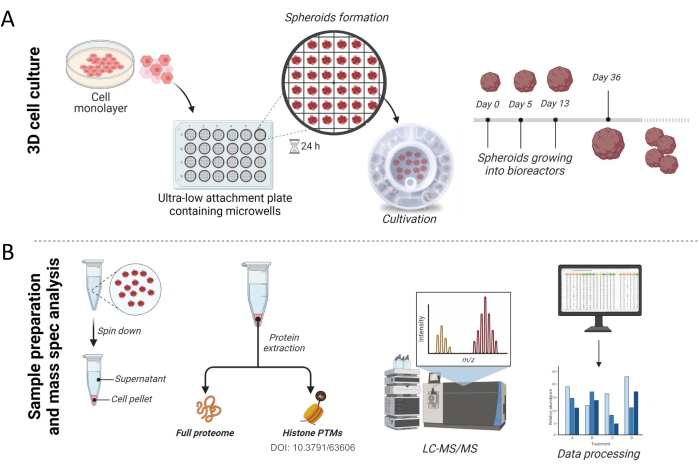
Рисунок 1: Рабочий процесс для культивирования сфероидов и пробоподготовки . (A) Экспериментальный подход к 3D-культуре клеток. Плоские клеточные культуры при желаемом слиянии трипсинизировали и высевали на 24-луночную планшет со сверхнизким присоединением, содержащую микролунки, где клетки самособираются в сфероиды. Через 24 ч сфероиды переносили в биореактор и культивировали до тех пор, пока они не были готовы к анализу. (B) После сбора сфероиды гранулировали, а пеллеты и культуральную надосадочную жидкость хранили до переработки. Гистоны16и негистонные белки экстрагировали, расщепляли в пептиды и анализировали с помощью масс-спектрометрии высокого разрешения. Необработанные файлы, полученные с помощью масс-спектрометрии, были найдены в базе данных человека, и данные были подвергнуты дальнейшей обработке. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
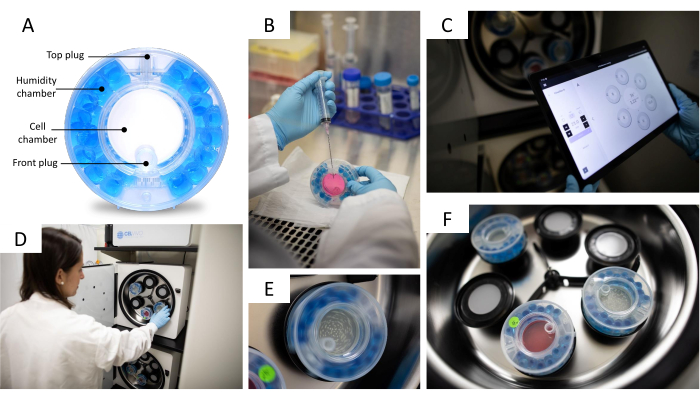
Рисунок 2: 3D система клеточных культур . (А) Детали биореактора. Биореактор состоит из камеры газообмена и увлажнения, содержащей водяные шарики, и открывающейся камеры с двумя заглушками для обмена средами и сбора сфероидов. (B) Обмен средами в биореакторе. Биореактор заполняют 10 мл питательной среды с помощью шприца с иглой. (C) Приложение для управления системой. Скорость вращения, уровень CO2, температура, журнал аварийных сигналов и другие функции можно контролировать с помощью блока управления. (D) Помещение биореактора в 3D-инкубатор. Каждый биореактор имеет соответствующий двигатель, который может медленно вращать биореактор. (E) Биореактор в движении со скоростью (об/мин), контролируемой планшетом (C). Скорость (об/мин) регулируется в соответствии с размером сфероидов. (F) Биореакторы внутри 3D-инкубатора. 3D-инкубатор может вместить до 6 индивидуально управляемых биореакторов. Фото любезно предоставлено Jason Torres Photography. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
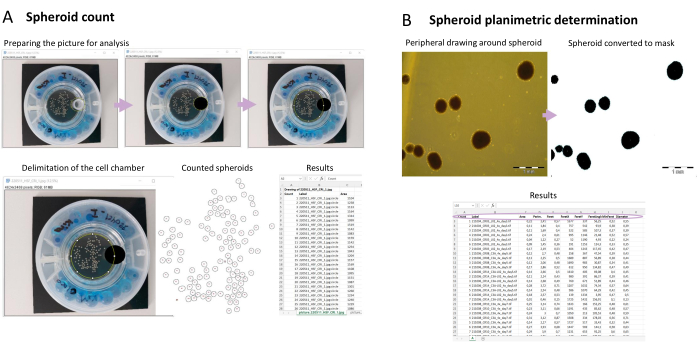
Рисунок 3: Фенотипическая характеристика сфероидов с помощью захвата изображений . (A) Полуавтоматический подсчет сфероидов. После получения снимков сфероидов в биореакторе изображение подготавливается к анализу в FIJI. Каждый сфероид подсчитывается, и для каждого из них присваивается идентификационный номер. Используется макрос, и отображаются результаты, показывающие идентификатор подсчитанного сфероида, метку (название изображения, которое было проанализировано) и область (количество пикселей, подсчитанных в сфероиде). (Б) Контурное определение площади сфероида. С помощью макроса определяется площадь, периметр и диаметр конкретного сфероида. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
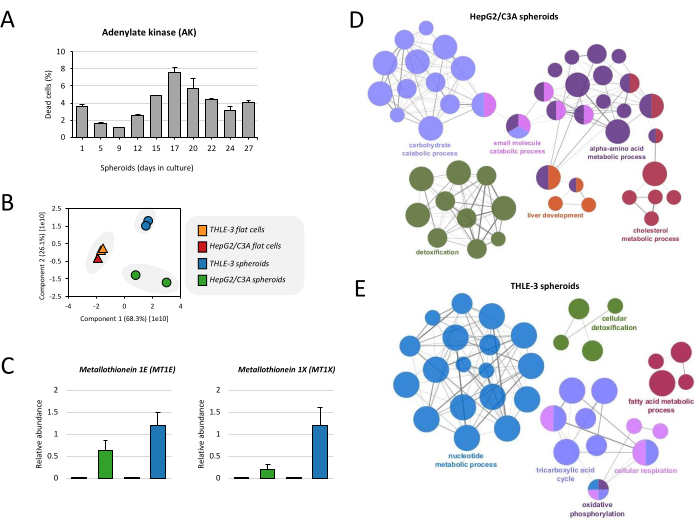
Рисунок 4: Протеомный анализ сфероидов печени. (А) Жизнеспособность сфероидов рассчитывали на основе высвобождения аденилаткиназы (АК) на культуре надосадочной жидкости. Результаты являются средством дублирования точек данных ± SD. (B) Для сравнения протеома плоских клеток и сфероидов THLE-3 и HepG2/C3A был проведен анализ главных компонент (PCA). (C) Относительное обилие металлотионеинов, которые представляют собой белки, экспрессируемые печенью человека. Данные представлены в виде средних значений ± SEM. (D) Функционально сгруппированная сеть показывает обогащение GO для сфероидов HepG2/C3A и (E) сфероидов THLE-3, где показана только метка наиболее значимого члена на группу. Сеть была построена с использованием ClueGo19. Размер узла представляет собой значение термина «обогащение». Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Дополнительный файл 1: Макроскрипт для подсчета сфероидов. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 2: Макрос для контурного определения сфероидов. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
Понимание биологии, лежащей в основе трехмерных (3D) клеточных структур, чрезвычайно важно для более полного понимания их функциональных возможностей. Растет интерес к использованию 3D-моделей для изучения сложной биологии и проведения скрининга токсичности. При культивировании клеток в 3D необходимо учитывать множество факторов, в том числе фенотипическую оценку модельной системы. Фенотип определяется как группа наблюдаемых характеристик конкретного организма, таких как морфология, поведение, физиологические и биохимические свойства20.
В этом протоколе мы демонстрируем, как эксперименты по протеомике могут быть проведены на нескольких сфероидах и могут быть использованы для мониторинга типичного фенотипа печени. Масс-спектрометрия стала широко применяемым методом для 3D-характеризации клеток, позволяющим исследовать различные биологические вопросы 12,16,21,22. Для комплексного анализа протеома рекомендуется использовать не менее 20 мкг белкового исходного материала, из которого 1 мкг вводят в масс-спектрометр. Важно отметить, что добавление меньшего количества образца может привести к потере чувствительности, а добавление большего количества постепенно ухудшит качество хроматографии и в конечном итоге приведет к блокировке колонки. В этом исследовании мы показали, что сфероиды HepG2/C3A и THLE-3 обогащены важными белками гликолиза и цикла TCA, которые являются специфическими путями печени и имеют решающее значение для поддержания уровня глюкозы в крови и для производства энергии23,24. На самом деле, масс-спектрометрический анализ дает не только информацию на белковом уровне, но и позволяет исследовать посттрансляционные модификации белков, как это было показано ранее нашей группой16.
Еще одним аспектом, который следует учитывать в 3D-фенотипических исследованиях, является количество и размер сфероидов. Помимо повышения воспроизводимости экспериментов, подсчет количества сфероидов и определение их размера имеют важное значение для определения того, когда следует разделить культуру на несколько биореакторов, поскольку количество трехмерных структур в сосуде может повлиять на размер сфероидов и уровень метаболической активности. Однако важно подчеркнуть, что количество и размер сфероидов зависят от клеточной линии, начального количества клеток, процесса расщепления и времени сбора. Подробная информация о культуре сфероидов HepG2/C3A, такая как количество клеток в сфероидах, содержание белка и размер в зависимости от возраста, была предоставлена Феем, Коженевской и Вжесински25. Для точного и успешного анализа с использованием полуавтоматического метода, описанного здесь, наиболее важным шагом является получение хорошей картинки сфероидов. Для простоты снимок можно сделать с помощью телефона или планшета, но его разрешение должно быть максимально высоким. Поскольку изображения быстро получаются, они позволяют проводить крупномасштабные скрининговые эксперименты для визуализации конкретных фенотипических особенностей или изучения реакции на медикаментозное лечение. В связи с увеличением числа клеточных анализов за последние 10 лет был разработан ряд программного обеспечения с открытым исходным кодом для анализа изображений26. В этом протоколе мы описываем полуавтоматическую систему, использующую программное обеспечение FIJI18 для подсчета и измерения размеров сфероидов. Мы представили скрипты (простые команды программирования) для определения последовательности алгоритмических операций, которые могут быть применены к коллекции изображений, что делает анализ простым и быстрым процессом. Однако, в зависимости от характеристики сфероида, следует использовать ручное измерение. Например, если сфероиды слишком полупрозрачные, шрифт FIJI будет неточным. Кстати, одним из важнейших критериев для работы этого метода является компактность сфероидов. Эта характеристика будет способствовать более усиленному цветовому контрасту между сфероидами и фоном, что необходимо для точности метода.
Таким образом, помимо представления методологии выращивания высоковоспроизводимых сфероидов, была также описана полуавтоматическая система в сочетании с фенотипической характеристикой с помощью захвата изображений и протеомики. Мы ожидаем, что этот набор инструментов для анализа 3D-клеток станет более надежным благодаря полностью автоматизированному программному обеспечению для анализа изображений и масс-спектрометрам следующего поколения.
Раскрытие информации
Хелле Седиги Франдсен работает научным сотрудником в компании CelVivo ApS, производителе системы ClinoStar. Каролина Миккельсен - аспирант в области промышленности, работающая в CelVivo ApS и получающая докторскую степень в SDU, Оденсе, Дания. Все остальные авторы не имеют конкурирующих финансовых интересов.
Благодарности
Лаборатория Sidoli выражает благодарность Фонду исследования лейкемии (грант Холлиса Браунштейна для новых исследователей), AFAR (премия Sagol Network GerOmics), Deerfield (премия Xseed), Relay Therapeutics, Merck и офису директора NIH (1S10OD030286-01).
Материалы
| Name | Company | Catalog Number | Comments |
| 1.5 mL microcentrifuge tubes | Bio-Rad | 2239480 | |
| 10 mL syringe | Fisher Scientific | 1481754 | Luer lock tip, graduated to 12 mL |
| 1000 µL wide bore pipet tips | Fisher Scientific | 14222703 | |
| 200 µL wide bore pipet tips | Fisher Scientific | 14222730 | |
| 96-well Orochem filter plate | Orochem | OF1100 | |
| 96-well skirted plate | Axygen | PCR-96-FS-C | |
| 96-well vacuum manifold | Millipore | MAVM0960R | |
| Ammonium bicarbonate | Sigma | A6141-25G | |
| Bronchial Epithelial Cell Growth Medium (BEGM) | Lonza | CC-3170 | |
| Cell culture grade water | Corning | 25-055-CV | |
| ClinoReactor | CelVivo | N/A | Bioreactor for 3D cell culture |
| ClinoStar incubator | CelVivo | N/A | CO2 incubator for 3D cell culture |
| DTT | Sigma | D0632-5G | |
| Dulbecco's Modified Eagle's Medium (DMEM) | Fisher Scientific | MT17205CV | |
| Elplasia 24-well round bottom ultra-low attachment plate containing microwells | Corning | 4441 | |
| Fetal Bovine Serum | Fisher Scientific | MT35010CV | |
| Formic acid | Thermo | 28905 | |
| Hank's Balanced Salt Solution (HBSS) | Fisher Scientific | MT21022CV | |
| hEGF | Corning | 354052 | |
| HERAcell vios 160i | Thermo | 51033557 | CO2 incubator for 2D cell culture |
| HPLC grade acetonitrile | Fisher Scientific | A955-4 | |
| HPLC grade methanol | Fisher Scientific | A452-1 | |
| HPLC grade water | Fisher Scientific | W5-4 | |
| Iodoacetamide | Sigma | I1149-5G | |
| L-glutamine | Fisher Scientific | MT25015CI | |
| Non-essential amino acids | Fisher Scientific | MT25025CI | |
| Oasis HLB Resin 30 µm | Waters | 186007549 | |
| Orbitrap Fusion Lumos Tribrid mass spectrometer | Thermo | IQLAAEGAAPFADBMBHQ | High resolution mass spectrometer |
| PAULA microscope | Leica | ||
| Penicillin-Streptomycin | Fisher Scientific | MT3002CI | |
| PerkinElmer Victor X2 multilabel microplate reader | PerkinElmer | ||
| pH paper | Hydrion | 93 | |
| Phosphoetanolamine | Sigma | P0503 | |
| Phosphoric acid | Fisher Scientific | A260-500 | |
| Pipette gun | Eppendorf | Z666467 (Milipore Sigma) | |
| Refrigerated centrifuge | Thermo | 75-217-420 | |
| Reprosil-Pur resin | MSWIL | R13.AQ.003 | 120 Å pore size, C18-AQ phase, 3 μM bead size |
| SDS | Bio-Rad | 1610301 | |
| Sequencing grade modified trypsin | Promega | V511A | |
| SpeedVac vacuum concentrator (96-well plates) | Thermo | 15308325 | Savant SPD1010 |
| Sterile hood | Thermo | 1375 | |
| Sterile serological pipettes | Fisher Scientific | 1367549 | |
| S-trap | Protifi | C02-micro-80 | |
| Syringe needle (18 G) | Fisher Scientific | 14817100 | 3" length, 0.05" diameter |
| Trifluoroacetic acid (TFA) | Thermo | 28904 | |
| Trypsin-EDTA | Gibco | 25300-054 | |
| Vortex | Sigma | Z258415 | |
| Water bath | Fisher Scientific | FSGPD10 |
Ссылки
- Ravi, M., Paramesh, V., Kaviya, S. R., Anuradha, E., Solomon, F. D. 3D cell culture systems: advantages and applications. Journal of Cellular Physiology. 230 (1), 16-26 (2015).
- Nirmalanandhan, V. S., Duren, A., Hendricks, P., Vielhauer, G., Sittampalam, G. S. Activity of anticancer agents in a three-dimensional cell culture model. Assay and Drug Development Technologies. 8 (5), 581-590 (2010).
- Erickson, I. E., Huang, A. H., Chung, C., Li, R. T., Burdick, J. A., Mauck, R. L. Differential maturation and structure-function relationships in mesenchymal stem cell- and chondrocyte-seeded hydrogels. Tissue Engineering Part A. 15 (5), 1041-1052 (2009).
- Vinci, M., et al. Advances in establishment and analysis of three-dimensional tumor spheroid-based functional assays for target validation and drug evaluation. BMC Biology. 10 (29), (2012).
- Liu, J., Abate, W., Xu, J., Corry, D., Kaul, B., Jackson, S. K. Three-dimensional spheroid cultures of A549 and HepG2 cells exhibit different lipopolysaccharide (LPS) receptor expression and LPS-induced cytokine response compared with monolayer cultures. Innate Immunity. 17 (3), 245-255 (2011).
- Khafaga, A. F., Mousa, S. A., Aleya, L., Abdel-Daim, M. M. Three-dimensional (3D) cell culture: a valuable step in advancing treatments for human hepatocellular carcinoma. Cancer Cell International. 22 (1), 243 (2022).
- Llovet, J. M., Burroughs, A., Bruix, J. Hepatocellular carcinoma. The Lancet. 362 (9399), 1907-1917 (2003).
- Sia, D., Llovet, J. M. Liver cancer: Translating '-omics' results into precision medicine for hepatocellular carcinoma. Nature Reviews Gastroenterology & Hepatology. 14 (10), 571-572 (2017).
- Tang, J., et al. A three-dimensional cell biology model of human hepatocellular carcinoma in vitro. Tumour Biology. 32 (3), 469-479 (2011).
- van Zijl, F., Mikulits, W. Hepatospheres: Three dimensional cell cultures resemble physiological conditions of the liver. World Journal of Hepatology. 2 (1), 1-7 (2010).
- Chaicharoenaudomrung, N., Kunhorm, P., Noisa, P. Three-dimensional cell culture systems as an in vitro platform for cancer and stem cell modeling. World Journal of Stem Cells. 11 (12), 1065-1083 (2019).
- Wrzesinski, K., Fey, S. J. Metabolic reprogramming and the recovery of physiological functionality in 3D cultures in micro-bioreactors. Bioengineering(Basel, Switzerland). 5 (1), 22 (2018).
- Breslin, S., O'Driscoll, L. Three-dimensional cell culture: The missing link in drug discovery. Drug Discovery Today. 18 (5-6), 240-249 (2013).
- Kapalczynska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science: AMS. 14 (4), 910-919 (2018).
- Wrzesinski, K., Frandsen, H. S., Calitz, C., Gouws, C., Korzeniowska, B., Fey, S. J. Clinostat 3D cell culture: Protocols for the preparation and functional analysis of highly reproducible, large, uniform spheroids and organoids. Methods in Molecular Biology. 2273, 17-62 (2021).
- Joseph-Chowdhury, J. N., et al. Global level quantification of histone post-translational modifications in a 3D cell culture model of hepatic tissue. Journal of Visualized Experiments: JoVE. 183, 63606 (2022).
- Wrzesinski, K., Fey, S. J. After trypsinisation, 3D spheroids of C3A hepatocytes need 18 days to re-establish similar levels of key physiological functions to those seen in the liver. Toxicology Research. 2, 123-135 (2013).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Bindea, G., et al. ClueGO: a Cytoscape plug-in to decipher functionally grouped gene ontology and pathway annotation networks. Bioinformatics. 25 (8), 1091-1093 (2009).
- Houle, D., Govindaraju, D. R., Omholt, S. Phenomics: The next challenge. Nature Reviews. Genetics. 11 (12), 855-866 (2010).
- Gonneaud, A., Asselin, C., Boudreau, F., Boisvert, F. M. Phenotypic analysis of organoids by proteomics. Proteomics. 17 (20), (2017).
- Avelino, T. M., et al. Mass spectrometry-based proteomics of 3D cell culture: A useful tool to validate culture of spheroids and organoids. SLAS Discovery. 27 (3), 167-174 (2022).
- Chiang, J., McManus, L. M., MitchellIn, R. N. . Liver physiology: Metabolism and Detoxification. Pathobiology of Human Disease. , 1770-1782 (2014).
- Begriche, K., Massart, J., Robin, M. A., Borgne-Sanchez, A., Fromenty, B. Drug-induced toxicity on mitochondria and lipid metabolism: Mechanistic diversity and deleterious consequences for the liver. Journal of Hepatology. 54 (4), 773-794 (2011).
- Fey, S. J., Korzeniowska, B., Wrzesinski, K. Response to and recovery from treatment in human liver-mimetic clinostat spheroids: a model for assessing repeated-dose drug toxicity. Toxicology Research. 9 (4), 379-389 (2020).
- Smith, K., et al. Phenotypic image analysis software tools for exploring and understanding big image data from cell-based assays. Cell Systems. 6 (6), 636-653 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены