Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
A β-glucuronidasa (GUS), basada en células de ensayo Muerte
En este artículo
Resumen
Ensayos muerte celular programada de uso común en los sistemas de mamíferos, tales como escalamiento de ADN o los ensayos de TUNEL, a menudo son difíciles de reproducir en las plantas. En combinación con un sistema reportero GUS, se propone una vía rápida, a base de plantas de ensayo transitorio para analizar las propiedades de la muerte potencial de genes específicos.
Resumen
Hemos desarrollado un novedoso sistema de expresión transitoria de plantas que al mismo tiempo expresa el gen reportero β-glucuronidasa (GUS), con la supuesta reguladores positivos o negativos de la muerte celular. En este sistema, N. benthamiana hojas son co-infiltrado con un casete de expresión 35S impulsado que contiene el gen para ser analizados, y el vector GUS pCambia 2301 utilizando LBA4404 cepa de Agrobacterium como un vehículo. Dado que las células vivas son necesarios para la expresión de GUS que se produzca, la pérdida de la actividad GUS se espera que cuando este gen marcador es co-expresada con reguladores positivos de la muerte celular. Igualmente, el aumento de la actividad GUS se observa cuando los genes anti-apoptóticos se utilizan en comparación con el control de vectores. Como se muestra a continuación, hemos utilizado con éxito este sistema en nuestro laboratorio para analizar los dos jugadores a favor y en contra la muerte. Estos incluyen la planta de anti-apoptótica Bcl-2 asociada athanoGene (BAG) de la familia, así como, los mamíferos conocidos inductores de la muerte celular, tales como BAX. Además, hemos utilizado este sistema para analizar la función de la muerte de truncamientos específicos dentro de las proteínas, lo cual podría proporcionar pistas sobre la posible modificación post-traduccional / activación de estas proteínas. A continuación, presentamos un método rápido y sensible de plantas basado, como un paso inicial en la investigación de la función de la muerte de genes específicos.
Protocolo
Plantas de Nicotiana benthamiana se cultivan en una cámara de crecimiento con temperatura controlada a 25 ° C. Totalmente expandido hojas sanas de plantas de 3-6 semanas de edad se utilizan.
Consejo: Se obtienen mejores resultados mediante el uso de hojas de reciente aparición
1. Agrobacterium protocolo de infiltración transitoria:
Día 1
- LB racha / rifampicina (25 mg / ml) / kanamicina (100 mg / ml) placas de agar con las acciones de glicerol de Agrobacterium tumefaciens (cepa LBA4404) que contiene los vectores apropiados con el gen de la (s) a ensayar para la muerte celular y el vector que contiene el casete de GUS bajo un promotor constitutivo. Siempre incluyen un control de vector vacío como control negativo.
- Se incuba a 28 ° C durante 2 días.
Día 3
- Inocular 2 ml de LB con rifampicina (25 mg / ml) y kanamicina (100 mg / ml) con una sola colonia de cada LB / Rifampicina / kanamicina placa previamente rayada.
- Incubar cada cultura por agitación a 28 ° C durante 24 horas a 200 rpm hasta que la densidad máxima de crecimiento se alcanza.
Sugerencia: Aglutinación veces se observa, en el que las culturas caso de necesidad de estar bien resuspendido (es decir, pipeteando arriba y abajo) antes de proceder.
Día 4
- Después de la incubación, aumentar el volumen total de 10 ml con LB fresco (con los antibióticos adecuados) y acetosiringona (concentración final 25 mM).
- Incubar cada cultura por agitación a 28 º C durante otras 16 horas.
Día 5
- Al día siguiente, lavar dos veces cada cultura mediante la adición de 10 ml (no añadir acetosiringona) medio de la infiltración (10 mM MgSO 4 .7 H 2 O, 9 mM MES, pH 5,6) y se centrifuga a 4000 xg durante 10 min a temperatura ambiente.
- Después de la centrifugación final, resuspender cada cultura, en medio de la infiltración de 5 ml contiene acetosiringona (100 M).
- Medir el OD 600 nm, las mediciones de entre 0,1 y 0,9 son aceptables.
Sugerencia: OD 600nm de tan bajas como 0.1 se han utilizado sin ningún problema, sin embargo, el aumento de las EP pueden producir resultados más consistentes. - Incubar los cultivos durante más tres horas para preparar los cultivos de Agrobacterium para la infección.
- Culturas mezcla que contiene el gen de la (s) a analizar y el control negativo (Agrobacterium que contiene el vector vacío) en una proporción de 1:1 con la cultura que contiene el casete de GUS.
- Infiltrarse en la abaxial (bajo) parte de las nuevas hojas que emergen con un 1 ml de jeringa sin aguja (Fig. 1).
Sugerencia: Infiltrarse en tanto la mezcla de control negativo (vector vacío + casete GUS) y la mezcla que contiene el gen que se vaya a analizar (gen x + casete GUS) de hojas opuestas de la misma planta. Utilice plantas por triplicado para cada tratamiento. - 3 días después de la infiltración de los impuestos especiales se infiltraron hojas y ensayo para la expresión de la proteína GUS.
2. Histoquímico GUS ensayo
Día 8
- Vacío infiltrarse en el medio de sustrato X-gluc en las hojas eliminado.
- Incubar en la oscuridad a temperatura ambiente durante la noche o hasta que la tinción de azul bien marcada.
Día 9
- Enjuague con agua destilada.
- Incubar en el 70% de etanol hasta que la clorofila es eliminado, entonces la transferencia de agua destilada. Visualmente evaluar los niveles de expresión de GUS.
3. Ensayo fluorométrico MUG:
Día 8
- Aislar la proteína total de molienda se infiltraron discos de hoja en un mortero con nitrógeno líquido. Añadir 100 uL de tampón de extracción GUS (50 mM NaPi pH 7,0, 10 mM EDTA, 0,1% Triton X-100, el 0,1% de N-lauroylsarcosine sal de sodio, β-mercaptoetanol (0,7 l / ml), manteniendo la muestra en hielo.
- Centrifugar la suspensión a 14.000 g por 5 min a 4 ° C y tomar el sobrenadante como la proteína soluble total.
- Medir la concentración mediante el uso de un nanodrop de acuerdo a las instrucciones del fabricante.
- Ajustar la concentración de proteínas y 100 mg de proteína soluble total para cada muestra usando un tampón de extracción de GUS.
- Añadir el sustrato MUG (4-metilumbeliferil-β-D-glucurónido trihidrato), preparado en tampón de extracción GUS a una concentración final de 2 mM. Un volumen total de 100 l por muestra (proteína + sustrato MUG) debería ser suficiente.
- Incubar las reacciones de 1 hora a 37 ° C.
- Detener las reacciones añadiendo 800 l de GUS dejar de tampón (0,2 M Na 2 CO 3).
- Medida de fluorescencia utilizando un lector de placas a una longitud de onda de excitación de 365 nm y la longitud de onda de emisión de 455 nm y comparar los valores de una curva estándar de MU. Los niveles de informe de la actividad GUS como nmol MU / mg de proteína soluble total / min.
4. Acciones y soluciones:
- Acetosiringona (1 M) de acciones (FW = 196.2 g) - 0.981 g en 5 ml de DMSO
- Kanamicina (100 mg / ml) de archivo - preparar en dH 2 0 - filtro de esterilización
- Rifampicina (25 mg / ml) de valores - preparar en DMSO
- Luria-Bertani (LB) medio líquido de crecimiento: (1 litro)
1% (w / v) Bacto-triptona, 10 g
0,5% (w / v) Bacto-extracto de levadura, 5 g
170 mM de cloruro de sodio 10 g
pH - 7 - Acetosiringona (25 M) = 25 l de una acción M 1 en un volumen final de 1 ml
- Media infiltración: (1 litro)
10 mM MgSO 4 .7 dH 2 0 (FW = 246,48 g), 2,4648 g
9 mM MES (FW = 213,25 g), 1,91925 g
pH - 5,6 - Acetosiringona (100 M) = 100 l de una acción 1M en un volumen final de 1 ml
- GUS tampón de extracción
50 mM NaPi pH 7,0, 10 mM EDTA, 0,1% Triton X-100, el 0,1% de N-lauroylsarcosine sal de sodio, β-mercaptoetanol (0,7 l / ml) - 2x tampón fosfato
0,2 M NaH 2 PO 4 y 0,2 M Na 2 HPO 4 pH 7 - X-Gluc sustrato solución
Disolver 1 mg de 5-bromo-4-cloro-3-indolil bD-glucurónido (X-gluc) en metanol de 0,1 ml. Añadir 1 ml de tampón fosfato 2x, 20 l de potasio 0,1 M ferricianuro, 10μl Triton X-100 el 10% y 850 l de agua destilada.
5. Los resultados representativos:
Siguiendo este protocolo, la pérdida de expresión de GUS se espera cuando se produce la muerte celular. Tenemos al mismo tiempo expresaron el gen reportero β-glucuronidasa (GUS) con un miembro de la Arabidopsis cito-protector de Bcl-2 asociada athanoGene (BAG) de la familia. Colaboramos infiltrado N. benthamiana deja con un cassette de 35S conducido expresión bolsa y el GUS vector pCambia 2301 utilizando LBA4404 cepa de Agrobacterium. Como se muestra en la figura 2, un aumento visible en la tinción de GUS se observó después de esta infiltración. Por el contrario, cuando el conocido pro-apoptóticos de la familia de Bcl-2 BAX se utilizó, una marcada reducción de la tinción de GUS se observó (Fig. 2). En ambos casos, la expresión de GUS estaba visiblemente diferente en comparación con el control. Sin embargo, cuando la diferencia en la expresión es menos evidente, ensayos fluorométricos MUG se puede realizar para quanitate expresión de GUS.

Figura 1. Ejemplo de la infiltración de la mezcla de Agrobacterium lado abaxial de N. benthamiana hojas con un 1 ml jeringa sin aguja.
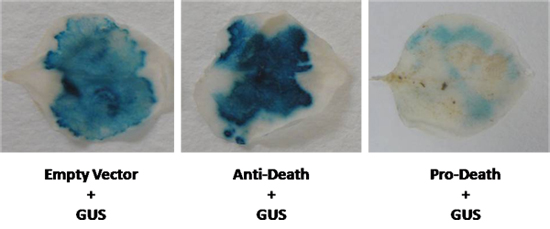
Figura 2. Un vector GUS fue co-expresados en N. benthamiana hojas con el gen anti-muerte, y un conocido inductor de muerte celular. Los niveles de GUS se compararon con un control de vector vacío (GUS control).
Discusión
A menudo es difícil de usar las técnicas de detección de células de muerte en las plantas que son comunes en sistemas de mamíferos. En combinación con un sistema reportero GUS, se presenta un método a base de plantas, sensibles para la detección y análisis de los jugadores de la muerte celular. Este método aprovecha el simple hecho de que las células vivas son necesarios para la expresión de GUS a ocurrir. Para asegurar resultados significativos y repetibilidad, es fundamental que las culturas que alberga...
Divulgaciones
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Rifampicina | VWR | IC19549001 | 25mg/mL en DMSO |
| 4'-hidroxi-3 ', 5'-dimethoxyacetophenone (acetosiringona) | VWR | TCD2666 | 0,981 g / ml en DMSO (1M stock) |
| 2 - (4-morfolino) etanosulfónico monohidrato de ácido (MES) | VWR | EM-6110 | 1,92 g / L en el agua para hacer 1 litro de los medios de infiltración |
| Bacto-triptona | Pescador | BP1421-2 | 10 g / L en el agua para hacer una L de medio LB |
| Bacto-extracto de levadura | VWR | EM1.03753.0500 | 5 g / L en el agua para hacer una L de medio LB |
| Cloruro de sodio | VWR | EM-7710 | 10 g / L en el agua para hacer una L de medio LB |
| Fosfato de sodio monobásico monohidrato | VWR | MK-7868 a 12 | 2,5 g / L en el agua para la toma de 50 mM de tampón NaPi |
| Fosfato de sodio dibásico heptahidratado | VWR | EMD-SX0715-1 | 5 g / L en el agua para la toma de 50 mM de tampón NaPi |
| Magnesio heptahidrato de sulfato | VWR | EM-MX0070-1 | 2,5 g / L en el agua para hacer 1 litro de los medios de infiltración |
| N-Lauroylsarcosine | VWR | TCL0151-500G | 0,1% v / v en buffer GUS |
| 5-bromo-4-cloro-3-indoxyl-beta-D-glucurónido cyclohexylammonium sal (X-gluc) | Oro Biotecnología | G1281C | 1mg/100uL en metanol 100% |
| 4-metilumbeliferil-μ-D-glucurónido hidrato (MUG) | Sigma | M5664 | 2 mM en 100 uL de tampón de extracción GUS |
| Trihidrato de ferrocianuro potásico | VWR | EM-PX1460-1 | De valores de 100 mm para la solución de sustrato X-gluc |
| β-metilumbeliferona (MU) | Sigma-Aldrich | M1381 | Por MU tampón estándar utilizar la curva de extracción de GUS |
| De carbonato de sodio | VWR | EM-SX0395-11 | 0,2 M en agua para la toma de GUS tampón de detención |
Referencias
- Jefferson, R. A. GUS fusions: , β-glucuronidase as a sensitive and versatile gene fusion marker in higher plants. EMBO J. 6, 3901-3901 (1987).
- Nishihara, M. Expression of the β-Glucuronidase Gene in Pollen of Lily (Lilium longiflorum), Tobacco (Nicotiana tabacum), Nicotiana rustica, and Peony (Paeonia lactiflora) by Particle Bombardment. Plant Physiol. 102, 357-357 (1993).
- Hodal, L. . Plant Science. 87, 115-115 (1992).
- Kabbage, M. The BAG proteins: a ubiquitous family of chaperone regulators. Cell Mol. Life Sci. . 65, 1390-1390 (2008).
- Kang, C. H. AtBAG6, a novel calmodulin-binding protein, induces programmed cell death in yeast and plants. Cell Death Differ. 13 (1), 84-84 (2006).
- Yan, J. . Plant Science. 165 (1), 1-1 (2006).
- Takayama, S., Reed, J. C. Molecular chaperone targeting and regulation by BAG family proteins. Nat Cell Biol. 3 (10), 237-237 (2001).
- Takayama, S. Cloning and functional analysis of BAG-1: a novel Bcl-2-binding protein with anti-cell death activity. Cell. 80 (2), 279-279 (1995).
- Vitha, S. Quantitative β-glucuronidase assay in transgenic plants. Biol. Plant. 35, 151-151 (1993).
- Otha, S. Construction and Expression in Tobacco of a β-Glucuronidase (GUS) Reporter Gene Containing an Intron Within the Coding Sequence. Plant Cell Physiol. 31, 805-805 (1990).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados