Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La aplicación de un ratón ligado Ensayo placas de Peyer asa intestinal para evaluar la absorción por las células bacterianas M
En este artículo
Resumen
Las células M en un folículo especializada asociada a epitelio que recubre las placas de Peyer juegan un papel importante para el inmunovigilancia la mucosa en el intestino de tejido linfoide asociado. Aquí se describe el método de evaluación para transcitosis bacteriana por las células M En vivo. Este método proporciona un método para comprender M-función de las células del sistema inmunológico.
Resumen
El interior de nuestro intestino es habitado por gran número de bacterias comensales. La superficie de la mucosa del tracto gastrointestinal está continuamente expuesta a ellos y, ocasionalmente, a los agentes patógenos. El tejido linfoide asociado al intestino (GALT) juegan un papel clave para la inducción de la respuesta inmune de la mucosa de estos microbios 1, 2. Para iniciar la respuesta inmune de la mucosa, los antígenos de la mucosa debe ser transportado desde el lumen intestinal a través de la barrera epitelial en folículos linfoides organizados, tales como las placas de Peyer. Este transcitosis antígeno está mediada por células especializadas del epitelio M 3, 4. Las células M son células atípicas del epitelio que fagocitan activamente macromoléculas y los microbios. A diferencia de las células dendríticas (DC) y los macrófagos, que los antígenos objetivo de los lisosomas para la degradación de las células M, principalmente transcytose los antígenos internalizados. Este transcitosis macromoleculares vigorosa a través de las células M ofrece a los antígenos subyacente folículos linfoides organizó unad se cree que es esencial para iniciar antígenos específicos de las respuestas inmunitarias de las mucosas. Sin embargo, los mecanismos moleculares de la promoción de esta captación de antígenos por las células M son en gran parte desconocido. Hemos informado anteriormente de que la glicoproteína 2 (GP2), específicamente expresado en la membrana plasmática apical de las células M entre los enterocitos, sirve como un receptor transcytotic para un subconjunto de comensales y enterobacterias patógenas, incluyendo Escherichia coli y Salmonella enterica serovar Typhimurium (S. Typhimurium ), mediante el reconocimiento de FimH, un componente de tipo I pili en la membrana bacteriana externa 5. A continuación, presentamos un método para la aplicación de un ensayo de Peyer del ratón bucle parche para evaluar la absorción intestinal de bacterias por las células M. Este método es una versión mejorada del ensayo con ratones asa intestinal se ha descrito anteriormente 6, 7. Los puntos de mejora son los siguientes: 1. Isoflurano fue utilizado como un agente anestésico. 2. Aproximadamente 1 cm incluyendo ligado asa intestinalING parche de Peyer se creó. 3. Las bacterias tomadas por las células M se marcaron con fluorescencia mediante reactivo de marcaje fluorescente o sobreexpresión de la proteína por fluorescentes, como la proteína verde fluorescente (GFP). 4. Las células M del epitelio folicular asociada que cubre las placas de Peyer se detectaron por todo el montaje immunostainig con anticuerpos anti GP2. 5. Fluorescentes transcitosis bacteriana por las células M fueron observados por el análisis microscópico confocal. El ensayo de Peyer del ratón parche asa intestinal puede proporcionar la respuesta qué tipo de comensales o bacterias patógenas transcytosed por las células M, y puede llevarnos a comprender el mecanismo molecular de cómo estimular el sistema inmunológico de la mucosa a través de las células M.
Protocolo
1. Preparación de las células bacterianas
- Glicerol racha surtido bacterias fluorescentes (GFP, como expresión de S. typhimurium) en una placa de agar LB que contenía 100 mg / ml de ampicilina.
- La cultura de una sola colonia de agar LB durante la noche en 2 ml de medio LB nuevo.
- Añadir 0,5 ml de cultivo bacteriano y 4,5 ml de medio LB e incubar nuevas hasta que la densidad óptica de 1,0 a 600 nm se alcanza.
- Cosecha de células bacterianas por centrifugación (3.000 xg, 5 min, 4 ° C).
- Descartar el sobrenadante y lavar dos veces con 5,0 ml de agua estéril de tampón fosfato salino (PBS).
- Resuspender sedimento bacteriano con 5 ml de PBS, y el uso de 50 l de la suspensión que contiene aproximadamente 10 7 unidades formadoras de colonias (UFC) en el inóculo.
- En el caso de la utilización de bacterias marcados con fluorescencia, las células bacterianas fueron etiquetados por reactivo de marcaje de fluorescencia de acuerdo con el protocolo estándar.
2. Anesthesia
- Llene una caja de plástico pequeña (10 x 10 x 5 cm) con un 5% (v / v) isoflurano vaporizado se mezcla con aire (caudal: 200 ml / min).
- Anestesiar de ocho a dieciséis débiles de edad, los ratones macho o hembra en el cuadro.
- Mueva el ratón a una mesa de autopsia después de la anestesia.
- Continuamente anestesiar a los ratones en un 2% (v / v) isoflurano vaporizado se mezcla con aire (caudal: 200 ml / min) (Figura 1). Este es un procedimiento terminal.
3. Ensayo ligado placas de Peyer bucle
- 1 cm de incisión de la piel del abdomen y luego se corta el peritoneo abdominal de un ratón anestesiado y sacar el intestino delgado que contiene la placa de Peyer.
- Ligar el intestino con hilo de coser, teniendo cuidado de evitar los vasos sanguíneos. Nota: sólo se unen por un lado del intestino, y dejar el otro lado flojo.
- Inyectar 50 l de suspensión bacteriana o PBS (control) con una jeringa en el bucle parche liga de Peyer en el s sueltoside del intestino (Figura 2).
- Enlazar lado flojo, y cerrar el abdomen del ratón con un clip.
- Después de 1 hora, quitar la liga de Peyer ciclo de parches, y la eutanasia a los ratones por dislocación cervical.
- Peyer al consumo de parches de bucle de las placas de Peyer liga.
- Parpadea la parte apical de las placas de Peyer por 1 ml de PBS con el uso de una jeringa conectada a una aguja para extraer el exceso de líquido mucoso y bacterias. Parpadear la placa de Peyer un plazo adicional de dos veces.
4. Tinción Todo el montaje y el análisis microscópico confocal de las placas de Peyer
- Fijar las placas de Peyer en BD Cytofix / Cytoperm solución en hielo durante 1 hora.
- Lavar las placas de Peyer tres veces con 1 ml de BD Perm / Wash buffer durante 5 minutos, y luego bloquear con 1 ml de tampón de bloqueo que contiene 0,1% (w / v) de saponina, un 0,2% (w / v) de BSA en PBS durante 30 minutos en hielo.
- Añadir 200 veces diluido anti-ratón de GP2 anticuerpo monoclonal (5 mg / ml) a la muestra para detectarM células.
- Incubar durante 2 horas a temperatura ambiente o durante la noche a 4 ° C.
- Lavar tres veces con 1 ml de PBS frío, se añaden después 200 veces diluido anti-rata de anticuerpos IgG conjugado con DyLight549 (20 ug / ml) a la muestra.
- Incubar la muestra en hielo durante 2 horas.
- Lavar tres veces con 1 ml de PBS frío, a continuación, añadir 50 veces diluido Alexa 633 faloidina conjugada con la muestra para detectar la F-actina.
- Incubar en hielo durante 2 horas.
- Lave suavemente con 1 ml de PBS frío. A continuación, colocar tres a cuatro piezas de la cubierta de vidrio circular en una diapositiva, e incluir las muestras en una solución de 30% de glicerol en PBS en la diapositiva (Figura 3).
- Observar las muestras con un microscopio DM-IRE2 confocal de barrido láser o un microscopio Restauración DeltaVision deconvolución.
5. Los resultados representativos:
En el ejemplo de muestra de un ratón ligado ensayo de placas de Peyer lazo con GFP-S. Typhityphimurium fue observado con un microscopio de deconvolución DeltaVision Restauración (Figura 4). GFP-S. Typhimurium es transcytosed de GP2 + en las células M. Un ensayo de Peyer del ratón parche asa intestinal puede identificar el tipo de bacterias comensales o patógenos que pueden ser transcytosed por las células M.

Figura 1. Anestesia de ratones en condiciones isoflurano vaporizado. Isoflurano vaporizado fue suministrada por un aparato de anestesia especial (lado izquierdo).
Figura 2. Resumen del ensayo de Peyer liga de bucle parche intestinal. La suspensión bacteriana fluorescentes se inyectó con una jeringa en el bucle parche liga de Peyer en el lado flojo del intestino.
Figura 3. Monte de las muestras. Las muestras fueron embebidas en una solución al 30% de glicerol en PBS en una lámina especial en la que estaba destinada una placa de plástico perforada (1 mm de espesor) por el agente adhesivo en un portaobjetos de vidrio.
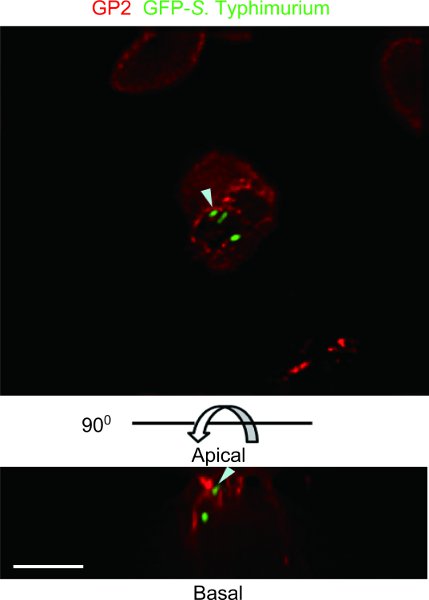
Figura 4. Ejemplo de un ratón ligado ensayo de placas de Peyer lazo con las buenas prácticas agrarias, S. Typhimurium. GP2, que se presenta como marcador de células específicas de M 5, se tiñeron con anticuerpos anti-ratón GP2 (rojo). La muestra se observa con un microscopio deconvolución DeltaVision Restauración. Que expresan GFP S. Typhimurium fue co-localizada con la GP2 en la membrana plasmática apical de las células M y en las vesículas citoplasmáticas subapical (puntas de flecha). Vista superior, apical. Fondo y laterales, puntos de vista lateral. Barra de escala: 10 micras.
Discusión
El tiempo de incubación de parches de Peyer ligado con la suspensión bacteriana suele ser de 1 hora para observar la incorporación de bacterias en las células M. En el caso de cuatro horas de incubación, las bacterias a menudo se detectan en la zona de las células T de las placas de Peyer. A medida que la anestesia con isoflurano vaporizado inhalantes podría mantener estables los ratones, el tiempo de incubación de las placas de Peyer ligado con la suspensión bacteriana se puede ampliar para observar las ...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a todos los miembros del BEI para el desarrollo de esta técnica. Esta investigación fue financiada en parte por la subvención-en-Ayudas a la Investigación Científica en áreas prioritarias "de tráfico de membrana" (HO), y la "Matriz de Fenómenos Infecciosas" (KH), Jóvenes Científicos (SF y KH), e Investigación Científica (HO ), y la investigación científica en áreas innovadoras "Logística intracelular" (HO), del Ministerio de Educación, Cultura, Deportes, Ciencia y Tecnología de Japón.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| LB agar ampicilina- 100 | SIGMA | L5667 | |
| Cy3 mono-reactiva Paquete de tintes | GE Healthcare | PA23001 | |
| Alexa Fluor 350 ácido carboxílico, succinimidil éster | Invitrogen | A10168 | |
| La anestesia de inhalación aparato | Shinano Seisakusho | SN-487 | |
| La fijación y Permeabilización Solución | BD | 554722 | |
| Anti-ratón Glicoproteína 2 anticuerpo | MBL | D278-3 | De 200 veces de dilución (5μg/ml) |
| De cabra anti-IgG de rata, F (ab ') 2 fragmento específico | Jackson ImmunoResearch | 112-505-006 | De 200 veces de dilución (20μg/ml) |
| Alexa Fluor 633 Phalloidin | Las sondas moleculares | A22284 | 50 veces la dilución |
| Láser confocal microscopio | Leica Microsystems | DMIRE2 | |
| DeltaVision Restauración deconvolución microscopio | Aplicada de precisión | DeltaVision núcleo |
Referencias
- Fagarasan, S., Honjo, T. Intestinal IgA synthesis: regulation of front-line body defences. Nat. Rev. Immunol. 3, 63-72 (2003).
- Hapfelmeier, S. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses. Science. 328, 1705-1709 (2010).
- Owen, R. L., Jones, A. L. Epithelial cell specialization within human Peyer's patches: an ultrastructural study of intestinal lymphoid follicles. Gastroenterology. 66, 189-203 (1974).
- Neutra, M. R., Mantis, N. J., Kraehenbuhl, J. P. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat. Immunol. 2, 1004-1009 (2001).
- Hase, K. Uptake through glycoprotein 2 of FimH(+) bacteria by M cells initiates mucosal immune response. Nature. 462, 226-230 (2009).
- Punyashthiti, K., Finkelstein, R. A. Enteropathogenicity of Escherichia coli. I. Evaluation of mouse intestinal loops. Infect. Immun. 4, 473-478 (1971).
- Owen, R. L., Pierce, N. F., Apple, R. T., Cray, W. C. M cell transport of Vibrio cholerae from the intestinal lumen into Peyer's patches: a mechanism for antigen sampling and for microbial transepithelial migration. J. Infect. Dis. 153, 1108-1118 (1986).
- Owen, R. L. M cells--entryways of opportunity for enteropathogens. J. Exp. Med. 180, 7-9 (1994).
- Clark, M. A., Hirst, B. H., Jepson, M. A. M-cell surface beta1 integrin expression and invasin-mediated targeting of Yersinia pseudotuberculosis to mouse Peyer's patch M cells. Infect. Immun. 66, 1237-1243 (1998).
- Jensen, V. B., Harty, J. T., Jones, B. D. Interactions of the invasive pathogens Salmonella typhimurium, Listeria monocytogenes, and Shigella flexneri with M cells and murine Peyer's patches. Infect. Immun. 66, 3758-3766 (1998).
- Nagai, S. Role of Peyer's patches in the induction of Helicobacter pylori-induced gastritis. Proc. Natl. Acad. Sci. U. S. A. 104, 8971-8976 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados