Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Preparación de la cola intacta discos intervertebrales bovina para la Cultura de Órganos
En este artículo
Resumen
Este protocolo ilustra una técnica de recolección de coccígea discos intervertebrales de la especie bovina para el cultivo de órganos para In vitro La cultura de órganos.
Resumen
El disco intervertebral (DIV) es la articulación de la columna vértebra a vértebra conexión. Su función es transmitir la carga de la columna y dar flexibilidad a la columna vertebral. Se compone de tres compartimentos: el núcleo pulposo interior (NP), que abarca el anillo fibroso (AF), y dos placas de extremo cartilaginoso conecta el PN y el FA en el cuerpo vertebral en ambos lados. El dolor discogénico, posiblemente causado por una enfermedad degenerativa del disco intervertebral (DDD) y hernias de disco ha sido identificado como un problema importante en nuestra sociedad moderna. Para estudiar los posibles mecanismos de la degeneración IVD, en los sistemas de cultivo in vitro con células de órganos disco en vivo son muy atractivas. El cultivo in vitro de la especie bovina intacta DIV coccígea ha avanzado a un sistema de modelo correspondiente, que permite el estudio de la mecano-biológicos aspectos en un ambiente bien controlado fisiológicos y mecánicos. DIV bovina cola se puede obtener con relativa facilidad en un mayor númerod son muy similares a los humanos DIV lumbar con respecto a la densidad celular, la población de células y las dimensiones. Sin embargo, las técnicas anteriores bovina caudal cosecha IVD retener platillos cartilaginosos y óseos platillos no después de 1-2 días de cultivo ya que las vías fueron bloqueadas, obviamente, la nutrición por la sangre coagulada. DIV son los principales órganos avascular, por lo tanto, los nutrientes a las células en el PN sólo dependen de la difusión a través de las papilas capilares del cuerpo vertebral adyacente. Presencia de restos de huesos y la sangre coagulada en la superficie de la placa terminal puede impedir la difusión de nutrientes en el centro del disco y la viabilidad celular compromiso. Nuestro grupo ha establecido un protocolo relativamente rápida de "crack", el DIV de la cola con un bajo riesgo de contaminación. Somos capaces de permeabilizar las superficies óseas recién cortada placa terminal mediante un sistema de chorro de lavado quirúrgico, que elimina los coágulos de sangre y restos de corte y de manera muy eficiente se vuelve a abrir la vía de difusión de nutriciónen el centro de la DIV. La presencia de placas de crecimiento en ambos lados del hueso vertebral tiene que ser evitada y para ser removido antes de la cultura. En este vídeo, se exponen los pasos cruciales en la preparación y demostrar la clave para una cultura de órganos con éxito el mantenimiento de la viabilidad celular alta durante 14 días en cultivo sin inflamación. El tiempo de cultivo podría extenderse al entorno mecánico adecuado se puede mantener mediante el uso de biorreactores de carga mecánica. La técnica ha demostrado aquí se puede extender a otras especies animales, como porcinos, ovinos y aislamiento leporino IVD caudal y lumbar.
Protocolo
1. La cosecha del disco intervertebral
- La cola toda la longitud de la especie bovina se obtiene de un matadero local, si es posible sin la piel ya que la presencia de la piel aumenta la probabilidad de contaminación (Fig. 2).
- Prepare la tabla de cortar grande y preparar la estación de trabajo e instrumentos estériles en la parte superior de una tabla de cortar (Fig. 2).
- Preparar bajo la capucha de gasa estéril laminar flujo estéril humedecida con cloruro sódico al 0,9% que contiene citrato de sodio de 55 mm y poner en cada pocillo de la placa de 6 pocillos.
- Prepare un recipiente y se diluye 1:100 solución de Betadine con agua del grifo.
- Sumerja la cola de la especie bovina todo en un recipiente que contiene 1% de solución de Betadine durante 5 min.
- En pocas palabras la cola seca con una gasa estéril y colocarlo en la estación de trabajo estéril.
- Retire con cuidado los músculos alrededor de la cola con hoja de bisturí # 22.
- Tajan las partes de la cola que no son necesarios, por lo general los dos extremos de la cola, que contienen relativamente grandes y muy pequeñosDIV (Fig. 3).
- Recortar aún más los músculos y tendones alrededor de la DIV con hoja de bisturí # 10. Tenga cuidado de no cortar el anillo externo de los discos.
- Marque la parte anterior del IVD con un marcador quirúrgico de la piel (este paso es opcional, que ayuda a determinar el centro de la rotación axial de nuestro biorreactor).
- Localice el IVD y el punto de conexión vértebra moviendo la cola suavemente. Siente la frontera entre IVD y el hueso con el lado opaco de una hoja de bisturí. El sitio de escisión debe ser 1-2 mm de distancia del IVD a la vértebra. Personalizada lugar hizo poseedor de la hoja industrial en el sitio de clivaje (Fig. 4).
- Cleave IVD y una vértebra a golpe de martillo en la parte superior del soporte de la cuchilla a medida industrial (Fig. 3).
- Repita en el otro lado de la conexión del DIV-vértebra.
- Envuelva aislados IVD con una gasa estéril humedecida con cloruro sódico al 0,9% que contiene citrato de sodio de 55 mm.
- Continuar con el aislamiento de DIV en el número deseado de la muestra (por lo general alrededor de 6 puedeser cosechados con un diámetro entre 10-20 mm).
- Conecte el sistema de lavado de chorro (Zimmer, inc.) Con solución de Ringer lactato estéril, 5L bolsas son de un tamaño útil (como alternativa PBS estéril o solución salina 0,9%).
- Sostenga el IVD con pinzas y el lavado de chorro-los dos lados de la superficie de la placa final con Zimmer Pulsavac chorro de lavado del sistema (Fig. 1C). La pistola de chorro se debe tirar en la superficie de la placa terminal en un ángulo entre 30 a 60 ° durante unos 30 a cada lado. (Figuras 1 y 7)
- Ponga el DIV de nuevo a la placa de 6 pocillos y envolver con una gasa humedecida, mientras que otra muestra de chorro de lavado de disco.
- DIV están listos para el cultivo de órganos y aguas abajo de aplicaciones (por ejemplo, viabilidad celular, la carga mecánica, la cultura de órganos) (Fig. 1D).
2. Resultados representante
Mediciones de los resultados para juzgar a una preparación exitosa del disco intervertebral puede ser un experimento de difusión, donde un tinte fluorescente de bajo peso molecular (por ejemplo, Procion rojo)se prepara como una solución al 1% en PBS 2. El IVD es luego mantenido con al menos 100 ml de solución de tinte y tinte entonces se permite difundir pasivamente en el IVD durante 24 horas bajo la hinchazón libre. El IVD es entonces flash-congeladas en nitrógeno líquido y trajo de vuelta a la temperatura ambiente y se deshidrata por una serie de transferencias de acetona (primera pre-enfriado de -80 ° C, entonces -20 ° C, luego 4 ° C y, finalmente, a la temperatura ambiente ). El disco puede ser embebido en poli-metil-acrilato de metilo (PMMA) y cortar con una cuchilla afilada para producir 100 micras de espesor secciones. Estas secciones se pueden ver por cualquier microscopio de campo claro estándar, pero de preferencia por el uso de microscopía de fluorescencia desde Procion rojo emite una fluorescencia de color rojo (Fig. 5-6). El trabeculi de la superficie ósea parece muy limpio después del paso de lavaging jet (Fig. 7).
Los parámetros de una cultura de órganos exitosos son en primer lugar la ausencia de contaminación, mantener la viabilidad celular (Figs. 8-9), la altura del disco ygeneral "del disco integridad", medida con cortes histológicos y safranina O / verde o tinción Hematoxilina de Meyer 3. Hemos desarrollado protocolos y macros publicado en otra parte 4,5 para teñir el tejido del disco en vivo y para explorar la viabilidad celular en 3D usando un microscopio láser confocal de barrido y el kit de coloración en vivo / muerto (Molecular Probes, Invitrogen, Basilea, Suiza). Hemos desarrollado más de una macro y la rutina para realizar conteo de células automatizado para estimar la viabilidad celular en el tejido 3D o 3D los transportistas que utilizan la plataforma NIH ImageJ 4-6. Protocolos alternativos han sido propuestos para determinar la viabilidad celular de las células del disco por la digestión inicial mediante digestión secuencial de la matriz extracelular con pronasa y colagenasa tipo 2 y luego a la mancha de la suspensión celular 7. Una versión anterior del protocolo ha supuesto un paso de incubación en PBS que contenía diez veces más concentrado concentración de penicilina / estreptomicina durante 10 minutos después de la recolección de los discos antes de órganos culture. Con el paso de lavado de chorro de este paso se convierte en obsoleto ya que este paso parece beneficioso para fines de cultivo.

Figura 1. Descripción de los pasos metodológicos para preparar bovina discos intervertebrales coccígea con placas intactas y una capa fina (1-2mm) de los huesos. A) Representación esquemática del disco intervertebral (DIV) y sus vías de nutrición. B) Procedimiento para cortar el IVD con una hoja personalizada del titular y una cuchilla afilada industrial. C) Jet lavado paso para asegurar la viabilidad celular alta para permitir el intercambio de nutrientes mantener las placas terminales y 1-2 mm de hueso adjunto a ambos lados. D) Por último, el IVD pueden ser cultivados en la cámara de muestra de un biorreactor o ser utilizado para cualquier aplicación de aguas abajo.
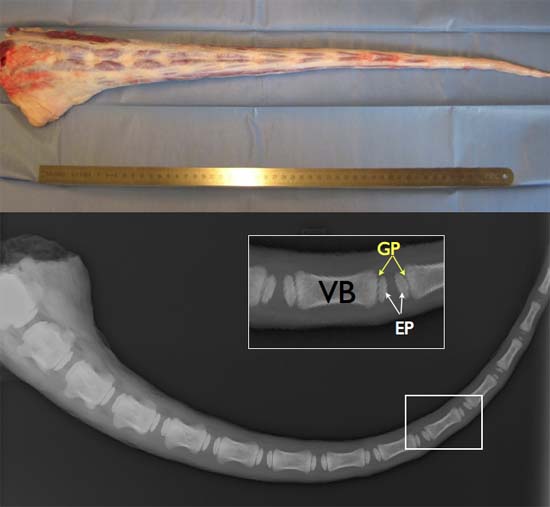
Figura 2 TOP:. Longitud total fresca de cola de la especie bovina (idealmente obtaINED a las 2-3 horas post-mortem para asegurar la viabilidad celular alta. Abajo: imagen de rayos X de una cola de la especie bovina de 6 meses de edad que ilustra la existencia de placas de crecimiento (GP), un centro secundario de osificación, entre las placas extremas ósea (EP) y los cuerpos de vértebras (VB).
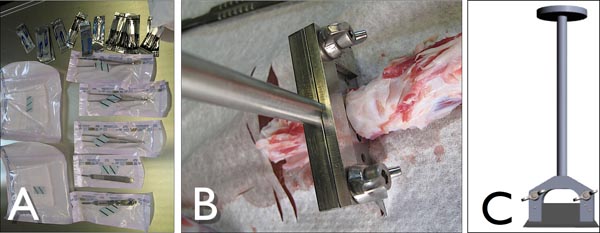
Figura 3. A Tools) para diseccionar la cola de la especie bovina en condiciones estériles. B) a medida el titular de la hoja de corte de los segmentos promocionales de la cola de la especie bovina en la acción, mientras que el corte del disco intervertebral. C) Vista lateral de la hoja personalizada titular con una hoja estándar industrial (Lutz, Alemania).

Figura 4. Dibujo y foto de la cola de la especie bovina después de retirar el tejido circundante y ligamentos que ilustran los sitios de escisión para cortar los segmentos promocionales. Parcial vértebra debe ser "agrietado" wiª del soporte de la cuchilla a medida idealmente 1-2 mm de distancia de las placas terminales cartilaginosas para asegurar que la superficie ósea completa.
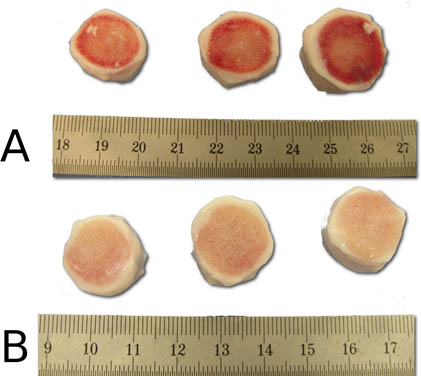
Figura 5. Demostración de la limpieza efectiva de la etapa de jet-lavado antes (A) y después (B). Observe las superficies limpias ósea de los segmentos de disco intervertebral después de que el procedimiento de fumigación.
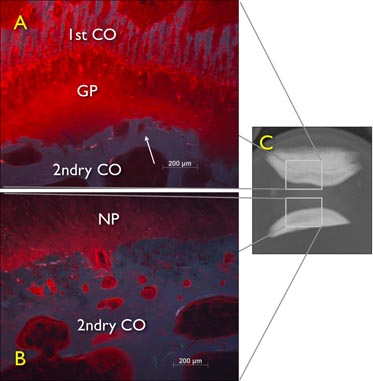
Figura 6. Free-inflamación experimento difusión de recién preparada extirpado los discos intervertebrales cola bovina (IVD) a la izquierda por 24 horas en una solución de 1% Procion rojo, lo que demuestra efecto de bloqueo de la placa de crecimiento. Una radiografía digital sagital de un DIV que todavía contiene la placa de crecimiento y una segunda capa de la imagen de microscopía de fluorescencia de hueso corte sagital a través de la coccígea explante bovina disco intervertebral con placa terminal cartilaginosa y ósea después de 24h libre difusión. GP: placa de crecimiento, 2ndry CO: centro secundario de osificación.

Figura 7. Free-inflamación experimento de recién preparada extirpado los discos intervertebrales cola bovina (IVD) a la izquierda por 24 horas en una solución de 1% Procion rojo, lo que demuestra el efecto del tratamiento de limpieza de chorro de lavado. Sagital secciones gruesas (~ 100 mm) de extirpar DIV bovina con placas de ~ 1,5 mmthick final ósea que se sometieron a un tratamiento de chorro de lavado (izquierda) el control sin tratamiento (derecha) jet-lavaged tratamiento. De entrada muestra el patrón de spray, que fue utilizado por la herida Zimmer desbridamiento sistema experimentos 24h libre difusión de bovinos explantes de disco intervertebral en rojo Procion 1%.
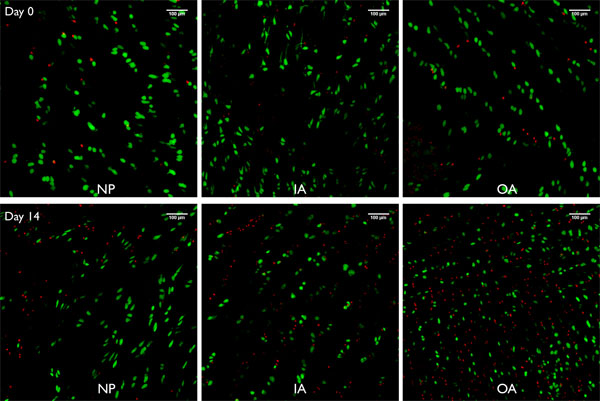
Figura 8. Imágenes Live / Dead de proyecciones de imágenes confocal pilas (250 micras) tomadas de bovinsegmentos e disco intervertebral preparados con este método de chorro de lavado mantenido bajo libre inflamación de los días 0 y 14, respectivamente, para el núcleo pulposo (NP), el interior del anillo fibroso (IA) y el anillo fibroso externo (OA). Las células verde = células vivas manchado por calceína AM (acetil éster metílico), glóbulos rojos = núcleo de las células muertas teñidas con homodímero de etidio-1.
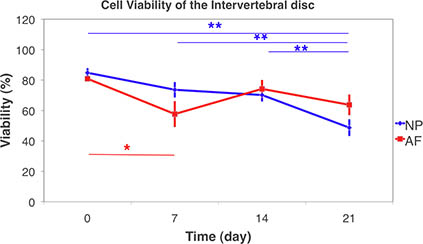
Figura 9. Viabilidad de las células del disco intervertebral con láser confocal de barrido microscopio en los tejidos vivos y escaneo 3D pila. La viabilidad celular de núcleo pulposo (NP) y anillo fibroso (AF) en los 21 días de cultivo bajo condiciones de libre hinchazón. (Media ± SEM, n = 6) Las diferencias estadísticas se sometieron a pruebas no paramétricas de Kruskal-Wallis firmado prueba la suma de rangos entre los grupos. Se encontraron diferencias significativas entre los días 21 y todos los puntos de otro momento de la NP. Mientras que en las diferencias de AF se encontraron entre el día 7 deel día 0. (* P <0,05, ** p <0,01).
Discusión
El primer paso para el cultivo de órganos con éxito es asegurarse de que el explante no debe estar contaminada. La cola debe ser de piel antes de comenzar con el procedimiento. Cualquier pelo llevados a un laboratorio estéril podría ser problemático en términos de contaminación. La cola de la especie bovina idealmente deben estar tan frescos como sea posible (esto afecta a la viabilidad inicial de la célula). Además, el paso de lavado betadine se recomienda para reducir el riesgo de contaminación. En lugar de ...
Divulgaciones
No tenemos nada que revelar.
Agradecimientos
Este proyecto fue financiado por la Swiss National Science Foundation (SNF # 310030-127586/1).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| De tejido fresco de bovino disco intervertebral de las colas de las especies bovina, de la casa de masacre local (idealmente dentro de las horas post-mortem y sin piel). | |||
| Pulsavac Plus System CA | Zimmer inc., Suiza | 00-5150-486-01 | El mejor rendimiento con el jefe de la cadera en aerosol y con fuente de alimentación de corriente alterna (la que tiene el paquete de 8 pilas AA también funciona, pero es menos conveniente) |
| Alta capacidad del ventilador spray w / Protector contra salpicaduras, longitud 12,7 cm | Zimmer inc., Suiza | 00-5150-175-00 | Hay varias cabezas de aerosol disponibles, hemos probado con éxito este |
| Hojas de bisturí # 22 y # 10 | Swann-Morten, Inglaterra | # 10: 0201 # 22: 0208 | |
| Titular de la hoja de bisturí # 3 y # 4 | Hausmann, Alemania | # 3: 06.103.00 # 4: 06.104.00 | |
| Lutz industrial blade | Lutz, Alemania | 1022.0884 | |
| Tampón fosfato salino (PBS) | Invitrogen, Suiza | 10010-023 | |
| Dulbecco Eagle modificado (DMEM) | Gibco, Suiza | 11960-044 | |
| Solución de Ringer lactato (sin glucosa) | Bichsel, Suiza | 133 0002 | |
| 6-y multi-pocillos | TPP, Suiza | 92006 | |
| Betadine solución | Mundipharma, Suiza | 10055025 | |
| Marcador quirúrgica de la piel | Porex Surgical, Suiza | 9560 | |
| Tabla de cortar grande | Cualquier marca es posible | ||
Referencias
- Lee, C. R., Iatridis, J. C., Poveda, L., Alini, M. In vitro organ culture of the bovine intervertebral disc: effects of vertebral endplate and potential for mechanobiology studies. Spine (Phila Pa 1976). 31, 515-522 (1976).
- Chan, S. C. W., Gantenbein-Ritter, B., Leung, V. Y., Chan, D. Cryopreserved intervertebral disc with injected bone marrow-derived stromal cells: a feasibility study using organ culture. Spine. J. 10 (6), 486-496 (2010).
- Chan, S. C., Ferguson, S. J., Wuertz, K., Gantenbein-Ritter, B. Biological Response of the Intervertebral Disc to Repetitive Short Term Cyclic Torsion. Spine (Phila Pa 1976). , (2011).
- Gantenbein-Ritter, B., Sprecher, C. M., Chan, S., Illien-Jünger, S., Grad, S. Confocal imaging protocols for live/dead staining in three-dimensional carriers. Methods Mol. Biol. 740, 127-140 (2011).
- Gantenbein-Ritter, B., Potier, E., Zeiter, S., van der Werf, M. Accuracy of three techniques to determine cell viability in 3D tissues or scaffolds. Tissue Engineering Part C Methods. 14, 353-358 (2008).
- Rasband, W. S. . ImageJ. , (1997).
- Haschtmann, D., Stoyanov, J. V., Ettinger, L., Nolte, L. P., Ferguson, S. J. Establishment of a novel intervertebral disc/endplate culture model: analysis of an ex vivo in vitro whole-organ rabbit culture system. Spine. 31, 2918-2925 (2006).
- Gantenbein, B., Grünhagen, T., Lee, C. R., van Donkelaar, C. C. An in vitro organ culturing system for intervertebral disc explants with vertebral endplates: a feasibility study with ovine caudal discs. Spine. 31, 2665-2673 (2006).
- Korecki, C. L., Kuo, C. K., Tuan, R. S., Iatridis, J. C. Intervertebral disc cell response to dynamic compression is age and frequency dependent. J. Orthop. Res. 27, 800-806 (2009).
- Korecki, C. L., MacLean, J. J., Iatridis, J. C. Dynamic compression effects on intervertebral disc mechanics and biology. Spine (Phila Pa 1976). 33, 1403-1409 (1976).
- Jim, B., Steffen, T., Moir, J., Roughley, P., Haglund, L. Development of an intact intervertebral disc organ culture system in which degeneration can be induced as a prelude to studying repair potential. European Spine Journal. , 1-11 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados