A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מידול והדמיה 3-Dimensional Cell קיבוציים Invasion
In This Article
Summary
מודלים של פלישת תאים סרטניים לתוך מטריצה תלת ממדי תאיים לשקף טוב יותר את In vivo המצב מאשר דו מימדי מבחני תנועתיות. באמצעות פלישה מטריצה מבחני בשילוב עם הדמיה confocal של תאים fluorescently שכותרתו, מידע מפורט על דרכי הפלישה התרומות נפרדות של מוביל לעומת התאים הבאים ניתן להשיג.
Abstract
המאפיין המגדיר של ממאירות סרטן הפלישה גרורות 1. בכמה סוגי סרטן (ה g. Glioma 2), פלישה מקומית לתוך הרקמה הבריאה המקיפה אותה היא שורש של מחלות ומוות. עבור סוגי סרטן אחרים (ה g. השד, סרטן ריאות, וכו '.), הוא תהליך של גרורות, שבו תאים סרטניים לנוע ממקום הגידול הראשוני מסה, ליישב אתרי דיסטלי, ובסופו של דבר לתרום כשל איברים, שבסופו של דבר מוביל לתחלואה תמותה 3. ההערכה היא כי הפלישה גרורות אחראים ל -90% ממקרי המוות מסרטן 4. כתוצאה מכך, חלה עניין רב בזיהוי תהליכים מולקולריים המתווכים חלבון קריטית של הפלישה גרורות לצורך אבחון וטיפול בשיפור 5.
האתגר העומד בפני החוקרים הוא לפתח סרטן מבחני הפלישה כי די דומה למצב in vivoכדי לאפשר דוגמנות מחלה מדויק 6. דו מימדי תנועתיות מבחני סלולריים הם רק אינפורמטיבי על היבט אחד של הפלישה אינם מביאים בחשבון שיפוץ תאי חלבון מטריקס (ECM) אשר גם הוא אלמנט קריטי. לאחרונה, מחקרים מעודן ההבנה שלנו של הפלישה תא הגידול גילה כי תאים בודדים יכול לנוע על ידי מצבי מוארך או מעוגל 7. בנוסף, חלה הערכה גדולה יותר של התרומה של הפלישה קיבוצי, שבו תאים לפלוש בקווצות, סדינים אשכולות, בעיקר גידולים מובחנים מאוד כי לשמור על המאפיינים אפיתל, להתפשטות סרטן 8.
אנו מציגים שיטה מעודן 9 לבחינת תרומתם של חלבונים מועמד לפלישה קולקטיבית 10. בפרט, על ידי הנדסה בריכות נפרדות של תאים לבטא את חלבוני ניאון שונים, אפשר מולקולרי לנתח את הפעילויות proteins הנדרשים בתאים המובילים לעומת אלו הנדרשים בתאים הבאים. השימוש RNAi מספק את הכלי מולקולרית בניסוי לפרק את התהליכים הכרוכים הפלישה תא יחיד, כמו גם עמדות שונות של חדירה קולקטיבית. בהליך זה, תערובות של תאים fluorescently שכותרתו הם מצופה בתחתית להוסיף Transwell מילא בעבר עם חלבון ECM Matrigel, אז מותר לפלוש "כלפי מעלה" דרך המסנן לתוך Matrigel. שחזור של סדרת Z-ערימות התמונה, מתקבל על ידי הדמיה confocal, תוך ייצוג תלת מימדי המאפשר הדמיה של קולקטיבי גדילי הפולש וניתוח של ייצוג של תאים fluorescently שכותרתו מובילים לעומת העמדות הבאות.
Protocol
1. תיוג retroviral של תאים עם חלבוני ניאון
- Retroviral פלייט אריזה תאים (למשל פיניקס) לעבר 0.25 x 10 6 תאים לכל טוב של 6-היטב המנה ב 10% בסרום שור עוברית (FBS) / DMEM.
- תאים עם DNA Transfect retroviral 48 שעות לאחר מכן התאים באמצעות Effectene בהתאם להוראות היצרנים.
- יש לשטוף את הבארות פעמיים עם 24 שעות בינוני מאוחר יותר, ולאחר מכן להוסיף 1.5 מ"ל של 10% FBS / DMEM לכל טוב.
- איסוף וירוס ארוזים בתרבית רקמה בינוני 48 שעות מאוחר יותר על ידי pipetting והעברת ל 2 צינורות microcentrifuge מ"ל.
- צנטריפוגה בסל"ד 1600 במשך 5 דקות עד גלולה כל התאים.
- הסר supernatant לצינור נקי חנות ב -80 ° C.
- תאים להיות retrovirally transduced הם מצופה החוצה 1.5 x 10 5 תאים לכל גם מנה 6 היטב להציב חממה humidified על 37 מעלות צלזיוס למשך הלילה.
- למחרת, להסיר את מדיה של תאים המודעהד 1 מ"ל של המניה וירוס בתוספת polybrene 4 μl (2 מ"ג / מ"ל) היטב כל אחד. החלפת צלחות חממה.
- לאחר דגירה של 5-6 שעות, להוסיף 2 מ"ל 10% FBS / DMEM זה היטב צלחות מוחלפים ב 37 ° C inbubator לילה.
- למחרת, להחליף את התקשורת ולאפשר תאים 24 שעות לפני הוספת מדיה סלקטיבית המתאימה.
- כאשר ומחוברות (אשר תלויה בשיעור הצמיחה של תאים, ואת היעילות של התמרה retroviral, אבל בדרך כלל לוקח 4-14 ימים), trypsinize תאים ולמיין עבור תאים באמצעות הקרינה הלא transduced כנקודת התייחסות, לאסוף תאים עם בריכה הקרינה יותר מאשר אי - transduced תאים aliquots להקפיא ב -80 ° C לשימוש עתידי.
2. Assay הופכי Matrigel הפלישה
- אט אט להפשיר aliquot של Matrigel מלא (כלומר מכיל גורמי גדילה) על הקרח (איור 1A).
- לאחר שהופשרו, לדלל Matrigel 01:01 בקרח קר PBS (יחד עם כל תוספת אחרתטיפול בריכוז 2x ב PBS לפני דילול; איור 1B). כדי להקל לטפל Matrigel לפני פילמור, כל plasticware (טיפים למשל, צינורות וכו ') צריכים להיות קרים כקרח.
- הכנס כמו נקבוביות רבות 8 מיקרון 6.5 מ"מ בקוטר ציפוי Transwells כנדרש לתוך הבארות של צלחת 24 רקמות היטב בתרבות, אז בזהירות פיפטה 100 μl של Matrigel מדולל לתוך בארות לעזוב כדי לדגור על ~ 30 דקות בשעה 37 ° C כדי לחזק (תרשים 1C).
- במהלך תקופה זו, להכין את אחד או יותר fluorescently שכותרתו השעיות התא בין 1-4 x 10 5 תאים לכל מ"ל, בהתאם לקו התא, ממצב טרום טיפול אחד (ה g., SiRNA טיפול תרופתי) בצמיחה הרגיל שלהם בינוני (איור 1D).
- כאשר Matrigel יש הקרושה, להפוך את Transwells ו פיפטה 100 μl של השעיה על התא התחתון כלפי מעלה מול של המסנן (איור 1E).
- בזהירות לכסות את Transwells עם הבסיס של רקמת 24 בארצלחת תרבות, ליצור קשר עם כל טיפה של השעיה תא (איור 1F).
- דגירה את הצלחת במצב הפוך למשך 4 שעות כדי לאפשר התקשרות התא (איור 1G).
- לאחר תקופה זו, לפנות את הצלחות בצד ימין למעלה ולשטוף כל Transwell ידי רציפים טובל בינוני 2 x 1 מ"ל סרום חופשי (איור 2A).
- השאירו את Transwells ב 1 / 3 המכיל גם תרופות או טיפולים נדרשים (2B איור).
- בעדינות פיפטה 100 μl של 10% FBS / DMEM פלוס chemoattractant (ה g. EGF במהירות של 25 ng / ml) לתוך Transwell על גבי Matrigel הקרושה / תערובת PBS, להחליף את המכסה דגירה של 3-5 ימים לכל 37 ° C עם 5% CO 2 (איור 2 ג).
3. מכתים ויזואליזציה
- תאים להביע את חלבוני ניאון ניתן לדלג על השלבים הבאים לפני מיקרוסקופיה confocal
- כדי לא פלורסנט תאים תמונה הפולשים, Matrigel Transwells מקום 24 מנות טריות היטב פיפטה 1 מ"ל של 4 מיקרומטרCalcein AM פתרון כתם על גבי תקע כל Matrigel, שמאפשר לו לשפוך על הכתם מן הצדדים העליון והתחתון. Calcein AM (אסתר acetoxymethyl של calcein) הוא צבע תא חי כי כתמי התאים כולו ירוק לא דורש קיבוע.
- דגירה 1 שעה בשעה 37 ° C ב 5% CO 2 האווירה humidified, שבו תאים נקודת מוכתמים לגמרי ומוכן להיות צילמו באמצעות מיקרוסקופיה confocal.
- לחילופין, אי - ניאון התאים הפולשים Matrigel עשויים להיות קבועים ומוכתמת כמתואר להלן ב 3.5-3.9.
- העברת כל Transwell לצלחת 24 גם טרי. כיסוי 1 מ"ל של 4% para-formaldehyde/0.2% טריטון X-100.
- דגירה בטמפרטורת החדר למשך שעה 0.5.
- הסר מקבע לשטוף 3 פעמים עם 1 מ"ל PBS.
- הסר RNA cytoplasmic עם טיפול 30 דקות באמצעות RNase 100 מיקרוגרם / מ"ל RNase. לשטוף 2 פעמים עם PBS.
- להדמיה להוסיף 0.01 מ"ג / מ"ל יודיד Propidium (PI) מדולל PBS ולהשאיר בטמפרטורת החדר על דהר.ק. שעה 0.5. לשטוף 3 פעמים עם PBS. בשלב זה, מוכתם לצרכן transwell יכולים להישמר בטמפרטורת החדר בחושך במשך חודש לפחות 1.
- שיטות דימות מדויק על ידי מיקרוסקופיה confocal תלויים המשאבים הזמינים. באמצעות מיקרוסקופ confocal הפוכה, Transwell מקום עם כמות קטנה של PBS שיורית על coverslip גדול (להבטיח בועות לא קיימים) על אי - טבילה אובייקטיבי X 20 ו ללכוד קטעי אופטי כל 10-15 מיקרומטר מהחלק התחתון של התקע matrigel. פרוסות אופטי יחיד יכול לשמש כדי לכמת את מידת הפלישה (איור 3A) או לבנות תוך 3 מימדי האובייקטים באמצעות תוכנה מתאימה, כגון Volocity (איור 3B).
4. נציג תוצאות
דוגמה סדרה Z-של פרוסות אופטי מוצג איור 3A. במקרה זה, התאים היו מוכתמות Calcein בבוקר את מספר התאים הפולשים מבית המסנן ניתן לראות ירידה עם המרחק. כימות בvasion ניתן לעשות זאת באמצעות ניתוח היחס בין Calcein AM פיקסלים פיקסלים שלילי חיובי במרווח אחד, או באמצעות שיטת קיבוע / מכתים כמפורט לעיל והספירה גרעינים לצרכן חיובית בעמדה זו. אחד היתרונות של Calcein AM מכתים היא 3 מימדי כי שחזורים של הפלישה תא ניתן להרכיב באמצעות תוכנה כגון Volocity, נותן תיאור ויזואלי של מצב של פלישה (איור 3B). אם התאים מסומנים על ידי ביטוי של חלבוני ניאון, אז העמדות של כל תא צבע ניתן דמיינו ב 3 מימדי שחזורים, שנצפו גם מהצד (איור 3 ג) או על ידי ביצוע פרוסות באמצעות שחזור (איור 3D).
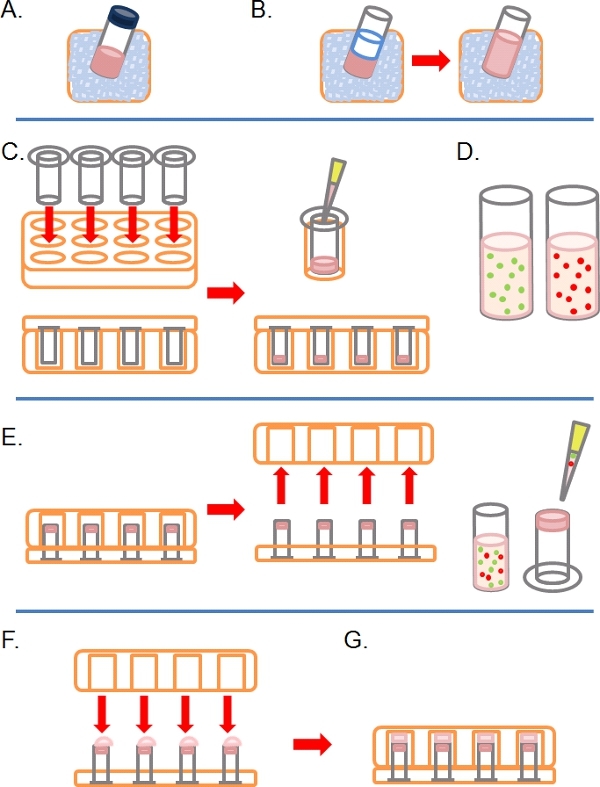
באיור 1. תרשים סכמטי של השלבים הכרוכים בהקמת assay הפלישה הפוך. א) Matrigel ECM מופשר על הקרח. ב) Matrigel היא מדוללת 1:01 עם PBS ובו כל טיפולים תרופתיים בריכוז הסופי פעמיים. ג) מוסיף Transwell ממוקמות לתוך צלחות multiwell ו Matrigel pipetted זה לתוך זה. ד) השעיות Cell עשה בריכוז הרצוי. ה) לאחר Matrigel קבע, את הצלחת מתהפכת, מוסר, התאים מצופה על המסנן התחתון של מחדיר Transwell. F) במצב ההפוך, הצלחת multiwall ממוקם היטב מעל מוסיף Transwell, ליצור קשר עם השעיה התא. G) תאים מותר לדבוק המסנן במשך 4 שעות.
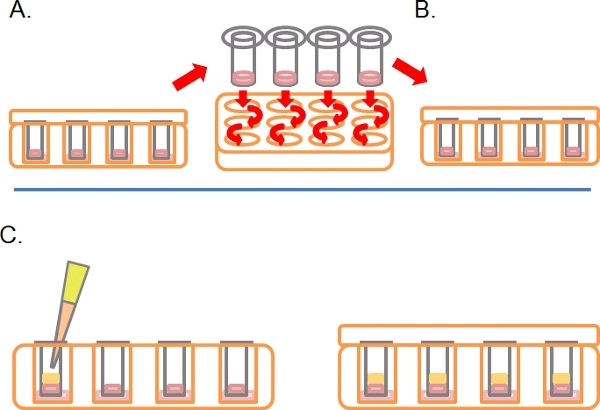
באיור 2. המשך בתרשים סכמטי עבור assay הפלישה הפוך. א) לאחר התאים דבק, טובלים כל Transwell לתוך סרום ללא מדיה פעמיים כדי להסיר את התאים רופף. ב) מקום רחצה Transwell לתוך מדיה המכילה גם בתוספת טיפולים הסופי כנדרש. ג) מדיה המכילה chemoattractant (נסיוב למשל 10% שור עוברית) עם טיפולים כנדרש היא שכבתית בזהירות על Matrigel.
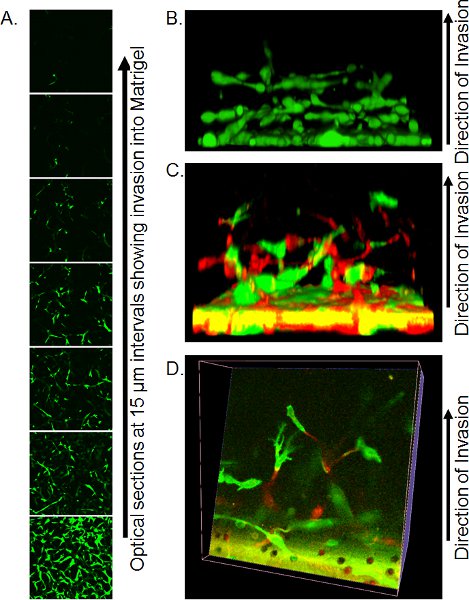
באיור 3. תמונות נציג תוצאות assay הפלישה הפוך. א) סעיפים אופטית של תאים מוכתם Calcein AM הפולש Matrigel, נלקחה ב 15 מיקרומטר במרווחים על ידי מיקרוסקופיה confocal. ב) שיקום שיקום 3 מימדי הפלישה תא מתוך ערימה של תמונות confocal-Z סדרה, במבט מהצד. הודפס מתוך התייחסות 10. ג) שחזור תלת ממדי של תאים GFP ו-RFP שכותרתו פלישה Matrigel במבט מהצד. ד) פרוסה אופטי באמצעות שחזור 3 ממדי של תאים GFP ו-RFP שכותרתו. הודפס מתוך התייחסות 10.
Discussion
מבחני Matrigel הפלישה מסורתי הוקמו עם תאים להציב על גבי שכבה של חלבון תאי מטריקס עם תנועתיות chemoattractant-Induced לכיוון ועל דרך פילטר בתחתית. הפולשנות היה הבקיע כפונקציה של כמה תאים אפשר לסמוך על החלק התחתון של המסנן. אמנם למעשה יש הבדל קטן עם assay "הפוך" הפלישה שתוארו לעיל, ק...
Disclosures
המחברים אין לחשוף.
Acknowledgements
המימון למחקר זה הוא מן לחקר הסרטן בבריטניה.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
|---|---|---|---|
| DMEM (Medium השתנה Dulbecco של הנשרים) | GIBCO | 21969 | |
| סרום שור עוברית | PAA | ת 15-101 | |
| פניצילין סטרפטומיצין | GIBCO | 15140 | |
| 200 מ"מ L-גלוטמין (100x) | GIBCO | 25050-032 | |
| Puromycin | Sigma-Aldrich | P8833 | |
| 0.05% טריפסין EDTA | GIBCO | 25300 | |
| Polybrene | Sigma-Aldrich | AL-118 | |
| Lipofectamine מגיב 2000 | Invitrogen | 11668019 | |
| Transwells 6.5mm, 8.0 מיקרומטר גודל הנקבוביות | קורנינג | 3422 | |
| השלם Matrigel | BD Biosciences | 354234 | |
| Calcein AM | Invitrogen | C1430 | |
| RNase | Qiagen | 19101 | |
| Propidium יודיד | Sigma-Aldrich | P4864 | |
| Confocal microcope | לייקה | SP2MP |
References
- Olson, M. F., Sahai, E. The actin cytoskeleton in cancer cell motility. Clin. Exp. Metastasis. 26, 273-287 (2008).
- Hoelzinger, D. B., Demuth, T., Berens, M. E. Autocrine factors that sustain glioma invasion and paracrine biology in the brain microenvironment. J. Natl. Cancer. Inst. 99, 1583-1593 (2007).
- Chaffer, C. L., Weinberg, R. A. A perspective on cancer cell metastasis. Science. 331, 1559-1564 (2011).
- Hanahan, D., Weinberg, R. A. The Hallmarks of Cancer. Cell. 100, 57-70 (2000).
- Francia, G., Cruz-Munoz, W., Man, S., Xu, P., Kerbel, R. S. Mouse models of advanced spontaneous metastasis for experimental therapeutics. Nat. Rev. Cancer. 11, 135-141 (2011).
- Hooper, S., Marshall, J. F., Sahai, E. Tumor cell migration in three dimensions. Methods. Enzymol. 406, 625-643 (2006).
- Croft, D. R., Olson, M. F. Regulating the conversion between rounded and elongated modes of cancer cell movement. Cancer Cell. 14, 349-351 (2008).
- Wolf, K. Multi-step pericellular proteolysis controls the transition from individual to collective cancer cell invasion. Nat. Cell. Biol. 9, 893-904 (2007).
- Hennigan, R. F., Hawker, K. L., Ozanne, B. W. Fos-transformation activates genes associated with invasion. Oncogene. 9, 3591-3600 (1994).
- Scott, R. W. LIM kinases are required for invasive path generation by tumor and tumor-associated stromal cells. J. Cell. Biol. 191, 169-185 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved