このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
から細胞外液のヴァンパイア·アイソレーション
要約
モデル生物 Cエレガンス受動循環系としてpseudocoelomic流体を使用しています。この流体の直接アッセイは、以前には不可能であった。ここでは、直接アッセイするために、細胞外空間を斬新な手法を提示し、原則として例の証拠としてRNAi応答時に全身のサイレン信号を使用する。
要約
遺伝的に扱いやすいモデル生物で虫はその短い世代時間で有効になって生物学的な質問でも、成長と小型のしやすさの無数の洞察を提供してきました。この小さなサイズは、しかし、他のモデルシステムに見られる技術的なアプローチの数を不許可しています。たとえば、哺乳動物系と植物の接ぎ木技術の輸血は、循環系の組成およびシグナリングの質問を有効にします。ワームの循環系、偽体腔は、最近まで直接アッセイすることは不可能であった。細胞間のシグナリングおよび循環器系の組成物Cの質問にお答えするには虫の研究者は、伝統的に遺伝的解析、細胞/組織特異救助、及びモザイク解析に目を向けました。これらの技術は、細胞間で何が起こっているのかを推測するための手段を提供しますが、細胞外分子の同定および特徴に普遍的に適用されません。ここでは、NEを提示直接アッセイするwly開発された技術でのpseudocoelomic流体エレガンス 。技術は細胞外液の量を増加させるためにいずれかの遺伝的または物理的操作から始まります。その後動物は細かいバランス圧力制御を可能にするマイクロインジェクションのリグを使用して吸血鬼の逆マイクロインジェクション法に供される。細胞外液の分離した後、収集された流体は、他の動物への伝達によってまたは分子によってアッセイすることができる。この手法の有効性を実証するために、我々は全身RNAi応答時のアッセイ細胞外シグナル伝達分子、長いdsRNAの具体例を詳細にアプローチを提示する。全身性RNAiの特性評価は、原則として例の証拠ですが、私たちは、循環系の組成およびシグナリングのさまざまな質問に答えるために適応可能であるとして、このテクニックを参照してください。
プロトコル
1。材料の調整
吸血鬼の逆マイクロインジェクションのために必要な材料は、トランスジェニックCを作るために使用される標準的なマイクロインジェクション技術に必要なものと同様であるエレガンス株1。いくつかの試薬 (例えば、アッセイプレート)が実験的移転の日を作っていますが、材料の多くは、協調的(時刻表については表1を参照)8日間で準備しなければなりません。このように、それは(必要な試薬や機器については表2を参照)は、この手法を使用する際は慎重に前もって計画することが重要です。
インジェクションパッド:
- 溶解するまでH 2 Oと暑さの中で2%アガロース溶液を作る。 4で1.5 mlのマイクロチューブ内や店舗内に1ミリリットルのアリコートでアリコート℃、
- それらの縁が少し速くそれらを拾って容易にするベンチトップエッジをオフに突出持つ作業台の上に22×50mmのカバーガラスをレイアウトします。
- POK通気を可能にするためのマイクロ遠心チューブの蓋にEA小さな穴(画鋲を使用します)。溶融する約5 mLの水、及びマイクロ波(約35秒)を15 mLのビーカーにチューブを置きます。
- パスツールピペットや電球場所カバーガラス上に溶けたアガロースの滴(約35μL)とすぐに最初から90°の角度で降下第二の上のカバーガラスを配置を使用しています。他のいくつかのカバーガラスについて、この手順を繰り返します。
- アガロースが固化した後、カバーガラスを取り外し、パッド(早く必要に応じて、スライドを15〜30分間50から80℃のオーブン内に配置することができます)完全に一晩空気乾燥することができます。
- パッドはその後無期限に室温でカバーガラスの箱に格納することができます。
アッセイプレート:
PAL-1 RNAiを関連付けられた胚の致死性を検定するため、アッセイプレートの調製は、吸血鬼の実験の日に行われる必要があります。目標は、HAにあるあなたのワームを飢えさせていないが最小限の細菌の芝生をVEの。過度に厚い芝生は小さく、半透明の変形のL1動物は簡単に食品中に失われる可能性があるとして非常に困難でPAL-1幼虫を記録できます。プレートの準備が目的の表現型を記録すると最適化されるべきである。
- LB寒天プレート上で増殖させ、単一のコロニーを持つOP50 LBブロスシード5mLs:OP50を準備します。振とうしながら37℃で一晩OP50をインキュベートし、4℃で保存
- (注1を参照)は、基本的なプロトコルに従って35ミリメートルのNGMプレートを準備します。
- それぞれのNGMプレートに一晩OP50の文化スポット、20μL(ステップ1.7)。 LB-OP50を乾燥させる(これは20分未満を取る必要があります)。
注射針:
- (代表的な針の形状は図1を参照)サター機器からP97燃える/ブラウンマイクロピペットプラーを使用して、ホウケイ酸ガラスキャピラリーから注射針を引き抜きます。
- ストア注入ペトリ皿と粘土から作らニードルホルダーの針(1を参照)。
2。ワームの調製
成人での推定pseudocoelomicボリューム虫ふたなりは40から80ピコリットル(私信COM。デビッドホール)です。このような小さなリザーバから細胞外液のサンプルを得るためにそれが可能な合計リソースを増やすことが有益である。我々はドナーワームで使用可能流体を大幅に向上させる3つの方法を特定している。私たちの主な方法は、細胞外液量の10倍以上に増加した( 図2)を引き起こす可能性がCLR-1(e1745)変異体の表現型を利用している。 2の代替方法は、ほぼ1ワームの総量の3分のpseudocoelomic流体と動物におけるGLP-1(RNAi)をまたはレーザ·アブレーションの結果、その除去のために生殖細胞が生殖系列アカウント空隙を充填するという事実( 図2)を利用する 2 </>(商標)。
CLR-1(e1745)を使用して、ドナーワームの準備
CLR-1(e1745)転写アッセイワークフローについては、 図3を参照してください。
- LB +カルベニシリン25μg/mLプレート上の単一のコロニーをdsRNAを発現する細菌からストリーク。我々は、このデモのためにPAL-1 dsRNAを産生菌を使用します。 37℃で一晩インキュベート℃、
- 縞LB +25μgの/ PAL-1(RNAi)は細菌のカルベニシリンプレートから、25μg/mLカルベニシリンを補充したLBで3mLの一晩培養物を接種するために、単一のコロニーを選択します。
- 25μg/ mLのカルベニシリンと1mMのIPTGを補充した35ミリメートルのNGMプレートに一晩培養した培養液の15μLのピペット。プレートの中心から外れプレート細菌をすることを確かめて下さい。 (約20分)乾燥させます。
- 500μLの新鮮な漂白剤(:NaHypochlorite 1時01分5M KOH)を作る。
- シードされた板の上に漂白剤溶液の10μLのピペット。トンを確認してくださいoは細菌のスポットから離れて漂白液滴を配置します。
- CLR-1(e1745)逆マイクロインジェクションのための動物の小さな、きれいで、同期化された人口を取得するには、漂白剤のドロップに2月10日妊娠した大人を選ぶ。大人がきれいな、部分的に発達段階の胚を残して解散。これらの胚はその後孵化し、幼虫は食べ物にクロールされます。
- 20℃で4日間インキュベート
- 25にプレートをシフト℃で4時間腫れ誘導する。
- 非シードのNGMプレートにワームをピックアップし、キューティクルから細菌をオフクリアする時間を考慮してください。 NGMプレートに転送しているときに(オプションのステップ)M9でワームをすすぐ。
- 非シードプレートのNGMプレートにL4/Youngアダルト(YA)の受取人のワームを動かし、キューティクルから細菌をオフクリアする時間を考慮してください。 NGMプレートに転送しているときに(オプションのステップ)M9でワームをすすぐ。
A2)は、GLP-1を用いてドナーワームの代替調剤(RNAi)を
- 縞板からLBの+ 25μg/ mLのカルベニシリンは、GLP-1(RNAi)は細菌の単一コロニーをカルベニシリンを補充したLB 3mLの一晩培養物を接種する。 37℃で一晩インキュベートする。
- 25μg/ mLのカルベニシリンと1mMのIPTGを補充した35 mmのNGMプレート上のGLP-1(RNAi)を一晩培養した培養液の15μLのピペット。室温で一晩インキュベートする。
- GLP-1(RNAi)をプレートに5 L3/L4動物を転送します。 20℃で2日間インキュベートRNAiは、生殖細胞の増殖欠陥の子孫におけるGLP-1の結果を対象としています。できないことは完全に細胞外液でいっぱいに空いている空間における生殖細胞の結果を開発しています。生殖細胞系の増殖せずに大人への進展が応じて必要になる場合があることに子孫を生成するためのRNAi食品の最適化。
- 上記CLR-1(e1745)ワーム調製プロトコルの手順2.1から2.3のように、PAL-L(RNAi)のプレートを用意しました。
- 新鮮な漂白ソリューションを作るる(1:1 5M KOH:NaHypochlorite)。
- シードPAL-1(RNAi)を皿の上に漂白剤溶液の10μLのピペット。斑点細菌病から離れて漂白液滴を配置してください。
- 漂白液滴に2月10日妊娠したGLP-1(RNAi)を成人をピックアップして胚を転送します。
- 20℃で4日間インキュベート
- 非シード60ミリメートルのNGMプレートにワームをピックアップし、キューティクルから細菌をオフクリアする時間を考慮してください。 NGMプレートに転送しているときに(オプションのステップ)M9でワームをすすぐ。
生殖細胞レーザーアブレーションを用いたドナー·ワームのB2)代替準備
- LB + 25μg/ mLのカルベニシリンプレート上の単一のコロニーをdsRNAを発現する細菌からストリーク。我々は、このデモのためにPAL-1 dsRNAを産生菌を使用します。 37℃で一晩インキュベート℃、
- カルベニシリンとプレートから25μg/ mLのカルベニシリンを補充したLBで3mLの一晩培養物を接種する。
- 番目のピペット15μLの25μg/ mLのカルベニシリンと1mMのIPTGを補充した35ミリのNGMプレート上にPAL-1-dsRNAを発現する細菌の電子一晩培養。一晩乾燥させます。
- 標準OP50プレートからのL1動物を隔離し、レーザーは標準プロトコル3を使用して体細胞生殖細胞前駆細胞Z1およびZ4を切除。
- 前述のPAL-1 RNAiのプレート上にレーザーアブレーションワームを回復します。
- 20℃で3日間インキュベート
- クリーンのNGMプレートにワームをピックアップし、キューティクルから細菌をオフクリアする時間を考慮してください。 NGMプレートに転送しているときに(オプションのステップ)M9でワームをすすぐ。
レシピエントワームの準備
- LBプレート上で単一のコロニーをOP50からストリーク。 37℃で一晩インキュベート℃、
- LBプレートからLBで3mLの一晩培養物を接種する。
- 35ミリのNGMプレートに一晩培養した培養液の15μLのピペット。プレートの中心から外れプレート細菌をすることを確かめて下さい。乾燥することができます(約20分)。
- 新鮮な漂白剤(:NaHypochlorite 1時01分5M KOH)を作る。
- シードされた板の上に漂白剤溶液の10μLのピペット。斑点細菌病から離れて漂白液滴を配置してください。
- 漂白液滴に2月10日妊娠のN2成人をピックアップして胚を転送します。
- 20℃で3日間インキュベート
- 少なくとも30分間20℃で、クリーンで非シードのNGMプレートとインキュベートするワームを移動します。
3。細胞外液のヴァンパイア·アイソレーション
次のプロトコルは、PLI-100ピコインジェクター、マイクロマニピュレーターで開催された静止した針、およびワームを針に滑り込ませることが可能なフローティングステージから成るマイクロインジェクションセットアップに固有のものです。しかし、一般的な手法は、十分な事前のエントリーへのミネラルオイルの流れの中で毛細血管防止するための圧力と携帯ミリアンペアを維持しながら、ドナー動物に空のマイクロインジェクションニードルを挿入することです体壁組織を貫通しながらterial。針はドナー動物圧力内にある間に、受信者のワームに針に移動させ、十分に圧力を増加させることによって追放することができ、細胞外液と針のキャピラリー充填を可能にするために削減されます。毛細管現象による流体の除去はまた、ピコインジェクターの機能を塗りつぶし、または吸引を使用することによって支援することができる。この一般化された手法は、バランス圧力の制御を可能にする他のマイクロインジェクションシステムに容易に適応する必要があります。
- 倒立顕微鏡、解剖顕微鏡、およびピコインジェクタ( 図1を参照)をオンにします。
- Pは明らかにピコインジェクターのセレクターノブを回し、電流測定がPSIにあることを確認します。この読み方、明確な圧力は、入力圧力であり、約0 psiである必要があります。
- 出力が閉じていることを確認するために、窒素タンクレギュレーターで一次チェックバルブ(ターンcounterclノブが緩んでいるまで)ockwise。
- メイン窒素タンクのバルブを開きます。 N2タンク最寄りのレギュレータゲージは現在タンクの内圧をお読みください。
- ゆっくり回りプライマリレギュレータバルブを回して外に圧力を高める。ピコインジェクター(これはレギュレータのゲージで読んで出力圧力より正確である)上の圧力の増加を監視します。ゆっくり100 psiに圧力を高める。 105 psiを超えないようにしてください。
- 100 PSIはPinjectノブを使って、30 psiに射出圧力を注入し、設定されたPにセレクタを切り替えるに達したとき。
- Pのバランスにセレクタノブを切り替えます。
- あなたのきれいなドナーとレシピエントのプレート上にミネラルオイル15μLの液滴を置きます。
- 鉱油中のあなたの2%アガロース注入パッドをカバーしています。
- ホルダーで引っ張らマイクロピペット針をロードして合わせます。
- 解剖顕微鏡を使って、1ドナーおよびアガロースウェブ上で互いに近い1受取人ワームをマウント広告。
- 位置ワームは、低倍率を使用しており、ドナーの近くに鉱物油に針を持って来る。
- pseudocoelomic空洞近傍の高権力と地位の針に移動します。
- 約10 psiにバランス圧力を増加させる。針の先端にミネラルオイルプラグを注意してください。
- ステージを移動することによってpseudocoelomicキャビティ内の針の先端を配置するために針にワームを押してください。
- 針の先端の鉱物油の位置にジャンプしてください。
- 毛細管現象は、針を埋めるようにするバランス圧力を減らすことができます。 (一つは、またプロセスの速度を上げるために、フィル機能を使用することができます)。
- ワームはニードルからの流体のスライドを収集した後。
- 受信者のワーム(針の先端は、鉱物油を残しすることはできません)により、低消費電力の倍率と位置に針を切り替えます。 [代わりに、針ホルダーは削除され、流体がマイクロチューブに液滴に転送することができます。]
- に切り替え高倍率及び顕微鏡ステージをスライドさせて、受信者のワームに針を移動させます。
- 一度受信者ワームに配置すると、ドナーから採取pseudocoelomic流体を注入する注射(35 psiで設定された)関数を使用します。
- 受信者を入力するのに使用されるのとは反対の方向に顕微鏡ステージをスライドさせて、受信者のワームから針を外します。
- ワームの外に針を使用すると、離れて注射パッドから針を上げてください。
- インジェクションパッドを取り外して、回復するワームでM9の液滴を配置します。
- アッセイプレート上のM9の10μLの液滴を置きます。
- アッセイプレートにM9に受取人ワームを選んでください。
4。 RNAiの表現型の転送を測定する
- 回収されたワームは、20℃で24時間増殖させる
- 板の上に胚および孵化子孫を残して、受取人の成人を削除します。 20℃でさらに24時間プレートをインキュベート
- スコア子孫として、斜線ハッチングが、表現型的変異体であること、または野生型幼虫ないというた。
注釈
- NGMメディアは、寒天の18グラム、バクトの2.5グラム、塩化ナトリウム3gとH 2 Oを追加することにより、1リットルバッチで行われるバー、オートクレーブをかき混ぜる追加します。撹拌プレート上にフラスコを入れ、攪拌しながらメディアは60℃まで冷ました後、オートクレーブ。メディアが冷却された後、コレステロールの1ミリリットル(エタノール中の5 mg / ml)を、1M CaCl 2を 、1M MgSO 4を 1mLの、リン酸カリウム緩衝液(pH6.0)を25mLの1 mLを加える。プレートはRNAiに使用する場合はNGMを60℃に冷却した後、1M IPTGの1 mLおよび25 mg / mLのカルベニシリン1mLで補足されているプレートは35ミリメートル(NGMの3.5 mL)または60ミリメートル(NGMの8.5 mL)をペトリプレートのどちらに注がれています。
- 2%アガロースは水で行われた。冷蔵庫で保管してください。 pseudocoelomic流体分離の日の前に溶けて、よくパッドを作る。パッドの乾燥には、ワームがパッドに付着作るパッドは十分に乾燥しているため、風乾の1日の最小値が必要です。注射パッドは乾燥しすぎていると、ドナー·ワームは、あなたが鉱物油を追加する前に、パッドの上に呼吸することによって、射出パッドにさらに水分を追加することができ、それらを操作することができるよりも速く乾燥されています。場合かかわらず、ワーム乾く前pseudocoelomic流体を分離するために、迅速に作業する能力が絶対に必要です。
- 我々は、アンピシリン耐性マーカーを選択するために私達のRNAiの食事の準備のすべてのステップでカルベニシリンを使用しています。カルベニシリン、アンピシリンより少ないサテライトコロニーで、より安定した結果であるアンピシリンアナログである。
- 我々は、NGM 1mMのIPTGおよび25μg/ mLのカルベニシリンで補われたRNAiプレートを使用しています。 RNAiの給餌ベクターは、E. HT115にあるdsRNAを特異的ヌクレアーゼを欠損している大腸菌株。
- (オプションのステップ)我々は与えられた時間非シードのNGMプレート上にドナーとレシピエントワームがキューティクルを失う十分な仕事をすることを見つける送り板から引き継がれ縛ら細菌。例のドナー動物におけるRNAi標的は、モビリティと干渉する場所が、これは真実ではない(例:UNC-22(RNAi)を )。したがって、プロセスを支援することが必要となる。そうするために、我々は、M9の約50μLのうつ病のスライドを使用しています。 RNAiの給餌プレートからM9にワームをピッキングし、標準白金ワームピックで攪拌すると、ほとんどの付着細菌を除去するのに十分である。
5。代表的な結果
提示は、CLR-1(e1745)PAL-1を標的dsRNAを発現する細菌上に成長させたワームから細胞外液のための実験的な転送のための代表的な結果である。ドナー動物の子孫が死亡し、及び/又は後方パターニング不良を示した。次に、細胞外液を譲渡これらの動物からのRNAiナイーブ野生型ワームの偽体腔へ。レシピエント動物のその後の子孫の一部は、次に予想されるPAL-1変異体の表現型( 図4)が表示されます。これは、標準的な細菌性食中毒または致死性の唯一のバックグラウンドレベル( 図4)表示されたコントロールRNAiベクターの細菌のいずれかに成長したドナー動物から細胞外液を受けたレシピエント動物の子孫とは対照的である。 RNAiを受けたドナー動物から細胞外液の受取人の子孫がdsRNA誘導される表現型の頻度の有意な増加を示しているが、浸透度は、子孫のほぼ100%が孵化胚として死ぬドナー動物の子孫ほど強力ではなく、唯一珍しい、著しく変形している動物が孵化。
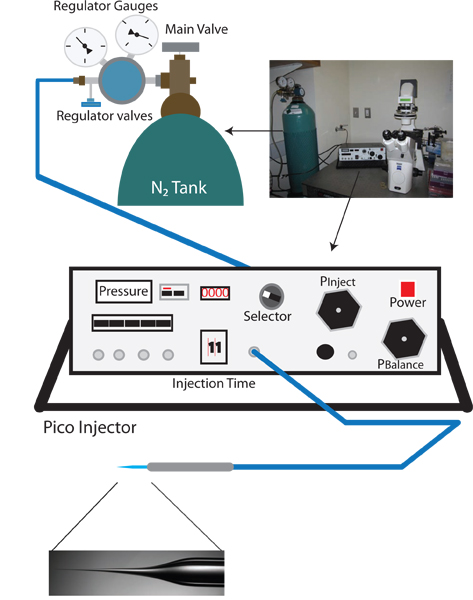
図1:吸血の逆噴射のセットアップ。適切なセットアップFORA吸血鬼逆マイクロインジェクションのセットアップでは、標準のCに似ていますelegansのマイクロインジェクションリグ、そして解剖顕微鏡、10Xと40X目標と倒立顕微鏡、位置決めのための可動ステージ、そして注射針ホルダー付きマニピュレーターを備えている。また、注射針の準備のための針プラーも必要です。バランス圧力(例えばワーナーインスツルメンツPLI-100)の微調整が必要なことができます逆にマイクロインジェクションプロトコルピコインジェクタに固有。
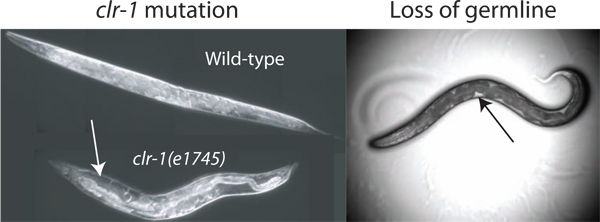
図2 pseudocoelomicボリュームの充実。分離のための利用可能なpseudocoelomic流体の体積は、野生型動物においてアッセイのためには不十分である。ボリュームがpseudocoelomic流体の明らかな蓄積(白い矢印)で、その結果、CLR-1(e1745)動物の温度シフトを通じて浸透圧バランスの調節を破壊することによって増加させることができる。さらに、レーザーアブレーションまたはGLP-1(RNAi)によって生殖腺の損失は(レーザーアブレーションによる損失が示されている)細胞外液へのアクセスを可能にする。使用可能な合計体積が制限温度で成長CLR-1(e1745)の動物で見られるものよりはるかに少ないですが、利用可能な流体は、最も容易に、暗い腸と体壁(黒い矢印)との間に明確なパッチとして観察される。
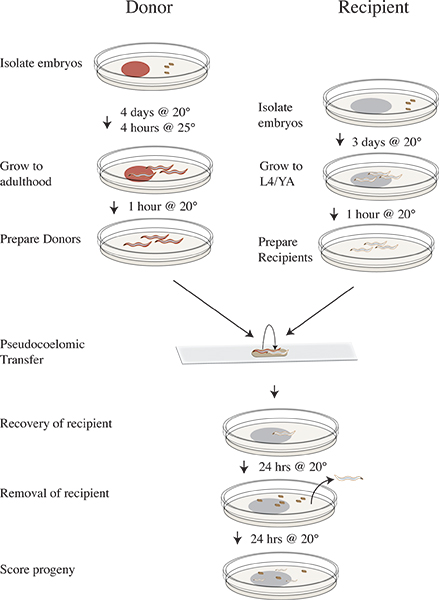
図3吸血の分離と転送プロトコルのタイムライン。 4日間は前の実験は20℃でのRNAi食品とインキュベートしたプレート上でCLR-1(e1745)ドナー胚を分離移転する三日前までOP50にN2のレシピエント胚を分離します。実験当日℃で4時間25にドナープレートをシフトします。に食糧とシフトを欠くクリーンプレート℃のインキュベーション20℃で25日以降のドナーを削除板をきれいにするレシピエント動物を移動20℃でインキュベートした食品や継続を欠く転写実験を行い、20℃でインキュベートしOP50プレート上の受信者のワームを回復20℃で24時間後にレシピエント動物を削除20℃で24時間受取人の子孫をインキュベート野生型、変異体、または孵化としてスコア子孫。
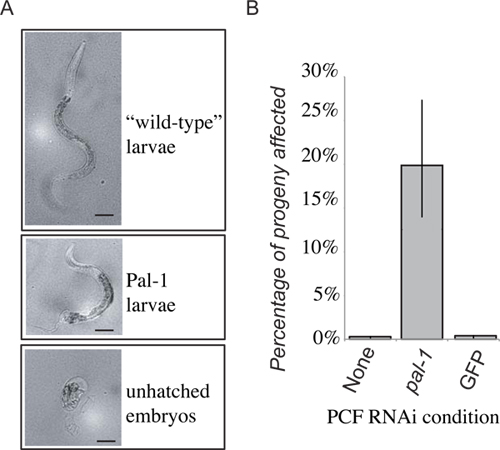
図4代表的な結果。受信者のPAL-1関数の損失は胚致死、または後方開発の独特の損失()になります。最初の24時間以内に築いたPCF転送子孫から48時間後のいずれかの野生型幼虫、PAL-1幼虫、または孵化胚としてスコアリングされます。孵化胚および表現型的にPAL-1幼虫の周波数がPAL-1(RNAi)を転送誘発表現型の指標を与えるために結合されます。 PAL-1のdsRNA食品上に成長させた動物からpseudocoelomic流体の領収書は、関連の強い誘導を生成コントロール転送受信者(B)の目に見えない表現型。
ディスカッション
我々はここで、モデル生物Cから細胞外液の単離および特徴付けを可能にする新規な方法を提示しているエレガンス 。技術は細胞外液の合計量を高めるためにドナーワームの遺伝的または物理的操作から始まります。細胞外液は、その後、変更されたマイクロインジェクション法を用いて単離される。ワームは、手順の間に依然としてワームを保持するために、乾燥したアガロ?...
開示事項
特別な利害関係は宣言されません。
謝辞
我々はハンターラボの共同性質を承諾したがって、この技術の開発が可能とからかわ役立つ議論と支援のためにそれらに感謝します。我々はナイジェルデラニーやワーム、および細菌株に対する線虫Caenorhabditis遺伝学センターに感謝したいと思います。この作品は、米国国立衛生研究所CPHにGM089795助成金によって支えられている。
資料
日ウォームプレップ素材の準備ストリーク移動した胚
| Name | Company | Catalog Number | Comments |
| -7または前 | きれいに維持し、うまく供給 CLR-1(e1745)とN2ワーム | インジェクションパッド、NGMプレート、NGM +炭水化物/ IPTGプレート、OP50のLB在庫を確認 | |
| -6 | |||
| -5 | RNAiの食物と一緒に一晩3 mLを接種 | ||
| -4 | シードRNAiのプレート | ||
| -3 | |||
| -2 | |||
| -1 | |||
| 0 | 4時間25にワームをシフト | アッセイプレートを作る | |
| NGMプレートをきれいにするワームを移動 | |||
| 吸血転送 | |||
| 受信者を回復 | |||
| 1 | 転送先の相手を削除 | ||
| 2 | スコア子孫 |
表1。素材の準備タイム。
設備会社概要カタログ番号 CLR-1(e1745)Ⅱ 9 GLP-1 RNAiベクター 10ソース(Ahringer給食ライブラリ) PAL-1 RNAiベクター 11| ピコリットル圧力インジェクタ | ワーナー·インスツルメンツ | 65から0001(PLI-100) |
| 火焔/ブラウンマイクロピペットプラー | サターインスツルメンツ | P97 |
| AXIOVERT 200 | ツァイス | |
| 試薬 | ||
| ミネラルオイル | [EMサイエンス | MX1560-1 |
| 22x50のない1つの½カバーガラス | コーニング | |
| SeaKem LEアガロース | ロンザ | 50004 |
| ホウケイ酸ガラス管 | ワールド精度インスツルメンツ | 1B100F-4 |
| 次亜塩素酸ナトリウム溶液(5%有効塩素) | JTベーカー | 9416から01 |
| Cエレガンスと菌株 | ||
| 線虫遺伝学センター(CGC) | CB3241 | |
| F02A9.6 | ||
| pHC187 | ||
| OP50-GFP 5 | 線虫遺伝学センター(CGC) | OP50-GFP |
| YFP E大腸菌の 4 | MC4100-YFP | |
表2。特定の試薬および装置。
参考文献
- Berkowitz, L. A., Knight, A. L., Caldwell, G. A., Caldwell, K. A. Generation of Stable Transgenic C. elegans Using Microinjection. J. Vis. Exp. (18), e833-e833 (2008).
- Hirose, T., Nakano, Y., Nagamatsu, Y., Misumi, T., Ohta, H., Ohshima, Y. Cyclic GMP-dependent protein kinase EGL-4 controls body size and lifespan in C elegans. Development. 130, 1089-1099 (2003).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Dev. Biol. 87, 286-300 (1981).
- Hegreness, M., Shoresh, N., Hartl, D., Kishony, R. An equivalence principle for the incorporation of favorable mutations in asexual populations. Science. 311, 1615-1617 (2006).
- Labrousse, A., Chauvet, S., Couillault, C., Kurz, C. L., Ewbank, J. J. Caenorhabditis elegans is a model host for Salmonella typhimurium. Curr. Biol. 10, 1543-1545 (2000).
- Kamath, R. S., Martinez-Campos, M., Zipperlen, P., Fraser, A. G., Ahringer, J. Effectiveness of specific RNA-mediated interference through ingested double-stranded RNA in Caenorhabditis elegans. Genome. Biol. 2, (2001).
- Min, K., Kang, J., Lee, J. A modified feeding RNAi method for simultaneous knock-down of more than one gene in Caenorhabditis elegans. Biotechniques. 48, 229-232 (2010).
- Zhuang, J. J., Hunter, C. P. Tissue-specificity of Caenorhabditis elegans Enhanced RNAi Mutants. Genetics. 188 (1), 235-237 (2011).
- Way, J. C., Chalfie, M. mec-3, a homeobox-containing gene that specifies differentiation of the touch receptor neurons in C. elegans. Cell. 54, 5-16 (1988).
- Kamath, R. S., Fraser, A. G., Dong, Y., Poulin, G., Durbin, R., Gotta, M., Kanapin, A., Bot, N. L. e., Moreno, S., Sohrmann, M. Systematic functional analysis of the Caenorhabditis elegans genome using RNAi. Nature. 421, 231-237 (2003).
- Winston, W. M., Molodowitch, C., Hunter, C. P. Systemic RNAi in C. elegans requires the putative transmembrane protein SID-1. Science. 295, 2456-2459 (2002).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved