Method Article
Die Überwachung der reduktiven und oxidativen Halbreaktionen eines Flavin-abhängige Monooxygenase mit Stopped-Flow Spektrophotometrie
In diesem Artikel
Zusammenfassung
Wir beschreiben die Verwendung eines Stopped-Flow-Gerät sowohl die reduktive und oxidative Reaktionen von Halb-Untersuchung Aspergillus fumigatus Ein Siderophor (SIDA), eine Flavin-abhängige Monooxygenase. Wir stellen dann die Spektren entsprechend der Spezies in der Reaktion von Sida, und wir berechnen die Geschwindigkeitskonstanten für ihre Bildung.
Zusammenfassung
Aspergillus fumigatus Siderophor A (SIDA) ist ein FAD-haltige Monooxygenase, die die Hydroxylierung von Ornithin katalysiert in der Biosynthese von Hydroxamat Siderophore, die für Virulenz (zB ferricrocin oder N ', N ", N'''-triacetylfusarinine C) 1 sind. Die Reaktion von Sida katalysiert werden in reduktive und oxidative Halbreaktionen (Schema 1) unterteilt werden. Bei der reduktiven halbreaktion die oxidierte FAD gebunden an A f Sida, durch NADPH 2,3 reduziert wird. Bei der oxidativen halbreaktion die reduzierten Cofaktor reagiert mit molekularem Sauerstoff zu einem C4a-hydroperoxyflavin Zwischenschicht, die ein Sauerstoffatom überträgt Ornithin bilden. Hier haben wir ein Verfahren, um die zu messen und erkennen die verschiedenen spektralen Formen von Sida Verwendung eines Stopped-Flow-Gerät installiert beschreiben eine anaerobe Handschuhfach. In Stopped-Flow-Instrument, sind kleine Mengen der Reaktanten rasch gemischt, und nach der Strömung durch th gestoppte Anschlag Spritze (1), werden die spektralen Veränderungen der Lösung in der Zelle angeordnet Beobachtung über die Zeit aufgezeichnet. Im ersten Teil des Experiments zeigen wir, wie wir die Stopped-Flow-Instrument im Single-Modus, wo die anaerobe Reduktion des Flavin in a-f Sida durch NADPH direkt gemessen wird, zu verwenden. Wir verwenden dann doppelt Mischen Einstellungen in der A f Sida erste anaerob durch NADPH wird für eine bestimmte Zeit in einer alternden Schleife reduziert, und dann mit molekularem Sauerstoff in der Zelle Beobachtung (Abbildung 1). Um dieses Experiment durchzuführen, sind anaerobe Puffer erforderlich, weil, wenn nur die reduktive halbreaktion überwacht wird, kein Sauerstoff in den Lösungen mit der reduzierten Flavin reagieren und bilden eine C4a-hydroperoxyflavin Zwischenschicht, die letztlich zerfallen wieder in den oxidierten Flavin . Dies würde nicht zulassen, dass der Benutzer genau zu messen Ermäßigungssätze da komplette Umsatz der Enz wäreYme. Wenn die oxidative halbreaktion geprüft wird das Enzym muss in Abwesenheit von Sauerstoff, so dass nur die Schritte von Reduktion und Oxidation beobachtet reduziert werden. Einer der Puffer in diesem Experiment verwendet Sauerstoff gesättigt ist, so dass wir die oxidative halbreaktion bei höheren Konzentrationen von Sauerstoff zu studieren. Diese sind oft die durchgeführten Verfahren bei der Untersuchung entweder die reduktive oder oxidative Halbreaktionen mit Flavin-Monooxygenasen. Die Zeitskala der Pre-Steady-State-Experimente mit der Stopped-Flow durchgeführt ist Millisekunden bis Sekunden, die die Bestimmung der intrinsischen Geschwindigkeitskonstanten und die Detektion und Identifizierung von Zwischenstufen der Reaktion 4 zu ermöglichen. Die hier beschriebenen Verfahren kann auf andere Flavin-abhängigen Monooxygenasen angewendet werden. 5,6
Protokoll
1. Vorbereitung der anaeroben Buffer
- Planen 1 l 100 mM Kaliumphosphatpuffer, pH 7,5. Gießen 250 ml des Puffers in einen 500 ml Büchner-Kolben mit einem Rührstab.
- Der Kolben wird mit einem Gummistopfen und legen Sie es auf einer Rührplatte. Den kurzen Schlauch von der Flasche in ein Schlenk-Linie.
- Degas der Puffer unter Vakuum für 5 Stunden bei Raumtemperatur unter Rühren. Während dieser Zeit, führen 5 aufeinander folgenden Runden von Vakuumentgasung und Spülen mit Argon jede Stunde.
- Spülen Sie den Kolben mit Argon für 10 Sekunden und trennen Sie ihn von der Vakuumkammer. Der Kolben wird im Handschuhfach.
- Lassen Sie die Flasche offen im Handschuhfach über Nacht unter kräftigem Rühren.
2. Entfernung von Sauerstoff aus der Stopped-Flow-System
- Planen 1 l 0,1 M Natriumacetat, pH 5,0. Gießen Sie 125 ml dieses Puffers in einen 250-ml-Büchner-Kolben und führen Sie die Schritte von 1,2 bis 1,4.
- Abwiegen 5mg Glucoseoxidase aus Aspergillus niger (181.300 U / g) und 0,9 g Glukose mit einem 1,5-ml-Eppendorf-Röhrchen und 50 ml Falcon konischen Rohr, jeweils. Legen Sie beide Behälter in das Handschuhfach.
- Man löst Glucoseoxidase und Glucose in 50 ml anaeroben 0,1 M Natriumacetat, pH 5,0 (Endkonzentrationen von 18,13 U / ml und 100 mM). Füllen Sie den Behälter Spritzen mit dieser Lösung (Abbildung 1).
- Damit der Antrieb Ventile in der "Load"-Position stehen und füllt das Laufwerk Spritzen (Abbildung 1). Drehen Sie das Ventil auf die F "Drive"-Position. Leeren Sie den Stop-Spritze, indem Sie auf Leere in der Pro-Data Control Software. Schieben Sie den Puffer von Laufwerk F Spritze durch die Strömung Schaltung manuell durch Anheben des entsprechenden Laufwerks-RAM. Wiederholen Sie diesen Schritt zehnmal insgesamt. Gehen Sie ebenso mit den anderen drei Spritzen-Laufwerk. Eine Stunde warten.
- Ersetzen der Lösung des Reservoirs Spritzen mit dem gleichen Puffer ContaiNing Glucoseoxidase und Glucose. Wiederholen Sie den Schritt 2.4.
- Wiederholen Sie Schritt 2,5 und lassen Sie die Lösung in der Flow-System über Nacht stehen.
- Nach Inkubation über Nacht Schrittwiederholung 2.5.
3. Vorbereitung von Sauerstoff gesättigt Buffer
- Es werden 100 mM Kaliumphosphatpuffer (pH 7,5) und gießen Sie 50 ml in einem 50-ml-Fläschchen mit einem Rührstab. Verschließe das Röhrchen mit einem Stopfen und einem Wheaton Wheaton Aluminium-Dichtung.
- Stellen Sie die Durchstechflasche auf dem Eis. Tauchen mit einer langen Nadel verbunden ist, um einen Behälter mit 100% Sauerstoff in die Lösung. Legen Sie eine andere kurze Nadel durch den Stopfen der Durchstechflasche als Belüftung.
- Dicke die Lösung mit 100% Sauerstoff für 1 Stunde unter Rühren.
- Entfernen Sie zuerst die kurze Nadel aus der Flasche und 10 Sekunden warten, bevor Sie die lange Nadel. Legen Sie die geschlossene Flasche im Handschuhfach.
4. Herstellung von NADPH Lösung
- Abwiegen 1 mg NADPH in einem 1,5 ml Eppendorf-Röhrchen und setzen it in das Handschuhfach.
- Lösen Sie die NADPH in 300 ul anaerobe 100 mM Kaliumphosphatpuffer, pH 7,5. Entfernen Sie 30 ul dieser Lösung aus dem Handschuhfach, um die NADPH-Konzentration mit einem Spektralphotometer (340 nm ε = 6270 M -1 cm -1) zu bestimmen.
5. Entfernung von Sauerstoff aus der Enzymlösung
- Nehmen Sie 400 ul Enzym-Stammlösung aus dem Gefrierschrank und tauen im Handschuhfach. Das Enzym Stammlösung (360 pM) wurde zuvor in 100 mM Kaliumphosphatpuffer (pH 7,5), enthaltend 100 mM NaCl, und in flüssigem Stickstoff eingefroren.
- Übertragen Sie die Enzymlösung in einem 25-ml-Fläschchen mit einem Rührstab, verschließe das Röhrchen mit einem Stopfen und einem Wheaton Wheaton Aluminium-Siegel und aus dem Handschuhfach.
- Dazu Küvette auf Eis und verbinden Sie es mit einem Schlenk-Linie durch Einführen einer Nadel durch den Stopfen der Durchstechflasche.
- Degas die Enzymlösung durch Ausführen 5 aufeinander folgenden Runden vonVakuumentgasung und mit Argon gespült alle 20 Minuten für 1 Stunde.
- Spülen Sie das Fläschchen mit Argon für 10 Sekunden und trennen Sie ihn von der Vakuumkammer. Dazu Küvette auf Eis im Handschuhfach.
6. Reduktive Half-Reaktion: Überwachung Flavin Reduction
- Bereiten Sie die Stopped-Flow-Instrument und die Pro-Data Control Software für Einzel-Mischen-Modus nach dem Protokoll des Herstellers.
- Schalten einem zirkulierenden Wasserbad (15 ° C). Entfernen von Sauerstoff aus dem Wasser durch Einleiten von Stickstoff durch sie für 20 Minuten. Dies verhindert die Kontamination durch die Sauerstoff-Flow-Schaltung.
- Daß die Temperatur der Antrieb Spritzen und die Beobachtung Zelle bei 15 ° C durch Verbinden des Wasserbad Gehäuse des Stopped-Flow der zirkulierenden Bad.
- In der Systemsteuerung des Pro-Data-Software wählen Photodiodenarray Externer Trigger (für Stopped-Flow-Betrieb zu aktivieren), und LogaritHMIC Skala.
- Starten Sie das Pro-Data-Viewer-Software und das Verzeichnis an, wo die Daten gespeichert werden sollen.
- Ersetzen der Lösung des Reservoirs Spritzen C und F mit anaeroben 100 mM Kaliumphosphatpuffer (pH 7,5). Drehen Sie den C-und F-Ventile an den "Drive"-Position. Leeren Sie den Stop-Spritze, indem Sie in der Pro-Data Control Software Leere. Schieben Sie das Laufwerk Puffer von beiden Spritzen durch die Strömung Schaltung manuell durch Anheben des entsprechenden Antriebs-ram insgesamt fünfmal (klicken Sie vor jeder Bewegung des Stempels Leer).
- Um sicherzustellen, dass Glucose-Oxidase wurde vollständig aus dem Strömungskreislauf entfernt, führen Sie Schritt 6,6 insgesamt viermal.
- Klicken Sie auf Baseline in der Pro-Data Control Software.
- Mischen Sie 100 ul Enzym-Stammlösung mit 1100 uL anaerobe 100 mM Kaliumphosphatpuffer (Endkonzentration nach dem Vermischen in der Stopped-Flow von 15 uM).
- Ersetzen Sie die Lösung von Reservoir syringe F mit der Enzymlösung. Drehen Sie das Ventil auf die F "Drive"-Position. Leeren Sie den Stop-Spritze, indem Sie in der Pro-Data Control Software Leere. Schieben Sie das Laufwerk aus Enzymlösung F Spritze durch die Strömung Schaltung manuell durch Anheben des entsprechenden Antriebs-RAM. Führen Sie diesen insgesamt dreimal. In der Pro-Data-Software, stellen Sie die Aufnahmezeit bis 60 s.
- Sicherstellen, dass beide Laufwerk Spritzen mit den jeweiligen Lösungen und dem Antrieb Stößel gefüllt sind in Kontakt mit den Antriebs Spritzenkolben. Drehen Sie beide Ventile an den "Drive"-Position und klicken Sie in der Pro-Data Control Software erwerben, um das Laufwerk durchzuführen. Wiederholen Sie diesen Schritt noch zweimal, um die Daten in dreifacher Ausfertigung zu erhalten. Dies ergibt Spektren der oxidierten Form des Enzyms.
- Mit dem A 452 nm-Wert aus den Laufwerken erhalten, ermitteln Sie die Enzymkonzentration vor dem Mischen (452 nm ε = 13.700 M -1 cm -1) und bereiten Sie 4 mL einer NADPH solution 1,5-fach konzentrierter.
- Ersetzen Sie die Lösung von C Reservoir Spritze mit der NADPH-Lösung und leer und befüllen Sie die Stop-Spritze dreimal in 6,10 beschrieben.
- Wiederholen Sie Schritt 6.11. Dies ergibt Spektren während der Reduktion des Enzyms.
7. Oxidativer Half-Reaktion: Überwachung Flavin Oxidation
- Bereiten Sie die Stopped-Flow-Instrument und die Pro-Data Control Software für Doppel-Misch-Modus nach dem Protokoll des Herstellers.
- Wiederholen Sie die Schritte von 6,2 bis 6,5.
- Ersetzen der Lösung in den vier Reservoirs Spritzen mit anaeroben 100 mM Kaliumphosphatpuffer (pH 7,5). Drehen Sie das Ventil auf die F "Drive"-Position. Leeren Sie den Stop-Spritze, indem Sie auf Leere in der Pro-Data Control Software. Drücken Sie den Puffer aus der Spritze Laufwerk F durch den Strömungskreislauf durch manuelles Anheben des entsprechenden Antriebs Stößel. Führen Sie diesen Schritt insgesamt fünfmal mit jedem Laufwerk Spritze.
- Führen Sie Schritt 7,3 viermal in total vollständig zu entfernen, den Inhalt von dem Strömungskreislauf.
- Klicken Sie auf Baseline in der Pro-Data Control Software.
- Mischen Sie 200 ul Enzym-Stammlösung mit 1000 ul anaerobe 100 mM Kaliumphosphatpuffer (Endkonzentration nach dem Vermischen in der Stopped-Flow von 15 uM).
- Ersetzen Sie die Lösung von Reservoir Spritze A mit dem Enzym-Lösung. Drehen Sie den ein Ventil, um den "Drive"-Position. Leeren Sie den Stop-Spritze, indem Sie in der Pro-Data Control Software Leere. Schieben Sie das Laufwerk aus Enzymlösung Spritze A durch die Strömung Schaltung manuell durch Anheben des entsprechenden Antriebs-RAM. Führen Sie diesen Schritt insgesamt dreimal. In der Pro-Data Control Software, die Verzögerungszeit bis 0,5 s und Aufnahmezeit bis 60 s.
- Sicherstellen, dass alle Laufwerk Spritzen mit den jeweiligen Lösungen und dem Antrieb Stößel gefüllt sind in Kontakt mit den Antriebs Spritzenkolben. Schalten Sie alle Ventile an den "Drive"-Position und klicken Sie in der Pro-Dat Acquireein Steuerungs-Software, um das Laufwerk durchzuführen. Wiederholen Sie diesen Schritt noch zweimal, um die Daten in dreifacher Ausfertigung zu erhalten. Dies ergibt Spektren der oxidierten Form des Enzyms.
- Ersetzen Sie die Lösung von B Reservoir Spritze mit einer NADPH-Lösung 1,5-fach konzentrierter als der Enzymlösung in Spritze A. Den B Ventil mit dem "Drive"-Position und leer und befüllen Sie die Stop-Spritze dreimal wie in 7.7 beschrieben.
- Ersetzen Sie die Lösung von Reservoir Spritze C mit Sauerstoff angereicherte Puffer. Drehen Sie das Ventil mit dem C "Laufwerk"-Position und leer und befüllen Sie die Stop-Spritze dreimal wie in 7.7 beschrieben. In der Pro-Data Control Software, die Verzögerung und Aufnahmezeit bei 15 und 900 s, beziehungsweise.
- Wiederholen Sie den Schritt 7.8. Dies ergibt Spektren während der Reoxidation des vollständig reduzierten Enzyms.
8. Datenanalyse
- Starten Sie das Pro-Data-Konverter-Software. Klicken Sie auf das Symbol Optionen und wählen Sie Speichern in ProDataCSV.
- Geöffnetdas Verzeichnis, in dem die Dateien gespeichert wurden. Ziehen Sie die Dateien in das APL-Pro-Data Converter-Fenster. Die Daten werden automatisch als CSV-Format-Dateien im gleichen Verzeichnis gespeichert werden.
- Öffnen Sie die CSV-Format-Dateien mit Microsoft Excel (Microsoft, Redmond, WA, USA). Normalisieren der Grundlinie der Stopped-Flow-Spuren durch Subtraktion der entsprechenden Absorption bei 700 nm liegt.
- Analysieren Sie die korrigierten Spuren mit KaleidaGraph (Synergy Software, Reading, PA) durch Einsetzen der Handlung der Absorption bei der entsprechenden maximalen Abhängigkeit von der Zeit an die entsprechende Exponentialfunktion. Wie in 2B, die Absorption bei 452 nm wurde als eine Funktion der Zeit aufgetragen, um die Geschwindigkeit der Reduktion Flavin nach dem Mischen des Enzyms und NADPH in Stopped-Flow-Instrument zu bestimmen gezeigt. In diesem Fall wurde die beste Anpassung an die Daten unter Verwendung eines doppelt exponentiellen Gleichung und Bewertung von 0,65 und 0,23 s -1 für die erste und zweite Phase der Reduktion, berechnet RESgleichauf. Um die Geschwindigkeit der Bildung des C4a-hydroperoxyflavin Zwischen-und der Reoxidation nach der Umsetzung der reduzierten Enzyms mit Sauerstoff zu bestimmen, analysierten wir die Stopped-Flow-Spuren bei 380 und 452 nm (Abbildung 3B). Mit einem einzigen exponentiellen Gleichung berechneten wir von 1,4 und 0,006 s -1 für die erste und zweite Schritt der oxidativen halben Reaktion.
9. Repräsentative Ergebnisse
Die Ergebnisse der Experimente in den vorherigen Abschnitten beschrieben, wie für die reduktive halbreaktion von A f Sida durch Messen der Änderungen in der Extinktion bei 452 nm, der den Änderungen in der Redox-Zustand des Flavin entsprechen kann überwacht werden. Die Geschwindigkeit dieser Schritt kann durch Anpassen der Daten an die entsprechende Gleichung (; Schritt 8.4 Abbildung 2) bestimmt werden. Die Reduktionsrate erhalten (0,65 s -1) ist ähnlich der k cat-Wert berechnet mitSteady-State-Experimente 2, was darauf hindeutet, dass die Verringerung der geschwindigkeitsbestimmende Schritt der Reaktion ist. Cytos Biotechnology nutzt die Doppel-Misch-Modus der Stopped-Flow, kann die Geschwindigkeit der Oxidation und der Zwischenprodukte in diesem halben Reaktion bestimmt (Abbildung 3; Schritt 8.4) werden. Bei der Umsetzung von A f Sida katalysiert wird die C4a-hydroperoxyflavin eindeutig erkannt (λ max von 380 nm), und die Rate der Bildung und Zerfall berechnet werden kann. Das langsame Tempo der Reoxidation erhalten (0,006 s -1) zeigt, dass die C4a-hydroperoxyflavin sehr stabil ist, in Abwesenheit der Ornithin.

Schema 1. Mechanismus einer f Sida. Die isoallozaxine Ring des FAD-Cofaktor wird angezeigt. Das oxidierte Flavin (A) bindet an NADPH (B) und reagiert auf Flavin und NADP + (C) zu bilden. Nach der Reaktion mit molekularem Sauerstoff und die Bindung vonOrnithin, wird die C4a-hydroperoxyflavin (D) gebildet. Dies ist die Hydroxylierung Arten. Nach Hydroxylierung von Ornithin, muss der hydroxyflavin (E) entwässert werden, um die oxidierte Enzym zu bilden. NADP + gebunden bleibt während des katalytischen Zyklus und ist das letzte Produkt zu entlassen (F) werden.
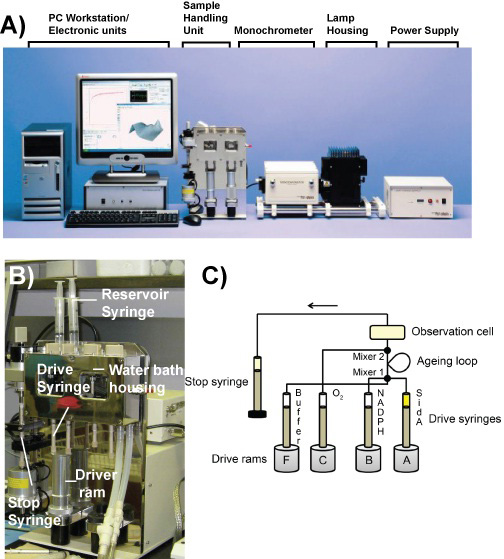
Abbildung 1. Die Stopped-Flow-Gerät. A) Bild von den Komponenten der Angewandte Photophysik SX20 Stopped-Flow-Spektralphotometer. B) Bild von der Probe Handling Unit. C) Schema der Strömung Schaltung in Doppel-Mischen-Modus.
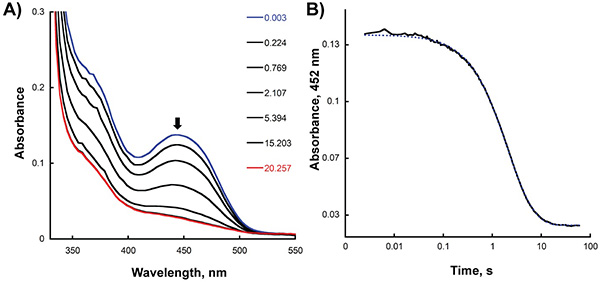
Abbildung 2. Anaerobe Reduktion von Sida mit NADPH in der Stopped-Flow-Gerät. A) Spektrale Änderungen nach dem Mischen gleicher Volumina von 30 uM und 45 uM Sida NADPH aufgezeichnet. Das erste Spektrum (oxidiert SIDA) und zuletzt Spektrum (vollständig reduziert SidA) ist in blau bzw. rot hervorgehoben. B) Absorption bei 452 nm Spur als eine Funktion der Zeit aufgezeichnet.
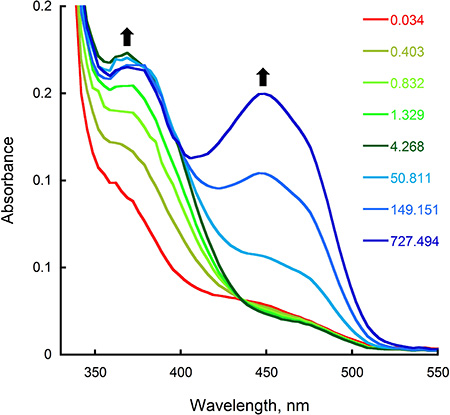
Abbildung 3. Oxidation von Sida in der Stopped-Flow-Gerät. A) Spektrale Änderungen nach dem Mischen gleicher Volumina des vollständig reduzierten SIDA und oxygeniertem Puffer aufgenommen. Die Endkonzentrationen waren 15 uM Sida, 22,5 uM NADPH, und 0,95 mm Sauerstoff. Das Spektrum bei 0,034, 4,268 aufgezeichnet und 727,494 s entspricht dem vollständig reduzierten Enzyms, die C4a-hydroperoxyflavin Zwischenschicht (λ max von 380 nm), und das oxidierte Enzym (λ max von 450 nm) betragen. B) Die Absorption Spur bei 382 und 452 nm als Funktion der Zeit aufgezeichnet.
Diskussion
Enzyme, die Redox-Reaktionen katalysieren, enthalten in der Regel Cofaktoren wie Häme und Flavine, die bedeutende Veränderungen erfahren Absorption während des Katalysezyklus. Die oxidierte Form des Flavin zeigt Absorptionsmaxima bei ~ 360 und 450 nm, und seine Reduktion wird typischerweise durch die Absorption nach Abnahme bei 450 nm 7 überwacht. Im Allgemeinen sind einige kurzlebige Zwischenstufen vorliegenden sondern bilden und Zerfall zu schnell, um in regelmäßigen Spektralphotometer gemessen werden. Verwendung des Applied Photophysik SX20 Stopped-Flow-Spektralphotometer (oder ähnliches), ist es möglich, Änderungen in der Extinktion Millisekundenbereich (Totzeit, 2 ms) zu messen. Hier untersuchten wir die reduktive und oxidative Halbreaktionen des Flavin-abhängige Monooxygenase A f Sida, als Modell. Die Geschwindigkeit der Hydrid wurde durch Messen der Veränderung der Absorption bei 452 nm nach dem Mischen des Enzyms mit NADPH unter anaeroben Bedingungen bestimmt. Anschließend, unter advantage der Doppel-Mischen-Modus der Stopped-Flow-Instrument, wurde das Enzym NADPH reagiert zunächst mit, bis zur vollständigen Reduktion wurde erreicht, dann ist die reduzierte Enzym-NADP +-Komplex wurde mit Sauerstoff gemischt. Nach diesem Verfahren ist es möglich, transiente Flavin oxygenierten Zwischenstufen zu erkennen und Raten von Bildung und Zerfall zu messen. Die Identifizierung dieser Zwischenprodukte bietet experimentellen Daten über die Art der reagierenden Spezies in der Katalyse. Im Fall von A f Sida, die Bildung des C4a-hydroperoxyflavin (typischerweise bei 370 bis 380 nm überwacht), die die Hydroxylierung von Spezies ist. Darüber hinaus Messen der konstanten jeder Stufe ermöglicht es, Informationen über die geschwindigkeitsbestimmende Schritt der Reaktion zu erhalten und dazu beitragen, die kinetischen und chemischen Mechanismen des Enzyms aufzuklären.
Im Allgemeinen können ähnliche Ansätze für andere Flavoenzyme oder Proteine, für die Absorption ändert aufgetreten sind, wie Proteine verwendet werden, dass contain Häm, Pyridoxal-Phosphat-oder Nicht-Häm-Eisen 8-10. Eine Einschränkung dieses Verfahrens besteht darin, dass große Mengen von gereinigtem Enzym benötigt werden, aber dies kann unter Verwendung eines Ausdrucks mit hohen Ausbeuten zu überwinden. Man bestimmt die optimale Protein-Konzentration für die Aufnahme von Spektren mit genügend Eiweiß, so dass ein Signal stark genug beobachtet werden kann, aber nicht zu viel, so dass Enzym wird nicht verschwendet. Typischerweise ist die niedrigste Enzymkonzentration für Flavin-Enzyme in Stopped-Flow-Experimenten verwendet 6-10 pM (nach dem Mischen) und wird unter Verwendung der entsprechenden molaren Extinktionskoeffizienten des Enzyms. Im Fall von A f Sida, ist der Prozentsatz des Enzyms gebunden FAD 50-65% 2. Apo-Protein wird als inaktives in diesen Experimenten betrachtet, weil ein gebundenes FAD-Cofaktor ist notwendig für die Katalyse. Eine weitere mögliche Einschränkung dieser Methode ist, wenn Prozesse in einem Enzym auftreten schneller als 2 ms (Totzeit der Stopped-Flow) werden sie nicht eingehalten werden, aber there sind Strategien, bei denen Preise gesunken, um dieses Problem überwunden werden kann berichtet. Ein Beispiel dafür die Verwendung einer hohen NaCl-Konzentration in der Reaktion eines Ferredoxin-NADP +-Reduktase 11. Die Wäsche von Sauerstoff aus der Strömungskreislauf der Stopped-Flow ist oft eine heikle Schritt in diesem Experiment und erfordert besondere Aufmerksamkeit. Die Glucose-Oxidase-Glucose hier beschriebene System wird erfolgreich in den meisten Labors verwendet, da es eine effektive und kostengünstige Methode ist. Es gibt jedoch einige Nachteile, die die Produktion von H 2 O 2 sind und für einige Anwendungen der Alternativen, da der Protocatechuat Dioxygenase-Protocatechuat sollte als 12 ist. Die Verwendung eines anaeroben Handschuhfach erleichtert, um anaerobe Bedingungen zu gewährleisten, ist jedoch nicht wesentlich. Sauerstoff muss aus dem Strömungskreislauf der Stopped-Flow entfernt werden, wie wir das Enzym in Abwesenheit von Sauerstoff reduziert werden soll oder reagieren mit Sauerstoff in einer Konzentrations, die wir angeben. Obwohl die Stopped-Flow ist im Handschuhfach, gibt es Sauerstoff in der Strömungskreislauf wenn wir aeroben Puffer verwendet in früheren Experimenten. Zusätzlich zu Absorptionsmessungen, können Fluoreszenz-und Circulardichroismus-Assays in die Angewandte Photophysik SX20 Stopped-Flow-Spektralphotometer mit dem entsprechenden Zubehör durchgeführt werden.
Offenlegungen
Wir haben nichts zu offenbaren.
Danksagungen
Forschung von der NSF Auszeichnung MCB-1021384 gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Allgemeine Laborgeräte | Firma | Katalog-Nummer | |
| Vakuumpumpe | Welch | - | |
| Büchner-Kolben | Fischer | 70340-500 | |
| Rührstäbchen | Fischer | 14-512-129 | |
| Stir Platten | Fischer | 11-100-49S | |
| Schlenk-Linien | Kontes Glass | - | |
| Argontank | Airgas | AR UPC300 | |
| Stickstofftank | Airgas | Ni200 | |
| Stickstoff-Tank, ultra hohen Reinheitsgrad | Airgas | NI UHP200 | |
| Sauerstoffbehälter | Airgas | OX 40 | |
| 5% Wasserstoff Gleichgewicht Stickstofftank | Airgas | X02NI95B200H998 | |
| SX20 StOp-Flow-Spektrophotometer | AppliedPhotophysics | - | |
| Im Handschuhfach | Schüchtern | - | |
| Wasserbad | Brinkmann Lauda | - | |
| Vorräte | |||
| 50-ml-Falcon-Röhrchen BD | Fischer | 14-432-23 | |
| 15 ml konischen Röhrchen BD Falcon | Fischer | 05-527-90 | |
| 1,5 ml Eppendorf-Reaktionsgefäße | Fischer | 05-402-18 | |
| 50 und 25 ml Glasfläschchen | Fischer | 06-402 | |
| Gummistopfen | Fischer | 06-447H | |
| Aluminiumkappen | Fischer | 06-406-15 | |
| Reagents | |||
| Kaliumphosphat, monobasisches | Fischer | AC2714080025 | |
| Kaliumphosphat, dibasisches | Fischer | P288-500 | |
| Natriumacetat | Sigma | S-2889 | |
| Glucose-Oxidase aus A. Niger | Sigma | G7141-250KU | |
| D-Glucose | Fischer | D16-500 | |
| β-NADPH | Fischer | ICN10116783 | |
| L (+)-Ornithin-hydrochlorid | Fischer | ICN10116783 |
Referenzen
- Hissen, A. H. The Aspergillus fumigatus siderophore biosynthetic gene sidA, encoding L-ornithine N5-oxygenase, is required for virulence. Infect. Immun. 73 (9), 5493-5503 (2005).
- Chocklett, S. W., Sobrado, P. Aspergillus fumigatus SidA is a highly specific ornithine hydroxylase with bound flavin cofactor. Biochemistry. 49 (31), 6777-6783 (2010).
- Mayfield, J. A. Comprehensive spectroscopic, steady state, and transient kinetic studies of a representative siderophore-associated flavin monooxygenase. J. Biol. Chem. 285 (40), 30375-30388 (2010).
- Fierke, C. A., Hammes, G. G. Transient kinetic approaches to enzyme mechanisms. Contemporary enzyme kinetics and mechanism. , (2009).
- Palfey, B. A., McDonald, C. A. Control of catalysis in flavin-dependent monooxygenases. Arch. Biochem. Biophys. 493 (1), 26-26 (2010).
- van Berkel, W. J. H., Kamerbeek, N. M., Fraaije, M. W. Flavoprotein monooxygenases, a diverse class of oxidative biocatalysts. J. Biotechnol. 124 (4), 670-689 (2006).
- Chapman, S. K., Reid, G. A. . Flavoprotein Protocols. , (1999).
- Sobrado, P., Fitzpatrick, P. F. Solvent and primary deuterium isotope effects show that lactate CH and OH bond cleavage are concerted in Y254F flavocytochrome b2, consistent with a hydride transfer mechanism. Biochemistry. 42, 15208-15214 (2003).
- Kumar, S., Gawandi, V. B., Capito, N., Phillips, R. S. Substituent effects on the reaction of β-benzoylalanines with Pseudomonas fluorescens kynureninase. Biochemistry. 49 (36), 7909-7913 (2010).
- Yun, D., García-Serres, R., Chicalese, B. M., An, Y. H., Huynh, B. H., Bollinger, J. M. J. (μ-1,2-Peroxo)diiron(III/III) complex as a precursor to the diiron(III/IV) intermediate X in the assembly of the iron-radical cofactor of ribonucleotide reductase from mouse. Biochemistry. 46 (7), 1925-1932 (2007).
- Pennati, A., Zanetti, G., Aliverti, A., Gadda, G. Effect of salt and pH on the reductive half-reaction of Mycobacterium tuberculosis FprA with NADPH Biochemistry. Biochemistry. 47 (11), 3418-3425 (2008).
- Patil, P. V., Allou, D. P. The use of protocatechuate dioxygenase for maintaining anaerobic conditions in biochemical experiments. Analytical Biochemistry. 286 (2), 187-192 (2000).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten