Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Высокая пропускная способность синтеза углеводов и Функционализация Polyanhydride наночастиц
В этой статье
Резюме
В этой статье, высокая пропускная способность метода представлена для синтеза олигосахаридов и их крепление к поверхности наночастицы polyanhydride для дальнейшего использования в ориентированных на конкретные рецепторы на антиген представляющих клеток.
Аннотация
Transdisciplinary approaches involving areas such as material design, nanotechnology, chemistry, and immunology have to be utilized to rationally design efficacious vaccines carriers. Nanoparticle-based platforms can prolong the persistence of vaccine antigens, which could improve vaccine immunogenicity1. Several biodegradable polymers have been studied as vaccine delivery vehicles1; in particular, polyanhydride particles have demonstrated the ability to provide sustained release of stable protein antigens and to activate antigen presenting cells and modulate immune responses2-12.
The molecular design of these vaccine carriers needs to integrate the rational selection of polymer properties as well as the incorporation of appropriate targeting agents. High throughput automated fabrication of targeting ligands and functionalized particles is a powerful tool that will enhance the ability to study a wide range of properties and will lead to the design of reproducible vaccine delivery devices.
The addition of targeting ligands capable of being recognized by specific receptors on immune cells has been shown to modulate and tailor immune responses10,11,13 C-type lectin receptors (CLRs) are pattern recognition receptors (PRRs) that recognize carbohydrates present on the surface of pathogens. The stimulation of immune cells via CLRs allows for enhanced internalization of antigen and subsequent presentation for further T cell activation14,15. Therefore, carbohydrate molecules play an important role in the study of immune responses; however, the use of these biomolecules often suffers from the lack of availability of structurally well-defined and pure carbohydrates. An automation platform based on iterative solution-phase reactions can enable rapid and controlled synthesis of these synthetically challenging molecules using significantly lower building block quantities than traditional solid-phase methods16,17.
Herein we report a protocol for the automated solution-phase synthesis of oligosaccharides such as mannose-based targeting ligands with fluorous solid-phase extraction for intermediate purification. After development of automated methods to make the carbohydrate-based targeting agent, we describe methods for their attachment on the surface of polyanhydride nanoparticles employing an automated robotic set up operated by LabVIEW as previously described10. Surface functionalization with carbohydrates has shown efficacy in targeting CLRs10,11 and increasing the throughput of the fabrication method to unearth the complexities associated with a multi-parametric system will be of great value (Figure 1a).
протокол
1. Высокая пропускная способность углеводов Синтез
- До автоматизированного синтеза dimannoside, надлежащим образом защищены сахар-доноры, как правило, trichloroacetimidate и акцептором, в основном, алкенил fluorous алкоголем, синтезированные на настольный.
- Программа написана для автоматизированного синтеза dimannoside. Схематическое изображение основных автоматизированная процедура представлена на рисунке 2. В программе, он заверил, что до того промотора, смесь донора и акцептора перемешивают в течение 30 мин.
- Решения синтетических донора, акцептора и trimethylsilyltrifluoromethanesulfonate сделаны в дихлорметане. Толуол и дихлорметан наиболее часто используются для гликозилирования реакций.
- Кроме того, подготовить решения реагентов для снятия защиты временных защитных групп в 80% метанола и 100% метанола.
- До начала программы, убедитесь, что relatив влажность воздуха в помещении составляет 30% или ниже в автоматизации камеры. Повышенная влажность отрицательно сказывается на реакции гликозилирования.
- После запуска программы, робот-манипулятор переносит решения донора и акцептора в реакции флакон последовательно. Затем смесь перемешивают в течение 30 мин.
- Далее робот-манипулятор переносит от 0,2 до 0,3 эквивалентов trimethylsilyltrifluoromethanesulfonate в смесь, как правило, при комнатной температуре, хотя более низких температурах, как -20 ° С может быть достигнута. Реакционную смесь перемешивают в течение 30 мин.
- Через 30 мин, реакция останавливается и небольшой аликвоты удалены, чтобы следить за реакцией прогресса. Если это не полная, реакция может быть продолжена и в конечном итоге время, требуемое могут быть изменены.
- После завершения реакции реакционную смесь передается fluorous твердофазной экстракции (FSPE) баллончиков, содержащих C 8 F 17-модифицированный силикагель для очистки.
- Корзинухребты, сначала промывают 80% метанол-вода смеси (8 мл), чтобы избавиться от не-fluorous фракции.
- Тогда картриджи промывают 100% метанола для получения желаемого fluorous с метками продукта. Если дополнительная очистка требуется, машина может быть остановлена и продукта реакции (ы) снимается для очистки дополнительных средств.
- После очистки цикла манипулятора распределяет метоксид натрия в реакцию флаконе. Реакция перемешивают в течение 2 часов. Если это не полная, реакция может быть вновь продолжается в течение длительного времени и в конечном счете запрограммированного времени, необходимого могут быть изменены.
- После завершения реакции продукт очищают FSPE, а затем подвергаются растворению в безводного толуола с последующим испарением, чтобы удалить остатки воды.
- Тогда цикл (с шагом 6 до 13) повторяется до желаемой длины цепи получено для молекулы-мишени.
- Охраняемые продукт, полученный из автоматизация йан дополнительно очищают и полностью характеризуются методы, такие как ядерный магнитный резонанс (ЯМР). Полное снятие защиты (удаление всех остальных защитных групп) конечного молекулы целевого затем завершить за пределами платформы автоматизации, как правило, потому что он обычно включает в себя взрывоопасных газов водорода и палладия. На последнем этапе снятия защиты была проведена настольная вне платформы автоматизации. Первым шагом было озонолиза двойной связи в fluorous тег с последующим окислением производства альдегида в карбоновую кислоту. Продукт очищали с помощью колоночной хроматографии. Последним шагом было снятие защиты бензиловый эфир групп палладия катализируемой гидрирования. Продукт прошел через целит площадку, чтобы избавиться от палладия, чтобы получить чистый конечный продукт.
2. Высокая пропускная способность поверхности наночастиц Функционализация
- Высокая пропускная способность синтеза полимеров и наночастиц изготовление осуществляется по тому же пр.otocol и создали робота описывается Петерсен и др. 19. сополимера систем, используемых для изготовления частиц на основе себациновой кислота (SA) и 1,6-бис (пара-carboxyphenoxy) гексана (CPH), и 1,8-бис-( пара-carboxyphenoxy) -3,6-dioxaoctane (CPTEG) и Копенгаген. Схематическое изображение робота аппарата осаждения использовались представлена на рисунке 1b.
- После изготовления наночастиц, содержащих держатель трубки с наночастицами библиотеки подключить к линейной стадии привода.
- Для крепления углеводов на поверхности polyanhydride частиц, амин-карбоновой кислоты реакции соединения 20, состоящий из двух последовательных реакций проводится.
- Для первой реакции, шприц в первый программируемый насос шприц наполняется 10 эквивалентов (формула) (эквивалент средней молярной концентрации карбоновых кислот на поверхности частиц) 1-этил-3-(3-диметиламинопропил)-окrbodiimide гидрохлорид (EDC) и 10 экв. этилендиамина в водном растворе, а шприц во второй насос программируемый шприц загружается с 12 экв. Н-гидроксисукцинимида (NHS) в водном растворе.
- С помощью программы LabVIEW, реагент суспензии поступают в библиотеки * наночастицы.
- Затем каждый образец ультразвуком (30 с при 40 Гц) и держатель трубки отделяется от роботов платформы.
- Наночастиц суспензии инкубировали в течение 9 ** ч при постоянном вращении при 4 ° C.
- После того, как время реакции завершена, трубы центрифугируют (12000 х г в течение 5 мин) и вернулся в роботов станции выполнить два шага стирки.
- Для мытья, остается пустой шприц и загружено в первый программируемый насос шприца, а шприца во второй насос шприц наполняется холодной водой. Супернатант в каждой трубы выведены в пустой шприц и второй депозиты насос холодной воды.
- Усреднение наносуспензии частиц осуществляется, как описано в шаге 2.6. Трубы затем центрифугируют (12000 х г в течение 5 мин) и на втором этапе стирки проводили, как описано в шаге 2.9.
- Для второй реакции, в двух шагах осаждения используются. На первом этапе осаждения, 12 экв. ОДГ загружаются с одного насоса и 12 экв. от NHS будут загружены со второй насос.
- На втором этапе осаждения включает в себя 10 экв. из конкретных сахаридов на первой и второй насос (например, галактоза, лактоза или ди-маннозы) *** и третий насос с 10 экв. гликолевой кислоты (используется в качестве контроля ****).
- Суспензий наночастиц гомогенизируют, как описано на шаге 2.6 и выдерживают в течение 9 часов при постоянном вращении при 4 ° C.
- После того, как время реакции завершения стирки шаг выполняется, как описано в пунктах 2.8, 2.9 и 2.10.
- Функционализированных наночастиц библиотеки помещается в вакуумную камеру, чтобы высохнуть в течение по крайней мере 2 часа.
- Функционализированных наночастиц, то характертеризуется рентгеновской фотоэлектронной спектроскопии и высокую пропускную способность фенола серной кислотой анализ для определения состава поверхности и концентрации сахаридов соответственно. Сканирование электронной микроскопии и динамического рассеяния света используются для определения размера частиц, размер дистрибутива, и поверхностного заряда.
Примечания: * объемы осаждения зависит от массы наночастиц, содержащихся в каждой трубке.
** Время реакции для первой и второй реакций могут быть изменены для настройки конечной концентрации сахаридов.
*** Каждый сахаридов на хранение в пробирках в зависимости от желаемой группы.
**** Для специфической реакции, занятых в данном исследовании для крепления углеводов, гликолевая кислота используется в качестве компоновщика контроля, так как снимают защиту сахаридов уже есть эта молекула ковалентно связаны между собой, что позволяет для дальнейшего крепления к поверхности наночастиц.
3. Представитель Результаты
FULют защиту dimannoside показано на рисунке 2 был синтезирован использованием платформы автоматизации. Синтезированные соединения характеризуются 1 H ЯМР в VXR 400 МГц спектрометр использованием CDCl 3 в качестве растворителя. ЯМР-спектр показан на рисунке 3.
Использование высокопроизводительного изготовления наночастиц и функционализации polyanhydride наночастицы, описанных здесь, крепления dimannose, лактозы и галактозы была проведена успешно 10, 11. С помощью этой настройки, оптимальные условия реакции (например, температуры реакции и времени) были определены для достижения желаемого функционализации наночастиц и морфологии. Когда Реакцию проводили при 4 ° С, а комнатной температуры, снижение агрегации наночастиц наблюдалось SEM (данные не представлены). В таблице 1 приведены результаты представитель характеристики функционализированных 50:50 CPTEG: CPH наночастицы либо с ди-манноза илилактоза, синтезированных при температуре 4 ° C. Полученные данные свидетельствуют о небольшом увеличении среднего диаметра наночастиц за счет функционализации. В то время как не-функционализированных наночастиц был отрицательный потенциал дзета-прибл. -20 МВ, функциональными частиц показал положительный дзета-потенциал значение, демонстрируя успешное функционализации поверхности наночастиц. Лактозы и ди-маннозы являются нейтральными сахарами, однако свободных аминогрупп от этилендиамина компоновщик использовал приложить сахаридов могут быть причиной положительного дзета-потенциал.
Время реакции других переменных, которые могут повлиять как на окончательный морфологии наночастиц и степень привязанности сахар достигнут. Регулируя время реакции, конечная концентрация сахара прикреплен к поверхности наночастицы могут управляться как показано на рисунке 4а. Как и ожидалось, концентрации dimannose на поверхность 50:50 CPTEG: CPH наночастиц увеличивается собщее время реакции и достигает максимума через 18 часов. Наночастицы функционализированных 24 часов общего времени реакции были использованы для оценки их способности к целевой Clrs на мышь костного мозга, полученных дендритные клетки (ДК). Проточная цитометрия была использована для оценки экспрессии двух CL рецепторов (например, CIRE (CD209, DC-SIGN) и манноза рецептора (CD206)) после стимуляции, не функциональными, а лактоза и ди-маннозы функционализированных наночастиц (рис. 4В). Высшее выражение и рецепторов, что указывает на эффективный таргетинг, был получен, когда клетки стимулировали как лактоза и ди-маннозы функционализированных наночастиц. Тем не менее, ди-манноза-функциональными частицами показали более высокий уровень экспрессии указывает на специфичность этого лиганд для рецепторов, которые были изучены.
| Наночастиц типа | Средний диаметр частиц (нм) | Пр.ярости частиц ζ-потенциал (мВ) |
| Non-функционализированных | 162 ± 43 | -20 ± 0,6 |
| Лактоза | 235 ± 34 | 26 ± 2,4 |
| Ди-манноза | 243 ± 32 | 30 ± 4,2 |
Таблица 1. Наночастиц характеристику. Non-функциональными и функциональных характеризовались квазиупругого рассеяния света и дзета-потенциал измерений. Данные размер частиц представляют собой среднее значение ± стандартное отклонение (SD) динамического рассеяния света данные, собранные в трех независимых экспериментах. Зета потенциальных данные представляют собой среднее значение ± SD из трех независимых измерений. Изменение знака дзета-потенциал, показывает, что сахар был эффективно сопряженных с 50:50 CPTEG: CPH поверхности наночастицы.
= "/ Files/ftp_upload/3967/3967fig1.jpg" />
Рисунок 1. (A) Графическое представление подход осуществляться с углеводами функционализации polyanhydride наночастиц и пример функциональными библиотеки наночастиц, которые могут быть разработаны с учетом описанных высокой пропускной подход. (Б) Схематическое изображение автоматизированного аппарата осаждения частиц используются для функционализации, которая состоит из (я) три С 1000 насосов; (II) стадии робота интегрирован двумя приводами (Zaber): один для движения в направлении х, а другая для движения в направлении у, (III), второй этап роботы с двумя соседними стойками (подходит для трубы и кюветы), состоящий из трех приводов, по одному для каждого направления (х, у, г). Насосы и в общей сложности пять приводов, соединенных последовательно. Приводы и насосы работают на компьютере с помощью LabVIEW программного обеспечения. Эта схема не в масштабе.arge.jpg "целевых =" _blank "> Нажмите здесь, чтобы увеличить цифру.
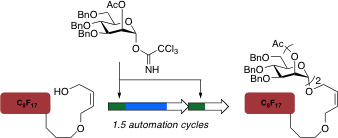
Рисунок 2. Графическое представление автоматизированных итерационного синтеза углеводов использованием маннозы в качестве примера.
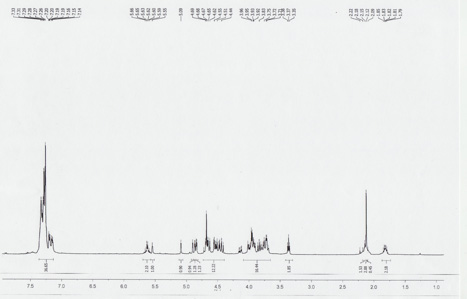
Рисунок 3. 1 H ЯМР защищены dimannoside.
Рисунок 4. (А) Влияние времени реакции на поверхности наночастиц концентрации сахаридов. В данных показал, 50:50 CPTEG: CPH наночастицы с функциональными dimannose в разное время реакции и реакции проводили при 4 ° C. Средние и стандартные ошибки двух независимых экспериментах показано функционализации. (B), лактозы и ди-маннозы функционализированных наночастицэффективной целевой DC-SIGN (CIRE, CD209) и маннозы рецепторов (CD206) в костном мозге производных дендритных клеток, о чем свидетельствует расширение выражение этих двух маркеров после стимуляции с функциональными 50:50 CPTEG: CPH наночастиц по сравнению с выражением с неправительственными организациями, функциональными частицами.
Обсуждение
Эффективность углеводов ориентации агентов прямых взаимодействий наночастиц на клетки иммунной системы была продемонстрирована ранее 10, 11. Предыдущие исследования в нашей лаборатории показали, что конкретные сахара придает polyanhydride наночастицы способны ориентированы на разли?...
Раскрытие информации
NLBP является соучредителем и имеет собственный капитал в углеводном компании LuCella Biosciences, Inc
Благодарности
Авторы хотели бы поблагодарить армии США медицинских исследований и материального Command (грант № W81XWH-10-1-0806) и Национальные институты здравоохранения (грант № U19 AI091031-01 и грант № 1R01GM090280) за финансовую поддержку. Б. признает Balloun профессора в области химической и биологической инженерии и NLBP признает профессора Уилкинсона междисциплинарных технических наук. Мы благодарим Юлию Вела за помощь в проведении экспериментов наночастиц функционализации.
Материалы
| Name | Company | Catalog Number | Comments |
| Имя | Компания | Номер в каталоге | |
| Моторизованный XYZ этап: 3-кратный Т-LSM050A, 50 мм хода на ось | Zaber технологии | T-XYZ-LSM050A-KT04 | |
| NE-1000 один насос шприца | Новые системы насоса эры | NE-1000 | |
| Pyrex * Vista * оправы многоразовые стеклянные трубки культуры | Гранулирование | 07-250-125 | |
| ASW 1000 | Chemspeed технологии | ||
| LabVIEW | National Instruments | 776671-35 | |
| SGE газонепроницаемыми Шприцы, Луер Лок | Sigma Aldrich | 509507 | |
| XL-2000 Sonicator | Qsonica | Q55 | |
| Мини-ротатор трубы | Fisher Scientific | 05-450-127 |
Ссылки
- Zepp, F. Principles of vacine design-lessons from nature. Vaccine. 28, C14-C24 (2010).
- Ulery, B. D., Phanse, Y., Sinha, A., Wannemuehler, M. J., Narasimhan, B., Bellaire, B. H. Polymer chemistry influences monocytic uptake of polyanhydride nanospheres. Pharm. Res. 26, 683-690 (2009).
- Torres, M. P., Wilson-Welder, J. H., Lopac, S. K., Phanse, Y., Carrillo-Conde, B., Ramer-Tait, A. E. Polyanhydride microparticles enhance dendritic cell antigen presentation and activation. Acta Biomater. 7, 2857-2864 (2011).
- Torres, M. P., Determan, A. S., Anderson, G. L., Mallapragada, S. K., Narasimhan, B. Amphiphilic polyanhydrides for protein stabilization and release. Biomaterials. 28, 108-116 (2007).
- Petersen, L. K., Ramer-Tait, A. E., Broderick, S. R., Kong, C. S., Ulery, B. D., Rajan, K. Activation of innate immune responses in a pathogen-mimicking manner by amphiphilic polyanhydride nanoparticle adjuvants. Biomaterials. 32, 6815-6822 (2011).
- Petersen, L. K., Xue, L., Wannemuehler, M. J., Rajan, K., Narasimhan, B. The simultaneous effect of polymer chemistry and device geometry on the in vitro activation of murine dendritic cells. Biomaterials. 30, 5131-5142 (2009).
- Lopac, S. K., Torres, M. P., Wilson-Welder, J. H., Wannemuehler, M. J., Narasimhan, B. Effect of polymer chemistry and fabrication method on protein release and stability from polyanhydride microspheres. J. Biomed. Mater. Res. B. 91, 938-947 (2009).
- Determan, A. S., Wilson, J. H., Kipper, M. J., Wannemuehler, M. J., Narasimhan, B. Protein stability in the presence of polymer degradation products: Consequences for controlled release formulations. Biomaterials. 27, 3312-3320 (2006).
- Determan, A. S., Lin, V. S. Y., Nilsen-Hamilton, M., Narasimhan, B. Encapsulation, stabilization, and release of BSA-FITC from polyanhydride microspheres. J. Controlled Release. 100, 97-109 (2004).
- Chavez-Santoscoy, A., Roychoudhury, R., Ramer-Tait, A. E., Pohl, N. L. B., Wannemuehler, M. J., Narasimhan, B. Tailoring the immune response of alveolar macrophages by targeting different C-type lectin receptors using "pathogen-like" amphiphilic polyanhydride nanoparticles. Biomaterials. , (2011).
- Carrillo-Conde, B., Song, E. -. H., Chavez-Santoscoy, A., Phanse, Y., Ramer-Tait, A., Pohl, N. L. Mannose-functionalized "pathogen-like" polyanhydride nanoparticles target C-type lectin receptors on dendritic cells. Mol. Pharmaceutics. 8, 1877-1886 (2011).
- Carrillo-Conde, B., Schiltz, E., Torres, M. P., Yu, J., Phillips, G., Minion, C. Amphipilic polyanhydrides for stabilization of Yersinia pestis antigens. Acta. Biomater. 6, 3110-3119 (2010).
- Reddy, S. T., Swartz, M. A., Hubbell, J. A. Targeting dendritic cells with biomaterials: developing the next generation of vaccines. Trends Immunol. 27, 573-580 (2006).
- Higashi, N., Fujioka, K., Denda-Nagai, K., Hashimoto, S., Nagai, S., Sato, T. The macrophage C-type lectin specific for galactose/N-acetylgalactosamine is an endocytic receptor expressed on monocyte-derived immature dendritic cells. J. Biol. Chem. 277, 20686 (2002).
- Geijtenbeek, T. B. Signalling through C-type lectin receptors: shaping immune responses. Nat. Rev. Immunol. 9, 465-479 (2009).
- Seeberger, P. H. Automated oligosaccharide synthesis. Chem. Soc. Rev. 37, 19-28 (2008).
- Seeberger, P. H. Automated Carbohydrate Synthesis as Platform to Address Fundamental Aspects of Glycobiology-Current Status and Future Challenges. Carb. Res. 343, 1889-1896 (2008).
- Jaipuri, F. A., Pohl, N. L. Toward solution-phase automated iterative synthesis: fluorous-tag assisted solution-phase synthesis of linear and branched mannose oligomers. Org. Biomol. Chem. 6, 2686-2691 (2008).
- Petersen, L. K., Chavez-Santoscoy, A., Narasimhan, B. Combinatorial synthesis of and high-throughput protein release from polymer film and nanoparticle libraries. J. Vis. Exp. , (2011).
- Song, E. -. H., Osanya, A. O., Petersen, C. A., Pohl, N. L. B. Synthesis of multivalent tuberculosis and Leishmania-associated capping carbohydrates reveals structure-dependent responses allowing immune evasion. J. Am. Chem. Soc. 132, 11428-11430 (2010).
- Hakamori, S. Aberrant glycosylation in tumor and tumor associated carbohydrate antigens. Adv. Cancer Res. 59, 257-331 (1989).
- Atherton, T., Sheppard, R. C. . Solid-phase peptide synthesis: a practical approach. , (1999).
- Caruthers, M. H. Gene synthesis machines: DNA chemistry and the uses. Science. 230, 281-285 (1985).
- Plante, O. J., Palmacci, E. R., Seeberger, P. H. Automated solid- phase synthesis of oligosaccharides. Science. 291, 1523-1527 (2001).
- Ko, K. -. S., Park, G., Yu, Y., Pohl, N. L. Protecting group-based colorimetric monitoring of fluorous-phase and solid-phase synthesis of oligoglucosamines. Org. Lett. 10, 5381-5384 (2008).
- Pohl, N. L., Chen, X. H. R., Wang, G. P. Automated solution-phase oligosaccharide synthesis and carbohydrate microarrays: development of fluorous-based tools for glycomics. Chemical Glycobiology. , 272-287 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены