Method Article
Simultanée pré-et post-synaptique enregistrement électrophysiologique de
Dans cet article
Résumé
Cette vidéo montre les procédures utilisées pour cultiver des cultures primaires d'embryon de Xenopus et les cellules musculaires et l'utilité de cette préparation pour faire simultanées pré-et post-synaptique des enregistrements de patch-clamp.
Résumé
Beaucoup d'informations sur le couplage des courants ioniques présynaptiques avec la libération de neurotransmetteur a été obtenue à partir de préparations d'invertébrés, notamment le calmar géant synapse 1. Toutefois, à l'exception de la préparation décrite ici, il existe peu de préparations vertébrés dans lequel il est possible d'effectuer des mesures simultanées de la libération des neurotransmetteurs et des courants ioniques présynaptiques. Embryonnaires de Xenopus motoneurones et les cellules musculaires peuvent être cultivées ensemble dans un milieu de culture simple à la température ambiante, ils vont former des synapses fonctionnelles dans les 12 à 24 heures, et peut être utilisée pour étudier les nerfs et le développement des cellules musculaires et les interactions synaptiques pendant plusieurs jours (jusqu'à ce que prolifération se produit). Quelques avantages de ces co-cultures sur les préparatifs autres vertébrés comprennent la simplicité de préparation, la capacité de maintenir les cultures et le travail à la température ambiante, et l'accessibilité aisée des synapses formée 2-4. La préparation a été largement utilisé pour étudier les propriétés biophysiques des canaux ioniques présynaptiques et la régulation de 5-8 libération du transmetteur. En outre, la préparation s'est prêté à d'autres usages, y compris l'étude de la croissance des neurites et la synaptogenèse 9-12, les mécanismes moléculaires de la libération des neurotransmetteurs 13-15, le rôle de messagers diffusibles dans neuromodulation 16,17, et in vitro plasticité synaptique 18 - 19.
Protocole
1. Préparation pré-expérimentale
- Préparer les solutions suivantes (voir le tableau 1 pour les compositions): (a) 1 litre NFR (Ringer de grenouille normale), (b) une solution saline 100 ml 10%, (c) 100 ml CMF (Ca 2 + / Mg 2 + sans solution ), (d) 1 ml SA (Insulin-transferrine-Sélénium, Sigma I1884), (e) 100 ml de milieu L-15 de la culture, (f) 10 ml HCG (gonadotrophine chorionique humaine Sigma CG-10), (g) 100 ml K +-interne solution, (h) 100 ml K +-interne solution pour l'amphotéricine B. La force osmotique de la solution 1 doit être vérifiée afin de s'assurer qu'elle est d'environ 260 mOsm l'aide d'un osmomètre à pression de vapeur (p. ex Wescor modèle # 5100C) .
- Stériliser par filtration des solutions (b) et (c). Les solutions (a) (b) et (c) peuvent être stockées jusqu'à trois mois à 4 ° C. Préparer une solution (d) par addition de 1 ml d'eau désionisée H 2 O dans le flacon contenant la poudre lyophilisée par une aiguille de calibre 25 et un filtre seringue seringue. Cette solution finale cun être conservés à 4 ° C pendant 30 jours.
- Préparer une solution (E) dans une hotte à flux laminaire, en combinant tous les composants dans un bécher ou une fiole. Stériliser par filtration de la solution finale et transférer aliquotes de 10 ml dans des tubes à centrifuger stériles. Conserver à -20 ° C.
- Préparer l'HCG (solution (f)) en ajoutant 10 ml d'eau désionisée H 2 0 dans le flacon contenant la poudre lyophilisée aide d'une aiguille de calibre 25 seringue et d'un filtre seringue. Cette solution finale peut être conservé à 4 ° C pendant 30 jours.
- Fabriquer au moins deux outils de microdissection par collage d'un axe minuties (26002-10, Outils Fine Science) à l'extrémité d'une pipette Pasteur en verre avec de la colle cyanoacrylate. Permettre à l'extrémité pointue de la broche à s'étendre au-delà de l'extrémité de la pipette d'environ 0,5 cm.
- Deux jours avant la préparation des cultures, induire la reproduction à la procédure suivante. Identifier un couple reproducteur-prêt de Xenopus en observant un éminent, cloaque rougeâtre sur la pigmentation foncée des femmes et sur le plan surface des pattes avant du mâle. Un à la fois, déduction faite chaque grenouille et maintenez-la face ventrale vers le bas sur un évier avec le filet de sorte qu'il ne peut pas s'échapper. Injecter 1 ml de solution (f) à travers le net et sous-cutanée dans des sacs lymphatiques dorsaux.
- Placez le couple reproducteur ensemble dans un réservoir couvert dix litres d'eau. Afin de s'assurer que les animaux ne seront pas piétiner les oeufs fraîchement pondus et fertilisés, installer un plancher blindé avec un maillage d'environ ½ "équipés d'environ 1-2 cm au-dessus du fond de la cuve (figure 1A).
- Laisser grenouilles intactes pendant 12-48 h jusqu'à ce que les animaux sont en amplexus les oeufs fertilisés sont observées à l'étage inférieur de l'écran (figure 1B).
- Retirer les animaux de la citerne, mais laisser les œufs reposer pendant au moins 24 heures plus. Cette paire de grenouilles peuvent être réutilisés élevés après six semaines.
- Desserrez les embryons du fond de la cuve et de les transférer à quatre ou cinq culte mm 60x15ure plats contenant une solution saline à 10% (solution B). Trier les embryons par étape selon le schéma de Niewkoop et Faber (réf. 20). Embryons utiles seront ceux au stade 22-24. Figure 2A montre un embryon au stade d'environ 22, tandis que la figure 2B montre un embryon qui est trop loin dans le développement pour être utile (environ étape 28). Il est important de choisir les embryons qui sont en bonne santé: ceux qui sont d'apparence lisse marron clair avec des marbrures blanches et sont idéales. Les embryons qui ont de grandes taches noires ou blanches sont généralement malsain et inutilisable.
2. Microdissection d'embryons de xénope
- L'intérieur d'une hotte à flux laminaire, l'étiquette et remplissez environ à mi-chemin trois plats 60x15 mm culture stériles avec une solution saline à 10%, et une avec FMC.
- En utilisant une solution stérile, pipette Pasteur en verre transfert de cinq à dix étapes 22-24 embryons dans l'une des boîtes contenant une solution saline à 10%. Avec l'aide d'un zoom stéréo disséquermicroscope ment intérieur de la hotte (0,6-5x avec oculaires x 10), enlever la couche de gelée et de la membrane vitelline de chaque embryon en utilisant deux paires de pinces stériles N ° 5 (11251-30, Outils Fine Science). (Voir les figures 3A et 3B).
- Laver les embryons nus en les faisant passer, un à la fois, à travers les deux autres plats de solution saline à 10% et finalement dans le récipient métallique contenant du FMC. Utiliser une nouvelle pipette stérile pour chaque transfert et minimiser le volume de solution transféré de plat à plat.
- À son tour, chaque embryon tenir doucement mais fermement avec une pince et, en utilisant l'outil de microdissection façonné à l'étape 1.5, retirer le tube neural et myotomes associés qui sont situés à l'aspect le plus dorsale de l'animal. Faire en faisant trois tranches, une à chaque extrémité de l'emplacement du tube neural et un tiers seulement ventrale de celle-ci (figure 4A). Déplacez chaque tube neural disséqué / myotome à une partie propre de la vaisselle hors de la Granul'eau jaunees et d'autres débris (figure 4B). L'axe dorsal-ventral, et les emplacements du tube neural et myotomes sont indiqués sur la figure 4.
- Après une quinzaine de minutes dans cette solution pince utilisation (CMF) pour soulever la peau pigmentée libre du tissu disséqué et jeter. Après un temps supplémentaire 30-60 min, les cellules vont former un "tas de sable", comme ils se dissocient les uns des autres (figure 4C).
3. Préparation de nerf-muscle co-cultures
- Décongeler un tube de 10 ml de milieu de culture et ajouter aseptiquement 70 pi SA et 35 ng / ml BDNF (Sigma B3795).
- Étiquette et remplissez stériles boîtes de 35 mm (culture FD35-100 World Precision Instruments) environ à mi-chemin avec un milieu de culture L-15 (solution (e)), un pour chaque embryon disséqués.
- Fabriquer une pipette de placage en saisissant chaque extrémité d'une pipette Pasteur en verre tout en maintenant la partie conique à feu. Tirer les bouts dehors à environ 10 cm et puis se détachent de l'extrémité pour donner une pointe d'environ 0,2 mm.
- Utiliser la pipette placage pour aspirer le "tas de sable" d'un embryon en minimisant la quantité de solution établi. Expulser les cellules sur le fond d'une boîte de culture. Plaque de cellules sur plusieurs lignes. Observez plaqué des cellules indifférenciées (figure 5A et 5B).
- Laisser les boîtes de cellules intactes plaqués pendant au moins quinze minutes pour laisser le temps aux cellules de se fixer l'assiette.
4. Patch-clamp nerf-muscle Synapses
- Après 12-24 h de culture, les cellules plaquées prendre différentes caractéristiques morphologiques: les cellules musculaires deviennent fusiformes et neurones spinaux étendre les processus longs (figure 6). Fonctionnelle contact synaptique entre les varicosités neurites et les cellules musculaires peuvent être confirmés par paires simultanées des enregistrements électrophysiologiques. "M", "S" et "V" se réfèrent respectivement à la cellule musculaire, neuronalesoma et varicosités présynaptique.
- Préparer deux électrodes de patch pour l'enregistrement: l'un pour le varicosités présynaptique et l'autre pour la cellule musculaire.
- Pour l'électrode présynaptique, préparer une solution contenant de l'amphotéricine comme suit: Ajouter 100 ul de DMSO à un tube de 1,5 ml contenant 5 mg d'amphotéricine B (Sigma A4888). Vortex cette solution pendant 10 sec. Ensuite, ajouter 10 ul de cette solution dans un tube à centrifuger second contient 625 K +-ul interne solution pour l'amphotéricine B (solution de (h)). Vortex comme ci-dessus.
- Remplir l'électrode de pré-synaptique avec l'amphotéricine contenant K +-interne solution préparée à l'étape 4,3 et l'électrode de post-synaptique avec K +-interne solution (solution (g)).
- Remplacez le support dans la boîte de culture avec NFR et le transférer à un microscope inversé équipé d'une optique à contraste de phase.
- Positionnez les deux électrodes juste au-dessus de leurs cibles respectives. Obtenir la collaboration de cellules entièresnfiguration avec l'électrode de la cellule musculaire avant la configuration de patch perforé avec l'électrode de varicosités.
- Pour confirmer le fonctionnement de la synapse, dépolariser la varice avec un amplificateur de patch-clamp (par exemple Axopatch 200B, Molecular Devices) sous le contrôle du logiciel (par exemple pCLAMP 9, Molecular Devices) et d'observer les courants simultanés présynaptiques et postsynaptiques. La figure 7 montre les courants observés en réponse à la dépolarisation des mesures de tension donnés à la varicosités présynaptique par incréments de 10 mV à -30 mV à +40 mV. Les courants entrants vus dans la cellule présynaptique sont portés par Na + et Ca 2 + et les courants sortants par K +. Courants enregistrés dans la cellule postsynaptique sont des réponses à des neurotransmetteurs libérés de la varice et sont portées principalement par des ions Na + à travers les canaux récepteurs de l'acétylcholine nicotinique.
Résultats
La figure 4B montre la vue dorsale d'un cordon médullaire isolée / myotome immédiatement après son retrait à partir d'un embryon de Xenopus étape 22. Figure 4C montre que, après l'enlèvement de la peau et la solution d'incubation de Ca 2 +-Mg 2 + sans solution (CMF, ( c)), les cellules se dissocient en un "tas de sable" et sont prêts pour le placage. Immédiatement après l'étalement dans les cellules du milieu de culture présentent peu de variabilité morphologique (figure 5B), mais prendre des formes distinctes après 24 heures de culture. Les cellules musculaires deviennent fusiformes alors que les neurones restent sphériques tout en s'étendant neurites qui varicosites élaborés au niveau des synapses avec les cellules musculaires (figure 6). L'enregistrement simultané de correctif associé de la varice présynaptique et postsynaptique des cellules musculaires (figure 7) révèle les courants présynaptiques entrants et sortants associés à la libération de neurotransmetteurs et la resultant courants postsynaptiques excitateurs.

Figure 1:.. Paire d'élevage de grenouilles dans un seau d'accouplement au sommet de l'écran B: Frogs in amplexus avec des œufs fécondés.
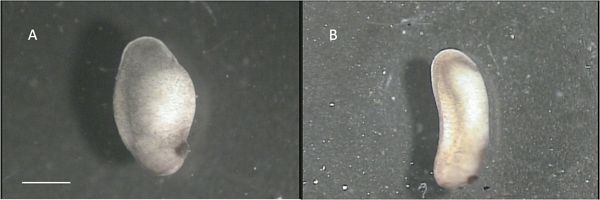
Figure 2:. B "convenable" embryon étape 22:. "Impropre" stade 28 embryonnaire. La barre d'échelle représente 1 mm.
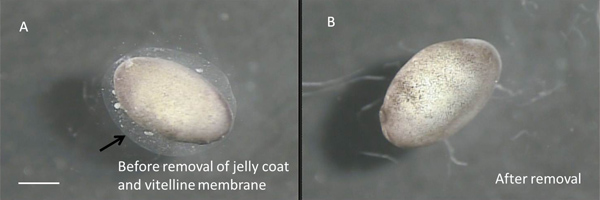
Figure 3:. Stage 22 embryons avant de les enlever de vitelline membrane et la couche gelée. La flèche indique le bord extérieur de la couche gelée. La membrane vitelline adhère intimement à la embrans et est pratiquement invisible B:. embryon nu. La barre d'échelle représente 1 mm.
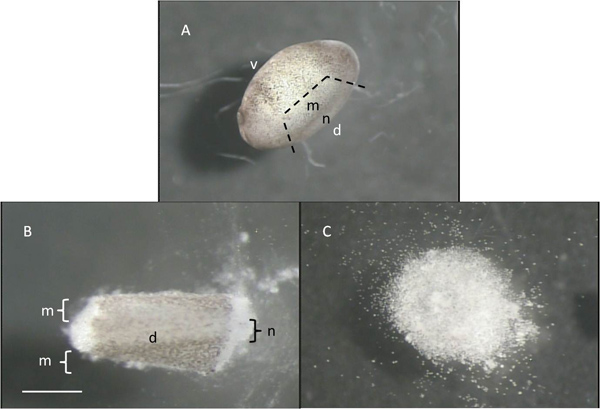
Figure 4: Stage 22 embryons par une ligne en pointillés indiquant à être disséqué partie B:.. Aiguë isolée partie dorsale de l'embryon; "d" et "v" se réfèrent aux aspects dorsale et ventrale de l'embryon, tandis que "m" et «n» indiquent les emplacements approximatifs des mytomes et tube neural C:. "tas de sable" de cellules après 60 min au FCM. La barre d'échelle représente 1 mm pour A, et 0,5 mm pour B et C.
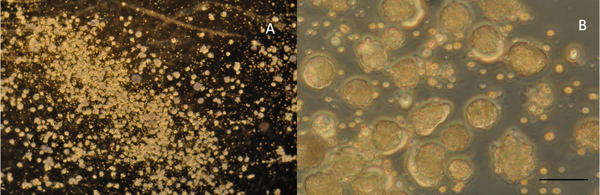
A la figure 5:. 5x vue puissance de cellules en culture immédiatement après l'étalement. B: la culture même à 40x. Échellebarre représente 40 pm pour A et pour B. 5 pm
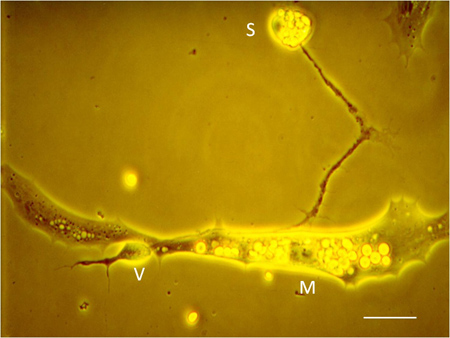
Figure 6. Jonction neuromusculaire en culture avec identification de neurones soma (S), varicosités présynaptique (V), et la cellule postsynaptique du muscle (M). Barre d'échelle: 5 um.
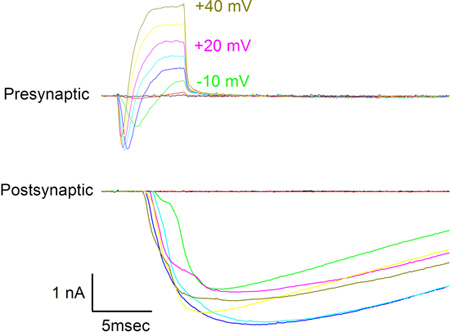
Figure 7. Présynaptiques (en haut) et post-synaptique (en bas) courants observés en réponse à la demande de 10 mV de tension progressive étapes présentées à la varicosités présynaptique de -30 mV à +40 mV. Mesures de tension sont indiquées à côté de quelques-unes des traces présynaptiques. Le potentiel de maintien pour les deux cellules était de -70 mV.
Discussion
Les principales étapes de la co-culture réussie des motoneurones et les cellules musculaires sont l'utilisation d'embryons mis en scène de façon appropriée produits de l'élevage de grenouilles Xenopus induite, et la dissection minutieuse aseptique des neurones spinaux et les myoblastes non différenciés. Les œufs fécondés devrait être laissé au repos jusqu'à ce qu'ils atteignent environ 10 ou scène afin de les déplacer plus vite souvent freine leur développement. Embryons sains sont identifiés par un aspect lisse et une brune et blanche tachetée de coloration. Etape 22-24 embryons sont les plus utiles, car c'est le point au cours du développement, juste après la fermeture du tube neural et avant les myocytes se sont différenciés de façon significative. En outre, les cellules provenant d'embryons plus âgés ne parviennent pas à dissocier ainsi au FCM. Des précautions doivent être prises lors du retrait de la membrane vitelline car elle adhère fortement à l'embryon. La membrane doit être déchiré l'aide de pinces pointues pour que l'embryon se dégage intacte. Une autre importante precaution est de bien placer les cellules sur le fond de la boîte de culture (plutôt que de les laisser s'y installer). Cette méthode est préférable car cela augmente la probabilité que les cellules adhèrent à la boîte de culture.
Neurotransmission fonctionnelle entre le nerf et le muscle peut être déterminée avec enregistrement juste postsynaptique et, souvent, peut être déterminée par l'observation de la contraction musculaire spontanée après innervation. Cellules musculaires innervées non pas se contracter dans la culture. D'enregistrement postsynaptique seule est utile pour enregistrer des plateaux vertébraux courants miniatures ou potentiels, mais des mesures de libération évoquée nécessite une stimulation présynaptique, et la corrélation des courants pré-et post-synaptique exige le double de patch-clamp.
En plus de la méthode d'enregistrement appariés correctif décrit ici, cette préparation offre la possibilité d'introduire une pipette troisième au soma neuronal 5 Ce permet la génération d'un potentiel d'action that peut se propager à la varicosités présynaptique et conduire à la libération de neurotransmetteurs. En outre, les agents putatifs qui sont censés servir de médiateur ou de moduler la transmission synaptique peut être introduit de chaque côté de la synapse: via la pipette cellule musculaire ou par diffusion à partir d'une pipette à la troisième place soma.
Déclarations de divulgation
Aucun conflit d'intérêt déclaré.
Remerciements
Financé par la NSF (0854551).
matériels
| Name | Company | Catalog Number | Comments | ||||||||||||||
| Équipement / Fournitures | Vendeur | Catalogue / Numéro de modèle | |||||||||||||||
| Insulin-transferrine-Sélénium | Sigma | I1884 | |||||||||||||||
| La gonadotrophine chorionique humaine | Sigma | CG-10 | |||||||||||||||
| Osmomètre Pression de vapeur | Wescor | 5100C | |||||||||||||||
| Pins minuties | Outils Fine Science | 26002-10 | |||||||||||||||
| L'amphotéricine B | Sigma | A4888 | |||||||||||||||
| Forceps | Outils Fine Science | 11251-30 | |||||||||||||||
|
Table 1.
Références
- Augustine, G. J., Eckert, R. Divalent cations differentially support transmitter release at the squid giant synapse. J. Physiol. 346, 257-271 (1984).
- Spitzer, N. C., Lamborghini, J. E. The development of the action potential mechanism of amphibian neurons isolated in culture. Proc. Natl. Acad. Sci. U.S.A. 73, 1641 (1976).
- Weldon, P. R., Cohen, M. W. Development of synaptic ultrastructure at neuromuscular contacts in an amphibian cell culture system. J. Neurocytol. 8, 239-259 (1979).
- Tabti, N., Poo, M. -. M., Banker, G., Goslin, K. . Culturing Nerve Cells. , 137-153 (1991).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J. Neurosci. 17, 2990 (1997).
- DiGregorio, D. A., Peskoff, A., Vergara, J. L. Measurement of action potential-induced presynaptic calcium domains at a cultured neuromuscular junction. J. Neurosci. 19, 7846 (1999).
- Yazejian, B., Sun, X. P., Grinnell, A. D. Tracking presynaptic Ca2+ dynamics during neurotransmitter release with Ca2+-activated K+ channels. Nat. Neurosci. 3, 566 (2000).
- Sun, X. P., Chen, B. M., Sand, O., Kidokoro, Y., Grinnell, A. D. Depolarization-induced Ca2+ entry preferentially evokes release of large quanta in the developing Xenopus neuromuscular junction. J. Neurophysiol. 104 (5), 2730-2740 (2010).
- Xie, S. P., Poo, M. M. Initial events in the formation of neuromuscular synapse: rapid induction of acetylcholine release from embryonic neurons. Proc. Natl. Acad. Sci. U.S.A. 83, 7069 (1986).
- Li, P. P., Chen, C., Lee, C. W., Madhavan, R., Peng, H. B. Axonal filopodial asymmetry induced by synaptic target. Mol. Biol Cell. 22 (14), 2480-2490 (2011).
- Feng, Z., Ko, C. P. Schwann cells promote synaptogenesis at the neuromuscular junction via transforming growth factor-beta1. J. Neurosci. 28 (39), 9599-9609 (2008).
- Song, H. J., Ming, G. L., Poo, M. M. cAMP-induced switching in turning direction of nerve growth cones. Nature. 17 (6639), 275-279 (1997).
- Morimoto, T., Wang, X. H., Poo, M. M. Overexpression of synaptotagmin modulates short-term synaptic plasticity at developing neuromuscular junctions. Neuroscience. 82 (4), 969-978 (1998).
- Lu, B., Czernik, A. J., Popov, S., Wang, T., Poo, M. M., Greengard, P. Expression of synapsin I correlates with maturation of the neuromuscular synapse. Neuroscience. 74 (4), 1087-1097 (1996).
- Schaeffer, E., Alder, J., Greengard, P., Poo, M. M. Synapsin IIa accelerates functional development of neuromuscular synapses. Proc. Natl. Acad. Sci. U.S.A. 26 (9), 3882-3886 (1994).
- Liou, J. C., Tsai, F. Z., Ho, S. Y. Potentiation of quantal secretion by insulin-like growth factor-1 at developing motoneurons in Xenopus cell culture. J. Physiol. 553 (Pt. 3), 719-7128 (2003).
- Peng, H. B., Yang, J. F., Dai, Z., Lee, C. W., Hung, H. W., Feng, Z. H., Ko, C. P. Differential effects of neurotrophins and schwann cell-derived signals on neuronal survival/growth and synaptogenesis. J. Neurosci. 23 (12), 5050-5060 (2003).
- Dan, Y., Poo, M. M. Hebbian depression of isolated neuromuscular synapses in vitro. Science. 12 (5063), 1570-1573 (1992).
- Xiao, Q., Xu, L., Spitzer, N. C. Target-dependent regulation of neurotransmitter specification and embryonic neuronal calcium spike activity. J. Neurosci. 30 (16), 5792-5801 (2010).
- Niewkoop, P. D., Faber, J. . Normal table of Xenopus laevis (Daudin). , (1967).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon