È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Misurare intracellulare Ca
In questo articolo
Riepilogo
Intracellulare di Ca 2 + Dinamiche sono molto importanti in sperma fisiologia e Ca 2 + Sensibili coloranti fluorescenti costituiscono uno strumento versatile per studiarli. Esperimenti di popolazione (fluorometria e fermato il flusso fluorometria) ed esperimenti cella singola (citometria a flusso e l'imaging di singola cellula) sono utilizzati per tenere traccia spazio-temporale [Ca 2 +] Cambiamenti nelle cellule di sperma umano.
Abstract
Gli spermatozoi sono cellule riproduttive maschili specialmente progettati per raggiungere, riconoscere e fondersi con l'uovo. Per eseguire queste attività, gli spermatozoi devono essere preparati ad affrontare un ambiente in costante evoluzione e per superare le numerose barriere fisiche. Essere in sostanza transcriptionally e translationally silenziosa, queste cellule mobili affidano profondamente su diversi meccanismi di segnalazione di orientarsi e di nuotare in modo diretto, e fare i conti con le difficili condizioni ambientali durante il loro viaggio per trovare l'uovo. In particolare, Ca 2 +-mediata segnalazione è fondamentale per diverse funzioni spermatiche: attivazione della motilità, capacitazione (un processo complesso che prepara lo sperma per la reazione acrosomiale) e la reazione acrosomiale (un evento esocitotico che permette la fusione spermatozoo-uovo). L'uso di coloranti fluorescenti per monitorare fluttuazioni intracellulari di questo ione è di notevole importanza per la loro facilità di applicazione, sensibilità e versatilità di detezione. Utilizzando un unico protocollo di colorante di caricamento utilizziamo quattro diverse tecniche di fluorimetrici per monitorare lo sperma Ca 2 + dinamica. Ciascuna tecnica fornisce informazioni distinta che consente la risoluzione spaziale e / o temporale, generando dati sia a singola cella e di popolazioni cellulari.
Introduzione
Ca 2 + è un secondo messaggero universale di vie di trasduzione del segnale in cellule eucariotiche. Intracellulare di Ca 2 + (Ca 2 + i) partecipa alla regolazione di molti processi fisiologici fondamentali nelle cellule sia eccitabili e non eccitabili. L'importanza e l'universalità di Ca 2 + come secondo messaggero durante eventi di trasduzione del segnale è derivato dalla sua versatilità spazio-temporale nella trasmissione delle informazioni all'interno della cellula. Mentre Ca 2 + non possono essere sintetizzati de novo o degradati all'interno della cellula, la sua concentrazione intracellulare ([Ca 2 +] i) viene mantenuta entro limiti molto ristretti attraverso diversi meccanismi cellulari che continuamente tampone, sequester, compartimenti stagni, e / o accumulare Ca 2 +. Cambiamenti nella concentrazione di questo ione possono verificarsi in aree molto localizzate all'interno della cella 1, e decifrare tali fluttuazioni è essenziale per ottenere una deeper comprensione di (1) il loro ruolo nel meccanismo di segnalazione, (2) il loro significato fisiologico, e (3) meccanismi generali di segnalazione cellulare. Ca 2 +-mediata segnalazione è di particolare importanza in sperma fisiologia 2. La motilità degli spermatozoi è una delle funzioni più importanti per il successo la fecondazione, e in effetti, diversi difetti della motilità degli spermatozoi può causare sterilità 3-5. L'importanza di Ca 2 + in movimento flagellare tempo è stato riconosciuto 6, tuttavia, il meccanismo di come Ca 2 + controlla la forma specifica di flagellare curvatura non è completamente nota.
Prima di fondersi con l'uovo, spermatozoi deve subire capacitazione, un processo complesso alla residenza spermatozoo all'interno del tratto femminile. Durante la capacitazione, architettura lipidico della membrana e l'organizzazione spermatozoi vengono modificati, soprattutto a seguito della rimozione del colesterolo dalla membrana plasmatica. Inoltre, diverse proteine sono tirosin-fosforoylated 7. Soprattutto, durante la capacitazione vi è un aumento del pH intracellulare (pH i) e in [Ca 2 +] i, e il potenziale di membrana hyperpolarizes in alcune specie 2. Capacitazione avviene solo in una sottopopolazione di spermatozoi (20-40%), ed i meccanismi coinvolti in tutti questi cambiamenti cellulari sono tutt'altro che chiare. E 'generalmente accettato che solo una sottopopolazione di spermatozoi capacitati subiscono la reazione acrosomiale (AR), quando esposti ad induttori fisiologici. L'AR è anche un evento di 2 +-regolamentato Ca richiesto per la fertilizzazione in tutte le specie che possiedono un acrosomiale (organello specializzato con le membrane esterne ed interne). Durante questo processo i fusibili membrana acrosomiale esterna con la membrana plasmatica dello spermatozoo, rilasciando enzimi idrolitici che permettono al spermatozoo di penetrare la matrice glico-proteico che circonda l'uovo (zona pellucida, o ZP). L'AR espone anche una nuova superficie spermatozoo fusogenica che interagisce conla membrana plasmatica uovo per la fusione finale di entrambi i gameti. Ci sono diversi ligandi cellulari che inducono l'AR, progesterone essendo uno dei più studiati tra loro.
In questo lavoro presentiamo quattro diverse tecniche che prevedono l'utilizzo di un colorante fluorescente Ca 2 +-sensibile da misurare [Ca 2 +] i cambiamenti di sperma umano innescata dal progesterone (tranne per citometria di flusso, in cui abbiamo misurato la [Ca 2 + ] i aumentare indotta durante il processo di capacitazione in vitro). In questo caso particolare abbiamo utilizzato Fluo-3 AM (Life Technologies, Grand Island, NY), un colorante membrana permeabile con una K d = 325 nM. In vitro abbiamo monitorato cambiamenti di fluorescenza in funzione del tempo con tre delle metodologie, e con la quarta tecnica abbiamo misurato valori di fluorescenza in un singolo punto nel tempo dato. Questi diversi approcci sono complementari, in quanto del tutto che forniscono risoluzione spaziale e temporaleoluzione sia a singola cella e livelli di popolazione di cellule.
Cella Popolazione o esperimenti Bulk
Tecniche di bulk sono ampiamente utilizzati non solo perché gli strumenti di cui hanno bisogno sono facilmente disponibili, ma anche perché sono semplici, ben consolidata, e consentono il calcolo della media delle informazioni a misurazioni effettuate su milioni di cellule in un singolo esperimento.
Tecnica # 1. Fluorometria convenzionale
Questa tecnica monitora le variazioni nella fluorescenza in funzione del tempo; gli esperimenti sono eseguite in provette di vetro con volumi di campione da 200 a 1.000 microlitri. Corretta miscelazione dei reagenti aggiunti richiede agitazione magnetica, e quindi la risoluzione temporale ottenuta è dell'ordine di secondi. L'intervallo di concentrazione cellulare tipica dei campioni analizzati è di 10 -10 8 5 cellule / ml.
Tecnica # 2. Arrestato fluorometria flusso
Tsua tecnica controlla anche cambiamenti nella fluorescenza in funzione del tempo, ma i reagenti vengono rapidamente miscelati tra loro (mediante pressione) in una cuvetta di registrazione contenente un volume di campione molto piccolo (che vanno 25-100 microlitri). Pertanto, omogeneizzazione dei reagenti è istantanea, consentendo un'elevata risoluzione temporale nell'ordine di millisecondi. Analisi delle tracce risultanti fluorescenza in funzione del tempo sono adatte per determinare le velocità di reazione, chiarire la complessità del meccanismo di reazione, ottenendo informazioni sulle intermedi di reazione breve durata, ecc L'intervallo di concentrazione cellulare comune dei campioni analizzati è 10 5 -10 7 cellule / ml.
Esperimenti Single Cell
Esperimenti bulk riportano il comportamento medio di un gran numero di cellule, tuttavia, una popolazione può frequentemente esibire proprietà eterogenee che sono trascurati durante tale tipo di misure. Tecniche di singola cella sono quindi utilizzati per integrare thinformazioni e ottenuto con esperimenti popolazioni cellulari.
Tecnica # 3. Citometria a Flusso
Nonostante l'importanza delle informazioni derivanti da misurazioni singola cellula, è importante analizzare un gran numero di celle per impedire l'estrapolazione erronea proprietà cellula-specifici per un'intera popolazione. Per questo motivo, le tecniche ad alta produttività sono favorite e il metodo più popolare è citometria di flusso, in cui 10.000 cellule per condizione sono convenzionalmente analizzati. Questo metodo consente l'analisi multi-parametrica di popolazioni eterogenee come è categorizza le cellule in base alla loro dimensione (forward scatter (FSC)), granularità (side scatter (SSC)) e di intensità di fluorescenza (etichettatura specifica con un anticorpo, marcatore viabilità, ecc) , fornendo così informazioni sulla distribuzione dei parametri 'per un gruppo di celle. Citometria a flusso fornisce immediata, piuttosto che le informazioni in funzione del tempo 8. In avanti e laterale valori scatter are anche utile per selezionare una porta che include celle ma discrimina detriti cellulari, polvere, ecc Per misure di fluorescenza, fluorescenza controlli negativi e positivi deve essere inclusa anche. Se viene usato più di un canale di fluorescenza, un processo noto come compensazione deve essere eseguita (per dettagli vedere http://www.bdbiosciences.com/resources/protocols/setting_compensation.jsp ). Compensazione consente sovrapposizione spettrale discriminazione tra fluorofori. Citometria di flusso consente anche la discriminazione di cellule morte, generalmente per mezzo di propidio ioduro colorazione.
Tecnica # 4. Singolo Imaging cellulare
Microscopia è un altro metodo comune per studiare il comportamento di singole cellule, ma è adatto per gli studi di tempo-dipendenti e fornisce anche la risoluzione spaziale. Un grave inconveniente è che l'analisi high-throughput è solo agli inizi in questo momento 9.
Protocollo
In questo articolo riportiamo l'utilizzo delle quattro summenzionate tecniche per misurare la [Ca 2 +] i cambiamenti nelle cellule di sperma umano. Abbiamo usato progesterone per innescare una risposta di Ca 2 +, in quanto è noto che questo steroide produce un transitorio [Ca 2 +] i in spermatozoi. In particolare, in sperma umano, progesterone attiva direttamente un canale Ca 2 + (ossia CatSper) espresso esclusivamente nella membrana plasmatica di cellule spermatiche 10,11. Abbiamo anche misurato riposo [Ca 2 +] i, prima e dopo la capacitazione dato che è anche ampiamente accettato che un aumento della [Ca 2 +] i si verifica durante la capacitazione. Per le tecniche che richiedono un controllo positivo è stato utilizzato un Ca 2 +-ionoforo ionomicina-per indurre massimale Ca 2 + uptake nella cellula, e quindi, la risposta fluorescenza massima, per il valore di fluorescenza minima, abbiamo usato Mn 2 + per saziare fluorescenza.
1. Sperm Preparazione del campione con il metodo del galleggiante (vedi figura 1)
Utilizzare solo eiaculato campioni (ottenuti con la masturbazione) le cui caratteristiche soddisfano i parametri stabiliti dalla nuova edizione del manuale di laboratorio dell'Organizzazione mondiale della sanità (disponibile presso http://whqlibdoc.who.int/publications/2010/9789241547789_eng.pdf ) per l'esame e trattamento dello sperma umano.
- Ottenere il campione di seme all'interno di un contenitore sterile e posto che (con tappo svitato) all'interno di un incubatore a 37 ° C e 5% di CO 2 / aria 95% durante 30 min. Questo passo è per esempio liquefazione.
- Posto aliquote da 500 microlitri del campione seminale liquefatto sul fondo di provette di vetro pulito (1,0 x 7,5 cm). Sono necessari circa otto provette per un campione medio formato (4 ml).
- Attentamente strato 1 ml di F-10 medio di Ham (su. pplemented con 2 mM CaCl 2 e 5 mg / ml di sieroalbumina bovina a promuovere capacitazione in vitro) in cima a ciascuna aliquota sperma (vedere Figura 1) TIP: toccare la parete del tubo con la punta della micropipetta, dispensare e dolcemente il mezzo sopra il campione. E 'fondamentale per farlo lentamente, come la miscelazione dei due strati (campione e medie) devono essere evitati.
- Appoggiarsi con attenzione i tubi ad un angolo di 30 ° circa. Ciò aumenterà superficie tra i due liquidi, migliorando così lo spostamento (swim-up) di cellule umane dal campione al mezzo durante l'incubazione.
- Posizionare il gruppo del affacciati provette all'interno un incubatore a 37 ° C e 5% CO 2 / aria 95% per 1 ora.
- Usando una micropipetta rimuovere delicatamente il 700 microlitri superiore di F-10 medio di HAM (che ora contiene spermatozoi mobili) da ciascuna provetta e piscina tutti i campioni raccolti in un unico tubo di vetro pulito (1.0 x 7.5 cm, per volumi più grandi utilizzano un 15 mlFalcon tube), evitando la formazione di bolle. Introdurre 10 ml di campione raggruppato sul vetro piano ottico di un Makler conteggio base della camera, e quindi posizionare il vetro di copertura (una volta che il coperchio è a posto, evitare di sollevare o coprire di nuovo per mantenere la diffusione uniforme del campione di sperma). Assicurati di evitare la formazione di bolle all'interno della camera in quanto ciò si tradurrebbe in una conta delle cellule impreciso.
- Osservare al microscopio composto (si consiglia l'uso di un obiettivo 20X). Il vetro di copertura del conteggio Camera Makler ha una grande piazza composto da 100 quadrati più piccoli (cioè un 10 per griglia 10). Contare le cellule in ogni striscia di 10 quadrati. Questo numero rappresenta la loro concentrazione in milioni di cellule / ml. Ripetere il conteggio in due ulteriori strisce di 10 quadrati, e calcolare la media dei tre conteggi. NOTA: se una camera di conteggio Makler (che è stato appositamente progettato per contare spermatozoi) non è disponibile, ogni camera di emocitometro può essere utilizzato.
- Regolare fina del campioneconcentrazione per l 1x10 7 cellule / ml in integrato F-10 medio di Ham. Quando necessario, incubare il campione a 37 ° C e 5% CO 2 / aria 95% per 5 ore a promuovere capacitazione.
2. Fluorescente Loading Dye per Ca 2 + Misure
Ci sono diversi coloranti fluorescenti disponibili per misurare intracellulare Ca 2 +; quello appropriato deve essere selezionato in base alla sua K d, e le sue lunghezze d'onda di eccitazione e di emissione (per misurazioni qualitative e quantitative, lunghezze d'onda di eccitazione e di emissione singole e doppie, rispettivamente, deve essere utilizzato) maggiori informazioni). Per la presente domanda qualitativa abbiamo utilizzato Fluo-3 AM, un colorante cellulare permeante con la K d = 325 nm, e di emissione singolo e lunghezze d'onda di eccitazione di 506/526 nm, rispettivamente 12.
- Preparare 50 ml di una 1 mM Fluo-03:00 soluzione madre sciogliendo il contenuto di una fiala 50 mcg colorante (MW = 1130 g / mol) in 44 ml di DMSO anidro.
- Usando una provetta da microcentrifuga 1,5 miscelare il volume di sospensione di spermatozoi (vedi quantità necessaria per ogni specifica tecnica di seguito) con abbastanza 1 mM Fluo-03:00 soluzione madre per ottenere una concentrazione finale di 2 mM Fluo-3:00 (cioè 1 ml di magazzino Fluo-3 AM viene aggiunto per ogni 500 ml di sospensione di spermatozoi).
- Incubare per 30 min a 37 ° C e al riparo dalla luce.
- Centrifugare la provetta a 750 xg per 5 minuti utilizzando una microcentrifuga, aspirare e scartare il surnatante e risospendere il pellet nel volume appropriato (vedi concentrazione richiesta per ogni specifica tecnica di seguito) di sperma umano medio (HSM; mM: 120 NaCl, 15 NaHCO 3 , 4 KCl, CaCl 2 1,8, 1 MgCl2, 10 HEPES, 10 Na lattato, 5 D-glucosio, 1 Na piruvato, pH = 7,4) NOTA: La formazione di una nuvola piuttosto che un pellet indica che le cellule sono in buone condizioni.
- Le cellule sono ora caricate con il colorante, rimangono vitali (mantenuto a 37 ° C e al riparo dalla luce) per circa due ore, e possono essere utilizzati in qualsiasi delle seguenti tecniche.
3. Tecnica # 1. Fluorometria convenzionale (Information media da una grande popolazione di cella)
Equipaggiamento: Per la nostra popolazione di spermatozoi [Ca 2 +] i misurazioni usiamo un SLM Aminco spettrofluorometro gestito dal software Olis (Bogart, GA, USA) con controllo agitatore magnetico (SIM Aminco), e accoppiato ad un LED blu (Luxeon Star LXHL- LB3C, da LUMILEDS) e un filtro di 465-505 nm passa-banda (Chroma Technology Corp.) per Fluo-03:00 eccitazione. Il LED è controllato da un alimentatore fuoriserie (700 mA). Emissione luminosa è misurata impostando la lunghezza d'onda di emissione (λ Em) a 525 nm su monocromatore del spettrofluorimetro.
- Posto 570 pl di HSM e 30 ml di sospensione cellulare spermatozoi (precedentemente caricato con Fluo-3 AM e risospese in HSM avere 1x10 8 cellule / ml) in una provetta di vetro a fondo piatto (ID 8 x 50 mm). Posizionare una ancoretta magnetica all'interno del tubo e inserire il tubo nella camera di lettura del spettrofluorimetro (preriscaldata a 37 ° C), agitare il campione durante tutto il tempo di acquisizione.
- Iniziare l'esperimento utilizzando il software del materiale (software Olis in questo caso) e procedere ad acquisire valori di fluorescenza ad una frequenza di 0,5 Hz durante 300 sec. Applicare i composti di prova desiderati mediante iniezione del volume appropriato da una soluzione madre (generalmente 100X più concentrata rispetto alla concentrazione finale desiderata) utilizzando un micro-siringa Hamilton come segue:
- Acquisire fluorescenza basale per 30 sec.
- Aggiungere 4 mM progesterone (Pg).
- A 100 sec aggiungere 20 pM ionomicina (come controllo positivo, per ottenere il massimo valore di fluorescenza).
- Eseguire un controllo negativo ripetendo i punti da 3.1 a 3.2.3, ma aggiungendo invece di Pg solo il solvente usato per scioglierlo (HSM con il 0,01% DMSO anidro).
- Esportare valori di intensità di fluorescenza prime per Microsoft Excel e normalizzare utilizzando la seguente equazione: (F/F0) - 1. Dove F è l'intensità di fluorescenza misurata in un dato tempo (t), e F0 è la fluorescenza basale medio scattata durante il primo 30 sec. Tracciare la serie totale di (F/F0) - 1 valori in funzione del tempo (Figura 2A). Misurare la differenza tra i valori di intensità di fluorescenza prima e dopo l'aggiunta dei composti di prova (Af), tracciare loro su un grafico a barre ed elaborare i dati applicando appropriati metodi di analisi statistica (Figura 2B).
4. Tecnica # 2. Arrestato Flow fluorometria (informazioni con alta risoluzione temporale da una grande popolazione di cella)
Equipaggiamento: intracellulare [Ca 2 +] i cambiamenti sono misurati con alta risoluzione temporale utilizzando un SFM-20 flusso interrotto mixer accoppiato ad un rapido sistema ottico MOS-200 cinetica, sia da strumenti scientifici biologico (Grenoble, Francia). Tutti i dati sono analizzati con software Bio-Kine32 dalla stessa azienda.
- Impostare le condizioni appropriate, in attrezzature; la sorgente di illuminazione deve essere messo in funzione almeno 15 minuti prima di iniziare l'esperimento; regolare filtri eccitazione e di emissione, regolare il fotomoltiplicatore ad un valore di tensione all'interno della gamma stabilita dal costruttore stopped-flow, e impostare la temperatura del bagno a 37 ° C.
- Riempire una delle siringhe dello strumento con 1 ml di Fluo-3 AM spermatozoi-caricati (1x10 7 cellule / ml) e la seconda siringa con 1 ml del composto da testare, sia HSM (controllo negativo),10 micron ionomicina (controllo positivo) o 10 micron Pg sciolto in HSM. Nota: In questo passaggio è fondamentale per evitare la formazione di bolle mentre disegna i liquidi nelle siringhe.
- Sollevare entrambi i pistoni dello strumento fino a toccare la punta degli stantuffi della siringa.
- Impostare la portata al valore minimo che fornirà una risposta misurabile in modo da minimizzare il danno cellulare. La portata che usiamo nel sistema SFM-20 è di 1 ml / sec 13.
- Impostare la frequenza (in questo caso 10 msec) e il tempo di campionamento totale (in questo caso 50 sec).
- Innescare la miscelazione dei reagenti. NOTA: Mentre uno grilletto singolo alla volta può essere effettuata manualmente, una serie di inneschi consecutivi di avviamento può essere pre-programmato pure.
- La traccia di fluorescenza grezza (unità arbitrarie) vs ora è visualizzata sullo schermo del computer.
- La miscelazione dei reagenti per sé genererà una traccia che non è una linea retta. Pertanto, al fine di ottenere l'effettivo [Ca2 +] cambio derivato da uno stimolo, la traccia di controllo ottenuta da cellule di miscelazione di fluido (controllo negativo) deve essere sottratto da ciascuno una delle tracce sperimentali. Analizzare i dati come richiesto; alcuni parametri cinetici possono essere ottenuti anche con il software di acquisizione Bio-Kine32. Tracce prima senza sottrazione sono mostrati in figura 1 supplementare per il confronto.
- Per cambiare il reagente nel composto siringa prova, pulirla accuratamente con acqua distillata. Poi riempire la siringa al suo volume massimo con acqua distillata, posizionarlo nella corrispondente pistone del fluorimetro stopped-flow e spingere l'acqua attraverso il meccanismo interno (l'acqua di risciacquo deve essere diretto al contenitore rifiuti). Ripetere questa operazione per altre due volte.
- Ripetere i passaggi 4,2-4,9, riempiendo la seconda siringa con il successivo composto di prova desiderata.
- Alla fine dell'esperimento, risciacquare l'intera attrezzatura con acqua distillata, allontanando completamente l'acqua daltubi interni.
5. Tecnica # 3. Citometria a Flusso (Informazioni Single cellulari ottenute da un gran numero di cellule)
Apparecchiatura: Questa tecnica permette la misurazione simultanea di più parametri in un unico momento nel tempo, ma a differenza delle tecniche precedenti, non misura le variazioni nel tempo, ma piuttosto fornisce i valori di parametro al momento della misurazione. Pertanto, invece di aggiungere Pg per innescare la risposta, in questo caso abbiamo misurato intracellulare Ca 2 + livelli in spermatozoi prima e dopo l'induzione capacitazione. Abbiamo usato un FACSCanto Cytometer (Becton Dickinson) e dati sono stati analizzati con il software FlowJo (Albero Stella 9.3.3).
- Preparare i campioni sperimentali in provette citometro ponendo 500 microlitri di sospensione cellulare (4x10 6 cellule / ml) per provetta in ciascuna condizione da testare (in questo caso, dieci condizioni; vedi Tabella 1). Raccogliere i dati di fluorescenza from 10.000 eventi per campione.
- Per impostare un esperimento di utilizzare il software attrezzature per:
- Creare una nuova: cartella, esperimento, campione e numero di tubi.
- Selezionare le impostazioni appropriate per il citometro Fluo-3 AM (usare coniugati con fluoresceina isotiocianato-filtro) e PI (utilizzare PI-ioduro di propidio-filtro).
- Eseguire i tubi di controllo senza macchia 1 e 2 nel citometro. Raccogliere FSC e SSC dati per verificare che siano appropriate impostazioni di soglia e per creare la porta corrispondente per discriminare i detriti dalle cellule.
- Per creare i controlli di compensazione, eseguire i seguenti campioni di controllo, la raccolta automatica dei dati e massimi di fluorescenza (PI e canali FITC) (Nota: questa attività è di solito eseguita da un tecnico del materiale):
- Cellule non colorati (tubi 1 e 2).
- Le cellule caricate con Fluo-3 AM (2 mM) (tubi 3 e 4).
- Le cellule morte (spermatozoi sospesi in 0,1% Triton X-100 in HSM per 10 minuti a temperatura ambiente)colorate con PI (1,2 mM PI; ovvero 0,25 ml di 2,4 mM PI viene aggiunta a 500 ml di sospensione di spermatozoi) durante 30 min a 37 ° C, al riparo dalla luce (provette 5 e 6).- Visualizzare dati registrati e selezionare la porta per le popolazioni desiderati.
- Regolare il cancello e selezionare "Applica" per tutti i controlli di compensazione.
- Selezionare esperimento> Impostazione di compensazione> calcolo di compensazione.
- Rinominare l'impostazione di compensazione e di collegamento e salvare.
- Eseguire tutte le provette sperimentali (in questo caso, i tubi 7-10). Alla fine, esportare tutti i dati per il software disponibile per l'analisi (vedi passo 5.6).
- Analizzare i risultati di ciascun esperimento utilizzando il software del dispositivo, l'FlowJo software disponibile in commercio o software Cytobank libero ( http://www.cytobank.org/ ).
6. Tecnica # 4. Imaging singola cella (singola Info cella ad alta risoluzione spaziale)
Apparecchiatura:. Imaging Custom-built set-up di imaging nostro set-up è composta da un invertito Nikon Diaphot 300 microscopio dotato di un regolatore di temperatura (Medical System Corp., Greenvale, NY), una Nikon Planapo 60X (1,4 NA immersione in olio) obiettivo. Illuminazione a fluorescenza è fornita da una Luxeon V Stella Lambertiano Ciano parte LED # LXHL-LE5C (Lumileds Lighting LLC, San Jose, CA) collegato a una casella di controllo stroboscopico custom-built. Il LED è stato montato in una assemblea FlashCube40 con specchio dicroico M40-DC400 (Rapp Opto elettronica, Amburgo, Germania) (larghezze di banda: eccitazione 450-490 nm, specchio dicroico 505 nm e di emissione 520-560 nm). Uscita a LED è stato sincronizzato con il Esposizione Out segnale di una fotocamera Snap freddo CCD tramite la casella di controllo per la produzione di un singolo flash di 2 msec durata per esposizione individuale. Il tempo di esposizione della fotocamera è stato fissato pari alla durata del flash (2 ms). Le immagini vengono raccolti ogni 250 msec (o possono essere regolati in base allela risoluzione temporale desiderata) utilizzando il software IQ (Andor Bioimmagini, Wilmington, NC).
- Preparare vetrini coprioggetto rotondi (diametro = 25 mm) applicando una goccia 5 ml di soluzione di poli-L-lisina (0.01% w / v) nella posizione centrale. Lasciate riposare per almeno 1 ora (si può asciugare). Utilizzando uno spruzzatore risciacquo area trattata con acqua prima dell'uso. Questa procedura consentirà di spermatozoi di aderire alla polizza di copertura dal loro capo, mentre il loro flagello può ancora muoversi.
- Preparare i composti da testare da loro dissoluzione in HSM secondo la Tabella 2. Composti vengono aggiunti in sequenza nella stessa camera di registrazione, avendo cura di aggiungere sempre lo stesso volume, e per regolare la concentrazione della soluzione madre prendendo in considerazione la diluizione avrà quando miscelato con il volume già presente nella camera (come indicato nella Tabella 2). Mantenere tutte le soluzioni di prova in un bagno a 37 ° C fino al loro impiego.
- Montare il vetrino all'interno del recording da camera e posto 10 ml di Fluo-3 celle AM-caricati (1 x 10 7 cellule / ml) nel centro. Coprire le cellule con 200 ml di pre-riscaldato HSM.
- Posizionare la camera sul palco del microscopio pre-riscaldato a 37 ° C, vedere le celle (con contrasto di fase) e selezionare un'area per l'imaging. E 'importante scegliere una zona dove la densità delle cellule è adeguato (vedere Figura 5A); troppe cellule rendono difficile l'analisi a causa di segnali sovrapposti NOTA: Le cellule devono essere saldamente fissati al vetrino per la loro testa, ma esibendo movimento flagellare, che conferma. vitalità.
- Acquisire immagini di fluorescenza in modalità live per regolare la messa a fuoco e la luminosità.
- Iniziare l'esperimento attivando il software di acquisizione immagini in serie temporali (IQ in questo caso). Tipicamente quattro immagini sono acquisite al secondo con l'illuminazione di 2 msec per immagine.
- Utilizzare una micropipetta per aggiungere attentamente (goccia a goccia) il composto in esame (Pg in questo caso), continuano imagacquisizione e come richiesto ed eseguire due aggiunte per passi nella stessa camera di: (1) 20 pM ionomicina per ottenere la massima fluorescenza e (2) 5 mM MnCl2 ottenere fluorescenza minima. Alternativamente, composti possono essere aggiunti utilizzando una camera di perfusione che presentano il vantaggio di consentire la rimozione stimolo, e la capacità di bagnare uniformemente le cellule con il composto. Allo stesso tempo, esso ha gli svantaggi che richiedono grandi quantità di soluzione e di controllo della temperatura rendendo più problematica.
- Ripetere l'acquisizione di una nuova camera con ogni composto di test desiderato.
- Eseguire l'analisi di immagini online utilizzando il software dell'apparecchiatura, o non in linea utilizzando il software IQ o immagine J freeware. Disegnare le regioni di interesse (ROI) in giro per ogni cella (o parte di cellule) e anche selezionare un'area cell-free (per il fondo automatico sottrazione dal software). Una serie di intensità-tempo di fluorescenza viene poi ottenuto per ciascun ROI e questi dati may essere esportati in Microsoft Excel per ulteriori analisi. Normalizziamo valori di intensità di fluorescenza utilizzando la seguente equazione: (F/F0) - 1. Dove F è l'intensità di fluorescenza misurata in un dato tempo (t) e F0 è la fluorescenza media scattata durante il primo 30 sec. Tracciare la serie totale di (F/F0) - 1 vs tempo (Figura 5B). I valori possono essere normalizzati utilizzando il valore di fluorescenza ottenuto dopo aggiunta ionomicina come 100%.
- Image Analysis può alternativamente essere eseguita usando Immagine J software libero.
Tecnica # 1. Fluorometria convenzionale
Progesterone è uno dei noti AR induttori e, come previsto, fa provocare un transitorio [Ca 2 +] i aumentare in sperma umano (mostrato in Figura 2). Aggiunta di un calcio ionoforo (ionomicina) induce il massimo [Ca 2 +] i, che non ritorna a livelli basali.
Tecnica # 2. Ssormontata fluorometria flusso
Il progesterone indotta [Ca 2 +] i è stata misurata aumento come prima (fluorometria convenzionale), ma questa volta con maggiore risoluzione temporale, in questo caso la frequenza di acquisizione è 0,1 Hz. Come mostrato in figura 3, sia progesterone (transitoria, linea rossa) e ionomicina (sostenuta, linea blu) hanno causato una molto veloce [Ca 2 +] i aumentare. L'assenza di un ritardo nella progesterone indotta [Ca 2 +] i aumento è in linea con i rapporti precedenti che suggeriscono che il progesterone attiva direttamente il Ca 2 + canali CatSper, senza segnalazione intermedio 10,14.
Tecnica # 3. Citometria a Flusso
[Ca 2 +] i è stata misurata in capacitati e non capacitati sperma umano. Come già riportato nel topo 15, sperma bovino 16 e sperma umano 17, abbiamo osservato anche un aumento [Cun 2 +] i in capacitati rispetto ai non-capacitati sperma umano. Baldi, et al. (1991) 17 riferito superiore basale [Ca 2 +] i in capacitati che in sperma umano non capacitati usando fluorometria convenzionale. In questo lavoro abbiamo utilizzato la citometria a flusso per misurare la [Ca 2 +] i, prima e dopo capacitazione in vitro. Citometria di flusso ci permette di vedere che la distribuzione dei valori di fluorescenza per spermatozoi capacitati (Figura 4D, traccia blu) viene spostata verso valori più elevati rispetto alle spermatozoi non capacitati (Figura 4D, traccia rossa). I valori di fluorescenza per ogni singola cellula possono essere osservate nelle dot plot bidimensionali mostrate in Figura 4G; importante, il segnale derivante da cellule morte (15% circa) può essere eliminato (Figura 4G, quadranti superiori).
Tecnica # 4. Singolo Imaging cellulare
Il progesterone induced [Ca 2 +] i cambiamenti è stata misurata in cellule spermatiche singoli. Il progesterone inoltre provoca un incremento in [Ca 2 +] i, sia nella testa dello spermatozoo e nella flagello. Come osservato negli esperimenti di popolazione, l'analisi singola cellula ha rivelato un transitorio e un aumento sostenuto per il progesterone e ionomicina, rispettivamente.
Risultati
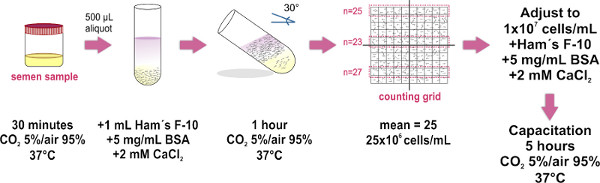
Figura 1. Rappresentazione schematica del protocollo sperimentale per la preparazione dei campioni di sperma con il metodo semi-sommerso. Le fasi principali per la separazione di spermatozoi mobili e per la regolazione della loro concentrazione sono illustrate. L'ultimo passaggio di incubazione viene eseguita solo q...
Discussione
Segnalazione intracellulare è di vitale importanza per la maggior parte delle attività cellulari; Ca 2 + è un messaggero ubiquitario che accompagna le cellule di mammiferi in tutto il loro intero ciclo di vita, dalla loro origine alla fecondazione, alla fine del loro ciclo di vita. In risposta a stimoli diversi, [Ca 2 +] i aumenta, oscilla e diminuisce con codificazione spazio-temporale, di conseguenza, diversi processi sono attivati, modulate o denuncia da parte di Ca 2 + messaggi co...
Divulgazioni
Non abbiamo nulla da rivelare.
Riconoscimenti
Gli autori ringraziano Jose Luis De la Vega, Erika Melchy e Dr. Takuya Nishigaki per l'assistenza tecnica. Questo lavoro è stato supportato dal Consejo Nacional de Ciencia y Tecnología (CONACYT-Messico) (99.333 e 128.566 per CT); Dirección General de Asuntos del personale Académico / Universidad Nacional Autónoma de México (IN202212-3 a CT).
Materiali
| Name | Company | Catalog Number | Comments |
| Ham's F-10 | Sigma-Aldrich | N-6013 | |
| Bovine Serum Albumin | Sigma-Aldrich | A-7906 | |
| Calcium Chloride Dihydrate approx. 99% | Sigma-Aldrich | C-3881 | |
| Makler Counting Chamber | SEFI Medical Insruments LTD | SEF-MAKL | |
| Fluo-3 AM | Invitrogen | F-1242 | 20 vials/50 μg each |
| Ionomycin | Alomone | I-700 | |
| Progesterone | Sigma-Aldrich | P0130 | |
| Sodium chloride | Sigma-Aldrich | S-9888 | Reagents for human sperm medium (HSM) |
| Potassium chloride | Sigma-Aldrich | P-3911 | Reagents for human sperm medium (HSM) |
| Sodium bicarbonate | JT Baker | 3506 | Reagents for human sperm medium (HSM) |
| Magnesium chloride | Sigma-Aldrich | M-2670 | Reagents for human sperm medium (HSM) |
| Calcium chloride anhydrous | Sigma-Aldrich | C-1016 | Reagents for human sperm medium (HSM) |
| HEPES | Sigma-Aldrich | H-3125 | Reagents for human sperm medium (HSM) |
| D-Glucose | JT Baker | 1906-01 | Reagents for human sperm medium (HSM) |
| Sodium pyruvate | Sigma-Aldrich | P-2256 | Reagents for human sperm medium (HSM) |
| Sodium L-lactate (aprox. 99%) | Sigma-Aldrich | L- 7022 | Reagents for human sperm medium (HSM) |
| Propidium Iodide | Invitrogen | L-7011 | Component B |
| Triton X-100 (t-Octylphenoxypolyethoxyethanol) | Sigma- Aldrich | X-100 | 2.4 mM solution in water |
| Round coverslip | VWR | 48380 080 | 25 mm diameter |
| Poly-L-lysine solution | Sigma-Aldrich | P8920 | |
| Manganese chloride | Sigma-Aldrich | M-3634 | |
| Attofluor; Cell Chamber, for microscopy | Life technologies | A-7816 | |
| Dimethyl Sulphoxide | Sigma-Aldrich | D2650 | 5x5 ml |
Riferimenti
- Bouschet, T., Henley, J. M. Calcium as an extracellular signalling molecule: perspectives on the Calcium Sensing Receptor in the brain. Comptes Rendus Biologies. 328, 691-700 (2005).
- Darszon, A., Nishigaki, T., Beltran, C., Trevino, C. L. Calcium channels in the development, maturation, and function of spermatozoa. Physiol. Rev. 91, 1305-1355 (2011).
- Esposito, G., et al. Mice deficient for soluble adenylyl cyclase are infertile because of a severe sperm-motility defect. Proc. Natl. Acad. Sci. U.S.A. 101, 2993-2998 (2004).
- Avenarius, M. R., et al. Human male infertility caused by mutations in the CATSPER1 channel protein. American Journal of Human Genetics. 84, 505-510 (2009).
- Carlson, A. E., et al. Pharmacological targeting of native CatSper channels reveals a required role in maintenance of sperm hyperactivation. PLoS ONE. 4, e6844 (2009).
- Brokaw, C. J. Calcium and flagellar response during the chemotaxis of bracken spermatozoids. J. Cell. Physiol. 83, 151-158 (1974).
- Visconti, P. E., et al. Capacitation of mouse spermatozoa. II. Protein tyrosine phosphorylation and capacitation are regulated by a cAMP-dependent pathway. Development. 121, 1139-1150 (1995).
- Svahn, H. A., van den Berg, A. Single cells or large populations. Lab on a chip. 7, 544-546 (2007).
- Pepperkok, R., Ellenberg, J. High-throughput fluorescence microscopy for systems biology. Nat. Rev. Mol. Cell Biol. 7, 690-696 (2006).
- Strunker, T., et al. The CatSper channel mediates progesterone-induced Ca2+ influx in human sperm. Nature. 471, 382-386 (2011).
- Lishko, P., et al. The Control of Male Fertility by Spermatozoan Ion Channels. Annu. Rev. Physiol. , (2011).
- Kao, J. P., Harootunian, A. T., Tsien, R. Y. Photochemically generated cytosolic calcium pulses and their detection by fluo-3. J. Biol. Chem. 264, 8179-8184 (1989).
- Kilic, F., et al. Caged progesterone: a new tool for studying rapid nongenomic actions of progesterone. Journal of the American Chemical Society. 131, 4027-4030 (2009).
- Lishko, P. V., Botchkina, I. L., Kirichok, Y. Progesterone activates the principal Ca2+ channel of human sperm. Nature. 471, 387-391 (2011).
- Xia, J., Ren, D. The BSA-induced Ca2+ influx during sperm capacitation is CATSPER channel-dependent. Reprod. Biol. Endocrinol. 7, 119 (2009).
- Galantino-Homer, H. L., Florman, H. M., Storey, B. T., Dobrinski, I., Kopf, G. S. Bovine sperm capacitation: assessment of phosphodiesterase activity and intracellular alkalinization on capacitation-associated protein tyrosine phosphorylation. Mol. Reprod. Dev. 67, 487-500 (2004).
- Baldi, E., et al. Intracellular calcium accumulation and responsiveness to progesterone in capacitating human spermatozoa. J. Androl. 12, 323-330 (1991).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon