Method Article
Betrieb einer Tischbioreaktor
In diesem Artikel
Zusammenfassung
Fermenter werden verwendet, um Kultur Ausbeute und Produktivität von biotechnisch hergestellten Zellen zu erhöhen. Nach dem Screening mehrere mikrobiellen oder tierischen Zellkultur-Kandidaten in Schüttelkolben, ist der nächste logische Schritt, um der ausgewählten Kultur Biomasse mit dem Fermenter zu erhöhen. Dieses Video zeigt den Aufbau und Betrieb einer typischen Tisch-Bioreaktor-System.
Zusammenfassung
Fermentationssysteme werden verwendet, um eine optimale Wachstumsbedingungen für viele verschiedene Arten von Zellkulturen zu schaffen. Die Fähigkeit von Fermentern lieferte sorgfältig zu steuern Temperatur, pH und gelöstem Sauerstoff-Konzentrationen, insbesondere sind sie für den Einsatz effizienter Groß Wachstum und Expression von Fermentationsprodukten. Dieses Video wird kurz die Vorteile der Fermenter über die Schüttelkolben. Es wird auch Schlüsselkomponenten einer typischen Tisch-Fermentationssystem identifizieren und grundlegende Anweisungen auf Setup des Schiffes und Kalibrierung der Sonden. Der Betrachter wird mit dem Sterilisationsverfahren vertraut gemacht und gezeigt, wie man das Wachstumsmedium in dem Behälter mit der Kultur zu beimpfen. Bedienkonzept, Sampling, und die Ernte wird auch demonstriert werden. Einfache Datenanalyse und Systembereinigung wird auch diskutiert werden.
Einleitung
Basisfermentationstechnologie ist eine Erweiterung der einfachen Schüttelkolben Technik für wachsende Kulturen. Es entstand aus dem Wunsch, Wachstumsumgebungen für lebende Kulturen in einer vollständigeren und quantitative Weise zu steuern. Batch-Kultur Schüttelkolben sind in der Regel durch ungenaue Kontrolle der Temperatur beschränkt. Temperaturverteilung in einem inkubiert Shaker oder warmen Zimmer ist sehr variabel, manchmal verirrt 5 ° C oder mehr von der vorgesehenen Sollwert. Da der Schüttelkolben wird normalerweise bei einer festen Geschwindigkeit bewegt, ist die Sauerstoffaufnahme und Gasaustausch beschränkt. Sobald das vorhandene Umgebungs Sauerstoff verbraucht ist, den meisten Kulturen nicht zu gedeihen. Es gibt keine pH-Kontrolle in Schüttelkolben. In vielen Fällen, wenn die Kultur nicht von Futter-Vorrat begrenzt ist, saure wird es zu dem Punkt der Schaden für die Kultur und die Atmung verlangsamt sich dramatisch. Die meisten Schüttelkolben-Kulturen werden auch als "Los", was bedeutet, dass sie nur einmal am oder nahe dem Beginn der Kulturen inoculatio speist laufenn. Nach der ersten Kohlenstoffquelle verbraucht ist, stoppt der Kultur wachsen. In einigen Fällen kann seinen Stoffwechsel zu verschieben und beginnen, andere Metaboliten in dem Kulturmedium verbraucht, manchmal, die die Eigenschaften der resultierenden Biomasse oder Protein. Schüttelkolben sind gewöhnlich einer Medienverdampfungsverlust in wärmeren Umgebungen Kultur, typischerweise 10% Volumen pro 24 Stunden bei 37 ° C. Dieser Verlust ändert die Dichte der Kultur und verbietet längere Zeitbetrieb des Systems. Schließlich kann der Benutzer stoßen Schäumen aus den Medien nach dem Rühren. Das Auftreten von Schaum in dem Kopfraum über der Kultur wird der Gasaustausch und weitere Knie Wachstum begrenzen.
Die Grundfermentationssystem ist entworfen, um alle diese Einschränkungen zu adressieren. Sorgfältige Temperatursteuerung in Fermentationsbehälter durch die Verwendung von Laufradbewegung und einem Heizmantel erreicht. Ein Sensor in das Gefäß und Regelung der Heizung und Kühlung dieser Jacke üblicherweise eingesetztErgebnisse der Temperaturregelung ± 0,1 º C um den Sollwert. Tisch-Fermenter der Regel bieten Kontrolle der pH-Wert über flüssige Reagenz zusätzlich durch eine Pumpe. Der pH-Wert wird kontinuierlich in dem Bemühen, die optimale Umgebung für das Zellwachstum zu halten überwacht. Eine ausreichende Belüftung ist durch die oben erwähnte Mischflügel oder durch die Beimischung von Luft oder Sauerstoff ergänzt Gas direkt in die Kultur eingetragen. Bei scherempfindlichen Kulturen, Sauerstoff ergänzt Gas der primäre Mechanismus für die Aufrechterhaltung der Sauerstoffgehalt in der Kultur. Messung von Sauerstoff in der Lösung wird gewöhnlich durch eine polarographische Sonde, die normalerweise nicht für die Verwendung in Schüttelkolben erhältlich erreicht. Es ist auch möglich, kontinuierlich oder periodisch hinzuzufügen Zufuhr zu dem Behälter, um das Wachstum in einer linearen oder exponentiellen Art und Weise aufrecht zu erhalten. Die Austrittsgaskondensator eine kalte Oberfläche für Dampf in den Abgasstrom zu kondensieren, wodurch die Erhaltung Kulturvolumen und Dichte. Periodische Zugabe von Antischaum Tensid betätigteneine Leitfähigkeitssonde in der Kultur, wodurch Schaum auf der Oberfläche und damit den Gasaustausch.
Das Schiff, mit allen Sonden, Armaturen, Laufräder, Ernte Rohre und Röhren, zusammengebaut und in einem Standard-Autoklaven sterilisiert. Sonde nach der endgültigen Kalibrierung und Stabilisierung der Betriebsumgebung wird die Kultur in den Behälter gegeben. Das System kann dann verwendet werden, um die Kultur in einer Weise, die mehr quantitative und genauer als mit einem Schüttelkolben Methode charakterisieren. Strenge Kontrolle von Temperatur, pH, Sauerstoffgehalt, Futterverbrauch, Flüssigkeitsverdampfung und Schaumniveaus alle zu einem viel höheren Biomasse und bessere Eiweißausbeute beitragen.
Protokoll
- Beginnen Sie den Betrieb mit Gefäß-Setup. Ein herkömmlicher Fermenter besteht aus folgenden Komponenten, die auf (Abbildung 1) installiert werden müssen:
- pH-Sonde - für die Messung von pH-Wert in der Live-Kultur. Kalibrieren Sonde vor der Installation und sterilisieren mit dem Gefäß. Installieren Sonde in der Kopfplatte.
- pO 2-Sonde - für die Messung von gelöstem Sauerstoff im Inneren des Schiffes während der Gärung. Installieren Sie in der Kopfplatte.
- Ernte-Rohr zum Abtasten der Kultur. Installieren Sie dieses höhenverstellbar Komponente in der Kopfplatte.
- Gasverteiler - liegt am Boden des Behälters und liefert Gas Infusion zu der Kultur. Haken Sprinkler bis zu der Gasquelle auf der Fermenter und montieren in der Kopfplatte.
- Laufrad Welle und Laufrad - das Laufrad rührt die Kultur und ist entscheidend für die Aufrechterhaltung der Einheitlichkeit Kultur im Behälter.
- Abgaskühler - zur Verminderung der Verdampfungsverlust im Behälter durch Abkühlen der Abgasweg.
- Reagenz Pumpleitungen zur pH-Kontrolle oder Futtermittel hinaus.
- Reinigen Sie das Schiff und Kopfplatte mit Wasser und Seife. Eine weiche Bürste zum Waschen des Gefäßes und Kopfplatte empfohlen. Bleich-oder Reinigungsmittel mit Chlor kann verwendet werden, um den Behälter zu reinigen.
- Wenn die Medien nicht hitzelabil sind, fügen Sie ihn der sauberen Gefäß. Fügen Sie nur, bis die maximale Arbeitsvolumen erreicht ist. In diesem Fall beträgt die maximale Arbeitsvolumen 3,3 L für einen 5 l Gesamtvolumen Gefäß.
- Montieren Sie das Gefäß Kopfplatte, so dass der O-Ring-Dichtung richtig sitzt.
- Installieren Sie den Abgaskondensator.
- Installieren Sie die Antischaumsonde in die 10 mm-Anschluss.
- Installieren Sie das Rohr in seine Ernte 10 mm Port. Setzen Sie ein Stück Schlauch auf der Oberseite der sie und klemmen Sie sie ab.
- Installieren Schläuche und einen 0,20 um Filter auf der Einlassspülung und dann klemmen Sie diese aus.
- Kalibrieren Sie die pH-Sonde:
- Sammeln Sie 2 Referenzpuffer in kleinen Bechern, einer Waschflasche und ein Ersatz wash Becher.
- Haken Sie die pH-Sonde bis in den Fermenter und drehen Sie den Fermenter auf.
- Blättern Sie auf den Parameter pH-Wert und mit der Menütaste, blättern Sie zu der Option "Cal" und drücken Sie "Enter".
- Wählen Sie '2 'für 2-Punkt-Kalibrierung.
- Waschen Sie die Sondenspitze und tauchen in der niedrigen Referenzpuffer. Der Wert auf dem Fermenter stabilisieren. Über die Tasten + und -, stellen Sie den angezeigten Wert auf den Wert der pH-Referenz-Puffer entsprechen. Sobald es aufhört zu blinken, drücken Sie "Enter".
- Waschen Sie die Sonde ab und legen Sie sie in der zweiten Referenzpuffer. Lassen Sie den Wert zu stabilisieren und dann über die Tastatur, um die angezeigte Wert entsprechen den hohen Referenzpufferwert. Drücken Sie "Enter" bestätigen.
- Waschen Sie die Sondenspitze aus und ziehen Sie es aus dem Fermenter. Setzen Sie die Schutzkappe für den Anschluss und installieren Sie es in der Kopfplatte.
- Öffnen Sie die pO 2 Sondenspitze und zu überprüfen, um sicherzustellen, dass esist genug, Elektrolyt, um die Spitze zu decken. Falls nicht, fügen Sie einige in den Vorratsbehälter und schließen Sie es wieder auf.
- Installieren Sie die pO 2-Sonde in der Kopfplatte und stellen Sie sicher, dass der Autoklav Kappe auf seiner elektrischen Verbindungen zu schützen. Es wird nach der Sterilisation zu kalibrieren.
- Besorgen Sie sich eine Flasche für Reagenz-Feed mit einem Tauchrohr und Luftfilter. In Pumpschlauch auf dem Tauchrohr-Anschluss und das andere Ende an den Einlass-Anschluss auf der Fermenter.
- Platz Schlauch auf alle unbenutzten Ports klemmen Schlauch aus.
- Installieren eines 0,45 &mgr; m auf der Abgaskühler. Dieser Filter sorgt dafür, dass das Schiff nicht im Autoklaven unter Druck.
- Prüfen, ob alle Rohre, die unter dem Niveau der Medien gehen werden abgeklemmt, Medien aus Coming Out zu verhindern.
- Setzen Sie das Schiff im Autoklaven für 25 bis 30 Minuten bei 121 ° C, Flüssigkeitskreislauf. Vorsicht: Wenn es herauskommt, wird es sehr heiß.
- Installieren Sie das Schiff auf der Fermenter Basis.
- Schließen Sie den pH-WertSondenkabel.
- Befestigen Sie die pO 2-Sonde Kabel.
- Haken Sie die Sprinkler bis zu der Gasmesser hinaus.
- Steril hinzufügen 1 M NaOH-Reagenz an der Flasche mit dem Tauchrohr und installieren Sie den Pumpenkopf auf der Grundpumpenkopf Spindel.
- Setzen Sie den Temperaturfühler im Schutzrohr auf der Kopfplatte. Stellen Sie sicher, dass es geht den ganzen Weg auf den Boden des Schutzrohres.
- Senken Sie den Arm auf die Agitation Gefäße Laufrad Kupplung.
- Stellen Sie sicher, dass der Fermenter ist.
- Prüfen Sie, ob Wasser vorhanden ist, um den Fermenter.
- Schalten Sie die Luftzufuhr in den Fermenter.
- Blättern Sie zu dem Temperaturparameter und die Temperatur auf 37 ° C Drücken Sie die Taste "Enter", um die Temperatursteuerung starten. Das Schiff wird in 15 min oder weniger erwärmen.
- Drehen, um den Gasstrom 1 Gefäßvolumen Medium pro Minute oder weniger. Für diese Einrichtung ist Gasstrom 3 l / min. Bubbles sollte unten angezeigt.
- Blättern Sie zu der Agitation parameter und auf 300 Umdrehungen pro Minute eingestellt. Drücken Sie die Eingabetaste, um auf der Agitation zu machen.
- Sobald die Temperatur 37 ° C erreicht, blättern Sie zu dem Parameter pH-Wert und legen Sie es auf 6,8. Drehen Sie den pH-Kontrolle durch Drücken der Taste "Enter".
- Eingestellt Rühren zu der maximalen Geschwindigkeit von 1000 rpm für den Lauf.
- Stellen Sie sicher, dass die pO 2-Sonde richtig polarisiert, um die richtigen Werte anzeigen. Nach 2 Stunden, blättern Sie zu dem Parameter pO 2 und verwenden Sie die "Menü"-Taste, um das "Kalibrieren Funktion 'wählen und wählen Sie die 1-Punkt-Kalibrierung.
- Nach 15 Minuten, verwenden Sie die Cursor, um den Wert auf 100 gesetzt, und drücken Sie "Enter". Dies wird pO 2 zu kalibrieren.
- Blättern Sie zu Unruhe und zu 300 Umdrehungen pro Minute eingestellt.
- Mit der "Menü"-Taste, schalten Sie den 'Cascade' auf 'on' in der Unruhe-Menü. Dadurch wird die Geschwindigkeit der Bewegung in dem Bemühen, zerhacken Luftblasen und zwingen mehr Sauerstoff in Lösung als Wachstums Nachfrage zunimmt.
- Blättern Sie zu dem Parameter pO 2 und setzen Sie den Wert auf 30 erhöht. Drücken Sie die Taste 'Enter' pO 2 zu starten.
- Startet die Steuerungssoftware auf dem PC.
- Sobald die Sonden kalibriert sind, ist Rühren stabil bei 300 Upm, die Temperatur bei 37 ° C und pH-Wert in der Nähe von 6,8, ist es Zeit, zu beimpfen. Mit Alkohol, sterilisieren, den Hafen, die zur Impfung verwendet wird.
- Zeichnen Sie den Impfstoff in eine Spritze und fügen Sie es in den sterilisierten Port. Schließen Sie den Anschluss.
- Markieren Sie die Zeit der Impfung in einem Logbuch.
- Es ist auch wichtig, um eine Probe zu nehmen Sterilisationszeit. Sterilisieren Sie das Ende der Ernte Rohr Rohr mit Alkohol.
- Öffnen Sie die Klammer für den Ernte-Anschluss und mit einer Spritze, um eine Probe zu ziehen. Diese erste Probe wird in der Regel verworfen werden, da es in der Rohr gesessen.
- Verwenden Sie eine andere Spritze, um eine weitere Probe zu ziehen.
- Mit einem dritten Spritze, drücken Sie wieder Luft durch das Rohr, so viel Totvolumen entfernenvon der Linie und klemmen Sie die Zeile aus.
- Bestimmen Sie die Zelldichte und pH-Wert und die Werte notieren. Mit mikrobiellen Kulturen, ist es sinnvoll, Werte einloggen jede Stunde. Interval ist Kultur abhängig.
- Ernte-Methode hängt von der Absicht, für die Kultur nach dem Wachstum abgeschlossen ist. In diesem Fall probieren Sie die Kultur eine letzte Frist bis zum Endpunkt Werte für die Zelldichte und pH-Wert möglich oder die Messung von Zellfeuchtmasse zu erhalten. Öffnen Sie die Kopfplatte der Inhalte in einem ausgewiesenen "Kill-Tank" mit Bleichmittel oder andere antimikrobielle Mittel angeordnet ist.
Ergebnisse
Der Bioreaktor kann mit oder ohne die IRIS-Software ausgeführt werden. Allerdings, um Daten zu erfassen, ist es am besten, um die Software zu nutzen. Vor der Zugabe von Bakterien, muss der pH-und Sauerstoffsensoren kalibriert werden, das Laufrad und die Drehzahlsolltemperatur einzustellen. In Fig. 2 ist die Datenausgabe für einen Bioreaktor Lauf dargestellt. Die Temperatur wurde auf 30 º C, die Rührgeschwindigkeit auf 200 Upm eingestellt. Die Parameter können für jeden Versuch unterschiedlich sein, aber vor der Zugabe der Bakterien, sollte das System im Gleichgewichtszustand sein. In Fig. 3 ist die Änderung der Sauerstoffkonzentration mit der Zugabe der Bakterienkultur gezeigt. Die Sollwerte für diesen Versuch sind 37 ° C, Rührer bei 200 U, O 2 bei 70%. Zum Zeitpunkt 19.20 Uhr, die Förderpumpe liefert die bakterielle Keimkultur bei einer OD von 0,1 was ein unmittelbar in der O 2-Niveau sinken. Der Bioreaktor reagiert auf die Veränderung O 2-Pegel mit einem Anstieg in der Luftströmung und Laufraddrehzahl. Ter Sollwerte für die Erhöhungen in der Kaskade (Schritt 35) gesetzt. Der Reaktor pH wurde in Echtzeit überwacht, wobei der pH-Wert abnimmt, dann zunimmt, wenn der pH Linie Schwankung im Laufe der Zeit (Fig. 4) gezeigt. Der gesamte Durchlauf analysiert werden und Parameter für nachfolgende Experimente eingestellt.

Fig. 1 ist. Tischbioreaktor mit allen beschriftet und miteinander verbundenen Teilen. Dieses Bild zeigt den Rührkessel zu Beginn des Laufs. Die Teile des Reaktors sind beschriftet und sind die Sensoren, Laufrad, Temperaturanzeige, Futter-und Probenflaschen, Abgas Hafen, Luftdruckmesser, Wärmemantel, Kondensator Turm und Bedienfeld.

2. Screen-Bild der Bioreaktor sofTWARE zu Beginn der Flucht. Zu Beginn der Rührkessel Lauf wurde die Temperatur auf 30 ° C (gelbe Linie) gesetzt, Laufrad Geschwindigkeit auf 200 Umdrehungen pro Minute (rote Linie), pH-Wert bei 6,5 (grüne Linie), und pO 2 bei 57,2% (blaue Linie). Klicken Sie hier, um eine größere Abbildung anzuzeigen .
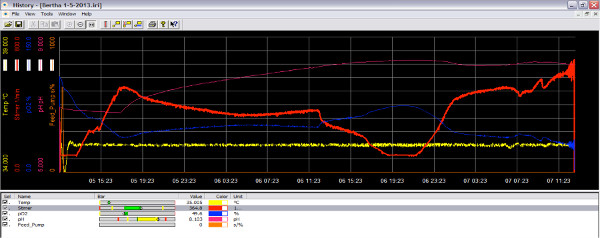
3. Schirmbild des Bioreaktors Software während der Lauf Sauerstoff abnimmt. Wenn die Kultur in der aktiven Wachstumsphase verbraucht Sauerstoff und die Menge an Sauerstoff in dem Reaktor verringert wird (blaue Linie). Durch die Erhöhung der Laufraddrehzahl, mehr Sauerstoff in der Kultur (rote Linie) hinzugefügt werden. Klicken Sie hier, um eine größere Abbildung anzuzeigen .

4. Screen-Bild von Bioreaktor-Software, die pH-Änderung über die Zeit. Den pH-Wert der Kultur wird kontinuierlich überwacht und im Laufe der Zeit abnimmt, wie Milchsäure produziert wird und steigt dann als Basis mit dem Bioreaktor (blaue Linie) aufgenommen. Klicken Sie hier, um eine größere Abbildung anzuzeigen .
Diskussion
Rührkessel-Bioreaktoren sind der Standard in der Biotechnologie-Industrie und haben seit über 40 Jahren 1 verwendet. Die kleine Rührkessel wurde für Scale-up, Scale-Down, Stammoptimierung, Charakterisierung und Prozessentwicklung wichtig. Es kann auch eine wichtige Rolle bei der Entwicklung von individualisierten Medizin 2. Der kleine Bioreaktor am ähnlichsten ist in-situ-Bedingungen für das Zellwachstum, weil sie überwacht und in einem Durchlauf zu optimieren. Meistens werden die ersten Experimente mit Schüttelkolben durchgeführt, aber die Bedingungen in der kleinen Bioreaktor erheblich vom Schüttelkolben. In einem Experiment haben wir festgestellt, dass die Bedingungen für ein optimales Wachstum von E. coli und Herstellung des grün fluoreszierenden Proteins (GFP) in Schüttelkolben nicht in den gerührten Tank (unveröffentlichte Daten) zu übersetzen.
Andere Methoden der wachsenden Zellen in großem Maßstab sind Rollerflaschen, single use Schaukel Plattform Bioreaktoren 3 und größeren einzelnen Bioreaktoren mit einem Arbeitsvolumen von 50 bis 5.000 L. Jede Methode bietet Herausforderungen für Scale-up, aber hat einen Platz in der Produktion gefunden. Die einzelne Verwendung Schwingplattform Bioreaktor ist ähnlich zu dem gerührten Tank und liefert eine geregelte Umgebung. Es unterscheidet sich von dem Rührbehälter in diesem Mischen erfolgt durch eine Schwenkbewegung um Wellen zu Zelle Absetzen zu verhindern und Oxygenierung zu erzeugen. Die Hydrodynamik für dieses Verfahren unterscheidet sich von dem Rührbehälter und maximales Volumen auf 1000 L. Die Unterschiede können Zellwachstum und die Produktproduktion beeinflussen beschränkt. Andere Einzelnutzung Systeme kombinieren die Rührkessel mit dem Einweg-Reaktor, eine Plattform bieten, mit einem Minimum an Infrastruktur und damit verbundenen Aufwand und die Fähigkeit für Hochdurchsatz-Bioprozess-4.
Neue Benutzer von Tischbioreaktoren können Probleme Bestimmung anfänglichen Sollwerte für pH, pO 2 und Temperatur habenTemperatur, aber veröffentlichte Forschungs können diese Informationen 5, 6, 7, 8, 9 verwiesen werden. Mit Bakterienkulturen, insbesondere empfiehlt es sich, unter Rühren bei der gleichen Geschwindigkeit wie die Schüttelkolben und der Temperatur bei der gleichen Sollwert startet. Kultur pH-Wert der letzten Schüttelkolben Läufe können auch als Ausgangspunkt verwendet werden. Einstellung der pO 2-Wert ist schwieriger und wird in der Regel empirisch ermittelt. , Beginnend mit 50% pO 2 ist jedoch eine empfohlene Ausgangspunkt.
Offenlegungen
Autor A. Magno ist ein Mitarbeiter der ATR Biotech, die Reagenzien und Instrumente in diesem Artikel verwendet produziert.
Danksagungen
Dieses Projekt war Teil durch Unterstützung der Johns Hopkins University, Büro des Provost durch die Gateway-Science Initiative.
Materialien
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | |
| LB broth | Sigma | L3022 | |
| ampicillin | Sigma | A1593-25G | |
| LB broth | Sigma | L3022 | |
| antifoam 204 | Sigma | A8311 | |
| 1 M Sodium Hydroxide | Sigma | 38215-1EA-R | |
| Reference Buffer, pH 4.00 | Sigma | B5020 | |
| Reference Buffer, pH 7.00 | Sigma | B4770 | |
| pO2 probe electrolyte | Broadley James | AS-3140-C30-0025 | |
| 0.45 micron filter | Cole Parmer | EW-02915-22 | |
| 0.22 micron filter | Cole Parmer | EW-29950-40 | |
| Luer Lock syringe, 10 mL | Cole Parmer | EW-07940-12 | |
| Minifors Bioreactor | Infors HT | B-Pack 5.0 | |
| Air Admiral air pump | Cole Parmer | EW-79202-00 | |
| 1175 PD Chilling circulator | VWR | 13721-204 |
Referenzen
- Shuler, M., Kargi, F. . Bioprocess Engineering Basic Concepts. , (2002).
- Hambor, J. Bioreactor Design and Bioprocess Controls for Industrialized Cell Processing. BioProcess International. 10 (6), 22-33 (2012).
- Julien, C., Whitford, W. Bioreactor, Monitoring, Modeling and Simulation. BioProcess International. 5 (01), S10-S17 (2007).
- Fike, R. Nutrient Supplementation Strategies for Biopharmaceutical Production. Part 1: Identifying a Formulation. BioProcess International. 7 (11), 46-52 (2009).
- Jana, S., Deb, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Appl Microbiol Biotechnol. 67, 289-298 (2005).
- Wang, Z., Ly, M., Zhang, F., Zhong, W., Suen, A., Hickey, A. M., Dordick, J. S., Linhardt, R. J. E. coli K5 fermentation and the preparation of heparosan, a bioengineered heparin precursor. Biotechnol. Bioeng. 107, 964-973 (2010).
- Baltz, R. H., Demain, A. L., Davies, J. E. . Manual of Industrial Microbiology and Biotechnology. , (2010).
- Infors, H. T. . Minifors operating Manual and user guide. , .
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten