Method Article
Il funzionamento di un bioreattore da banco
In questo articolo
Riepilogo
Fermentatori sono utilizzati per aumentare la cultura resa e produttività delle cellule bioingegneria. Dopo la proiezione più microbiche o animali candidati colture di cellule in fiasche di scuotimento, il prossimo passo logico è quello di aumentare la biomassa della coltura selezionata con il fermentatore. Questo video dimostra l'installazione e il funzionamento di un tipico sistema di bioreattore da banco.
Abstract
Sistemi di fermentazione sono utilizzati per fornire un ambiente di crescita ottimale per diversi tipi di colture cellulari. La possibilità offerta dalla fermentatori per controllare accuratamente la temperatura, il pH e la concentrazione di ossigeno disciolto in particolare rende indispensabile efficiente crescita su grande scala e l'espressione di prodotti di fermentazione. Questo video descrivere brevemente i vantaggi del fermentatore sul in pallone. Sarà inoltre identificare i componenti fondamentali di un tipico sistema di fermentazione da banco e dare istruzioni di base sulla configurazione della nave e la taratura delle sue sonde. Lo spettatore sarà familiarizzato con il processo di sterilizzazione e mostrato come inoculare il terreno di coltura in vaso con la cultura. Saranno inoltre dimostrato concetti di base di funzionamento, il campionamento e raccolta. Saranno inoltre discussi l'analisi dei dati semplice e la pulizia del sistema.
Introduzione
Tecnologia di base fermentazione è un'estensione della tecnica semplice in pallone per la coltivazione di colture. Essa nasce dalla volontà di controllare gli ambienti di crescita per le colture vive in modo più completo e quantitativa. Batch fiaschi cultura scuotimento sono in genere limitati dal controllo impreciso della temperatura. Uniformità di temperatura in un agitatore incubate o camera calda è molto variabile, a volte allontanandosi 5 ° C o più dal valore di riferimento previsto. Poiché l'in pallone viene normalmente agitata ad una velocità fissa, scambio consumo di ossigeno e gas è limitata. Una volta che l'ossigeno ambiente disponibile è esaurito, la maggior parte delle culture non riescono a prosperare. Non vi è alcun controllo del pH in flaconi di scuotimento. In molti casi, se la cultura non è limitata dalla scorta di alimentazione, diventa acida al punto di danno alla cultura e la respirazione rallenta drasticamente. La maggior parte delle culture del dibattimento in pallone vengono eseguiti anche come un 'lotto', il che significa che sono alimentati solo una volta o vicino all'inizio delle culture inoculation. Dopo questa fonte di carbonio iniziale è consumato, la cultura smette di crescere. In alcuni casi il suo metabolismo può spostarsi e cominciare a consumare altri metaboliti nel brodo di coltura, a volte cambiando le caratteristiche della biomassa risultante o proteine. Fiaschi di scuotimento sono di solito soggetti a perdite per evaporazione media in ambienti di coltura più caldi, in genere il 10% del volume per 24 ore a 37 ° C. Questa perdita, la densità della cultura e proibisce il funzionamento a lungo termine del sistema. Infine, l'utente può verificare la formazione di schiuma dal supporto dopo agitazione. La presenza di schiuma nello spazio di testa al di sopra della cultura limiterà lo scambio di gas e di ulteriore crescita ginocchio.
Il sistema di fermentazione di base è progettato per soddisfare tutte queste limitazioni. Controllo della temperatura attenta è raggiunto in vasi di fermentazione con l'uso di girante agitazione e una camicia di riscaldamento. Un sensore inserito nel recipiente e retroazione di controllo di riscaldamento e raffreddamento di questa giacca solitorisultati nel controllo della temperatura ± 0.1 ° C intorno al setpoint. Fermentatori da banco in genere forniscono il controllo del pH tramite aggiunta del reagente liquido attraverso una pompa. Il valore del pH è costantemente monitorato nel tentativo di mantenere la ottimale per la crescita delle cellule. Aerazione corretta è mantenuta dalla girante miscelazione o la suddetta dall'infusione di aria o gas ossigeno integrato direttamente nella cultura. Con colture sensibili al taglio, gas ossigeno integrato è il meccanismo principale per il mantenimento del livello di ossigeno nella cultura. Misura di ossigeno in soluzione si ottiene di solito da una sonda polarografica che non è normalmente disponibile per l'uso in flaconi di scuotimento. È anche possibile aggiungere continuamente o periodicamente mangime al recipiente per mantenere la crescita in modo lineare o esponenziale. Il condensatore di gas in uscita fornisce una superficie fredda per il vapore nel flusso di gas di scarico di condensare, preservando in tal modo il volume cultura e densità. Aggiunta periodica di antischiuma tensioattivo è azionatoda una sonda di conducibilità nella cultura, riducendo schiuma sulla superficie e consentendo lo scambio di gas.
La nave, con tutte le sonde, raccordi, giranti, tubi di raccolta, e tubi, viene assemblato e sterilizzato in autoclave standard. Dopo calibrazioni di sonde finale e stabilizzazione di ambiente operativo, la coltura è aggiunto al recipiente. Il sistema può quindi essere utilizzato per caratterizzare la cultura in un modo che è più quantitativa e precisa che con un metodo in pallone. Stretto controllo della temperatura, pH, contenuto di ossigeno, consumo di mangime, liquido evaporazione, e livelli di schiuma contribuiscono a una biomassa molto elevata e quindi un rendimento proteina.
Protocollo
- Inizia il funzionamento con l'installazione nave. Un fermentatore convenzionale ha i seguenti componenti che devono essere installati (Figura 1):
- pH sonda - per la misura del pH nella cultura vivo. Calibrazione del tastatore prima dell'installazione e sterilizzare con la nave. Installare sonda nella piastra di testa.
- sonda pO 2 - per la misurazione del contenuto di ossigeno disciolto all'interno del recipiente durante la fermentazione. Installa nella piastra di testa.
- Tubo di raccolta per il campionamento della cultura. Installare questo componente regolabili in altezza con la piastra di testa.
- Scambiatore gas - risiede nella parte inferiore del recipiente e fornisce infusione gas alla cultura. Agganciare irroratore fino alla sorgente di gas in fermentatore e montare nella piastra di testa.
- Albero girante e - la girante agita la cultura ed è fondamentale per il mantenimento della uniformità della cultura nel vaso.
- Condensatore dei gas di scarico - per arginare la perdita per evaporazione nel serbatoio raffreddando il percorso dei gas di scarico.
- Linee pompa del reagente per il controllo del pH o aggiunta mangimi.
- Pulire il vaso e la piastra di testa con acqua e sapone. Una spazzola morbida è raccomandato per il lavaggio della nave e piastra di testa. Candeggina o detergenti con cloro non possono essere utilizzati per pulire il vaso.
- Se il supporto non è termolabile, aggiungerlo alla nave pulito. Aggiungere solo fino al raggiungimento del volume massimo di lavoro. In questo caso, il volume di lavoro massimo è di 3,3 L per un volume totale del vaso 5 L.
- Montare la piastra di testa imbarcazione, assicurandosi che la guarnizione O-ring sia posizionato correttamente.
- Installare il condensatore gas di scarico.
- Installare la sonda antischiuma nella sua porta 10 mm.
- Installare il tubo di raccolta nella propria porta 10 mm. Mettere un pezzo di tubo sulla parte superiore di esso e bloccarlo off.
- Installare i tubi ed un filtro 0.20 micron in ingresso sparge quindi bloccare questa via.
- Calibrare la sonda pH:
- Raccogliere 2 buffer di riferimento in piccoli bicchieri, una bottiglia di lavaggio e un wa ricambiobecher sh.
- Agganciare il pH sonda fino al fermentatore e girare il fermentatore su.
- Scorrere fino al parametro pH e tramite il tasto menu, scorrere l'opzione 'Cal', e premere 'Invio'.
- Selezionare '2 'per la taratura a 2 punti.
- Lavare la punta della sonda e immergerlo nel buffer di riferimento basso. Il valore sul fermentatore si stabilizzerà. Utilizzando i tasti + e - tasti, regolare il valore visualizzato corrisponda al valore del buffer di riferimento pH. Una volta che si smette di lampeggiare, premere il tasto 'Invio'.
- Lavare la sonda e inserirla nel secondo buffer di riferimento. Lasciare che il valore si stabilizzi e quindi utilizzare la tastiera per rendere il valore visualizzato corrisponde l'alto valore del buffer di riferimento. Premere 'Invio' per confermare.
- Lavare la punta della sonda spento e scollegarlo dal fermentatore. Mettere il cappuccio protettivo sulla connessione e installarlo in piastra di testa.
- Aprire la punta della sonda pO 2 e controllare che non vibasta elettrolita a coprire la punta. In caso contrario, aggiungere un po 'al serbatoio e chiudere il backup.
- Installare la sonda pO 2 nella piastra di testa e assicurarsi che il tappo autoclave è messo su di proteggere i suoi collegamenti elettrici. Sarà tarato dopo la sterilizzazione.
- Ottenere una bottiglia per l'alimentazione reagente con un tubo tuffo e filtro aria. Aggiungi il tubo della pompa per il porto pescante e collegare l'altra estremità alla porta di ingresso del fermentatore.
- Posizionare il tubo su tutte le porte inutilizzate poi morsetto del tubo off.
- Installare un filtro da 0,45 micron sul condensatore gas di scarico. Questo filtro garantisce che la nave non pressurizzare in autoclave.
- Verificare che tutti i tubi che vanno sotto il livello del supporto vengono bloccati off per evitare che i supporti di uscire.
- Mettere il recipiente in autoclave per 25-30 minuti a 121 ° C, ciclo di liquido. Attenzione: Quando si esce sarà molto caldo.
- Installare la nave sulla base fermentatore.
- Collegare il pHsonda cavo.
- Collegare il cavo della sonda pO 2.
- Agganciare il sparger fino al rotametro aggiunta gas.
- Sterilmente aggiungere 1 M NaOH reagente alla bottiglia con il pescante e installare la testa della pompa sulla testa mandrino pompa base.
- Mettere il sensore di temperatura nel pozzetto sulla piastra di testa. Assicurarsi che va tutto il modo al fondo del pozzetto.
- Abbassare il braccio agitazione sul giunto della girante navi.
- Assicurarsi che il fermentatore è acceso.
- Verificare che l'acqua è a disposizione del fermentatore.
- Accendere l'alimentazione dell'aria al fermentatore.
- Scorrere fino al parametro temperatura e impostare la temperatura a 37 ° C. Premere il tasto 'Invio' per avviare il controllo della temperatura. La nave si riscalda in 15 min o meno.
- Ruotare il flusso di gas di 1 volume del serbatoio di supporti per minuto o meno. Per questa configurazione, il flusso di gas è 3 L / min. Bubbles dovrebbero apparire in fondo.
- Scorrere fino al agitazione parameter e impostare a 300 rpm. Premere 'Enter' per attivare l'agitazione.
- Una volta che la temperatura ha raggiunto 37 ° C, scorrere fino al parametro pH e impostarlo a 6,8. Girare il controllo del pH premendo il tasto 'Invio'.
- Impostare agitazione alla velocità massima di 1.000 rpm per la corsa.
- Assicurarsi che la sonda pO 2 è polarizzato correttamente per visualizzare i valori corretti. Dopo 2 ore, scorrere fino al parametro pO 2 e usare il tasto 'Menu' per selezionare il 'Calibrate Function' e selezionare la taratura 1 punto.
- Dopo 15 minuti, utilizzare i cursori per impostare il valore a 100 e premere 'Invio'. Questo calibrare pO 2.
- Scorrere fino agitazione e impostare a 300 rpm.
- Utilizzando il tasto 'Menu', girare la 'cascata' su 'on' nel menu agitazione. Ciò consentirà di aumentare la velocità di agitazione nel tentativo di tritare bolle d'aria e forzare più ossigeno nella soluzione l'aumento della domanda di crescita.
- Scorrere fino al parametro pO 2 e impostare il valore a 30. Premere il tasto 'Invio' per avviare pO 2.
- Avviare il pacchetto software di controllo sul PC.
- Una volta che le sonde sono tarate, è stabile agitazione a 300 rpm, temperatura a 37 ° C e pH sia prossimo a 6,8, è tempo di inoculare. Uso di alcol, sterilizzare la porta che verrà utilizzata per l'inoculazione.
- Disegnare l'inoculo in una siringa e inserirlo nella porta sterilizzato. Chiudere la porta.
- Segnare il tempo di inoculazione in un registro.
- E 'anche importante prendere un campione al tempo di sterilizzazione. Sterilizzare l'estremità del tubo tubo di raccolta con l'alcol.
- Aprire il morsetto copre la porta raccolto e utilizzare una siringa per estrarre un campione. Questo primo campione è solitamente scartata poiché è stato seduto nel tubo.
- Utilizzare un altro siringa per tirare un altro campione.
- Con un terzo siringa, spingere l'aria indietro attraverso il tubo per rimuovere quanto più volume mortodalla linea ed attaccarla off line.
- Determinare la densità cellulare e pH e registrare i valori. Con colture microbiche, è utile per registrare i valori ogni ora. Interval è cultura dipendente.
- Metodologia raccolto dipende dal intenti per la coltura dopo la crescita è completata. In questo caso, il campione di cultura un tempo finale di ricevere il finecorsa per densità cellulare e possibile pH o misura di peso cella umida. Aprire la piastra di testa smaltiti dei contenuti in un designato "serbatoio kill" con candeggina o altri agenti antimicrobici.
Risultati
Il bioreattore può essere eseguito con o senza il software IRIS. Tuttavia, per acquisire i dati, si consiglia di utilizzare il software. Prima aggiunta di batteri, i sensori di pH e ossigeno devono essere calibrati, il set di velocità girante e la temperatura impostata. In figura 2, l'uscita dati per una corsa bioreattore è presentato. La temperatura è stata regolata a 30 ° C, la velocità della girante a 200 rpm. I parametri possono essere diverse per ogni esperimento, ma prima aggiunta di batteri, il sistema dovrebbe essere a regime. In Figura 3 viene mostrata la variazione della concentrazione di ossigeno con l'aggiunta della coltura batterica. I set-point per questo esperimento sono 37 ° C, agitatore a 200 rpm, O 2 al 70%. Al tempo 19:20, la pompa di alimentazione batte coltura batterica seme in un OD di 0,1 causando un calo immediatamente a livello O 2. Il bioreattore risponde ai mutamenti O 2 livello con un aumento della velocità del flusso d'aria e girante. Tegli set-point per gli aumenti sono fissati in cascata (passo 35). Il pH del reattore è stata monitorata in tempo reale, con il pH decrescente poi crescente come dimostrato dalla fluttuazione linea pH nel tempo (Figura 4). L'intera corsa può essere analizzato e parametri rettificato per esperimenti successivi.

Figura 1. Bioreattore da banco con tutte le parti etichettati e collegate. Questa figura mostra il reattore serbatoio agitato all'inizio di una corsa. Le parti del reattore vengono etichettati e comprendono i sensori, girante, indicatore temperatura, bottiglie di mangimi e di campionamento, di scarico, manometro, camicia di riscaldamento, condensatore torre, e pannello di controllo.

Figura 2. L'immagine dello schermo del bioreattore software all'inizio del periodo. All'inizio di una corsa serbatoio agitato, la temperatura è stata regolata a 30 ° C (linea gialla), velocità girante a 200 rpm (linea rossa), pH 6,5 (linea verde), e pO 2 al 57,2% (linea blu). Clicca qui per ingrandire la figura .
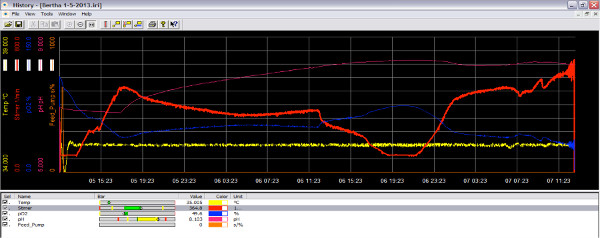
Figura 3. L'immagine dello schermo del software bioreattore durante la corsa come ossigeno diminuisce. Quando la coltura è in fase di crescita attiva, consuma ossigeno e la quantità di ossigeno nel reattore è diminuita (linea blu). Aumentando la velocità del girante, più ossigeno può essere aggiunto alla coltura (linea rossa). clicca qui per ingrandire la figura .

Figura 4. L'immagine dello schermo del software bioreattore mostrando cambiamento di pH nel tempo. Il pH della coltura viene monitorata continuamente e nel tempo diminuisce in acido lattico viene prodotto e poi aumenta come base si aggiunge al bioreattore (linea blu). clicca qui per ingrandire la figura .
Discussione
Bioreattori serbatoi agitati sono gli standard nel settore Biotecnologie e sono stati utilizzati per oltre 40 anni 1. Il piccolo serbatoio di agitazione è stato importante per scale-up, scale-down, ottimizzazione ceppo, caratterizzazione e sviluppo di processo. Esso può anche avere un ruolo importante nello sviluppo della medicina individualizzata 2. Il bioreattore piccola scala è più simile a condizioni in situ per la crescita cellulare, perché può essere monitorato e ottimizzato tutta una corsa. Molto spesso, i primi esperimenti sono eseguiti utilizzando palloni di scuotimento ma le condizioni del bioreattore piccola scala differiscono significativamente dal dibattimento in pallone. In un esperimento abbiamo scoperto che le condizioni per la crescita ottimale di E. coli e produzione di proteina fluorescente verde (GFP) nel pallone shake non si traducono al serbatoio agitato (dati non pubblicati).
Altri metodi di cellule in coltura su larga scala includono bottiglie di rulli, unico use a dondolo bioreattori piattaforma 3 e grandi bioreattori monouso con volumi di lavoro da 50 a 5.000 L. Ogni metodo prevede sfide per scale-up, ma ha trovato un posto in produzione. L'uso singolo dondolo piattaforma bioreattore è simile al serbatoio agitato, e fornisce un ambiente regolato. Si differenzia dal serbatoio agitato dal fatto che la miscelazione avviene a causa di un movimento oscillante per generare onde per prevenire sedimentazione delle cellule e fornire ossigenazione. L'idrodinamica per questo metodo sono diversi dal serbatoio agitato e volume massimo è limitato a 1.000 L. Le differenze possono influenzare la crescita cellulare e la produzione del prodotto. Altri sistemi monouso uniscono il serbatoio agitato con il reattore usa e getta per, fornire una piattaforma con un minimo di infrastrutture e overhead associato, e la capacità di high-throughput Bioprocessing 4.
I nuovi utenti di bioreattori da banco possono avere difficoltà a determinare valori di riferimento iniziali per pH, pO 2 e temtemperatura, tuttavia, la ricerca pubblicata possibile fare riferimento per queste informazioni 5, 6, 7, 8, 9. Con colture batteriche in particolare, si raccomanda di iniziare agitazione alla stessa velocità del matraccio agitatore e la temperatura alla stessa setpoint. Cultura pH da precedenti boccette shake piste può essere utilizzato anche come punto di partenza. Impostazione del valore di pO 2 è più difficile ed è tipicamente determinata empiricamente. Tuttavia, a partire 50% pO 2 è un punto di partenza raccomandata.
Divulgazioni
Autore A. Magno è un dipendente di ATR Biotech che produce reagenti e strumenti utilizzati in questo articolo.
Riconoscimenti
Questo progetto è stato il supporto in parte dalla Johns Hopkins University, Ufficio del prevosto attraverso il Science Initiative Gateway.
Materiali
| Name | Company | Catalog Number | Comments |
| Name | Company | Catalog Number | |
| LB broth | Sigma | L3022 | |
| ampicillin | Sigma | A1593-25G | |
| LB broth | Sigma | L3022 | |
| antifoam 204 | Sigma | A8311 | |
| 1 M Sodium Hydroxide | Sigma | 38215-1EA-R | |
| Reference Buffer, pH 4.00 | Sigma | B5020 | |
| Reference Buffer, pH 7.00 | Sigma | B4770 | |
| pO2 probe electrolyte | Broadley James | AS-3140-C30-0025 | |
| 0.45 micron filter | Cole Parmer | EW-02915-22 | |
| 0.22 micron filter | Cole Parmer | EW-29950-40 | |
| Luer Lock syringe, 10 mL | Cole Parmer | EW-07940-12 | |
| Minifors Bioreactor | Infors HT | B-Pack 5.0 | |
| Air Admiral air pump | Cole Parmer | EW-79202-00 | |
| 1175 PD Chilling circulator | VWR | 13721-204 |
Riferimenti
- Shuler, M., Kargi, F. . Bioprocess Engineering Basic Concepts. , (2002).
- Hambor, J. Bioreactor Design and Bioprocess Controls for Industrialized Cell Processing. BioProcess International. 10 (6), 22-33 (2012).
- Julien, C., Whitford, W. Bioreactor, Monitoring, Modeling and Simulation. BioProcess International. 5 (01), S10-S17 (2007).
- Fike, R. Nutrient Supplementation Strategies for Biopharmaceutical Production. Part 1: Identifying a Formulation. BioProcess International. 7 (11), 46-52 (2009).
- Jana, S., Deb, J. K. Strategies for efficient production of heterologous proteins in Escherichia coli. Appl Microbiol Biotechnol. 67, 289-298 (2005).
- Wang, Z., Ly, M., Zhang, F., Zhong, W., Suen, A., Hickey, A. M., Dordick, J. S., Linhardt, R. J. E. coli K5 fermentation and the preparation of heparosan, a bioengineered heparin precursor. Biotechnol. Bioeng. 107, 964-973 (2010).
- Baltz, R. H., Demain, A. L., Davies, J. E. . Manual of Industrial Microbiology and Biotechnology. , (2010).
- Infors, H. T. . Minifors operating Manual and user guide. , .
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon