Method Article
Derinlemesine ve Bilgilendirici metabolomic Analizi Çoklu Metaboliti'nin Bileşik Sınıfları Kurtar Multi-step Hazırlama Tekniği
Bu Makalede
Özet
Metabolomiks deneylerde sonuçların güvenilirliği numune hazırlama etkinliği ve yeniden üretilebilirlik bağlıdır. Daha sonra bileşikler bin kadar analiz, ya da ilgi sadece bileşik sınıfları seçeneği ile biyolojik sıvılardan metabolitlerin çıkarma sağlayan bir sıkı ve derinlemesine bir yöntem tarif edilmektedir.
Özet
Metabolomik biyolojik süreçler hakkında fikir elde etmek amacıyla canlı organizmaların örnekler profilleme sağlayan gelişmekte olan bir alandır. Metabolitler bir önemli yönü tutarsız teknikleri güvenilmez sonuçlar üretmek sayede örnek bir hazırlıktır. Bu teknik, protein çökeltme, sıvı-sıvı ekstraksiyonu, ve dört farklı sınıfa metabolitleri kısımlara ayrılması için bir araç olarak bir katı faz ekstraksiyon kapsar. Duyarlılığında bir artış ile sonuçlanan düşük bolluk moleküllerin geliştirilmiş zenginleştirme elde edilir ve sonuçta moleküllerin daha emin tanımlanmasında sonuçlanır. Bu teknik, plazma, bronkoalveolar lavaj sıvısında ve 50 ul kadar düşük hacimli beyin omurilik sıvısı numune uygulanmıştır. Örnekler çoklu alt uygulamalarda kullanılabilir; örneğin protein çökeltme elde edilen pelet bir sonraki analiz için saklanır. Bu aşamadan gelen süpernatan kullanılarak sıvı-sıvı ekstraksiyonu uğrarsu ve hidrofilik ve hidrofobik bileşikleri ayırmak için güçlü bir organik çözücü içinde eklenmektedir. Parçalanmış sonra, hidrofil tabaka, daha sonra analiz için işlenebilir ya da gerekli değilse atılır. Hidrofobik parça bundan başka yağlı asitler, nötr yağlar, fosfolipidler ve içine ayırmak için, üç katı faz ekstraksiyon adımları sırasında çözücülerin bir dizi ile muamele edilmektedir. Bu teknisyen bileşiklerin sınıf analizi için tercih edildiği seçmek için esneklik sağlar. Ayrıca kimyasal sınıf mevcut bazı bilgi beri daha güvenilir metaboliti belirlenmesine yardımcı olur.
Giriş
Biyolojik reaksiyonlar hücresel süreçlerin nihai ürünler olarak metabolitler üretmek. Metabolomik Bu işlemlerin bir sonucu olarak bir organizmada mevcut olan tüm bileşiklerin topluluğudur. Bu hücrelerin fizyolojisi bir görüntü sağlar ve içsel veya dışsal uyaranlara 1, 2 bir organizmanın tepkisini yansıtmaktadır. Bu tür uyaranlara, çevresel toksikolojik, farmakolojik, beslenme, hormonal, ya da hastalığa bağlı olabilir. Birçok metabolomic uygulamaları var ve şu anda araştırmacılar tarafından çalışılmaktadır ve biyolojik keşif 3, beslenme çalışmaları 4, gıda bilimi 5 ve uyuşturucu testi 6. içerir. Ne olursa olsun uygulama, veri, kirlenme ve yanlış pozitiflerin mevcudiyetinde varyasyonları azaltılmış ya da tercihan kaldırılması gerekir. Biyobelirtecin keşif veya biyolojik bir f bir kontrol ve bir hastalık grubu arasındaki farklılıkları belirlemek, ya da konularda ilaçların etkilerini araştıran durumundaLUID sorulan sorulara göre seçilir ve metabolitleri türleri 7 araştırılmaktadır. Örneğin, numuneler önce bronkoalveoler lavaj (BAL) metabolitler keşfetmek ve uygulamadan sonra sonra, astımlı akciğerlerdeki bir solunan ilacın hemen etkilerini inceleyerek eğer tercihli olacaktır. Farklar gerçek biyolojik çeşitlilik yerine uygun olmayan örnek hazırlama tekniğine bağlı olarak gözlenen emin olmak için, standart ve tutarlı bir laboratuar protokol 8 gereklidir. Örnek bilgi dikkatle böyle birkaç isim biyolojik sıvının, hayvan zorlanma, örnekleme zaman, konu yaş, cinsiyet gibi değişkenler, tüm kabul ve çalışmaya 9 çarpanlarına sağlamak için dokümante edilmelidir. Buna ek olarak, kirlenme veya yanlış pozitif olasılığını azaltmak için, bu çözücü boşlukları ve enstrüman boşlukları 10 analiz edilmesi tavsiye edilir.
Bu protokol için, dönem "Metabolites "belirlenen gerçek bileşikleri ifade etmek için kullanılacaktır. Satıcı yazılımı kullanarak, bir başlangıç zirve bulma algoritması kütle spektrum zirveleri tespit etmek için kullanılır. Bu tepeler kütle-yük (m / z) oranı ile tutma süresi göre hizalanır. İkinci bir algoritma daha sonra bir tek bir bileşik, birden fazla özelliklerini birleştirmek için kullanılır. Bu, sodyum, potasyum, ya da pozitif iyonizasyon modunda amonyum adüktleri ve negatif iyon modunda klorür gibi özellikleri içerir. Yazılımında ek seçenekler gibi dimerleri ve diğer adüktlerin gibi özellikleri içerir. 181.0707, m / z (M + H) zirveleri ile, bir örnek olarak glikoz kullanarak, 198,0972 m / z (M + NH4) ve 203,05261 m / z (M + Na), aynı tekabül eden üç adet tepe noktası olacaktır İlk algoritması ile bileşik. Moleküler formüle dayanır ikinci algoritması, uygulandığında Ancak Bu üç ilave bileşikleri bir bileşimi elde edilir gruplanmış olur.
Metabolitler samp içinde girişimlere sebep olabilirMevcut bileşiklerin karmaşıklığı nedeniyle les. Bir numune nedenleri metabolitlerinin varlığı bin özellikle alt bolluk metabolitlerin bastırılmasına işaret etmektedir. Örnek temizleme proteinleri müdahale kaldırmak ve birden çok bölüme daha sonra ayrılması, böylece, numune, en yüksek ayrılma iyileştirilmesi artan çözünürlük ve metabolit birlikte elüsyona uğratılmasına azaltılması karmaşıklığını azaltır. Bu nedenle, örnek temizleme ve bileşiklerin geliştirilmiş ayırma gereklidir. Hatta çeşitli kutupluluk çözücülerin kullanımı ile tek başına protein yağış, kanıtlanmıştır, bu meseleyi 11, 12 çözemez. Ancak, fraksiyonasyon sonraki adım MTBE gibi bir güçlü organik çözücü birleştirerek, metabolit kapsama artar. Yang et al. 12 Birleştirilen MTBE solven ekstraksiyonu kullanılarak 3806 metabolitlere, sırasıyla metanol ya da tek başına metanol-etanol çökeltme ile 1851 veya 2073 metabolitlerin bir artış raporKatı faz ekstraksiyonu (SPE) adım izledi. Azaltılmış metabolit örtüşme, geliştirilmiş ayırma ve yüksek tepe metabolit bolluk Bu yöntem ile gözlenmiştir.
Bu gibi polimer olmayan metabolitleri, bulaşma tehlikesi numune toplama, solventler veya alet gürültüye neden olabilir, ve potansiyel olarak önemli metabolitleri sinyal baskılanmasına neden olabilir. Tavsiye edilir teknisyeni (ler) ve hazırlama sürekli aynı marka, tipi ve örnek toplama şişeler, pipet uçları ve numunelerin toplanması ve hazırlama sırasında kullanılan herhangi bir başka tüplerin boyutunu kullanmak örnek önce numuneler edenler. Bu veri analisti gözlenen değişiklikler gerçek ve diğer kaynaklardan gelen arka plan farklılıkları nedeniyle olmadığını, tam güven duymalarını sağlar. Tedavi etkinliği, hastalık ve kontrol gruplarının, veya herhangi bir diğer metabolik analizler arasındaki farklılıklar daha sonra artan güven ile araştırılabilir.
Method Burada ele plazma, BAL sıvısında veya beyin omurilik sıvısı (CSF), sıvı kromatografisi-kütle spektrometrisi (LCMS) göre analiz için non-hedefli metabolomic profil için örnekler uygulanabilir kombine numune hazırlama yöntemleri 13-15 odaklanır. Sıvı kromatografisi (LC) ve ultra-performans sıvı kromatografi Hem (UPLC) ayırma teknikleri, bu prosedür daha sonra MS akuple edilebilir. Metabolomic çalışmalar yapan birçok araştırmacı bir protein çöktürme tekniği ve / veya sıvı-sıvı ekstraksiyon tekniği 16, 17 ya kullanın. Çalışmalarda, bu az metabolitleri tespit sonuçlandı. Burada tarif edilen yöntem, 12 metabolome daha geniş bir aralığını kapsayan, metabolitlerin daha fazla sayıda algılama ve tanımlanmasını sağlar. Bu artış, metabolit sınıfların önce ayrılması neden olduğu örnekleri ve düşük matris etkileri yüksek saflık kaynaklanmaktadır.
Bir ilk protein çöktürme aşaması numuneden proteini uzaklaştırmak için soğuk metanol (MeOH) kullanılarak gerçekleştirilir. Metil tert-butil eter (MTBE) ve su kullanılarak sıvı-sıvı ekstraksiyonu (LLE) hidrofilik ve hidrofobik bileşikleri ayırmak için kullanılır. Yağlı asitler, nötr yağlar, fosfolipidler ve - sonra katı faz ekstraksiyonu (SPE), üç sınıfa hidrofobik bileşikleri ayırmak için bir hidrofobik tabaka üzerinde gerçekleştirilir. Hidrofilik kısımlar su içinde% 5 asetonitril içinde yeniden ise hidrofobik kısımlar,% 100 metanol içinde yeniden edilir. Katı faz ekstraksiyonu (SPE) aşaması, aksi takdirde mevcut olacak birlikte elüt edilen bileşiklerin sayısını azaltarak sonuçlarda güven seviyesi, ilave bir ayırma aşaması gerçekleştirilir olmasaydı sağlar.
Protokol
1.. İlk Düşünceler, Cihazları ve Standartların Hazırlanması
- Her zaman (cam kültür tüpleri, cam şişeleri autosampler) depolanması veya (cam pipetler) lipit ve organik çözücüler aktarmak için camını kullanın.
- Havaya tüm lipit örnekleri ve standartları maruziyeti en aza indirmek. Seal politetralforoetilen (PFTE) hava pozlama ve buharlaşmayı önlemek için sıkıca kapakları. Hemen sonraki bir çözücü içinde tekrar süspansiyon ya da kuru lipidler, sabit bir nitrojen akımı içinde tutmak.
- Örnek 100 ul kullanın. Daha fazla (veya daha az) bir numunesi, mevcut durumda, uygun olarak miktarlar ayarlayın. Ancak NH2 SPE kolonu üzerinde lipid parçalanması sırasında gösterildiği gibi, birimler kalmalıdır belirtti.
- Santrifüjde açın ve numune hazırlama başlatmak için önceden 0 ° C'ye ayarlayın.
- Bu teknik pek çok uçucu çözücüler için örnek hazırlama sırasında kapatılmış tüm çözücüleri tutmak kullanır.
- Önerisi başına standartlarının iki tür hazırlayın.
- Sabit bir konsantrasyonda kirpi-standartların her oluşan bir negatif kontrol hazırlayın. Bu, tüm örneklerinde hem de toplu QC (ayrı günlerde örnek hazırlama tekrarlanabilirliği izlenmesi için kullanılan tırnaklı havuzlu numune) ve aracı olarak kullanılan bir araya getirilmiş numune içine çivili QC (havuzlanmış numuneleri daha önce hazırlanmış alt parçalara ayrılmış ve kullanılan çivili ) analizi sırasında ve ayrı günlerde enstrüman koşullar / dalgalanmaları izlemek.
- 1x, 2x, 4x ve standart sivri pozitif kontrolleri hazırlayın. Pozitif kontroller, tüm örnekler yanı sıra plazma toplanmış numuneye eklenir ve numune hazırlama adımları ve sağlamak için veri analizi sırasında kat değişiklik farkları analiz etmek ve tespit etmek Enstrümantal analiz adımları hem de kalite kontrol bileşikleri olarak kullanılan bu tüm yönleriyle hazırlama ve enstrümantal analiz doğru şekilde yapılmıştır.
- -80 ° C'de -20 ° C ve mağaza örneklerinde mağaza standartları Bazı dahili standıUzun süreli depolama aşağıdaki bozunmaya eğilimli ARDS -80 ° C'de saklanmalıdır
- Bu prosedür, örneğin MTBE gibi, tehlikeli yanıcı veya uçucu çözücülerin kullanımını gerektirir. Davlumbaz tüm adımları gerçekleştirin.
2.. İç Standartlar
- Bireysel projeleri ve kendi özel deneysel tasarıma dayalı iç standartlarını (ISTD) seçin. Bu tür plazma, BAL sıvısında veya idrar, bu örneklerde biyolojik bulunanlara doğada benzer olan izotopik olarak etiketlenmiş bir istDS olarak Biofluids için ideal olacaktır. Bunlar ama amino asitler, hormonlar ya da lipidler sınırlı değildir. Bitki metabolomic örnekleri için, örneğin flavonoidler veya karotenoidler olarak etiketlenmiş standartları kullanılabilir. Aynı araştırmacı örnek tipi analiz edilen temsili bir iç standart seçmelisiniz sayede diğer metabolomic çalışmalar için de geçerlidir.
- Seçilen ISTD kromatogramın geniş bir aralığı kapsar emin olun; Örneğin eğer tO toplama süresi her 5 dk akıtmak standartları kullanılır olabilir, 20 dk.
- Ml numune analiz edilen eksojen olan izotopik olarak etiketlenmiş bir standartlar ve / veya diğer polar çeşitli bileşikler kullanılarak, 2 mg / de hidrofilik stok çözelti oluşturur. 25 ug / ml kreatinin-D 3'ün nihai konsantrasyon, 100 ug / ml lizin-d 4 ve / ml valin-D 8 200 ug tüm standartlara su: her bir stok çözeltisinden, 01:01 metanol içinde bir çözelti oluşturmak .
- Numune analiz edilen eksojen olan izotopik olarak etiketlenmiş standartlara ve / veya diğer non-polar bileşiklerin çeşitli kullanarak hidrofobik stok çözümleri oluşturmak; 17:00 yağlı asit (4 mg / ml) içinde stok konsantrasyonları, 19:01 yağlı asit (4 mg / ml), 17:00 seramid (2 mg / ml), 17:00 PE (1.75 mg / ml), 15 : 0 PC (2 mg / ml), ve testosteron-D 2 (1 mg / ml). Her bir stoğundan alınan, 01:01 kloroform içinde bir çözelti oluşturmak: 50 lik bir nihai konsantrasyona kadar metanol tüm standartlaraug / ml 17:00 seramid, 100 ug / ml 15:00 PC, 100 ug / ml testosteron D-2, 200 ug / ml 17:00 yağlı asit, 200 ug / ml 19:01 yağlı asit, ve 200 ug / standart karışımı ml 17:00 PE.
- Algılama ve bu bileşikler için aletin doğrusallık sınırını belirlemek için her bir standart için en az beş farklı konsantrasyonları kullanılarak vaktinden önce her bir standart için iyonlaşma derecesinin test edin. Her bir standart için stok çözeltisinin konsantrasyonu deneysel tasarım bağlı olarak değişecektir ve birleştirilen çivili standart olarak her bir standart konsantrasyonu 2 mg / ml 'ye ml 20 ug / ikinci da iyonize ne kadar iyi bağlı olarak değişebilir.
- Pozitif kontroller bir başak karışımını oluşturmak ve kantitatif numune hazırlama ve enstrümantal verilerin doğruluğu gücünü izlemek için 1x, 2x, 4x veya konsantrasyon seviyelerinde numunelerin ekleyebilirsiniz. Pozitif kontroller nihai konsantrasyonu canolması: 2 mg / ml D-glikoz, 100 ug / ml alanin-D 3, 200 ug / ml metilmalonik asit D-3, 20 ug / ml trigliserid-D 5, ve / veya diğer hidrofobik ve hidrofilik standartları. Analiz için kullanılan MS ve HPLC enstrümantasyon hassasiyetine göre standart konsantrasyonları ayarlayın.
3.. Protein Yağış
- Aşağıda tarif edildiği gibi Çözünme, oda sıcaklığına kadar örnekler ve her bir örneğe istD 10 ul başak.
- Her bir örnek için (2.3 ve 2.4 'de stoktan oluşturulan) hem hidrofilik hem de hidrofobik standart çözeltilerin 10 ul başak. Analiz için kullanılan MS ve HPLC enstrümantasyon hassasiyetine göre gerekli standart konsantrasyonları ayarlayın
- Her bir numune için 1x, 2x, 4x veya pozitif kontrol solüsyonu (adım 2.6 stoktan oluşturulan) ya 10 ul Spike. MS ve HP hassasiyetine göre gerekli standart konsantrasyonları ayarlayınLC analizi için kullanılan alet
- Önce protein çökeltme aşamasından 10 saniye vorteksleyin Her numune
- Her bir örnek için (-20 ° C'de saklanan) buz soğukluğunda metanol 400 ul ekleyin.
- Tüp başına 10 sn Vortex.
- 18000 x g ile 15 dakika boyunca 0 ° C 'de santrifüj.
- Yeni bir cam tüpe tüm kültür süpernatant transferi ve daha sonra N2 altında kuru.
- Protein pelet fraksiyonu analiz adımlara 3,8-3,11 geçin. Protein pelet analiz değilse, Bölüm 4'e atlayın.
Not: protein topağı ilaç çalışmaları gerçekleştirirken yararlı olacaktır yüksek hidrofobik olan bileşikleri ihtiva edebilecektir 18, gıda gibi nöronal seroid-lipofuscinoses 20 ve lizozomal lipid depolama gibi çok hidrofobik bileşiklerin birikmesine hastalıkları ile ilişkili hidrofobik flavonoidler 19 veya metabolomic çalışmaları ile ilgili analizler hastalıklar 21. - T MTBE 1 ml ilave ediliro beyaz (ya da off-white) protein pelet, tüp başına 30 saniye boyunca girdap, daha sonra x g 18.000 ° C'de 15 dakika boyunca 0 ° C 'de santrifüj. Yeni bir camdan yapılmış bir kültür tübüne MTBE katmanı süzün.
Bu (temsilcisi sonuçları bkz. Şekil 5) burada hataları büyük ölçüde sonuçlarını etkileyecek gibi kritik bir adımdır.- Pellet boyutunun örnekleri arasında değişir çünkü sürekli tüm örnekler için MTBE aynı miktarda aspire. Sadece 900 ul süpernatan en az miktarda numune için dökülmüştür olabilir, bu nedenle, daha sonra, bütün numuneler için 900 ul süzün.
- Adımı tekrar 3.9 ve aşama 3.7 'de hazırlanan aynı camdan yapılmış bir kültür tübüne Organik tabakayı bir araya getirir.
- 01:01 kloroform, 200 ul 2 N akışı ve tekrar süspansiyon ile Kuru örnekleri: metanol. Vortex kısaca.
- Bir santrifüj tüpüne aktarılır. 18.000 x g'de 15 dakika boyunca 0 ° C'de santrifüj, sonra camını kullanarak vidalı kapaklı şişeleri autosampler süpernatant aktarmakpipetler.
4. Sıvı-sıvı ekstraksiyon
- Bir cam pipet kullanılarak, (Bölüm 3, aşama 6) bakiye kurutuldu, metanol, girdap 30 saniye için 3 ml MTBE eklemek girdap sonra, tüp başına 10 saniye 750 ul su ekleyin.
- Oda sıcaklığında bir santrifüj içinde 10 dakika boyunca ~ 200 xg Spin.
- Aspire MTBE (su almadan) tabakası ve temiz bir cam kültürü tüp transferi 2.5 ml.
Not: Bu, burada farklılıkların sonuçlarını etkileyecek gibi kritik bir adımdır. Sabit bir hacim altında, sulu katman pipetle arıtılabilen sağlar çünkü MTBE 2.5 ml dikkatli bir şekilde üst tabakadan boşaltılmalıdır. Deneyin başlangıcında numunenin hacmi, bu yöntem için belirtilen 100 ul daha az olduğu takdirde, orantılı olarak bu başlangıç numune hacmi yansıtacak şekilde MTBE hacmi büyütülebilir. - Numunenin geri kalan su kısmına 3 ml MTBE ekleyin ve vorteks tüp başına 10 saniye.
- Spin ~ 200oda sıcaklığında santrifüj içinde 10 dakika boyunca xg.
- Aspire (su almadan) MTBE 3 ml ve MTBE tüp ile birleştirir.
- N2 altında kurutulmasıyla geri kalan sulu tabaka konsantre edin.
- Suyun 100 ul tortu yeniden askıya.
- Kısaca cam kültür tüp, girdap buz soğuk MeOH 400 ul ekleyin ve sonra santrifüj tüpüne aktarın.
- 20-30 dakika boyunca -80 ° C'de bırakın. 18000 x g ile 15 dakika boyunca 0 ° C'de Spin.
Not: Bu, bu, herhangi bir geri kalan protein metanol içinde çökelmesine izin verdiği bir -80 ° C dondurucu içinde tüm numune rafı yerleştirilmesi önerilir. -80 ° C dondurucu mevcut değilse, diğer seçenekler şunlardır:, -20 ° C'de saklanması kuru buz örnekleri yerleştirerek, ya da bir buz kovası onları tutmak. Bu sürekli çökelmesine izin vermek için soğuk bir ortamda ve aynı sıcaklıkta örnekleri saklamak için önemlidir. - Için süpernatant ve transfer aspire 450 ulTemiz bir mikrosantrifüj tüpü. En fazla 45 ° 'den C' de vakumlu bir santrifüjlü konsantre tamamen Kuru (Yaklaşık 1-2 saat) götürür.
- % 5 asetonitril / su, 200 ul süpernatant kurutuldu, tekrar. Vortex kısaca. -80 ° C'de dondurun
5. Katı faz ekstraksiyon
- Nitrojen iyi bir akış (yaklaşık 10-15 dakika sürer) ile 35 ° C'de nitrojen altında MTBE fraksiyonu kurutun.
- Ne zaman tamamen kuru, azot akışını durdurmak ve hızlı bir cam pipet kullanarak 1 ml kloroform (CHCl3) tekrar süspansiyon. Vortex kısaca.
Not: CHCI3 gibi çözücüler düşük bir viskoziteye sahiptir. Pipetle sırasında, düşük yüzey gerilimli bir pipetten solvent kaybına neden olur. Bu pipet pipetle çözcünün ve pipet alanı arasında denge sağlamak için en az iki ön ıslatılmış olması önerilir. Mevcut ise bir gaz geçirmez şırınga de kullanılabilir. - Bir SPE vakum manifoldu ve NH 2 kurmak Fraksiyonasyon için SPE sütunlar.
- Sıcak RT'ye örnekleri ve her zaman N 2 sabit bir akışı altında askıda tutmak. Oda sıcaklığına getirildikten lipid yeniden süspansiyon sağlayacak ve azot oksidasyon ve lipid polimerizasyonunun önleyecektir.
- 400 ul hekzan ile yıkayın ve durum SPE kartuşu 2x. Atık atmak ve yeni bir cam toplama tüpü ile değiştirin.
- SPE kolonuna örnek ekleme, cam tüpler içinde akışı toplamak.
- Cam pipet 02:01 CHCl3 1 ml ekleyin ile: IPA (bu Neutral Kesir olduğu) aynı cam tüpler içinde akar toplamak.
- Oksidasyonunu (yaklaşık 10-15 dakika sürer) en aza indirmek için N2 altında nötr kısmını kurulayın.
- Cam pipet dietil eter içinde% 5 asetik asit, 1 ml ilave olarak, (bu, bir yağ asidi fraksiyonu olan) yeni bir cam tüpler içinde akışı toplamak.
- Oksidasyon (yaklaşık 10-15 dakika sürer) en aza indirmek için N2 altında yağ asidi fraksiyonu kurutun.
- 800 eklemek için plastik ipuçlarını kullanın ve# 181; SPE kartuşa metanol l ve akış yoluyla 15 ml'lik plastik konik tüplerde (bu, fosfatidik asit,) toplar.
- 1.5 ml santrifüj tüplerine fosfolipid fraksiyonu aktarın. 45 ° C (yaklaşık 1-1.5 saat sürer) 'de vakumlu bir santrifüjlü yoğunlaştırıcı ile örnekleri kurutun.
- Depolama için şişeler vida kapağı otomatik numune% 100 metanol, girdap ve transfer 200 ul üç fraksiyonlardan numunelerinin her yeniden süspanse edin.
6.. Depolama Koşulları Örnek
- Alet analiz için hazır olana kadar -80 ° C 'de, tüm numuneler saklayın.
Not: Organik bir çözücü içinde yeniden ekstraksiyon örnekleri, -20 ° C'de saklanabilir Muhtemel ilgi metabolitleri bu sıcaklıkta ayrışmaktadır Ancak bu tavsiye edilmez. Sıvı azot depolama da müfettişler kirlenme sorunları, özel saklama flakonlar gerekli bildirdin olarak tavsiye ve bölme cau homojenlik eksikliği bulunmadığıgeniş sıcaklık dalgalanmalarını şarkı. - Numune hacimleri (<100 ul) küçük ise, depolama sırasında üst kısmında çözücünün buharlaşmasını önlemek için şişeler içinde ekler kullanın.
- Numunelerin dondurma-çözme kaçının. Doğru alet analizden önce, sadece bir kez örnekleri çözülme. Tekrarlanan donma-çözülür örnek bozulması neden olur.
7. Sıvı Kromatografi Koşulları
- Hidrofobik kısmını analiz etmek için bir C-18 2.1 mm x 12.5 mm (5 um) koruyucu kolon ile bir C-18 2.1 mm x 50 mm (1.8 um) analitik sütun kullanarak.
- 4 autosampler sıcaklığını ayarlamak ° C, 60 kolon sıcaklığı ° C, 0.25 ml / dk 'ya 2 ul ve akış hızı için enjeksiyon hacmi.
- Mobil faz B için su (60:36:4): asetonitril: Mobil faz A için su içinde% 0.1 formik asit ve izopropanol içinde% 0.1 formik asit kullanarak
- Aşağıdaki gradyan elüsyon profili çalıştırın: başlatt% 30 B, ve 0 ila 1 dakika ila 70% B artışı, daha sonra 15 dakika için 1 'den% 100 B'ye artırmak ve 5 dakika% 10 B, yıkama ve 5 dakika sonrası dönemde, ardından 5 dakika için tutun.
- Hidrofil kısmını analiz etmek için bir bekçi sütun ile bir HILIC'i 2.1 mm x 50 mm (2.6 mikron) analitik kolon kullanın.
- 4 autosampler sıcaklığını ayarlamak ° C, 20 kolon sıcaklığı ° C, 0.5 ml / dk ve 2 ul akış hızı için enjeksiyon hacmi.
- 10 mM amonyum asetat, mobil faz A için pH 5.8 ve mobil faz B için 10 mM amonyum asetat, pH 5.8 içinde% 90 asetonitril içinde% 50 asetonitril kullanarak
- Aşağıdaki gradyan elüsyon profilini çalıştırmak: 0 ila 2 dakika% 100 B'de başlayın, sonra 5 dakika% 0 B, yıkama ve 10 dakika sonrası dönemde, ardından 15 dakika için, 2 den 50% B'ye azalır.
Sonuçlar
Tüm numune hazırlama tekniği yukarıda tarif edildiği gibi yapıldı ve en önemli ve / veya ilgili yönleri aşağıda sunulmuştur. Hidrofilik ve hidrofobik iç standartları çeşitli ekstraksiyon yöntemleri kullanarak iç standartları ve endojen metaboliti bollukları doğrudan karşılaştırmalar yapmak için toplanmış plazma örneklerinde içine çivili edildi. Sıvı kromatografisi-kütle spektrometrisi (LC-MS) veri kalitatif ve kantitatif yazılımı kullanılarak analiz ve mükemmel iyileşme ve endojen bileşikler ve hem de iç standartları ayrılması ile sonuçlanmıştır. Şekil 1, standart iki lipid ekstraksiyonunda MTBE-SPE metodunun etkinliğini göstermektedir (A) ve endojen bileşikleri (B).
Genel olarak, daha iyi bir ekstre etme ve metabolitlerinin kapsamı metanol ekstre etme, ya da 'MTBE Yalnızca' çıkarma gibi diğer yöntemlere göre elde edildi, bu numara of özellikleri, LC-MS analizi, aşağıdaki niteliksel ve niceliksel yazılımı kullanılarak karşılaştırılmıştır. Örneğin, yalnızca metanol ekstraksiyonu kullanılarak, kreatinin-D 3 için varyasyon% 15.2 idi. Bununla birlikte, MTBE LLE ile, bu% 1.04 CV düşürülmüştür. MTBE kullanılarak, lipid ve sulu bileşiklerin tekrarlanabilirliği D-2, C17 seramid, 15:00 PC ve tek başına metanol kullanılarak göre% 26,% 200,% 100,% 400 artmıştır sırasıyla 17:00 PE. Benzer artışlar yağ asidi iç standartları ve fosfotidilkolini ve phosphotidylethanolamine endojen metabolitleri tespit edilmiştir. Bu tür sphingosines, seramidler, diasilgliseroller, triaçilgliserol, kolesterol ve sfingomyelin gibi diğer endojen metabolitlerin tespit edilmemiştir ya dametanol kullanılarak ya da ihmal edilebilir düzeylerde tespit edildi. Bununla birlikte, bu endojen lipidler kolayca MTBE ekstraksiyonu kullanılarak tespit edildi.
Standart protokoller karşılaştırma eden analizlerde, aşağıdaki sonuçlar elde edilmiştir: Metanol çökeltme tek başına 1851 metabolitleri ile sonuçlanmıştır, metanol-etanol çökeltme 2073 metabolitleri verdi, sıvı-sıvı ekstraksiyonu ile MTBE sıvı-sıvı ve geri kazanılan katı faz ekstraksiyonu ile 3125 ve MTBE verdi 3806 metabolitleri. Azalma nedeniyle iyon bastırma ve önceki LC-MS temizleyici örnekleri için en olası ekstre edilen metabolitler, bir daha fazla sayıda Dolayısıyla bu yaklaşım, sonuç.
Şekil 2, daha emin, metabolit tespiti için ilgili kimyasal sınıfa hidrofobik metabolitleri ayrılması verimini göstermektedir. SPE sonra üç lipid fraksiyonlarında tespit edilen bileşiklerin en az bir örtüşme vardır. Destek olarak, 3: ŞekilISTD ait kimyasal sınıfına ilişkin fraksiyonda elute edilmiştir olduğunu gösteren, iç standartlar geri kazanımı.
Kalite kontrol numuneleri, numune hazırlama kalitesini değerlendirmek için analiz birden fazla gün büyük bir örneklem kümesi için gerekli olduğunda herhangi bir toplu etkilerini belirlemek için, ve enstrüman tekrarlanabilirlik izlemek için kullanılır. Kromatogramlar kirpi-standartları az ±% 5 den daha az ± 3 ppm ve tutma süresi penceresinde toplu hata geri kazanılan en az% 90 olduğundan emin olmak için incelenir. Bu kriterler yerine getirilmediği takdirde, sonuçlar atılır ve numuneler tekrar analiz edilir. Tutuşunda bir kayma bir seri için görülmektedir, böylece yığın etkileri bir durumda, veri analiz yazılımı bu düzeltebilir. Toplanmış plazma numunelerinin bir önceden hazırlanmış yığın örnek hazırlama uygulandı. Bölümler daha sonra, otomatik numune alıcı ampüller içine alt-numune alınır ve izleme aracı şartların kullanılmak için -80 ° C'de saklandıHer numune analiz boyunca yazıtlarıdır. Tablo 1 bu başak-standartların sonuçlarını gösterir. QC örnek için başak-standartların% CV% 10 daha büyük olduğu için yağ asidi negatif iyonlaşma modu fraksiyon (veriler tabloda gösterilmemiştir) analiz için kullanılmadı. Bu kısmıyla bu nedenle veri kümesi atılır ve alet kontrol ve muhafaza edildi. Tablo 2 Numune hazırlama ve üç nüsha alet enjeksiyonları üç farklı gün sonra numunelerde endojen metabolitlerin sonuçlarını gösterir. Numune hazırlama QC örnekleri, endojen metabolitler, numune hazırlama gücünü, hem de alet enjeksiyon tekrarlanabilirliğini gösteren, her tekrarlanabilir.
Numune hazırlama adımları düzgün takip değildir, ancak, güvenilir ve tutarsız sonuçlar elde edilir. Şekil 4, elde edilen sonuçları göstermektedir zaman, yöntemin protein çökeltme adımıözetlenen olarak takip edilmemektedir. Üç operatör, A, B, ve C toplanmış plazma örneklerinde aynı numune hazırlama prosedürü takip edilerek gerçekleştirilir. Operatör A, daha çok deney protokolüne göre yüzer gerekli miktarda pipetle göre yerine pelet bir ile her yıkama için> 1 ml pipetle. Bu, bir kısmı için yanlış pozitif bir daha fazla sayıda sonuçlandı ancak verilerin değişkenlik arttırdı.
Verilerin kromatografik tekrarlanabilirliği, Şekil 7'de görülebilir. Toplanmış plazma örnekleri bu protokolde tarif edildiği gibi protein çökeltme, sıvı-sıvı ekstraksiyonu, ve katı faz ekstraksiyonu kullanılarak ayrı günlerde üç kopya halinde hazırlanmıştır. Her bir fraksiyon protokol bölüm 7'de tarif edilen kromatografik ayırma kullanılarak analiz edilmiştir. Numuneler daha sonra, alet ve numune hazırlama tekrarlanabilirlik değerlendirmek için LC-MS ile ilgili üç kez enjekte edildi. Bu tutarlı bir örtüşme streng hem göstermektedirÜç farklı günlerde hazırlanan numune hazırlanması, hem de yeniden üretilebilir sonuçlar üretiminde kromatografik yöntemin gücü tekrarlanabilirliği th. Kimyasal gürültü bir artış yağ asidi fraksiyonu: negatif iyonlaşma modu için görülmektedir. Bu, LC-MS çözücüler içinde kirletici oluşabilir ve tutarsız kantitatif metabolomic sonuçlara neden olabilir. Bu nedenle önce 9 dakika için yıkanmış, sadece metabolitleri analiz edilmiştir.
Uzun iş listelerini çalıştırırken, cihazın duyarlılığı ve tampon konsantrasyonlarının değişim kaybı azalmış sinyal yoğunluğu ve tutma süresi kaymasına yol zamanla oluşabilir. Tutma süresi, üst üste binme varyasyon az% 5 ve sinyal yoğunluğu değişim% 10'dan daha az ise, veri standart laboratuar sınırlar içinde devam etmektedir. Analiz yazılımı aracı ve tutma süresi sürüklenme düzeltmek için verileri hizalamak ve normalize etmek için kullanılabilmektedir. Bununla birlikte, varyasyon lar isege, o nedeni belirlenmelidir. Bu rektifiye sonra, numuneler yeniden analiz edilebilir.
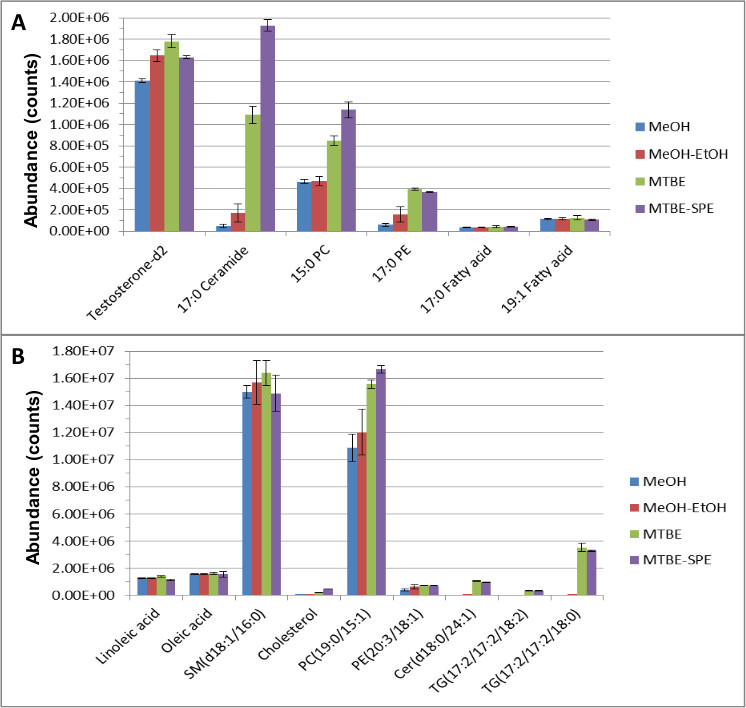
Şekil 1. Çıkarma ve ters fazlı kromatografi (RPC) 12 Aşağıdaki Lipid istDS (A) ve endojen metabolitlerin (B) bolluğu. Ekstraksiyon yapıldı ve elde edilen numuneler RPC kullanılarak ayrıldı ve pozitif ve negatif iyonizasyon modunda LC-MS kullanılarak analiz edildi. Bu rakam, Yang ve arkadaşları, 1300 A kromatografi, 217-226 (2013), Journal of modifiye edilmiştir.
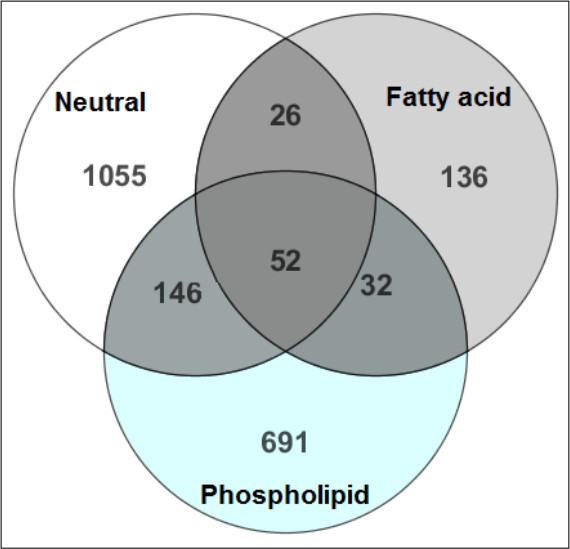
Şekil 2.. MTBE-SPE karşılaştırılması 12 fraksiyon. Her bir fr tanımlanan metabolitlerhareket hazırlık SPE bölümü sırasında üst üste binme miktarını belirlemek için karşılaştırılmıştır. Venn diyagramı içindeki rakamlar, her fraksiyon tespit metabolitlerin sayısını yansıtmaktadır. İşte küçük örtüşme SPE adımında başarılı bileşik çıkarma ve metaboliti sınıf ayrımını temsil eden üç fraksiyon arasında görülmektedir. Bu rakam, Yang ve arkadaşları, 1300 A kromatografi, 217-226 (2013), Journal of modifiye edilmiştir.
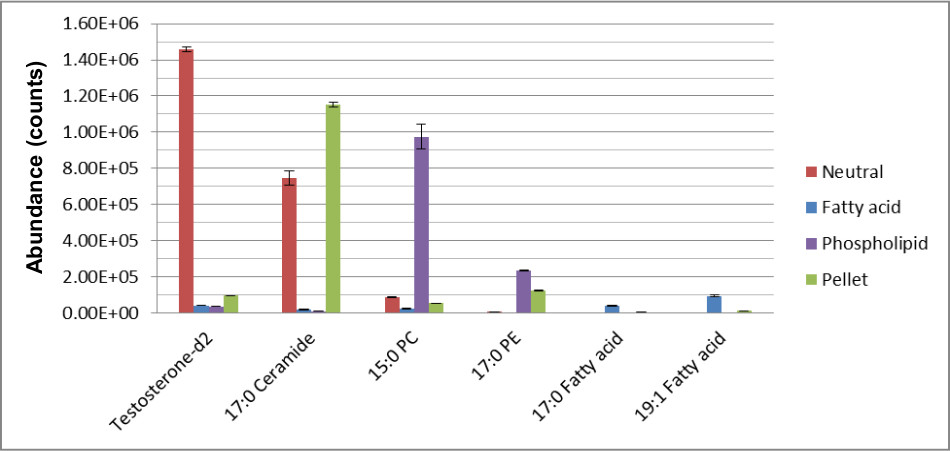
Şekil 3. MTBE-SPE yöntemi kullanan 12 kesirleri istDS kurtarma. Ekstraksiyon yapıldı ve elde edilen numuneler RPC kullanılarak ayrıldı ve metinde tarif edildiği gibi pozitif ve negatif modda LCMS ile analiz edilmiştir. Bu rakam, Yang ve diğerleri, 217-226 (2013) Kromatografi A 1300, Journal of modifiye edilmiştir. '/ P>
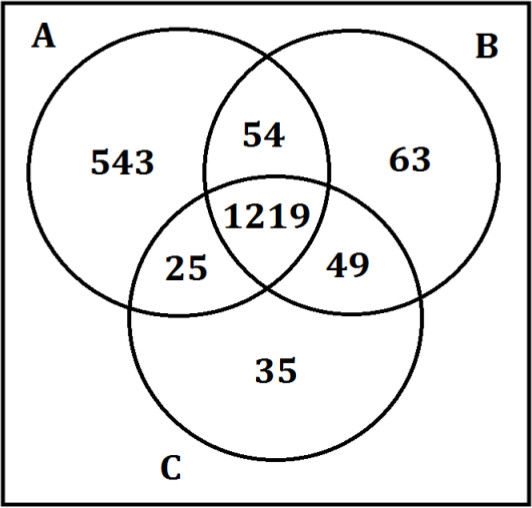
Şekil 4. Üç operatör tarafından hazırlanan pelet fraksiyonu Sonuçları. Üç örnek hazırlama operatörler A, B, ve C toplanmış plazma örneklerinde aynı protein hazırlama adımı gerçekleştirilir. Venn şemasında sayılar her operatör tarafından tespit metabolitlerin sayısını yansıtmaktadır. Operatör A 500 üzerinde daha fazla metabolit, çoğunluğu belirli bir kısmı için yanlış pozitif olarak sonuçlanan tüm süpernatant ve pelet bir pipetle ise operatörler B ve C Numune hazırlama protokole göre, gerekli hacmi pipetlenir.

Protein çökeltme aşaması sırasında protein pelet Şekil 5,. Formasyonu <. / Strong> (A) insan plazması içinde 100 ul önceden hazırlanmasını örnek için (B) plazma soğuk metanol ilave edildikten sonra, 18,000 x 15 dakika boyunca 0 ° C 'de santrifüjden sonra borunun alt kısmında oluşturulmuş (C) protein topağı g.

Sıvı-sıvı ekstraksiyonu (LLE) aşaması sırasında, hidrofilik ve hidrofobik tabakaların Şekil 6.. Ayrılması. Organik çözücü, metil tert-butil eter (MTBE) ve su hidrofilik ve hidrofobik metabolitleri ayırmak için kullanıldı. MTBE tabakası polar olmayan bileşikler çözülene ve su katmanı, polar bileşiklerin çözülene (A) yüzer plazma protein çıkarılmasından sonra,. (B) plazma azot altında kurutulduktan sonra, MTBE ilave edildikten sonra (C), plazma; Ong> plazma ve MTBE su (D) Ayrıca, santrifüjden sonra meydana (E)-MTBE su katmanı, üst tabaka MTBE (F) çıkarılması, (G) MTBE bertaraf edilmesinden sonra geri kalan esas olarak hidrofilik bir tabaka.
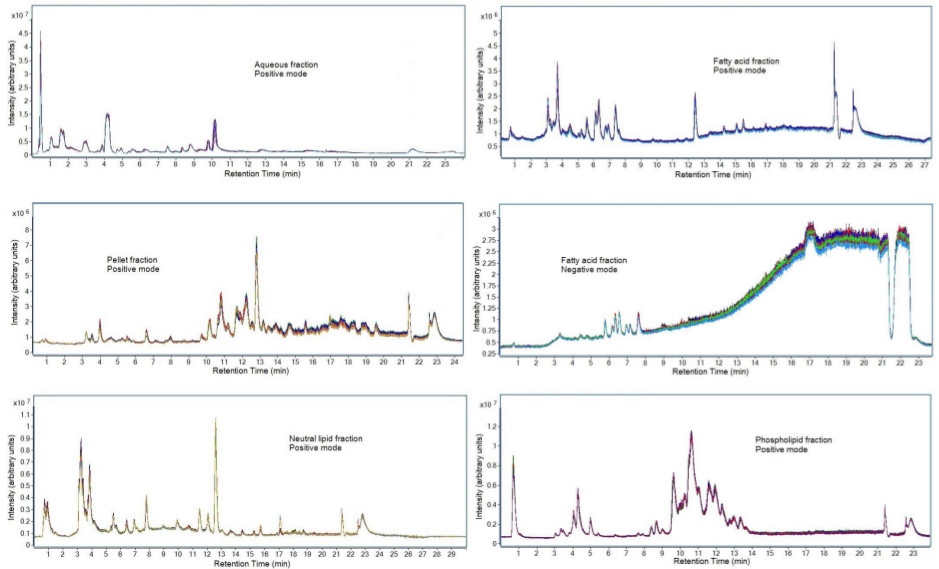
Şekil 7... Numune hazırlama üç ayrı havuza plazma QC örnekleri ve her bir numune üzerinde gerçekleştirilmiştir seçilen bir veri kümesinden fraksiyonların Kromatogramlar LC-MS alet üzerinde üç kez enjekte edilmiştir. Yöntem protokol bölümü 7'de gösterilen LC-MS parametreleri kullanılarak elde edilen plazma numunelerinin toplam iyon kromatogramları olan temsil etti. Diğer biyolojik sıvıların kromatografik gösterimi nedeniyle metabolit bileşim içinde farklılıklara değişir."k> bu rakamın daha büyük bir versiyonunu görmek için buraya tıklayınız.
| Kesir | İyonizasyon modu | İç Standart | n | Ortalama Tepe Alanı | Tepe Alan% CV |
| Sulu | Pozitif | Kreatinin-D 3 | 31 | 2217311 | 3.8% |
| Nötral lipid | Pozitif | Trigliserid-D 5 | 31 | 4837032 | % 9.9 |
| C17 Ceramid | 31 | 12736707 | % 7.9 ' | ||
| Phospholipid | Pozitif | 15:00 PC | 32 | 1248929 | 9.3% |
| 17:00 PE | 32 | 517234 | % 7.9 ' |
Çivili iç standartlar Tablo 1. Kalite kontrol sonuçları. Bir fare modeli, amfizem veri kümesinden toplanan plazma örnekleri, bu çok-haftalık çalışma için günlük olarak alet koşullarını izlemek için analiz edilmiştir. Kantitatif analiz yazılımı, iç standartlar, (n alet QC enjeksiyonlar = sayısı) tepe noktası alanlarını belirlemek için kullanılmıştır.
| Kesir | İyonizasyon modu | Endojen metabolitleri | Ortalama Tepe Alanı | Tepe Alan% CV |
| Sulu | Pozitif | Kreatinin | 2554574 | 2.3% |
| Valin | 3712151 | 3.3% | ||
| Glikoz | 2669190 | % 6.9 | ||
| Nötral lipid | Pozitif | 3-Dehydrosphinganine | 226644 | 3.9% |
| DG (16:00 / 16:01 / 00:00) | 11301 | % 8.2 | ||
| DG (P-14: 0/18: 1) | 364119 | % 1.9 | ||
| Phospholipid | Pozitif | PC (24:0 / 0:0) | 27599 | % 0.9 |
| PC16: 0/22: 6) | 2873326 | % 4.5 | ||
| PI (16:0 / 18:1) | 112998 | 4.4% | ||
| Yağ asidi | Pozitif | 10-okzo-5 ,8-dekadienik asit | 1363284 | 2.3% |
| 16-okso-heptadekanoik asit | 83700 | 2.9% | ||
| 2-metil valerik asit | 285782 | % 5.7 | ||
| Yağ asidi | Negatif | 10-hidroksi-8-oktadesenoik asit | 10042 | % 4.9 |
| (R)-laballenic asit | 173929 | % 6.5 | ||
| 2-keto valerik asit | 35488 | % 6.0 |
Endojen metabolitlerden Tablo 2. Kalite kontrol sonuçları. Insan hastalık veri kümesinden Toplanmış plazma örnekleri ayrı günlerde örnek hazırlama tekrarlanabilirliği izlemek için analiz edilmiştir. Örnekler, üç gün boyunca üç kez hazırlandı (n = 9 prep QC enjeksiyon) tabi tutulmuştur.
Tartışmalar
Klinik metabolomic çalışmaların bir gol hastalık veya tedavi ile ilgili metabolome değişiklikleri tespit etmektir. Bu nedenle numune hazırlama teknikleri, sağlam, tutarlı ve teknisyen teknisyen ve laboratuvardan laboratuvara 22 aktarılabilir olması gerekir. Edilen veriler örnek temsilcisi olması gerekir, ve tespit değişikliği oldukça numune hazırlama hataları daha ayarlamak örnek yansıtmak gerekir. Dolayısıyla doğru pipetleme, doğru sıcaklık, karışmayan katmanlarının verimli durulaştırmanın, azot altında kurutma ve cam ve ipuçları aynı marka ve boyutlarda kullanılması gereklidir.
Protein çökeltme aşaması sırasında, çözeltinin aynı miktarda her bir pelet boşaltıldı çok önemlidir. Bu hacim değişimini azaltır ve gibi örnek veri değişimini azaltır. Bu protein çöktürme adım metabolomic çalışmalar için gerekli olan ve ondan protein kaldırır beri Atlanamayacaköncesinde, küçük molekül için numuneler kütle spektrometresinde analiz profil. Bu patojenler ve büyük makromoleküllerin ortadan kaldırır ve bültenleri proteinlerden 7 metabolitleri bağlı. Numunelerdeki protein birikimi eksikliği HPLC kolon kullanım genişler ve doğruluk ve sonuç kalitesinin. 5. plazma örneklerinde bu tekniği gerçekleştirirken oluşan protein pelet bir tasvir olan Şekil artırır. Bu, küçük moleküllerin tespiti, iyon bolluk artırır ve numune içinde proteinlerinden matris etkilerini azaltır sağlar. Tüm proteinler, bu aşamada çıkarılır varsayılmıştır Ek olarak,, LC-MS analizi sırasında tespit edilen amino asitler, metabolik değişiklikler yerine protein arıza kaynaklı olacaktır.
Iki karışmayan katmanlar halinde, hidrofilik ve hidrofobik metabolitleri tarafından ayrılmıştır sıvı-sıvı ekstre etme aşaması çok önemlidir. Şekil 6 LLE prosedürü ve bir temsilcisi göstermektedirLLE tabakanın resentation. İki tabakadan bir yanlış ayrılması metabolitleri kaybolma ya da her iki fraksiyonda da elüt edilen iki sonuçlanır. Bu adımın dikkatli uygulama hidrofobik kısmını görünür hidrofilik bileşiklerin sayısını azaltır. Bu temsili sonuçlar içeren fraksiyon tespit edilemez çünkü bu bileşikler için sonuçlar güvenilmez hale gelir. Doğru yapıldığında, metaboliti örtüşme azalır.
Özellikle de lipidler değil, aynı zamanda örneğin, tiol grupları ihtiva edebilir, küçük molekülleri, oksidatif bozulmasını önlemek için, oksijene maruz minimumda tutulmalıdır. Bu nedenle, bu işlem her lipit veya tiol içeren bileşiklerin oksidasyonunu önlemek / azaltmak için azot altında gerçekleştirilir. Buna ek olarak, numune ve / veya çözelti transferi örnekleri hızlı bir şekilde kuruması için, sabit bir nitrojen akışı altında yerleştirilir, daha sonra oksijen maruz kalmasını azaltmak için (ilk dakika içinde) hızlıdır. Kuruduğunda, bunlar derhal vardırrilmesi yukarıda bahsedilen nedenlerden ötürü% 100 metanol içinde yeniden süspansiyon haline getirildi.
Laboratuar bir dizi yolla, bu kapsamlı bir yöntem yararlanabilir; Bileşiklerin bir sınıf izole etmek isteyen araştırmacılar, onların ihtiyaçlarına en uygun yöntemi bölümünü seçebilirsiniz. Sadece metabolitlerin bir havuz elde etmek için bir protein yağış gerçekleştirmek isteyenler bunu yapabilir. Hidrofilik metabolitleri, birçok ilaç, amino asitler ve şekerler veya yalnızca hidrofobik metabolitleri örneğin trigliseritler, epoksitler, yağda çözünen vitaminler, ve örneğin fosfolipidler gibi, arzu edildiği takdirde, daha sonra araştırmacılar, sıvı-sıvı özütleme gerçekleştirmek gibi, arzu edildiği takdirde protein çökeltme aşağıdaki adım ve istenmeyen kısmını atın. Hidrofobik bileşikler (nötr yağlar, yağ asitleri ve fosfolipid) daha fazla alt sınıflandırma gerektiren Araştırmacılar fraksinasyon adımla devam edebilir.
Depolama hususlar maintaini önemlidirDaha sonra analiz için numune canlılığı ng. Örnekler yanlış depolandığı takdirde, bozulma veya ayrışma oluşabilir. İdeal olarak, numune hafif hassas türlerin bozulmasını önlemek için ışıktan uzakta vidalı kapaklı amber şişelerde muhafaza edilmelidir. Örnekler 23-25, aynı zamanda metabolit bozulmasını önlemek için -80 ° C'de donmuş halde muhafaza edilmelidir. Burada ayrıntılı olarak ele rağmen, örnekler her zaman LC-MS analizi sırasında otomatik numune tepsisine 4 ° C'de tutulur. Bu, tüm örnekler, sabit bir sıcaklıkta ve çevre sıcaklığında değişiklikler örneklerin viskozitesi, çözünürlüğünü veya stabilitesini etkilemez tutulmasını sağlar. Bu tür LLE ve SPE olarak bu prosedürün manuel görünümleri, ilgili adımlara güven ve rahatlık sağlamak için uygulanabileceği önerilir.
Birkaç sınırlamalar, bu tekniğin var. Hidrofobik ve hidrofilik metabolitlerinin Gizli ayrılması bazı bileşikler özgü olarak meta olacak gibi garantiently nedeniyle, kimyasal bileşimi ve şarj durumu için her iki bölüme aynlır. Şekil 4, protein topak çıkarma aşaması sırasında uygun olmayan örnekleri ve teknik kalite kontrol hem de zayıf tekrarlanabilirlik metabolit neden olabilir gösterildiği gibi, ek olarak. Istatistiksel güç mevcut değildir, çünkü bu özellikle küçük veri kümelerinde istatistikleri etkiler. Bu nedenle, bu adım, tam olarak her bir örnek için, aynı her zaman gerçekleştirilebilir çok önemlidir. Başka bir sınırlama zamanı. Durak noktaları örnekleri dondurulmuş olabilir ve hazırlık ertesi gün de devam bu protokol boyunca olmasına rağmen, bütün bir gün bu yordamı gerçekleştirmek için kenara olmalıdır. Üçüncü olarak, bir biyolojik numune içinde, her bileşiğin iyon bastırılması için değerlendirilebilir değildir. Bu matris her metaboliti nasıl etkilediğini belirlemek mümkün olmadığından, geçerli seçenek teorik endogenou bazı sınıfları taklit dahili standartlar değerlendirmektirs metabolitleri. Son olarak, mutlak tanımlamalar bu yöntemle sadece gerçekleştirilemez. Veritabanı arama ve standartları ile işbirliği içinde tandem MS mutlak metabolit tespiti için gereklidir.
Metabolitler önemli bir kısmı, bileşimlerinin tanımlanmasıdır. Burada ayrıntılı olarak ele rağmen, kalite kontrol örnekleri LC-MS kullanılarak analiz edildi. Çoklu numune hazırlama boşlukları ve enstrüman boşlukları böylece daha güvenilir bir metaboliti hit sonuçlanan kirliliklerden yanlış pozitiflerin oranını azaltmak için plan çıkarma olarak kullanılmak üzere hazırlanmıştır. Bu etaptan sonra, "moleküler özellikleri" sayısının, m / z, tutma süresi, izotop oranı ve gerçek bileşiklerin bir listesini üretmek için adüktleri esasına dayanan bir araya gruplandırıldı. Bileşiklerin listesi büyük ölçüde azaltılmış olsa da, aynı bileşikten birden fazla ek ürünlerine dayalı değildi gibi, sonuçları daha güvenilir. Tam bir yöntem kapsamlı ve isolatio sağlarBu tür nötr lipidler, fosfolipidler, yağ asitleri, trigliseritler, steroidler, aynı zamanda, sulu fraksiyonda hidrofilik sınıfları izole ederken, bunların eikosanoidlerin, şekerler, flavonoidler ve amino asitler 12 tespit edilmiştir, 26 gibi hidrofobik metabolitlerin n.
Açıklamalar
Yazarlar, hiçbir rakip mali çıkarlarını olmadığını beyan ederim.
Teşekkürler
Sunulan öğretici Ulusal Yahudi Sağlık de Kütle Spektrometre Çekirdek Tesis içinde gerçekleştirilen ve geliştirilmiştir. NJH MS tesis CCSTI UL1 TR000154 tarafından kısmen desteklenmektedir. NIH hibe fon P20 HL-113445 ve R01 HL-095432 de bu çalışmaları destekledi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetonitrile | Fisher Scientific | A955-4 | |
| Methanol | Fisher Scientific | L-6815 | |
| Chloroform | Fisher Scientific | C606-1 | |
| Hexane | Sigma Aldrich | 34859 | |
| Acetic acid | Sigma Aldrich | 49199-50ML-F | |
| Methyl tert-butyl ether | J.T. Baker | 9042-03 | |
| Isopropyl alcohol | Sigma Aldrich | 34965-2.5L | |
| Water | Honeywell Burdick Jackson | 365-4 | |
| OA-SYS heating system | Organomation Associates, Inc | Used to keep samples under a constant flow of nitrogen while at 35 °C | |
| 12-position vacuum manifold | Phenomenex | ||
| Strata NH2 (55 µM, 70Å) 100 mg/ml SPE cartridges | Phenomenex | 8B-S009-EAK | |
| Glass pipette tips | Fisher Scientific | 13-678-20C | Used to transfer sample to SPE column |
| Plastic pipette tips | USA Scientific | 1182-1830 | Used when glass tips are not necessary |
| Microcentrifuge tubes | Fisher Scientific | 02-681-320 | |
| Graduated glass pipets | Fisher Scientific | 13-678-27B | Used to transfer organic solvents during sample prep |
| Pyrex glass culture tubes | Corning Incorporated | 99499-16X | Used to store aqueous and lipid fractions until the next step |
| Autosampler vials | Agilent Technologies | 5182-0545 | |
| Snap cap vials for autosampler vials | Agilent Technologies | 5182-0541 | |
| Glass inserts | Agilent Technologies | 5183-2085 | Used for small sample volumes |
| Mass Hunter Qualitative Analysis software | Agilent Technologies | Version B.06.00 | Used to monitor retention times and pressure curves |
| Mass Hunter Quantitative Analysis software | Agilent Technologies | Version B.05.02 | Used to analyze quality control and sample data |
| Mass Profiler Professional software | Agilent Technologies | Version B.12.50 | Used to determine statistics, fold changes, and perform metabolite identification |
Referanslar
- Beckonert, O., et al. Metabolic profiling, metabolomic and metabonomic procedures for NMR spectroscopy of urine, plasma, serum and tissue extracts. Nature Protocols. 2, 2692-2703 (2007).
- Clarke, C. J., Haselden, J. N. Metabolic Profiling as a Tool for Understanding Mechanisms of Toxicity. Toxicologic Pathology. 36, 140-147 (2008).
- Wang, X., Zhang, A., Sun, H. Power of Metabolomics in Diagnosis and Biomarker Discovery of Hepatocellular Carcinoma. Hepatology. 57, 2072-2077 (2013).
- Collino, S., Martin, F. -. P. J., Kochhar, S., Rezzi, S. Monitoring Healthy Metabolic Trajectories with Nutritional Metabonomics. Nutrients. 1, 101-110 (2009).
- Cevallos-Cevallos, J. M., Reyes-De-Corcuera, J. I., Etxeberria, E., Danyluk, M. D., Rodrick, G. E. Metabolomic analysis in food science: a review. Trends in Food Scienc., & Technology. 20, 557-566 (2009).
- Nicholson, J. K., Connelly, J., Lindon, J. C., Holmes, E. Metabonomics: a platform for studying drug toxicity and gene function. Nature reviews. Drug Discovery. 1, 153-161 (2002).
- Wishart, D., et al. . Metabolome Analysis: An Introduction. , 253-288 (2006).
- Vuckovic, D. Current trends and challenges in sample preparation for global metabolomics using liquid chromatography–mass spectrometry. Analytical and Bioanalytical Chemistry. 403, 1523-1548 (2012).
- Bollard, M. E., Stanley, E. G., Lindon, J. C., Nicholson, J. K., Holmes, E. NMR-based metabonomic approaches for evaluating physiological influences on biofluid composition. NMR in Biomedicine. 18, 143-162 (2005).
- Dong, M. W. . Modern HPLC for Practicing Scientists. , (2006).
- Want, E. J., et al. Solvent-dependent metabolite distribution, clustering, and protein extraction for serum profiling with mass spectrometry. Analytical Chemistry. 78, 743-752 (2006).
- Yang, Y., et al. New sample preparation approach for mass spectrometry-based profiling of plasma results in improved coverage of metabolome. Journal of Chromatography A. 1300, 217-226 (2013).
- Folch, J., Lees, M., Stanley, G. H. S. A simple method for the isolation and purification of total lipides from animal tissues. The Journal of Biological Chemistry. 226, 497-509 (1957).
- Matyash, V., Liebisch, G., Kurzchalia, T. V., Shevchenko, A., Schwudke, D. Lipid extraction by methyl-tert-butyl ether for high-throughput lipidomics. Journal of Lipid Research. 49, 1137-1146 (2008).
- Bligh, E. G., Dyer, W. J. A rapid method of total lipid extraction and purification. Canadian Journal of Biochemistry and Physiology. 37, 911-917 (1957).
- Ferreiro-Vera, C., Priego-Capote, F., Luque de Castro, M. D. Comparison of sample preparation approaches for phospholipids profiling in human serum by liquid chromatography–tandem mass spectrometry. Journal of Chromatography A. 1240, 21-28 (2012).
- Michopoulos, F., Lai, L., Gika, H., Theodoridis, G., Wilson, I. UPLC-MS-Based Analysis of Human Plasma for Metabonomics Using Solvent Precipitation or Solid Phase Extraction. Journal of Proteome Research. 8, 2114-2121 (2009).
- Kerns, E. H., Di, L. . Drug-like Properties: Concepts, Structure Design and Methods: from ADME to toxicity optimization. First edn. , (2008).
- Manach, C., Scalbert, A., Morand, C., Rémésy, C., Jiménez, L. Polyphenols: food sources and bioavailability. American Journal of Clinical Nutrition. 79, 727-747 (2004).
- Weimer, J. M., Kriscenski-Perry, E., Elshatory, Y., Pearce, D. A. The neuronal ceroid lipofuscinoses. Mutations in different proteins result in similar disease. NeuroMolecular Medicine. 1, 111-124 (2002).
- Schulze, H., Sandhoff, K. Lysosomal lipid storage diseases. Cold Spring Harbor Perspectives in Biology. 3, (2011).
- Kuhn, E., et al. Interlaboratory evaluation of automated, multiplexed peptide immunoaffinity enrichment coupled to multiple reaction monitoring mass spectrometry for quantifying proteins in plasma. Molecular and Cellular Proteomics. 11, (2012).
- Rist, M. J., et al. Influence of Freezing and Storage Procedure on Human Urine Samples in NMR-Based Metabolomics. Metabolites. 3, 243-258 (2013).
- Boomsma, F., Alberts, G., van Eijk, L., Manin‘t Veld, A. J., Schalekamp, M. A. Optimal Collection and Storage Conditions for Catecholamine Measurements in Human Plasma and Urine. Clinical Chemistry. 39, 2503-2508 (1993).
- Wood, J. T., et al. Comprehensive profiling of the human circulating endocannabinoid metabolome: clinical sampling and sample storage parameters. Clinical Chemistry and Laboratory. 46, 1289-1295 (2008).
- Bahr, T. M., et al. Peripheral blood mononuclear cell gene expression in chronic obstructive pulmonary disease. American Journal of Respiratory Cell and Molecular Biology. 49, 316-323 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır