È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Multicentrico MRI protocollo per la valutazione e la quantificazione della trombosi venosa profonda
In questo articolo
Riepilogo
The goal of this study is to use magnetic resonance venography with long-circulating gadolinium-based contrast agent and direct thrombus imaging for quantitative evaluation of DVT volume in a multicenter, clinical trial setting. Inter- and intra-observer variability assessments were conducted, and reproducibility of the protocol was determined.
Abstract
Abbiamo valutato una venografia a risonanza magnetica (MRV) approccio con gadofosveset di quantificare i cambiamenti di volume totale trombo come criterio principale per l'efficacia del trattamento in uno studio multicentrico randomizzato di confronto monoterapia edoxaban con un regime di eparina / warfarin per acuti, arti inferiori sintomatici trombosi venosa profonda (TVP ) trattamento. Abbiamo usato anche un approccio di imaging trombo diretta (DTHI, senza l'uso di un agente di contrasto) quantificare trombo fresco. Abbiamo quindi cercato di valutare la riproducibilità della metodologia di analisi e l'applicabilità di utilizzare 3D venografia a risonanza magnetica e l'imaging trombo diretta per la quantificazione di TVP in un ambiente studio multicentrico. Da 10 soggetti selezionati casualmente partecipanti al edoxaban trombo Reduction Imaging Study (Etris), il volume totale trombo in tutto il sistema venoso profondo degli arti inferiori è stata quantificata a livello bilaterale. I soggetti sono stati ripreso con sequenze 3D T1W gradiente echo prima (t direttahrombus immagini, DTHI), e 5 minuti dopo l'iniezione di 0,03 mmol / kg di gadofosveset trisodio (risonanza magnetica venografia, MRV). I margini della TVP sui corrispondenti, curve multi-planari immagini riformattate assiali sono stati delineati manualmente da due osservatori per ottenere misurazioni volumetriche del trombi venosi. MRV è stato utilizzato per calcolare il volume totale DVT, considerando DTHI stato utilizzato per calcolare il volume del trombo fresco. Correlazione intra-classe (ICC) e l'analisi Altman Bland sono state effettuate per confrontare la variabilità delle analisi inter e intra-osservatore. L'ICC per variabilità inter e intra-osservatore era eccellente (0,99 e 0,98, p <0.001, rispettivamente) senza pregiudizi su Bland-Altman analisi per le immagini MRV. Per le immagini DTHI, i risultati sono stati leggermente inferiori (ICC = 0.88 e 0.95, rispettivamente, p <0,001), con pregiudizio per i risultati inter-osservatore su appezzamenti di Bland-Altman. Questo studio ha dimostrato la fattibilità di stima del volume trombo in TVP con MRV con gadofosveset trisodio, con buona intra- e inter-osservatore riproducibilità in un contesto multicentrico.
Introduzione
Il tromboembolismo venoso (TEV) colpisce 300,000-600,000 persone negli Stati Uniti ogni anno 1. La trombosi venosa profonda (TVP) è la presentazione più comune di TEV, e più comunemente colpisce il polpaccio, coscia o vene pelviche. La diagnosi, la gestione e il follow-up dei soggetti con TVP non possono basarsi esclusivamente su esami clinici, in quanto i segni ed i sintomi di questa malattia sono aspecifici 2,3. Mentre esami del sangue (come D-dimero) possono aiutare a escludere la diagnosi di TVP, l'imaging è necessario per stabilire la presenza di TVP 4. Ecografia compressione (CUS) è attualmente il test di imaging più comunemente utilizzati nella diagnosi di sospetta TVP acuta. CUS è poco costoso ed ha alta sensibilità e specificità per rilevare TVP acuta 5. Tuttavia, CUS non può valutare in modo affidabile le vene profonde del bacino 6. Inoltre, CUS non può quantificare direttamente il volume trombo e la composizione, che sono importanti quando distinguere between DVT acuta (una potenziale fonte di embolia polmonare (EP)) e TVP cronica (meno probabile che embolizzare) e per la valutazione dell'efficacia terapeutica 7.
A differenza di tomografia computerizzata (CT), la risonanza magnetica (MRI), non garantisce radiazioni ionizzanti, ed è quindi adatto per gli esami di serie per valutare l'evoluzione del trombo o regressione. Rispetto al CUS, la risonanza magnetica in grado di rilevare TVP pelvico e può definire più precisamente prossimale (poplitea vena e sopra) e la gamba distale (sotto poplitea vena) TVP 8, per valutare meglio il rischio di PE. RM può caratterizzare età trombo e organizzazione, e può aiutare a differenziare acuta da TVP cronica 9-11 (arbitri aggiornati). La quantificazione del volume di trombo, un dato importante per valutare l'evoluzione della malattia e la risposta al trattamento, è fattibile con la RM. Protocolli venografia risonanza magnetica correnti vengono eseguite dopo l'iniezione di gadolinio (Gd) i mezzi di contrasto a base 12. Questisono piccole molecole peso molecolare che stravaso rapidamente dopo l'iniezione, e richiedono un'attenta tempismo per cogliere la fase di valorizzazione venosa necessario per visualizzare correttamente il trombo 13,14.
Uno studio proof-of-concept, edoxaban Trombo Reduction Imaging Study (Etris), utilizzando un disegno in aperto, ha valutato l'efficacia e la sicurezza di edoxaban 90 mg una volta al giorno per 10 giorni, seguiti da edoxaban 60 mg una volta al giorno per il trattamento acuta, trombosi venosa profonda sintomatica (ClinicalTrials.gov Identifier: NCT01662908). Etris rivolge sia edoxaban monoterapia, senza concomitante eparina a basso peso molecolare (LMW eparina) al momento di inizio del trattamento, è più efficace del trattamento standard con eparina LMW / warfarin nei soggetti con TVP, come valutato la variazione percentuale (%) da basale in trombo volume / dimensione (misurata con MRI) in occasione della Giornata 14-21.
Un altro obiettivo di Etris era quello di sviluppare e validare un MR sempliceflebografia (MRV) l'acquisizione delle immagini e il protocollo di analisi per la quantificazione del volume di trombo a TVP. Per superare alcune sfide affrontate dalle attuali protocolli MRV in contesti multicentrici, abbiamo utilizzato un, a lungo in circolo, pozza di sangue mezzo di contrasto a base di gadolinio-recentemente approvato dalla FDA (gadofosveset trisodio). Rispetto all'uso di extracellulari chelati a base di Gd (ad esempio, Gd-DTPA) per MRV, gadofosveset ha un tempo di circolazione significativamente più lungo, che permette l'uso di un sistema di acquisizione MR semplice, senza tempi di acquisizioni. Gadofosveset trisodio è un agente di contrasto MRI pozza di sangue che circola per 2-3 ore dopo l'iniezione endovenosa 15,16. Il suo profilo di sicurezza è simile a quelle delle agenzie tradizionali extravascolari extracellulari contrasto MRI 17. Permette stato stazionario l'imaging del sistema vascolare in un periodo di 1 ora. Pertanto, nessun operatore tempistica dipendente di acquisizione delle immagini dopo l'iniezione mezzo di contrasto è richiesta. L'ulteriore vantaggiodi utilizzo di questo agente di contrasto è che è una piccola molecola (peso molecolare 857 Da) 18 e può permeare i lati anche un trombo completamente occlusa, fornendo così un'eccellente contrasto della TVP dalle zone circostanti sulla MRV e consentendo il calcolo quantitativa della TVP volumi. Precedenti studi hanno dimostrato l'affidabilità inter-rater di visualizzare vene utilizzando la venografia MR Volume interpolata apnea Examination (VIBE) utilizzando gadofosveset trisodio 19. Qui, usiamo un approccio simile in un ambiente studio clinico multicentrico per valutare trombosi venosa profonda e utilizzare il volume della TVP misurato con la risonanza magnetica come endpoint. Etris fornisce una piattaforma ideale per valutare la fattibilità e la riproducibilità delle analisi dell'approccio di imaging MRV qui proposto, con un agente di contrasto pozza di sangue a base di Gd lungo circolanti per la valutazione dei volumi TVP. Valutiamo anche l'utilizzo di un approccio di imaging trombo diretta (DTHI) per quantificare l'entità della TVP fresco primal'iniezione di mezzi di contrasto.
Due esami RM sono stati eseguiti durante il corso dello studio: il primo entro 36 ore dopo la randomizzazione nel gruppo edoxaban monoterapia o eparina / gruppo warfarin, e la seconda tra 14 a 21 giorni dopo la randomizzazione. Le analisi di tutte le immagini sono state eseguite da un laboratorio centralizzato nucleo. Volume di trombo fresco è calcolata da un diretto trombo Imaging (DTHI) nelle gambe e bacino inferiore prima dell'iniezione di qualsiasi mezzo di contrasto. Il volume totale di trombo (fresco e vecchio) viene calcolato da un post di contrasto risonanza magnetica flebografia (MRV) le immagini delle vene delle gambe e del bacino inferiore.
Protocollo
Questo studio è stato approvato dai comitati etici locali presso tutti i centri partecipanti. Tutti i soggetti del trial multicentrico ha informato per iscritto il consenso informato a partecipare a Etris presso le rispettive istituzioni.
1. Acquisizione di immagini
- Eseguire la RM su una T scanner tutto il corpo 1.5 T o 3 utilizzando bobine phased array specializzati per MRV come la bobina vascolare periferica, bobine matrice del corpo o bobine run-off. Utilizzare queste bobine in combinazione con altre bobine matrice corpo o bobine della colonna vertebrale. Se non bobine specializzati adatti sono disponibili, utilizzare invece la bobina corpo.
NOTA: utilizzare gli scanner disponibili sul mercato come Siemens Symphony, Sonata, etc.- Soggetto dello schermo, e la revisione MRI questionario di sicurezza prima di eseguire la scansione. Avere cambio soggetto in un abito.
- Inserire una linea endovenosa nella vena antecubitale del soggetto per l'iniezione del mezzo di contrasto. Seguire proc standard di sicurezzaedures per iniettare un agente di contrasto a base di gadolinio-.
- Luogo soggetto in posizione supina, con i piedi prima posizione nella macchina MRI e la posizione corretta bobina sulle regioni da sottoporre a scansione. Bobine protetta tramite cinghie in velcro, se necessario.
- Gambe / piedi del soggetto Fissare per evitare artefatti da movimento durante la scansione MRI.
- Accendere il laser di centraggio e spostare il tavolo fino a quando le traverse laser si trovano appena sotto le ginocchia del soggetto (rotula). Accettare questa posizione per la iso-centro della scansione e spostare il tavolo paziente nella posizione centrale del foro scanner.
- Misurare la clearance della creatinina (CrCl) e determinare la dose del mezzo di contrasto da utilizzare per il soggetto in base al peso corporeo. Se CrCl <30 ml / min, soggetto è escluso dallo studio. Per gli individui con CrCL> 30 ml / min, ma inferiore a 45 ml / min, viene utilizzato 0,01 mmol / kg di mezzo di contrasto. Per gli individui con CrCL> 45 ml / min, ma <60 ml / min, 0,02 mmol / kg di gadofosveset viene iniettato. Per gli individui con normale funzionalità renale (clearance della creatinina> 60 ml / min), viene utilizzata una dose di 0,03 mmol / kg (0,12 ml / kg) gadofosveset trisodio. Un MRI alimentazione compatibile iniettore è utilizzato per iniettare il mezzo di contrasto.
- Eseguire l'imaging bilaterale delle gambe e bacino inferiore in una singola sessione d'esame della durata di circa 60 minuti, come mostrato nella Tabella 1 e descritto in sezione del protocollo MRI.
NOTA: Anonimizza dati del paziente prima del trasferimento di immagini a un laboratorio centrale di base per l'analisi.
2. MRI Protocol
- Eseguire il protocollo di imaging dalla console scanner selezionando ogni passo protocollo dalla finestra del protocollo e trascinandolo nella lista di esecuzione. Una volta pronto, eseguire la sequenza premendo Scan / Esegui o il pulsante equivalente.
- Acquisire gradiente 2D eco sequenze in base utilizzando parametri della sequenza nella tabella 1, nei tre assi ortogonali di immagine da metà polpaccio persopra la cresta iliaca e l'uso come localizzatori / esploratori.
- Eseguire tempo di scansioni di volo (TOF) angiografia in ogni segmento, come specificato nella tabella 1
NOTA: Queste scansioni sono utilizzati anche come localizzatori per aiutare a differenziare le arterie dalle vene come un agente di contrasto lungo circolante è utilizzata a regime in questo protocollo. Questo punto di vista della struttura arteriosa è abbastanza limitato e serve solo per aiutare l'analista immagine differenziare le arterie dalla vascolarizzazione venosa e non serve un angiogramma a tutti gli effetti. - Per evitare di acquisire immagini di qualità scadente a portata inferiore e superiore del volume di rilevamento, acquisizione di tre segmenti coronali 40 centimetri a un piede alla direzione testa sovrapposizione di 10 cm durante i 3D T1-pesate Gradient Echo.
NOTA: Questi tre segmenti comprendono: a) metà polpaccio sopra ginocchio b) sopra ginocchio coscia / bacino inferiore, e c) coscia / bacino per addome figura 1 mostra immagini campione con le tre posizioni di acquisizione.illustrato. - Per distinguere tra trombosi venosa acuta e cronica, acquisire T1W immagini dirette trombo (DTHI) e 3D gradient echo (GRE) sequenze utilizzando parametri nella tabella 1.
NOTA: Questi 3 scansioni servono anche come la scansione di pre-contrasto per l'acquisizione MRV. L'estensione della copertura di queste acquisizioni è uguale alle localizzatori iniziali acquisite nelle tre posizioni illustrate nella figura 1. Sequenza GRE è facilmente implementabile su diverse piattaforme di scansione e di tutti intensità di campo imaging.
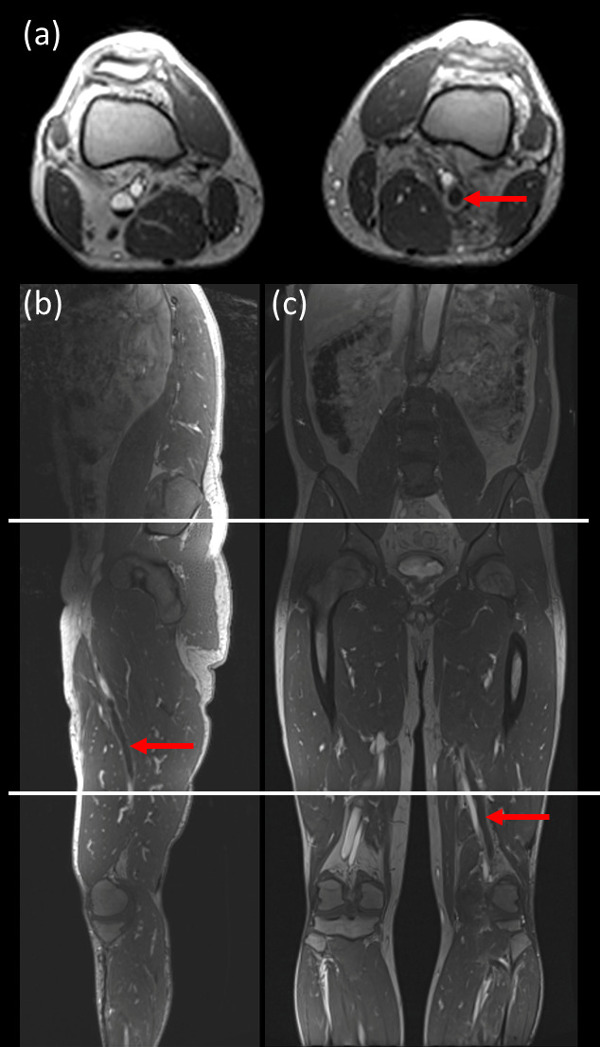
Figura 1:. Esempi di immagini che mostrano le posizioni di acquisizione per i 3 stazioni utilizzate per l'imaging Il campo di vista nella direzione coronale e assiale è stata di 40 cm per ogni posizione letto [acquisizione: (a metà polpaccio a sopra il ginocchio), (sopra le ginocchia a coscia / bacino), (coscia / bacino all'addome)] con 10 centimetri sovrapposizione tra ogni posizione letto. (A) un'immagine assiale; (B) l'immagine sagittale e (c) Immagine coronale. Freccia rossa indica TVP. Clicca qui per vedere una versione più grande di questa figura.
- Somministrare l'agente di contrasto (gadofosveset trisodio) ad una dose di 0,03 mmol / kg (0,12 ml / kg) per via endovenosa nel soggetto ad una velocità di 2 ml / sec e lavare con 20 ml di soluzione fisiologica. Lasciate che l'agente di contrasto circolare per 5 minuti al fine di garantire uno stato stazionario nella pozza di sangue.
- Acquisire immagini MRV; alberino contrasto gradiente 3D sequenze eco a 3 posizioni descritte in precedenza. Vedere i parametri della sequenza nella Tabella 1 e la Tabella 2. Utilizzare queste immagini per determinare le posizioni e le dimensioni dei trombi.
files / ftp_upload / 52761 / 52761table1.jpg "/>
Tabella 1: Lower protocollo venografia estremità MR con l'agente di contrasto, gadofosveset trisodio, tra cui l'imaging trombo diretta.
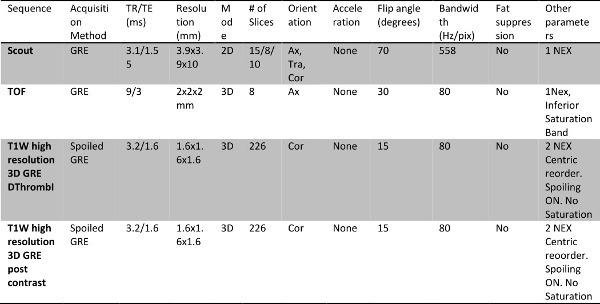
Tabella 2: Il parametro di imaging specifico per ogni sequenza acquisita nel protocollo.
- Dopo la scansione, rimuovere soggetto dallo scanner MRI e prendere la linea per via endovenosa. Chiedere al soggetto a modifiche di abito e uscire dalla struttura.
Analisi 3. Immagine
- Eseguire l'analisi delle immagini su una workstation di analisi di immagine dedicato esecuzione FDA ha approvato il software di elaborazione delle immagini open source come OsiriX MD 20, da 2 analisti di immagini addestrati. Assicurarsi che gli analisti hanno un minimo di 3 anni di esperienza ciascuno.
- Accecare temporaneamente tutte le immagini prima del trasferimento per l'immaginepostazione di lavoro analista per l'analisi.
- Assicurarsi che un radiologo valuta ogni risonanza magnetica per la presenza e la posizione di trombi. Fornire valutazione della radiologo l'analista immagine da utilizzare come guida durante l'analisi.
- Carica tutte le immagini DICOM da entrambe le visite MRI di un soggetto all'interno del software di elaborazione delle immagini selezionando "importazione", e confrontare le due immagini time-punti della serie MRV per ciascun soggetto per garantire un'adeguata copertura e registrazione spaziale attraverso punti di tempo.
- Selezionate lo strumento "3D MPR" visualizzatore di fornire la navigazione simultanea dei dati delle immagini in 3 viste ortogonali (assiale, coronale e sagittale).
NOTA: modalità 3D MPR del software di elaborazione delle immagini consente la visualizzazione dei vasi di interesse.
- Selezionate lo strumento "3D MPR" visualizzatore di fornire la navigazione simultanea dei dati delle immagini in 3 viste ortogonali (assiale, coronale e sagittale).
- Analizzare i seguenti navi se TVP è presente: iliaca esterna, femorale comune, femorale superficiale, profondo femorale, poplitea, tibiale anteriore, tibiale posteriore I &II, gastrocnemio I e II, e peroneo I & II vene. Tutte le analisi è limitata alle regioni dei vasi che sono presenti nelle immagini di entrambe punti temporali.
- Valutare la qualità dell'immagine per ogni vena con TVP conosciuta come indicato dalla valutazione della radiologo su una scala 0-5, con 0-2 essendo inanalizzabile e 3-5 di essere analizzabile per entrambe le sequenze DTHI e MRV. Per la ripartizione del sistema di punteggio Figura 2.
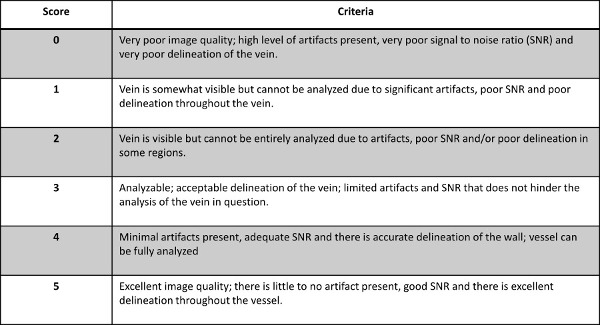
Figura 2: La composizione del sistema di punteggio utilizzato per la valutazione della qualità delle immagini per ciascun filone di interessi con TVP noto.
- Per l'analisi MRV, analizzare ogni nave individualmente. Dopo 3D curvo ricostruzione multiplanare, utilizzare contorni seguito la linea centrale di ogni filone, tracciato dall'analista, per generare percorso curvo per ogni vena e salvare il file.
- Stabilire la posizione del trombo in spazio tridimensionale. Dal piano MPR curva, verrà visualizzato un percorso 3D Bezier.
- Delineare la linea centrale della vena selezionando dello strumento "Contour Path" in "Modalità Creazione".
- Punti Luogo ripetutamente su una delle vista ortogonale MPR per raddrizzare l'intero vaso di interesse.
- Regolare, se necessario, per garantire che la nave è completamente raddrizzato in "Modalità di modifica"
- Quando il percorso profilo viene accuratamente delineato in linea centrale della nave, salvo selezionando l'icona "percorso curvo" per esportare il file
- Generare uno millimetri sezioni assiali perpendicolare al percorso curvo e salvarli come file DICOM (Figura 3). Osservare il percorso curvo, nave si raddrizzò, e corrispondenti immagini assiali per quantificare TVP da immagini MRV.
NOTA: Le immagini di rendering nel visualizzatore 3D MPR curva devono essere esportati in formato DICOM e ha aggiunto al database come una nuova serie di immagini.
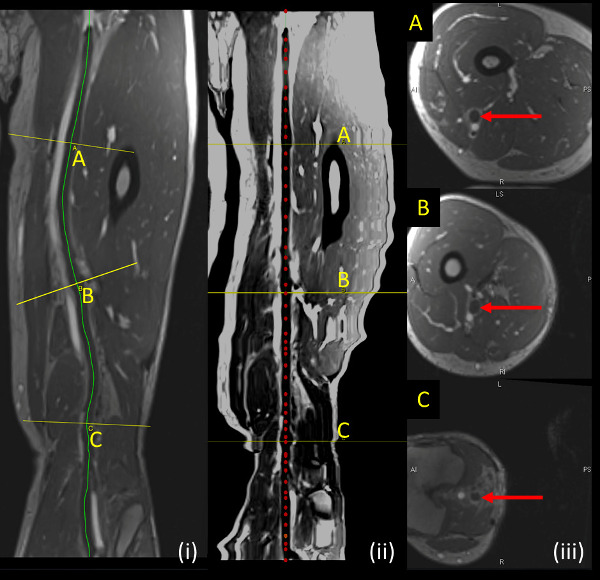
Figura 3:. DVT campione indicato sequenza MRV (i, pannello di sinistra) Percorso curvo (linea gialla) illustra il contorno seguita dalla vena in fase di analisi. (Ii, pannello centrale) nave raddrizzato lungo linea centrale della nave oggetto di analisi (linea rossa tratteggiata) (III, pannello di destra) mostra sezioni assiali perpendicolari alla vena analizzato nei punti indicati da linee gialle (A, B, C) su sezioni longitudinali. Clicca qui per vedere una versione più grande di questa figura.
- Su queste immagini DICOM assiali, manualmente regioni segmento dil'interesse che comprende il trombo (vedi Figura 4) utilizzando il "Closed Poligono ROI Tool". Salva le regioni di interesse a depositare selezionando l'opzione "Salva tutte le ROI di questa Serie" che si trova nel "ROI" menu a discesa e salvare i parametri ROI navigando al menu "Plugins" e selezionare "Strumenti ROI", seguito da "ROI Export ". Questo dovrebbe essere salvato in formato CSV.
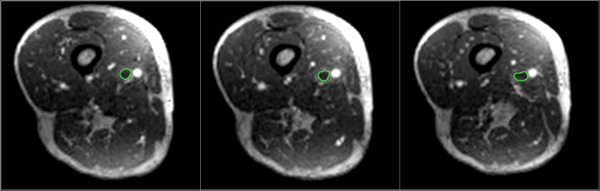
Figura 4:. Regioni segmentate manuale di interesse (verde) sono mostrati comprende il trombo sulle assiali riformattato immagini DICOM Cliccate qui per vedere una versione più grande di questa figura.
- Calcolare il volume trombo moltiplicando l'ar EA su ogni fetta analizzato dal spessore della fetta (1 mm) utilizzando un personalizzato costruito script di Matlab. Calcolare il volume totale di trombi in ogni materia, aggiungendo i volumi trombo in ogni vaso.
- Per l'analisi DTHI, identificare trombo fresco come regioni luminosi sul pre-contrasto scansioni T1W 3D gradiente echo 13 nelle regioni TVP segmentati dal MRV.
- Nelle immagini pre-contrasto assiale, calcolare il volume del trombo fresco disegnando regioni di interesse (ROI) manualmente come mostrato in Figura 5. Nella figura 6, le immagini campione indicano DVT misurata dal DTHI in combinazione con le immagini MRV sono raffigurati.
- Aprire le sequenze pre-contrasto e post-contrasto uno accanto all'altro. Selezionare vista "assiale" e delineare le regioni luminose lungo il vaso di interesse utilizzando il "poligono chiuso ROI Tool".
es / ftp_upload / 52761 / 52761fig5.jpg "/>
Figura 5: TVP campione indicato sulla sequenza di imaging DTHI (a) immagine coronale, (b) di immagini assiali, e (c) Immagine assiale che mostra regione di interesse (verde) tracciato trombo intorno fresca (frecce blu) sulle immagini pre-contrasto.. Le immagini DTHI vengono acquisite prima dell'iniezione di mezzo di contrasto e si basano su contenuti met-emoglobina trombo per produrre il segnale luminoso.

Figura 6:. DVT campione indicato sequenza di imaging DTHI I pannelli di sinistra mostrano immagini MRV con vuoti di segnale indicano TVP totale (frecce verdi). Lo spettacolo pannello di destra corrisponde immagini DTHI con segnale luminoso che indica la presenza di un trombo fresco (frecce blu). Cliccate qui per visualizzare unversione più grande di questa figura.
4. Valutazione della riproducibilità
- Valutare un sottoinsieme di dieci soggetti per la riproducibilità dell'analisi.
- Eseguire l'analisi, come sopra descritto, da due analisti di immagini separate (primari e secondari) lettori di valutare la variabilità inter-osservatore
- Assicurarsi che il lettore primaria esegue anche una seconda analisi di immagine tre mesi dopo la prima analisi per valutare la variabilità intra-osservatore dei risultati.
- Calcola coefficienti intra-classe-correlazione (ICC) e eseguire un'analisi Bland-Altman per valutare inter e intra-osservatore riproducibilità. Effettuare un un campione t-test per cercare pregiudizi su analisi Bland-Altman. ICC> 0.9 e pregiudizi su analisi Bland-Altman sono considerati accettabili.
Risultati
Ai fini delle valutazioni di riproducibilità, la linea di base e seguito delle scansioni sono state riunite e analizzati come casi distinti. Dalle 10 soggetti scelti a caso (2 visite ciascuno), ci sono stati 59 navi con TVP identificate utilizzando l'approccio MRV e 29 navi con trombo fresco identificato dalla DTHI. Nel sottogruppo di questi 10 soggetti selezionati a caso analizzati per le metriche di riproducibilità, non i vasi con TVP sono stati considerati di qualità non-analizzabile (definita come punteggio s...
Discussione
Questo studio ha dimostrato la fattibilità di quantificazione di trombosi venosa profonda su MR venografia con gadofosveset trisodio come agente di contrasto, con ottima riproducibilità delle analisi per quantificare il volume trombo in un contesto multicentrico. Per calcolare il volume totale di trombi, il metodo principale utilizzato post contrasto MRV scansione per misurare il volume di trombi. Il metodo secondario utilizzato è stato l'approccio di imaging trombo diretta (DTHI), sfruttando la presenza di met-e...
Divulgazioni
Venkatesh Mani has received research grants from Novartis. Nadia Alie, Sarayu Ramachandran, Cecilia Besa, Philip Robson and Bachir Taouli have nothing to disclose. Michele Mercuri and Michael Grosso are employees of Daiichi Sankyo. Greg Piazza has received research grants from Daiichi Sankyo, BMS, EKOS, and the Thrombosis Research Institute. Samuel Goldhaber has received grants from BMS, Daiichi Sankyo, EKOS, NHLBI and the Thrombosis Research Institute. He is a consultant for Ariad, Bayer, Boehringer Ingelheim, Bristol Myers Squibb, Daiichi Sankyo, Genentech, Janssen, Merck, Pfizer and Portola. Zahi Fayad has received research grants from Daiichi Sankyo, Roche, GlaxoSmithKline, Merck, VBL Therapeutics, Novartis, Bristol-Myers Squibb, and Via Pharmaceuticals.
Riconoscimenti
The authors have no acknowledgements.
Materiali
| Name | Company | Catalog Number | Comments |
| Ablavar (gadofosveset trisodium) | Lantheus | Contrast Agent | |
| 1.5 T or 3 T Scanners | GE, Siemens, or Phillips | GE (Horizon, Signa, Hdx, 750), Siemens (Symphony, Avanto, Sonata, Trio, Aera) or Philips (Intera, Achieva) |
Riferimenti
- Goldhaber, S. Z. Venous thromboembolism: epidemiology and magnitude of the problem. Best Pract Res Clin Haematol. 25, 235-242 (2012).
- Huisman, M. V., Klok, F. A. Diagnostic management of acute deep vein thrombosis and pulmonary embolism. J Thromb Haemost. 11, 412-422 (2013).
- Ramzi, D. W., Leeper, K. V. DVT and pulmonary embolism. Part I. Diagnosis. Am Fam Physician. 69, 2829-2836 (2004).
- Wilbur, J., Shian, B. Diagnosis of deep venous thrombosis and pulmonary embolism. Am Fam Physician. 86, 913-919 (2012).
- Goodacre, S., Sampson, F., Thomas, S., van Beek, E., Sutton, A. Systematic review and meta-analysis of the diagnostic accuracy of ultrasonography for deep vein thrombosis. BMC Med Imaging. 5, 6 (2005).
- Elias, A., et al. A single complete ultrasound investigation of the venous network for the diagnostic management of patients with a clinically suspected first episode of deep venous thrombosis of the lower limbs. Thromb Haemost. 89, 221-227 (2003).
- Farahmand, S., Farnia, M., Shahriaran, S., Khashayar, P. The accuracy of limited B-mode compression technique in diagnosing deep venous thrombosis in lower extremities. Am J Emerg Med. 29, 687-690 (2011).
- Sampson, F. C., Goodacre, S. W., Thomas, S. M., van Beek, E. J. The accuracy of MRI in diagnosis of suspected deep vein thrombosis: systematic review and meta-analysis. Eur Radiol. 17, 175-181 (2007).
- Moody, A. R. Direct imaging of deep-vein thrombosis with magnetic resonance imaging. Lancet. 350, 1073 (1997).
- Phinikaridou, A., et al. In vivo magnetization transfer and diffusion-weighted magnetic resonance imaging detects thrombus composition in a mouse model of deep vein thrombosis. Circ Cardiovasc Imaging. 6, 433-440 (2013).
- Phinikaridou, A., Qiao, Y., Giordano, N., Hamilton, J. A. Detection of thrombus size and protein content by ex vivo magnetization transfer and diffusion weighted MRI. J Cardiovasc Magn Reson. 14, 45 (2012).
- Carpenter, J. P., et al. Magnetic resonance venography for the detection of deep venous thrombosis: comparison with contrast venography and duplex Doppler ultrasonography. J Vasc Surg. 18, 734-741 (1993).
- Westerbeek, R. E., et al. Magnetic resonance direct thrombus imaging of the evolution of acute deep vein thrombosis of the leg. J Thromb Haemost. 6, 1087-1092 (2008).
- Koizumi, J., et al. Magnetic resonance venography of the lower limb. Int Angiol. 26, 171-182 (2007).
- Goyen, M. Gadofosveset: the first intravascular contrast agent EU-approved for use with magnetic resonance angiography. Future Cardiol. 3, 19-26 (2007).
- Aime, S., Caravan, P. Biodistribution of gadolinium-based contrast agents, including gadolinium deposition. J Magn Reson Imaging. 30, 1259-1267 (2009).
- Shamsi, K., Yucel, E. K., Chamberlin, P. A summary of safety of gadofosveset (MS-325) at 0.03 mmol/kg body weight dose: Phase II and Phase III clinical trials data. Invest Radiol. 41, 822-830 (2006).
- Zhang, H. Trisodium-[(2-(R)-[(4,4-diphenylcyclohexyl)phosphono-oxymethyl]-diethylenetriamin epentaacetato)(aquo)gadolinium(III). Gadofosveset. , (2004).
- Pfeil, A., et al. Magnetic resonance VIBE venography using the blood pool contrast agent gadofosveset trisodium--an interrater reliability study. Eur J Radiol. 81, 547-552 (2012).
- Rosset, A., Spadola, L., Ratib, O. OsiriX: an open-source software for navigating in multidimensional DICOM images. J Digit Imaging. 17, 205-216 (2004).
- Ouriel, K., Greenberg, R. K., Green, R. M., Massullo, J. M., Goines, D. R. A volumetric index for the quantification of deep venous thrombosis. J Vasc Surg. 30, 1060-1066 (1999).
- Elias, A., et al. A single complete ultrasound investigation of the venous network for the diagnostic management of patients with a clinically suspected first episode of deep venous thrombosis of the lower limbs. Thromb Haemost. 89, 221-227 (2003).
- Farahmand, S., Farnia, M., Shahriaran, S., Khashayar, P. The accuracy of limited B-mode compression technique in diagnosing deep venous thrombosis in lower extremities. Am J Emerg Med. 29, 687-690 (2011).
- Thomas, S. M., Goodacre, S. W., Sampson, F. C., van Beek, E. J. Diagnostic value of CT for deep vein thrombosis: results of a systematic review and meta-analysis. Clin Radiol. 63, 299-304 (2008).
- Heverhagen, J. T., Krombach, G. A., Gizewski, E. Application of Extracellular Gadolinium-based MRI Contrast Agents and the Risk of Nephrogenic Systemic Fibrosis. Rofo. , (2014).
- Alhadad, A., et al. Safety aspects of gadofosveset in clinical practice - analysis of acute and long-term complications. Magn Reson Imaging. , (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon