Method Article
RNAi的触发传送到
摘要
RNA interference (RNAi) is an extremely valuable tool for uncovering gene function. However, the ability to target genes using RNAi during pre-adult stages is limited in the major human malaria vector Anopheles gambiae. We describe an RNAi protocol to reduce gene function via direct injection during pupal development.
摘要
RNA interference (RNAi), a naturally occurring phenomenon in eukaryotic organisms, is an extremely valuable tool that can be utilized in the laboratory for functional genomic studies. The ability to knockdown individual genes selectively via this reverse genetic technique has allowed many researchers to rapidly uncover the biological roles of numerous genes within many organisms, by evaluation of loss-of-function phenotypes. In the major human malaria vector Anopheles gambiae, the predominant method used to reduce the function of targeted genes involves injection of double-stranded (dsRNA) into the hemocoel of the adult mosquito. While this method has been successful, gene knockdown in adults excludes the functional assessment of genes that are expressed and potentially play roles during pre-adult stages, as well as genes that are expressed in limited numbers of cells in adult mosquitoes. We describe a method for the injection of Serine Protease Inhibitor 2 (SRPN2) dsRNA during the early pupal stage and validate SRPN2 protein knockdown by observing decreased target protein levels and the formation of melanotic pseudo-tumors in SRPN2 knockdown adult mosquitoes. This evident phenotype has been described previously for adult stage knockdown of SRPN2 function, and we have recapitulated this adult phenotype by SRPN2 knockdown initiated during pupal development. When used in conjunction with a dye-labeled dsRNA solution, this technique enables easy visualization by simple light microscopy of injection quality and distribution of dsRNA in the hemocoel.
引言
疟疾是一种由蚊子传播的传染病,每年影响数以百万计的个人。世界卫生组织(WHO)报告说,在2013年大约有584000人死于疟疾,78%,其中发生在儿童五年1岁。导致人类疟疾的病原体是疟原虫属内顶复门寄生虫和按蚊雌性蚊子在人类宿主之间的传输。当蚊子采取血粉从谁被感染的个体,然后存款感染寄生虫进入未感染的个体在随后的血粉发生传输。在按蚊属, 冈比亚按蚊是最大的矢量能力的物种,是撒哈拉以南非洲地区1-3最突出的疟疾向量。
目前,由杀虫剂部署蚊虫媒介控制继续到bË用来减少人类疟疾负担的主要方法。虽然自上世纪60年代使用杀虫剂已被证明是非常成功的,抗药性的兴起,带动需要新的杀虫剂和替代的媒介控制策略4-7发展。 2010年期间,共有49 63个国家向世卫组织报告的说明杀虫剂抗药性疟疾媒介1的发生。此外,IR映射工具,它采用同行评议的文献,评估Afrotropical地区性数据,报告说,2001年和2012年间有阻力分别为7 46%和27%提高到拟除虫菊酯和滴滴涕。
RNA干扰(RNAi)在90年代初被认定为可能被用来灭活在矮牵牛工厂8,9和真菌孢霉 9,10基因的技术。此后不久,在1998年,RNA干扰最早在秀丽隐杆线虫记录为通过经由注射或进料的方法9,11-引入反义或双链RNA(dsRNA)的的减少在动物模型中的基因表达的一种手段。自从被发现以后,RNA干扰已被使研究人员能够利用反向遗传学通过高选择性转录后基因沉默机制,以迅速调查目的基因的功能角色,彻底改变了功能基因组学的追求。在一些生物如黑腹果蝇 ,使用表达干扰RNA构建体的转基因生物的已经用于基因敲除(KD)广泛的成功。虽然在一个使用转基因的。冈比亚为RNA干扰已被利用,并且可能被证明为大型屏幕是有用的,转基因蚊的菌株的产生是劳动力和时间密集的,一般服用两到三个月从识别的感兴趣的基因的给generati去在合适的转股价12。目前, 一个基因KD的主要方法。冈比亚是通过注射入血淋巴,在成年阶段,dsRNA的特异于给定基因12,13。这个过程通常需要一个月左右,从感兴趣的基因KD的评估基因鉴定去了,证明是比转基因方法12更加迅速。幼虫阶段的RNAi方法一直在一家新近成立的。基于微藻冈比亚和埃及伊蚊通过纳米颗粒喂养14-17或口服给药dsRNA分子18,提供机会在开发的早期阶段进行功能基因组分析。在直接喷射,进料,和纳米颗粒递送方法,双链RNA溶于自主由靶细胞和裂解由酶Dicer的成21-25核苷酸长"短干扰RNA"(siRNA的)19,20。这些siRNA然后incorporated入RNA诱导的沉默复合物(RISC)中,从其中一条链将被丢弃,从而允许所述RNA结合的RISC复合物结合并切割靶mRNA,从而降低其电平,并抑制其翻译19,20。
基本蚊生物学的许多内在特性矢量调制能力,包括主机偏好( 例如 ,嗅觉,味觉),交配,繁殖和免疫。鉴于这些生物过程的重要性,它很可能是他们的基因或药物水平调节将提供矢量控制的新机遇,包括杀虫剂抗性的规避,以及更广泛的综合方法,以矢量管理提供了新的工具。利用功能基因组学,评估基因基本这些内在的生物学特性的角色将启用新的目标识别和提供新的见解,我们如何才能有效地建立新的,更有效的控制战略中IES。我们描述了在An的蛹期开始的RNAi迅速注入方法的开发和使用。冈比亚 。我们观察到的RNAi触发器的蛹期注射能够产生的表型的观察早期的成年人, 即出现比,如果基因敲除成人发起苗后将观察后越快。此方法使基因拦截蛹发育间隔期间开始并延伸到成人的阶段,使得蛹发展期间启动基因敲除能坚持和影响成年早期血淋巴访问的细胞类型,以及细胞类型是变态期间更血淋巴访问的那比在成年人,例如在以下出现成人附属物发现感觉神经元。
研究方案
1.合成和制备的dsRNA
- 确定一个200-800碱基拦截区域(以产生相应的dsRNA)被预测为没有可识别的脱靶效应的感兴趣的基因内( 例如 ,另一种基因中没有序列同源性≥18碱基对)和阴性对照( 例如中,异源序列是不是目标昆虫基因组中存在,如大肠杆菌 lacZ基因(GenBank登录号基因ID:945006)。另外,使用阳性对照( 例如 ,它产生一个容易观察的表型,如SRPN2 21,22 ,GenBank登录基因ID:1270169)所述dsRNA靶向SRPN2的序列在Michel 等人的定义(2005)21。
注:E-RNAi是一种开源生物信息学的资源,为这样的区域的鉴定和用于设计寡核苷酸引物23的过程是有用的。 - 施行TANDARD PCR扩增( 即 ,在使用Taq DNA聚合酶30-35个循环),使用基因组DNA或cDNA模板以获得由T7启动子序列侧翼的dsRNA合成的模板(5'-TAATACGACTCACTATAGGG-3')中,用的dsRNA制剂进行并清理用市售的体外转录试剂盒按照制造商的说明。使用SRPN2 PCR扩增条件和作为所述的等人提出的引物信息。(2011)22。
- 量化由紫外吸收光谱纯化的RNA扩增子的产量在260毫微米波长,并调整到在无RNase水所需的浓度( 例如 ,3微克/微升)。
- 为低的RNA浓度进行故障排除,通过纺丝样品在室温下的真空离心机向下或通过冻干样品和在水较小体积重构减少液体体积。样品冻干所需要的时间将根据变化初始样品体积和双链RNA的浓度。
- 检查dsRNA的质量和长度上用1×TBE或TAE制备的2%琼脂糖凝胶缓冲液和用溴化乙锭(EtBr的)染色,与用于转录反应的模板DNA一起。的dsRNA会更慢比迁移模板DNA。质量和长度可以确保没有非特异性dsRNA的产品,分别比较产品与标准DNA标记,进行评估。
注意:乙锭是一种强效的诱变剂,应作相应处理。
注:在3微克/微升的dsRNA的浓度,0.5微升样品的比足够在溴化乙锭 - 染色的琼脂糖凝胶的可视化多。 - 直到需要在-20℃储存的dsRNA。多个冷冻/解冻循环可能导致退化,所以等分应为大量的dsRNA来制备。
2.准备快绿FCF染料(FGD)管
- 快速稀释绿FCF染料从在无RNase水原液(≥85%染料含量)至0.1%(体积/体积)(工作液)。
- 吸管1μl的染料至1.5 ml微量离心管的底部。
- 在约3小时的65℃加热块地方管在室温下蒸发液体,然后发生管为至少30分钟,在使用前冷却。这种干燥的固体染料将在dsRNA的悬浮液重建。
3.将注射针头
- 拉用热针车夫到10-30微米的尖端直径硼硅玻璃针。拉设置对应于:加热器调整没有。 1 = 100,暖风调整没有。 2 = 70。
- 为避免对针的细尖损伤,水平放置所有拉动针在培养皿上成形油灰的带状。
注意:毛细管针拉方法的更多的信息可以在进一步详细疟疾研究和参考试剂资源中心级M发现R4手册24。
4.准备注射站
- 收集所需材料:玻璃微细针被拉至精尖,微量,薄滤纸厚滤纸,培养皿,移液管,油漆刷和解剖光学显微镜。
- 准备微量作为微量人工指示,和注射量设定为每脉冲所需的音量( 例如 ,最高不超过69脉冲NL的)。
- 在一个平台上,很容易在显微镜下操纵( 例如 ,泡沫塑料管架的平坦的侧面),堆叠两个滤纸片在顶部薄滤纸,并与周围的边缘胶带固定。
- 重悬10微升在不同的着色染料管各dsRNA的解决方案,并在冰上的地方。
5.收集蛹注射液
- 填充小60毫米×15毫米的培养皿用10毫升去离子水,并收集〜50浅蛹(杜里纳克从使用一次性塑料移液管的养虫托盘化蛹后的第一个24小时)。
- 删除具有中等至暗角质层晒黑的蛹。
注意:一旦角质层开始晒黑,变得更加难以穿透角质层,并注射导致高得多的杀伤力。
6.注射的dsRNA
- 根据解剖显微镜,撅着注射针的远端有一对细镊子的。
- 通过回填与矿物油的针(使用具有3英寸,30号针头的注射器),并且与微量排出多余的油制备的注射针。
- 前填充注射针与dsRNA的最大数量,并在显微镜下喷射一个脉冲,以确保液体的分配。在没有液体被吸收和/或排出的情况下,检查针的远侧末端为任何堵塞,并确保针头牢固地固定在microinjecto河
- 挑蛹1-3,并将其放置到滤纸上。
- 使用画笔,定位在与背角质层访问的滤纸的蛹,并使用画笔推的滤纸上,并吸收过量的水。
- 稳定与画笔的尖端蛹,而在大约30°相对于蛹的背水面的角度针头插入的胸部和腹部之间的背角质层。注射应朝向蛹和针的后端被导向应的前至后方向上移动。
- 注射3微克/微升dsRNA的解决方案两个脉冲(每个脉冲69 NL)进入淋巴,并为您的色彩在整个体内的分布。如果没有颜色标识,稍移注射针的位置从障碍物清除尖和重复液体输送。
- 使用湿画笔轻轻地从针移动到蛹水养殖。 ŧ他蛹应该坚持在光接触画笔。
7.注射后条件
- 将培养皿注射蛹成蚊笼合适的气流( 例如 ,网笼或网状盖容器)。蛹饲养条件应在27±3℃的温度始终保持75±5%的湿度和是一个光下:8小时:16的暗循环。
- 制备10%(重量/体积)的葡萄糖溶液,并放置溶液饱和的棉球上蚊子笼网为成人喂养。
8.评估击倒
- 在所需的时间点上,在实验性的dsRNA注射昆虫评估表型,与对照组相比。
- 每日评估dsSRPN2和dsLacZ昆虫通过在-20℃冷却下成人为约2-3分钟,以2℃将它们转移到一个冷板和15X通过解剖显微镜的利用识别任何伪肿瘤形成放大倍率与明照明。评估后,返回成人杀虫条件(27±3℃,75±5%的湿度)。
注:在本协议所使用的实验和控制的dsRNA分别为dsSRPN2和dsLacZ。有适合于控制许多选项;然而,有人建议,阳性对照为哪些表型和/或表达是很容易可视化( 例如 ,通过解剖显微镜法)和/或定量[ 例如 ,定量实时PCR(QRT-PCR),免疫印迹]应该使用学习通过Western印迹和定量RT-PCR检测了这种技术。SRPN2蛋白和转录物定量时,分别在Michel 等人。(2005)21中描述。
- 每日评估dsSRPN2和dsLacZ昆虫通过在-20℃冷却下成人为约2-3分钟,以2℃将它们转移到一个冷板和15X通过解剖显微镜的利用识别任何伪肿瘤形成放大倍率与明照明。评估后,返回成人杀虫条件(27±3℃,75±5%的湿度)。
结果
蛹注射基因KD收率当在早期蛹期进行注射最佳的结果,当角质层晒黑水平低( 图1A,左和1B)。晒黑增加角质层硬化,一般24小时,导致增加的蛹死亡注射后(图1A,中,右)后。蛹发展的速度可以根据杀虫条件和动物密度24,25变化;因此,最好是在视觉上评估色素沉着。
在注射过程中,毛细管针以约30°的前方后方向( 图2A)的角度插入到背角质层。一旦针插入和所述dsRNA + 0.01%(重量/体积)的FGD被分配,染料的分布在整个血淋巴是明显的(Figu重新2B)。
对蛹羽化评价注射0.01%(重量/体积)的FGD显示70%出苗的平均速率,相比未注射的对照组( 图3A)的96.7%出现。值得注意的是,观察到了大量的非存活的蚊子( 图3B)从蛹壳局部出现。注射的动物表现出出苗时间没有延误( 图4A)或任性别( 图4B)偏见的影响。成人生存的其他评估进行了长达10天,出苗后发现在出苗后成人生存( 图4C)无明显影响。
KD质量验证通过与SRPN2相关击倒21,22作为击倒和阳性对照的黑色素假性肿瘤(重水复疑无路色素组织簇)的表型评估不存在与dsLacZ注射作为阴性对照关联的表型。所出现的成蚊在8天注射后(6-7天出苗后)进行评分。黑色素伪肿瘤( 图5A和5B)通过的dsSRPN2与93.5%的角质层观察在dsLacZ成蚊( 图6A)的0%。黑暗组织白化集群对色素斑( 图5C)的解剖鉴定。伪肿瘤对成人角质层早3天苗后均可见和也存在于dsSRPN2血淋巴和肠组织中的一个子集(未示出数据)。在5后喷射(成年早期阶段),显著在dsSRPN2下降SRPN2水平,但观察到未dsLacZ或非注入血淋巴分离蛋白( 图6B)。
ftp_upload / 53738 / 53738fig1.jpg"/>
图1:蛹的dsRNA注射发育分期的dsRNA导致最佳存活和进展到成年期的早期蛹注射。角质层的色素沉着水平低(A,左,和B)可以在第一0-24小时以下化蛹内被观察到。生存贫困人口的蛹表皮注射前(A,中,右)的结果适中晒黑。
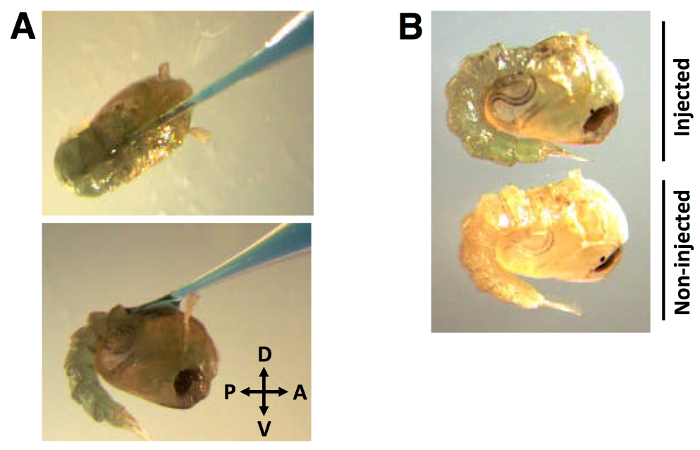
图2:注射位置和染料标记的双链RNA(A)的毛细管针注射染料标记的dsRNA进入背角质层的分布在约30°的角度,在从前到后的方向。 (B)的该染料明显地分布在蛹血淋巴。的dsRNA注射体积138 NL的,标有0.01%FGD(重量/体积)。

图3:后喷射成虫羽化 (A)的蛹的70%与0.01%的FGD注射(重量/体积)在成功出现(N = 60),相对于未注射的对照(n = 60)的96.7%。进行三次生物学重复。观察到大量非存留蚊子(B)从蛹壳部分出现。误差棒代表平均值(SEM)的标准误差。
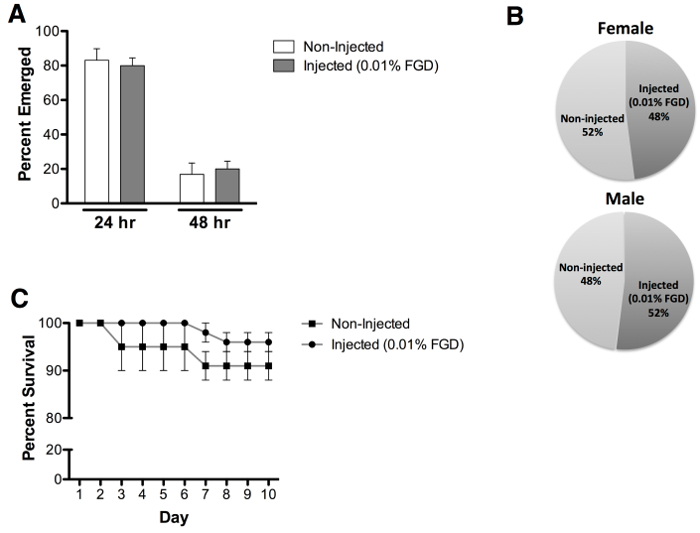
图4:出苗速度,性别评估和成人存活 (A)中观察到可比出现倍以下蛹注射含0.01%的FGD(24小时= 80%和48小时= 20%),相比于未注射蛹(24。 HR = 83%和48小时= 17%)。 (B )观察到0.01%的FGD注射蛹(女性= 48%和男性= 52%)和未注射的蛹(女性= 52%和男性= 48%),大约等于雌雄成虫羽化。 (C)生存分析结果显示,注射0.01%FGD不影响成人生存,评估多达10天出苗后。结果从含0.01%的FGD三个独立实验注射(60例)和未注射的(60)蛹(男性和女性的相等数目)表示的数据。误差棒代表平均值(SEM)的标准误差。

图5:伪肿瘤阳性对照表型反映成功的击倒上观察到的(A)的腹部和dsSRPN2的(B)的胸椎角质层-injected伪肿瘤,但不dsLacZ在第8天注射后-injected成人蚊子。(C)高倍(400X)角质层和色素斑块的解剖成像(A)(B)揭示黑暗变暗细胞群。
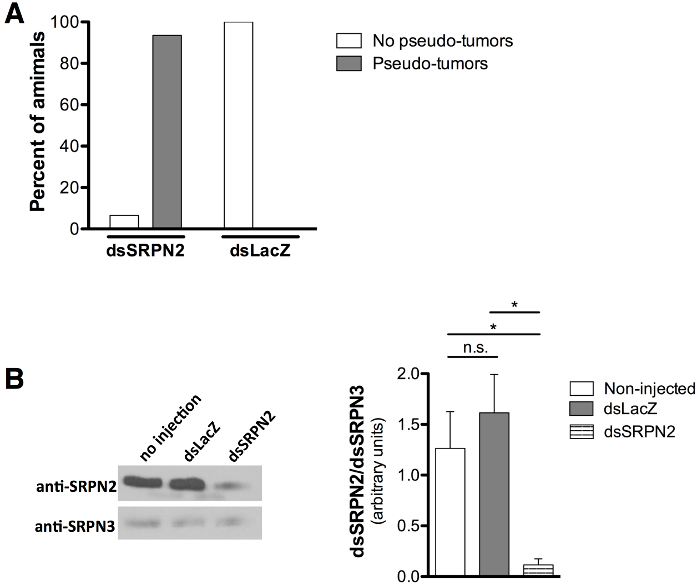
图6:假性肿瘤的形成量化,降低SRPN2蛋白水平 (A),蛹期注射导致假性肿瘤形成的dsSRPN2成年人93.5%(N = 21)相比,dsLacZ对照为0%(N = 19)。 。结果得到的第8天后注入。 (B)蛋白质印迹(左)的节目在dsSRPN2降低SRPN2水平,但不dsLacZ或非注入血淋巴分离蛋白(第5天注射后)。结果基于三个独立的实验。使用的抗SRPN2 21和抗SRPN3 26抗体稀释度为1:分别2,000:1,000和1。山羊抗 - ラ5000:BBIT的IgG-HRP(产品SC-2004,Santa Cruz公司,达拉斯德克萨斯州)1使用。所有蛋白水平进行定量(右)通过条带强度(ImageJ的软件,美国国立卫生研究院,贝塞斯达,MD)归一化到SRPN3,和统计由非配对t检验进行比较。 P <0.05 *,P≥0.05:NS(不显著)。误差棒代表平均值(SEM)的标准误差。
讨论
在蚊子引起的非转基因的RNAi目前的方法包括直接注射双链RNA进入成人血腔12,13或RNAi触发包覆的纳米微粒14-17或微藻为基础的dsRNA分子18幼虫取食。针对成蚊,而极有价值的,可以排除大量在早期发育阶段的功能基因。由幼虫喂养发起击倒可通过蛹期期间,由于成年阶段得到不一致的表型,在部分地可变蛋白的持久性的潜力。因此,引入了在蛹开发期间发起的RNAi将提供更加完全地评估期间成人预的发育阶段的基因功能,以及增强的能力时成人阶段来评估基因功能的装置专门针对一个额外的方法。与基于双链RNA注射或表达,基因敲除的持久性基因敲除的方法无法预测。因此,成绩单或蛋白质水平应在感兴趣的发育阶段进行评估感兴趣的基因。虽然我们观察到的延续的降低在5天注射后在SRPN2双链RNA注射的动物SRPN2蛋白水平的因子,如蛋白质周转和半衰期可以为不同的目标不同。关键是要保证,以及,要被用于注射所述dsRNA是很好浓缩并出现在琼脂糖凝胶上完好无损。我们建议实验者重新评估这些因素,如果击倒效果是不够的,并且双链RNA的各自的浓度,可能需要对特定基因靶凭经验测试。
我们描述了在An的蛹期用于RNA干扰的开始的方法。冈比亚发展。此方法依赖于通过dsRNA的显微注射引入直接进入早期蛹的血腔,并且允许通过注射质量的评价使用染料标记的dsRNA。形象化注射质量的能力构成用于确保成功击倒的关键的提高和构成还没有在大多数先前报道基于双链RNA协议侧重于成年阶段被认为是喷射型的基因敲除的一个方面。通过靶向在此发育期间,基因这一关键发育间隔期间可能发挥作用的发作的蛹,或在成年的早期阶段可以在功能上进行评估。此外,这种方法可以使双链RNA递送至细胞中,并建立RNA干扰中是变态期间访问的细胞,但在完全形成成蚊较少访问。
通过哈克等人最近的微阵列分析(2012)确定的560。冈比亚转录物被上调或至少4倍期间不同发育阶段下调,从胚胎到成年。 56的0成绩单标识,一套309被蛹发育期间27上调。这些结果表明,有对差异基因表达许多要求整个蚊发展,包括那些在蛹期所发生的,在此期间,该生物体经历变态的间隔。在许多昆虫物种,包括一种。冈比亚 ,参与诸如发展( 即蛹表皮和甲壳素结合蛋白)过程的基因27-31和免疫反应( 即收费受体样蛋白)27,32-34高度在蛹期表达。一旦完全形成成人已经出现,有继续应对环境和生理变化35基因的表达。值得注意的是,早期成年开发期间,有一个增加发育基因( 例如 ,成人表皮和肌浆蛋白)36,的表达以及其它关键基因( 即 ,精子特异性蛋白和细胞色素P450酶代谢)27,36。
在这个协议中,SRPN2的开发中使用的阳性对照,是一个。冈比亚丝氨酸蛋白酶抑制剂(丝氨酸蛋白酶抑制剂)。 SRPN2起着昆虫黑化,在昆虫21,22广谱先天免疫应答的负调节中起重要作用。在伪肿瘤形成21,22,即很容易被利用光学显微镜的观察到的表型成蚊结果SRPN2的击倒。鉴于这一独特的表型可在现场昆虫轻松得分,我们采用SRPN2初始蛹期的RNAi注射。此外,SRPN2是在所有发育阶段表达37,从而为蛹期的RNAi注入和功能评估好目标在早期的成人。我们表明,我们已经开发的方法能够诱导类似成人黑色素理想跟踪准的邻肿瘤形成的过程中发展的蛹期进行的双链RNA注射的结果。在制定这个协议,我们已经观察到,注射蛹早期发育过程中( 即幼虫,蛹蜕皮后的第一个24小时)是获得最佳成虫羽化的关键。在出现穷人获得注射后的情况下,我们建议分期幼虫更准确,获得蛹用更少的广泛角质层硬化,并保证早期蛹期注入的实现。此外,在注射过程中最小化对在最佳的出现率角质层结果损坏和增加放大率可帮助确保只有动物的预期区域被刺破。如果针应通过穿刺到腹侧角质层,染料标记的液体的池将在蛹的外部明显或将饱和滤纸。强烈建议丢弃有多个角质层刺穿任何蛹。
jove_content">随着许多实验室的成人蚊注射剂的性能的广泛的经验,先前确定微注射方法可以适于与简单的协议修改为在蛹RNAi实验中使用。总体而言,该方法的目标是提供研究者的能力展开期间反向遗传分析可以进行,进一步使研究,将支持的新颖矢量控制策略的发展的时间框架。有趣的是,在其它物种,如吸血蝽和草地贪夜蛾的实验中,揭示了该基因沉默效应往往是多当更多的预成年期间开始阶段38,39。在发展的各个阶段,击倒RNAi介导的基因是受到有关速度和基因沉默的持久性,并通过有针对性的基因编码的蛋白质的稳定性考虑,理想的RNAi靶基因往往是那些编码一个protein或RNA具有半衰期短,高周转率11,40。而转基因的RNAi策略也可使用,以解决在成人预阶段就迅速和RNAi的持久性考虑,转基因技术有很多缺点( 例如 ,转基因株系的生成所需要的时间,实验时限蚊子交配以产生昆虫与双链RNA监管的表达,和转基因股维护)。相比之下,我们的协议得到了发展蛹期间和源于且变态期间访问,但在成人不易进入细胞类型的启动基因敲除的方便和快捷的方法。使用染料标记的dsRNA混悬液允许注射成功的容易评估和蛹内引入材料的分散。我们对肿瘤形成在蛹注射成人发病数据相比,注射作为成年人的动物,是使用init一致在蛹期iation RNAi介导击倒。使用我们的G3蚊子线和我们的养虫室条件下,我们观察到早10天的成人注射后注入三到五天出苗后成年黑色素伪肿瘤的形成。通过进行早期蛹阶段喷射,我们早在五天后注射( 即 ,三至四天后出现)观察可见黑色素假性肿瘤的形成。这些数据意味着,这种方法能够在一个以前在深入研究的发展期( 即蛹发育)的基因敲除的开始。我们的染料标记方法也可能被证明为新幼虫注射协议的发展是有用的,由于角质层的过程中所有的幼虫龄的半透明性质。虽然在本研究中使用的控制需要进展到成年阶段来显示击倒表型,今后的实验,以评估在注射后早期蛹将提供蛹阶段特异性的表型对于这种方法为额外的发育阶段的扩张宝贵的见解,如后期蛹发展。总之,这种方法提供了RNAi介导的基因敲除的蛹期开始了宝贵的RNAi协议,增加可用的矢量昆虫研究社区内利用功能基因组学的工具。
披露声明
此视频文章开放获取是通过生物遗传支付。
致谢
We would like to thank Dr. Flaminia Catteruccia and her research group (Harvard School of Public Health, Boston, MA) for providing our laboratory with the G3 colony used in this research and for the LacZ template DNA. We thank Adam Jenkins (Boston College, Chestnut Hill, MA) for his assistance in maintaining the insectary. The Biology Department of Boston College generously funded the research associated with the development of this technique.
材料
| Name | Company | Catalog Number | Comments |
| MEGAscript RNAi kit | Ambion | AM1626 | |
| Nanoject II injector | Drummond | 3-000-204 | |
| Nanoject II foot switch | Drummond | 3-000-026 | |
| Borosilicate glass capillaries | Drummond | 3-000-203-G/X | |
| Glass micropipette puller | Narishigne | PB-7 | |
| Fast Green FCF dye | Sigma | F7258 | Can substitute with a non-toxic food dye. |
| Plastic transfer pipettes | Thermo Scientific | 1371150 | ¼ inch cut from tip to create a wider opening. |
| Whatman “thin” filter paper | GE Healthcare | 1001-090 | This is 9 cm diameter Grade 1, but can be altered depending on size of injection pad. |
| Western blot “thick” filter paper | BioRad | 107-3931 | This is the filter paper generally used for Western blots. |
| Petri dishes (60 mm x 15 mm) | Fisher Scientific | FB0875713A | |
| Paint brush (size 0) | Michael’s Art | 10474940 | Brush size and brand can vary based on availability and user preference. |
| Dissecting light microscope | ---- | ----- | This can vary based on availability and user preference. |
参考文献
- Kelly-Hope, L. A., McKenzie, F. E. The multiplicity of malaria transmission: a review of entomological inoculation rate measurements and methods across sub-Saharan Africa. Malar. J. 8 (1), 1-16 (2009).
- The malERA Consultative Group on Vector Control. A Research Agenda for Malaria Eradication: Vector Control. PLoS Med. 8 (1), e1000401 (2011).
- Enyati, A., Hemmingway, J. Malaria Management: Past, Present, and Future. Annu. Rev. of Entomol. 55 (1), 569-591 (2010).
- Edi, C. V., et al. CYP6 P450 Enzymes and ACE-1 Duplication Produce Extreme and Multiple Insecticide Resistance in the Malaria Mosquito Anopheles gambiae. PLoS Genet. 10 (3), 1004236 (2014).
- Mitchell, S. N., et al. Metabolic and Target-Site Mechanisms Combine to Confer Strong DDT Resistance in Anopheles gambiae. PLoS ONE. 9 (3), e92662 (2014).
- Knox, T. B., et al. An online tool for mapping insecticide resistance in major Anopheles vectors of human malaria parasites and review of resistance status for the Afrotropical region. Parasite Vector. 7 (76), 1-14 (2014).
- Napoli, C., Lemieux, C., Jorgensen, R. Introduction of a Chimeric Chalcone Synthase Gene into Petunia Results in Reversible Co-Suppression of Homologous Genes. Plant Cell. 2, 279-289 (2002).
- Sen, G. L., Blau, H. M. A brief history of RNAi: the silence of the genes. FASEB J. 20 (9), 1293-1299 (2006).
- Romano, N., Macino, G. Quelling: transient inactivation of gene expression in Neurospora crassa by transformation with homologous sequences. Mol. Microbiol. 6 (22), 3343-3353 (1992).
- Fire, A., Xu, S., Montgomery, M. K., Kostas, S. A., Driver, S. E., Mello, C. C. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Catteruccia, F., Levashina, E. A. RNAi in the Malaria Vector, Anopheles gambiae: Therapeutic Applications of RNAi: Methods and Protocols. Methods Mol. Biol. 555, 63-75 (2009).
- Garver, L., Dimopoulos, G. Protocol for RNAi Assays in Adult Mosquitoes (A). gambiae). J. Vis. Exp. (5), e230 (2007).
- Mysore, K., Andrews, E., Li, P., Duman-Scheel, M. Chitosan/siRNA nanoparticle targeting demonstrates a requirement for single-minded during larval and pupal olfactory system development of the vector mosquito Aedes aegypti. BMC Dev. Biol. 14 (9), 1-16 (2014).
- Mysore, K., Flannery, E. M., Tomchaney, M., Severson, D. W., Duman-Scheel, M. Disruption of Aedes aegypti Olfactory System Development through Chitosan/siRNA Nanoparticle Targeting of semaphorin-1a. PLoS Negl. Trop. Dis. 7 (5), (2013).
- Zhang, X., Zhang, J., Zhu, K. Y. Chitosan/double-stranded RNA nanoparticle-mediated RNA interference to silence chitin synthase genes through larval feeding in the African malaria mosquito (Anopheles gambiae). Insect Mol. Biol. 19 (5), 683-693 (2010).
- Zhang, X., et al. Chitosan/Interfering RNA Nanoparticle Mediated Gene Silencing in Disease Vector Mosquito Larvae. J. Vis. Exp. (97), e52523 (2015).
- Kumar, A., Wang, S., Ou, R., Samrakandi, M., Beerntsen, B. T., Sayre, R. T. Development of an RNAi based microalgal larvicide to control mosquitoes. Malaria World J. 4 (6), 1-7 (2013).
- Huvenne, H., Smagghe, G. Mechanisms of dsRNA uptake in insects and potential of RNAi for pest control: A review. J. Insect Physiol. 56 (3), 227-235 (2010).
- Burand, J. P., Hunter, W. B. RNAi: Future in insect management. J. Invertebr. Pathol. 112, S68-S74 (2013).
- Michel, K., Budd, A., Pinto, S., Gibson, T. J., Kafatos, F. C. Anopheles gambiae SRPN2 facilitates midgut invasion by the malaria parasite Plasmodium berghei. EMBO Rep. 6 (9), 891-897 (2005).
- An, C., Budd, A., Kanost, M. R., Michel, K. Characterization of a regulatory unit that controls melanization and affects longevity of mosquitoes. Cell Mol. Life Sci. 68 (11), 1929-1939 (2011).
- Horn, T., Boutros, M. E-RNAi: a web application for the multi-species design of RNAi reagents--2010 update. Nucleic Acids Res. 38, W332-W339 (2010).
- Benedict, M. Q. . Methods in Anopheles Research. , (2014).
- Lyimo, E. O., Takken, W., Koella, J. C. Effect of rearing temperature and larval density on larval survival, age at pupation and adult size of Anopheles gambiae. Entomol. Exp. Appl. 63, 265-271 (1992).
- Michel, K., et al. Increased melanizing activity in Anopheles gambiae does not affect development of Plasmodium falciparum. Proc. Natl. Acad. Sci. 103 (45), 16858-16863 (2006).
- Harker, B. W., et al. Transcription Profiling Associated With Life Cycle of Anopheles gambiae. J Med Entomol. 49 (2), 316-325 (2012).
- Dotson, E. M., Cornel, A. J., Willis, J. H., Collins, F. H. A family of pupal-specific cuticular protein genes in the mosquito Anopheles gambiae. Insect Biochem. Molec. Biol. 28, 459-472 (1998).
- Hopkins, T. L., Krchma, L. J., Ahmad, S. A., Kramer, K. J. Pupal cuticle proteins of Manduca sexta: characterization and profiles during sclerotization. Insect Biochem. Molec. Biol. 30, 19-27 (1999).
- Liang, J., Zhang, L., Xiang, Z., He, N. Expression profile of cuticular genes of silkworm, Bombyx mori. BMC Genomics. 11 (173), 1-13 (2010).
- Zhou, X., Riddiford, L. M. Broad specifies pupal development and mediates the "status quo" action of juvenile hormone on the pupal-adult transformation in Drosophila and Manduca. Development. 129, 2259-2269 (2002).
- Luna, C., Wang, X., Huang, Y., Zhang, J., Zheng, L. Characterization of four Toll related genes during development and immune responses in Anopheles gambiae. Insect Biochem. Molec. Biol. 32, 1171-1179 (2002).
- Tauszig, S., Jouanguy, E., Hoffmann, J. A., Imler, J. -. L. Toll-related receptors and the control of antimicrobial peptide expression in Drosophila. Proc. Natl. Acad. Sci. 97 (19), 10520-10525 (2000).
- Tryselius, Y., Samakovlis, C., Kimbrell, D. A., Hultmark, D. CecC, a cecropin gene expressed during metamorphosis in Drosophila pupae. Eur. J. Biochem. 204, 1-5 (1992).
- Goodisman, M. A. D., Isoe, J., Wheeler, D. E., Wells, M. A. Evolution of Insect Metamorphosis: a Microarray-Based Study of Larval and Adult Gene Expression in the Ant Camponotus Festinatus. Evolution. 59 (4), 858-870 (2005).
- Cook, P. E., Sinkins, S. P. Transcriptional profiling of Anopheles gambiae mosquitoes for adult age estimation. Insect Mol. Bio. 19 (6), 745-751 (2010).
- Suwanchaichinda, C., Kanost, M. R. The serpin gene family in Anopheles gambiae. Gene. 442 (1-2), 47-54 (2009).
- Araujo, R. N., et al. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug Rhodnius prolixus (Hemiptera: Reduviidae) by dsRNA ingestion or injection. Insect Biochem. Molec. Biol. 36 (9), 683-693 (2006).
- Griebler, M., Westerlund, S. A., Hoffmann, K. H., Meyering-Vos, M. RNA interference with the allatoregulating neuropeptide genes from the fall armyworm Spodoptera frugiperda and its effects on the JH titer in the hemolymph. J. Insect Physiol. 54 (6), 997-1007 (2008).
- Scott, J. G., et al. Towards the elements of successful insect RNAi. J. Insect Physiol. 59 (12), 1212-1221 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。