Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bestimmung der Carbonylfunktionen in Bio-Öle durch potentiometrische Titration: Die Faix Methode
In diesem Artikel
Zusammenfassung
Here we present a potentiometric titration technique for accurately quantifying carbonyl compounds in pyrolysis bio-oils.
Zusammenfassung
Carbonylverbindungen in Bioöle sind bekannt für Bioöl Eigenschaftsänderungen bei der Lagerung und während der Aktualisierung verantwortlich zu sein. Insbesondere Carbonyle bewirken eine Erhöhung der Viskosität (oft bezeichnet als "Alterung") bei der Lagerung von Bio-Ölen. Als solche hat Carbonylgehalt zuvor als ein Verfahren zum Verfolgen Bioöl Alterung und Kondensationsreaktionen mit geringerer Variabilität als Viskositätsmessungen verwendet. Darüber hinaus sind Carbonyle auch verantwortlich für die Bildung von Koks in Bioöl Veredelungsverfahren. In Anbetracht der Bedeutung von Carbonylen in Bioölen, genaue analytische Methoden zu deren Quantifizierung sind sehr wichtig für die Bio-Öl-Community. Potentiometrischen Titrationsverfahren basierend auf carbonyl Oximierung sind seit langem zur Bestimmung von Carbonylgehalt in Pyrolyse Bioölen verwendet. Hier präsentieren wir eine Modifikation der traditionellen carbonyl Oximierung Verfahren, die in weniger Reaktionszeit führt, kleinere Größe, höhere Präzision und mehr accUrat carbonyl Bestimmungen. Während traditionelle Methoden carbonyl Oximierung bei Raumtemperatur auf, stellte die Faix Verfahren erfolgt hier bei einer erhöhten Temperatur von 80 ° C.
Einleitung
Während der Pyrolyse Bioölen einer großen Vielzahl von Verbindungen und chemischen funktionellen Gruppen enthalten sind, ist die Quantifizierung von Carbonylgruppen besonders wichtig. Carbonylmetall sind bekannt für die Instabilität von Bio-Öl sowohl bei der Lagerung 1 und Verarbeitung 2 verantwortlich sein. Die Titration hier vorgestellte Methode ist eine einfache Technik, die die gesamte Carbonylgehalts von Bioölen zuverlässig quantifizieren können. Nur Aldehyde und Ketone funktionellen Gruppen werden mit dieser Methode quantifiziert; Carbonsäure und lactongruppenhaltige nicht quantifiziert.
Zur Analyse von Bio-Öle, Quantifizierung von Carbonylgruppen durch Titration wurde traditionell durchgeführt worden , um die Verfahren von Nicolaides 3 verwendet wird . Dieses Verfahren wurde in dem Bioöl Literatur 4, 5, 6, 7 verwendet. Das ist eineinfaches Verfahren , bei dem Carbonyle in das entsprechende Oxim umgewandelt werden (siehe Abbildung 1). Das freigesetzte HCl reagiert mit Pyridin, das Gleichgewicht zu Ende zu erzwingen. Die konjugierte Säure Pyridin wird mit einer bekannten Menge an NaOH (Base Titriermittel) titriert. Die Anzahl der Äquivalente von NaOH verwendet ist stöchiometrisch äquivalent zu den Molen von Carbonyl in der Bio-Öl.
Die Nicolaides Verfahren hat jedoch mehrere Einschränkungen. Es können Reaktionszeiten von mehr als 48 Stunden erfordern Abschluss zu erreichen. Dies schränkt Probendurchsatz. Es nutzt Pyridin, das toxisch ist. Einwaagen von 1 bis 2 g benötigt. Probengewicht verwendet wird, hängt von der Menge an Hydroxylamin HCl Gegenwart und der Carbonylgehalt der Probe. Wenn anfänglichen Schätzungen des Probengewichts verwendet falsch sind, hat die Titration wiederholt werden.
Faix et al. 8 ein Verfahren entwickelt, h verändert wurdeehe die Probleme der Nicolaides Methode zu adressieren. Die Reaktion wird für 2 Stunden bei 80 ° C durchgeführt, wodurch den Probendurchsatz zu erhöhen. Pyridin wurde mit Triethanolamin ersetzt, die eine weniger toxische Chemikalie ist. Die Stichprobengröße kann auf 100 bis 150 mg reduziert werden. Das Triethanolamin verbraucht das freigesetzte HCl, die Reaktion zum Abschluß der Fahrt und das unverbrauchte Triethanolamin direkt titriert. Eine Sekundär Titration des Hydroxylamins ist unnötig. Vergleich dieser Titrationsverfahren hat gezeigt , dass die Nicolaides Verfahren erheblich unterschätzt Carbonylgehalt von Bioöl 9.
Das hier beschriebene Verfahren ist von der ursprünglichen Methode 8 modifiziert worden mehr anwendbar auf die Analyse der Pyrolyse bio-Öle. Dieses Verfahren wurde für die Analyse der rohen Pyrolyse Bioölen entwickelt, aber es wurde auch auf andere Arten von Biomasse abgeleitete Öle, einschließlich Wasserstoff behandelte Bioölen erfolgreich angewendet. Additional, wurde diese Methode zur Überwachung Veränderungen in Carbonylgehalts während sowohl das Altern und die Aktualisierung verwendet wird.
Protokoll
Achtung: Bitte lesen Sie alle relevanten Sicherheitsdatenblätter (MSDS) vor Beginn. Ethanol ist entzündlich. Alle anwendbaren chemischen Bearbeitungsverfahren sind sowie alle geltenden Abfall Einweg- und Verfahren für den Umgang gefolgt werden.
1. Reagenzlösungen
- Bereiten Sie die Hydroxylaminhydrochlorid-Lösung (Lösung A): 7.7 g Hydroxylamin-hydrochlorid und 50 ml entionisiertes Wasser in einen 250-ml-Meßkolben. Wenn alle Feststoffe gelöst haben, verdünnt mit Ethanol zu markieren. Dies resultiert in einer 0,55 M Hydroxylaminhydrochlorid-Lösung in 80% (v / v) Ethanol.
- Bereiten Sie die Triethanolamin-Lösung (Lösung B): In 17,4 ml Triethanolamin in einem 250-mL-Messkolben. In 10 ml Wasser, und dann wird bis zur Marke mit Ethanol auf. 95% Ethanol, können auch verwendet werden, wenn die Zugabe von Wasser wird übersprungen. Dies resultiert in einer 0,48 M Triethanolamin-Lösung in 96% (v / v) Ethanol
- Bereiten Sie die SalzsäureLösung. Entweder kaufen 0,1 N Lösung oder bereiten unter Verwendung von 10 ml konzentrierter HCl und 1 l Wasser.
2. Bio-Öl-Probenahme und Handhabung
- Stellen Sie sicher, dass die Ölprobe ist bei Raumtemperatur vor der Entnahme einer Probe. Gründlich (Mischung von kräftig mindestens 1 Minute ausgeschüttelt und visuell inspizieren die Probe, um sicherzustellen, es homogen ist. Einige Bio-Öle können erfordern längere Schüttelzeiten) homogenisieren Bioöl eine repräsentative Probe zu erhalten.
- Für die Bio-Ölprobe, verwenden Sie 100 bis 150 mg Bio-Öl.
- Minimierung der Exposition gegenüber Sauerstoff und Wärme Probenabbau vor der Analyse zu verhindern.
3. Analytische Verfahren
- Standardisierung der Basislösung
- Trocken Na 2 CO 3 Primärstandard in einem Ofen bei 105 ° C über Nacht eine trockene Probe zu gewährleisten. Lassen Sie die Na 2 CO 3 auf Raumtemperatur abkühlen zu konditionieren.
- Wiegen 100 bis 150 mgNatriumcarbonat in ein Titrationsgefäß, notieren Sie das tatsächliche Gewicht, einen Rührstab hinzufügen und genügend Wasser zur Deckung der pH-Elektrode Lampe und Anschluss hinzufügen.
- Übertragen Sie die Probe in ein Titrationsgefäß, Waschen der Reaktionsflasche mehrmals separat mit Ethanol und Wasser in Anteilen eine endgültige 80% ige Lösung von Ethanol / Wasser zu machen. Titrieren mit der Säurelösung einen automatischen Titrator zum Endpunkt verwendet wird. Notieren Sie den Endpunkt. Der Endpunkt wird als Wendepunkt der Titrationskurve definiert.
- Wiederholen Sie den Vorgang zweimal drei Punkte zu erhalten.
- Verwenden des Mittelwertes als die Normalität der sauren Lösung.
- Herstellung von Titration Blanks
- Für Blank A: 0,5 ml Dimethylsulfoxid (DMSO) zu einem 5 ml-Fläschchen mit einem Spin-Flügel hinzuzufügen.
- 2 mL Hydroxylaminhydrochlorid-Lösung (Lösung A).
- 2 mL Triethanolamin-Lösung (Lösung B).
- Cap fest, in vorgewärmten (80 ° C) Wärmeer Block oder Wasserbad und rühre 2 Stunden.
- Titrieren mit Säurelösung einen automatischen Titrator zum Endpunkt, Rekord-Endpunkt.
- Für Blank B: Wird Mineralsäure vermutet in der Probe vorhanden zu sein, 0,5 mL DMSO bis 5 ml-Fläschchen mit einem Spin-Schaufel.
- 2 mL Triethanolamin-Lösung (Lösung B).
- Cap fest und für 2 Stunden bei 80 ° C rühren.
- Übertragen Sie die Probe in ein Titrationsgefäß, Waschen der Reaktionsflasche mehrmals separat mit Ethanol und Wasser in Anteilen eine endgültige 80% ige Lösung von Ethanol / Wasser zu machen. Titrieren mit der Säurelösung einen automatischen Titrator zum Endpunkt verwendet wird. Notieren Sie den Endpunkt.
- Wiederholen Sie den Vorgang dreimal drei Punkte zu erhalten.
- Die Validierung der Methode eines bekannten Carbonyl- Verwendung
- Man wiegt ~ 100 mg 4- (benzyloxy) benzaldehyd (4-BBA) zu einem 5 ml-Fläschchen, notieren Sie das tatsächliche Gewicht, fügen Sie einen Spin Fahne.
- In 0,5 ml DMSO.
- Sich auflösendie Probe in 2 ml Hydroxylaminhydrochlorid-Lösung (Lösung A).
- 2 mL Triethanolamin-Lösung (Lösung B).
- Schließen Sie den Deckel fest und rühren bei 80 ° C für 2 Stunden.
- Übertragen Sie die Probe in ein Titrationsgefäß, Waschen der Reaktionsflasche mehrmals separat mit Ethanol und Wasser in Anteilen eine endgültige 80% ige Lösung von Ethanol / Wasser zu machen. Titrieren mit der Säurelösung einen automatischen Titrator zum Endpunkt verwendet wird. Notieren Sie den Endpunkt.
- Wiederholen Sie den Vorgang dreimal, drei Punkte zu erhalten.
- Analyse von Bio-Öl unter Verwendung des Verfahrens
- Wiegen der Nähe von 100 mg des Bio-Öl zu 5 ml-Fläschchen, notieren Sie das tatsächliche Gewicht und fügen Sie einen Spin Fahne.
- In 0,5 ml DMSO.
- Auflösen der Probe in 2 ml Hydroxylaminhydrochlorid-Lösung (Lösung A).
- 2 mL Triethanolamin-Lösung (Lösung B).
- Schließen Sie den Deckel fest und rühren bei 80 ° C für 2 Stunden.
- Übertragen the Probe in ein Titrationsgefäß, mit Ethanol und Wasser mehrmals separat die Reaktionsfläschchen Waschen in Anteilen ein endgültiges 80% ige Lösung von Ethanol / Wasser zu machen. Titrieren mit der Säurelösung einen automatischen Titrator zum Endpunkt verwendet wird. Notieren Sie den Endpunkt.
- Wiederholen Sie den Vorgang dreimal, drei Punkte zu erhalten.
- Blank C: Wenn Mineralsäure vermutet wird, in der Probe vorhanden sind, wiegen fast 100 mg des Bio-Öl in einen 5-ml-Fläschchen, das Gewicht aufnehmen und einen Spin Fahne hinzuzufügen.
- In 0,5 ml DMSO.
- 2 mL Triethanolamin-Lösung (Lösung B).
- Cap fest und für 2 Stunden bei 80 ° C rühren.
- Übertragen Sie die Probe in ein Titrationsgefäß, Waschen der Reaktionsflasche mehrmals separat mit Ethanol und Wasser in Anteilen eine endgültige 80% ige Lösung von Ethanol / Wasser zu machen. Titrieren mit der Säurelösung einen automatischen Titrator zum Endpunkt verwendet wird. Notieren Sie den Endpunkt.
- Wiederholen Sie den Vorgang dreimal drei Punkte zu erhalten.
4. Berechnungen
- Standardisierung der Basislösung
- Berechnen der Konzentration der Säurelösung (mol / L) unter Verwendung der folgenden Gleichung. Das Gewicht des trockenen Natriumcarbonat in Gramm ist w 1, wird die Reinheit als Fraktion geschrieben (dh 99% 0,99), und der Endpunkt ist in mL.
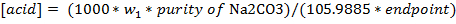
- Berechnen der Konzentration der Säurelösung (mol / L) unter Verwendung der folgenden Gleichung. Das Gewicht des trockenen Natriumcarbonat in Gramm ist w 1, wird die Reinheit als Fraktion geschrieben (dh 99% 0,99), und der Endpunkt ist in mL.
- Die Validierung der Methode eines bekannten Carbonyl- Verwendung
- Berechnen der Konzentration von 4BBA (mol / L) in der Probe die folgende Gleichung verwendet. Das Gewicht des 4BBA in Gramm wird w 2 wird die 4BBA Reinheit als Fraktion geschrieben (dh 99% 0,99), die Konzentration der Säurelösung (mol / L) [Säure], das Triethanolamin / Hydroxylamin • HCl blank Endpunkt EP BA (der Mittelwert von drei Zuschnitten, in ml), und der Endpunkt EP (in ml).
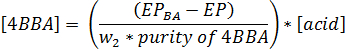
- Berechnen der Konzentration von 4BBA (mol / L) in der Probe die folgende Gleichung verwendet. Das Gewicht des 4BBA in Gramm wird w 2 wird die 4BBA Reinheit als Fraktion geschrieben (dh 99% 0,99), die Konzentration der Säurelösung (mol / L) [Säure], das Triethanolamin / Hydroxylamin • HCl blank Endpunkt EP BA (der Mittelwert von drei Zuschnitten, in ml), und der Endpunkt EP (in ml).
- Analyse von Bio-Öl
- Berechnen Sie die Konzentration von Carbonylen in Bioölen [CO] (mmol / g-Bio-Öl) unter Verwendung der folgenden Gleichung. Das Gewicht des Bioöl in Gramm w 3 ist, die Konzentration der Säurelösung (mol / L) [Säure], das Triethanolamin / Hydroxylamin • HCl blank Endpunkt EP BA (der Mittelwert von drei Zuschnitten in ml) und der Endpunkt EP (in ml).

- Berechnen Sie die Konzentration von Carbonylen in Bioölen [CO] (mmol / g-Bio-Öl) unter Verwendung der folgenden Gleichung. Das Gewicht des Bioöl in Gramm w 3 ist, die Konzentration der Säurelösung (mol / L) [Säure], das Triethanolamin / Hydroxylamin • HCl blank Endpunkt EP BA (der Mittelwert von drei Zuschnitten in ml) und der Endpunkt EP (in ml).
- Säure - Korrektur
HINWEIS: Die Gegenwart von Mineralsäuren oder organischen Säuren mit pKa <2 künstlich niedrig carbonyl Werte aufgrund der Reaktion der Säure mit Triethanolamin verursachen können.- Wenn dies vermutet wird, führen Sie die detaillierte Rohlinge in den Abschnitten 3.2.6 und 3.4.8. Das Gewicht der Bio-Öl in der Probe in Gramm ist,w 3, EP ist der Endpunkt der Probe und EP BA ist das Triethanolamin / Hydroxylamin leer. EP BB ist der Endpunkt von Blank B, EP BC ist Endpunkt Blank C und das Gewicht (g) Öl in Blank C verwendet w BC:
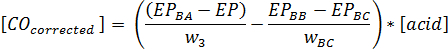
Für Bioöl Proben, die hauptsächlich Essigsäure enthalten, ist dies ein unnötiger Schritt.
- Wenn dies vermutet wird, führen Sie die detaillierte Rohlinge in den Abschnitten 3.2.6 und 3.4.8. Das Gewicht der Bio-Öl in der Probe in Gramm ist,w 3, EP ist der Endpunkt der Probe und EP BA ist das Triethanolamin / Hydroxylamin leer. EP BB ist der Endpunkt von Blank B, EP BC ist Endpunkt Blank C und das Gewicht (g) Öl in Blank C verwendet w BC:
Ergebnisse
Eine typische Titrationskurve besteht aus einem einzelnen Endpunkt, wie in Abbildung 2 dargestellt. Typische Titrationen für beide ein rohes Bio-Ölprobe, und eine leere Titration, gezeigt. Als Endpunkt liegt an dem Wendepunkt der Titrationskurve; der Endpunkt kann leicht durch Auftragen der ersten Ableitung der Titrationskurve (gezeigt auf der rechten Achse, dpH / dV, in Figur 2) identifiziert werden. Viele automatische Titrationssysteme haben So...
Diskussion
Representative Titrationskurven sind in Abbildung 2 dargestellt. Eine leere Titration, sowie eine Titration für eine Pyrolyseöl Probe, gezeigt. Ferner wird die erste Ableitung der Titrationskurve (DPH / dV) gezeigt, die für eine einfache Erkennung der Titrationsendpunkt ermöglicht. Der Einschub Tabelle 2 zeigt dreifacher Ausführung die Daten für beide Pyrolyseöl und leere Titrationen, mit Mittelwerten und Standardabweichungen. Die Endpunkt-Werte (in ml) gezeigt werden in Abschnit...
Offenlegungen
Die Autoren haben nichts zu offenbaren.
Danksagungen
Diese Arbeit wurde durch das US Department of Energy unter Vertrag Nr DE-AC36-08GO28308 mit dem National Renewable Energy Laboratory unterstützt. Die Finanzierung durch die US DOE Office of Energy Efficiency zur Verfügung gestellt und erneuerbare Energien Bioenergietechnologien Büro. Die US-Regierung behält und der Verleger, durch den Artikel für die Veröffentlichung der Annahme anerkennt, dass die US-Regierung behält eine nicht ausschließliche, bezahlte, unwiderrufliche, weltweite Lizenz zur Nutzung der veröffentlichten Form dieses Werk zu veröffentlichen oder zu vervielfältigen oder zu anderen erlauben, dies zu tun, für die US-Regierung Zwecke.
Materialien
| Name | Company | Catalog Number | Comments |
| Analytical balance | accurate to 0.1 mg | ||
| dry block heater with magnetic stirrer, or hot water bath with magnetic stirrer | |||
| Automatic titrator | We used a Metrohm Titrando 809 automatic titrator, though other equivalent systems are acceptable | ||
| Deionized water | |||
| Ethanol (reagent grade) | CAS # 64-17-5 | ||
| Hydroxylamine hydrochloride | CAS # 5470-11-1 | ||
| Triethanolamine | CAS #102-71-6 | ||
| Hydrochloric acid (37%) | CAS # 7647-01-0 | ||
| Sodium Carbonate (primary standard) | SigmaAldrich | 223484 | |
| 4-(benzyloxy)benzaldehyde | CAS # 4397-53-9 | ||
| Dimethyl sulfoxide | CAS # 67-68-5 | ||
| 5 mL glass Reacti-vials with solid lid and teflon spinvane | Thermoscientific | TS-13223 | |
| 200 mL volumetric flask | |||
| Volumetric or mechanical pipettes |
Referenzen
- Oasmaa, A., Kuoppala, E., Solantausta, Y. Fast pyrolysis of forestry residue. 2. physicochemical composition of product liquid. Energy Fuels. 17 (2), 433-443 (2003).
- Olarte, M., et al. Stabilization of Softwood-Derived Pyrolysis Oils for Continuous Bio-oil Hydroprocessing. Top. Catal. 59 (1), 55-64 (2016).
- Nicolaides, G. . The chemical characterization of pyrolytic oils. , (1984).
- Oasmaa, A., Korhonen, J., Kuoppala, E. An approach for stability measurement of wood-based fast pyrolysis bio-oils. Energy Fuels. 25 (7), 3307-3313 (2011).
- Chen, C. L., Lin, S. Y., Dence, C. W. . Methods in Lignin Chemistry. , 446-457 (1992).
- Scholze, B., Hanser, C., Meier, D. Characterization of the water-insoluble fraction from fast pyrolysis liquids (pyrolytic lignin) Part II. GPC, carbonyl groups, and 13C-NMR. J. Anal. Appl. Pyrolysis. 58-59, 387-400 (2001).
- Bayerbach, R., Meier, D. Characterization of the water-insoluble fraction from fast pyrolysis liquids (pyrolytic lignin). Part IV: Structure elucidation of oligomeric molecules. J. Anal. Appl. Pyrolysis. 85 (1-2), 98-107 (2009).
- Faix, O., Andersons, B., Zakis, G. Determination of Carbonyl Groups of Six Round Robin Lignins. Holzforschung. 52, 268-272 (1998).
- Black, S., Ferrell, J. Determination of Carbonyl Groups in Pyrolysis Bio-oils Using Potentiometric Titration: Review and Comparison of Methods. Energy Fuels. 30 (2), 1071-1077 (2016).
- Ferrell, J., et al. Standardization of Chemical Analytical Techniques for Pyrolysis Bio-oil: History, Challenges, and Current Status of Methods. Biofuels, Bioprod. Biorefin. 10, 496-507 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten