Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Recombinase aracılı Kaset Değişimi Kullanarak Fare Embriyonik Kök Hücre yapı-fonksiyon Çalışmaları
Bu Makalede
Özet
Proteinler genellikle farklı hücresel fonksiyonları sarf edebilirsiniz birden çok etki içerirler. Gen irtibat kutusu kapağı (KO) bu işlevsel çeşitliliği dikkate almaz. Burada, çeşitli işlevsel etki alanları veya bir proteinin varyantlarının moleküler diseksiyon sağlar KO embriyonik kök hücrelerin bir rekombinasyon aracılı kaset değişimi (RMCE) tabanlı bir yapı-işlev yaklaşım sunulmuştur.
Özet
fare embriyosu veya embriyonik kök hücrelerin (mESCs) gen mühendisliği bir proteinin fonksiyonunun çalışması için izin verir. Proteinler hücrenin workhorses ve genellikle translasyon sonrası modifikasyonlar ile etkilenebilir, birçok fonksiyonel bölgeye oluşmaktadır. koşullu veya kurucu knock-out (KO) farelerde tüm proteinin azalması dikkate bu işlevsel çeşitliliği ve düzenleme almaz. Bir Mesc hattı ve FLPe rekombinasyon aracılı kaset değişimi (RMCE) için bir yanaşma Alanı ROSA26 (R26) bölgesi içinde yer alan içine yerleştirildiği bir türetilen fare modeli, daha önce bildirilmiştir. Burada, çok alanlı bir proteinin farklı işlevleri moleküler diseksiyon için izin veren bir yapı-fonksiyon yaklaşımı hakkında rapor. Bu amaçla, RMCE uyumlu farelere KO fareleri çapraz olması ve daha sonra RMCE uyumlu KO mESCs izole edilmelidir. Daha sonra, farazi kurtarma yapılarının bir paneli RMCE targeti ile R26 lokusu içine sokulabilirng. Aday kurtarma cDNA'lar kolayca rekombinasyon klonlama kullanarak hedefleme vektörünün RMCE siteler arasında eklenebilir. Daha sonra, KO mESCs bir FLPe yeniden bağlayıcı ifade plazmidi ile kombinasyon halinde Hedefleme vektörü ile transfekte edilmiştir. RMCE ROSA26 yerleştirme siteleri promotör-az neomisin direnç genini yeniden etkinleştirir ve doğru hedefleme olayı seçilmesine izin verir. Bu şekilde,% 100'e yakın yüksek hedefleme verimleri yarı yüksek verimli bir şekilde çok sayıda farazi kurtarma yapıları sokulması için izin elde edilir. Son olarak, R26 odaklı kurtarma yapılarının çok sayıda ebeveyn KO mESCs gözlendi fenotipi kurtarmak etme kabiliyetleri açısından test edilebilir. Bu p120 katenin (p120ctn), fenotipik okuma olarak embriyoit organları (EBS) endoderm farklılaşmasını kullanılarak KO mESCs bir kanıt-temel yapı-fonksiyon çalışma sunulmaktadır. Bu yaklaşım önemli etki alanlarının belirlenmesini, varsayılan alt yolları ve hastalıkla ilişki noktasını sağlayanBelirli bir protein için KO fenotipleri altında yatan mutasyonlar.
Giriş
Memeli genomları yaklaşık 20,000 protein kodlama genleri ihtiva olduğu tahmin edilmektedir. Alternatif yapıştırma ve translasyon sonrası modifikasyonlar, protein repertuarı arttırır. Proteinler, modüler bir yapıya 1 ve genellikle farklı protein kompleksleri halinde kendi işe ve birden fazla hücresel süreçleri 2 katılımlarını izin birden fazla etkileşim bölgeleri içerir. Bir örnek p120ctn adlandırılan, çok fonksiyonlu bir proteindir. p120ctn Ctnnd1 geni tarafından kodlanan ve bir N-terminal ve C-terminal bölgesi tarafından kuşatılır geniş bir merkezi armadillonun tekrar alanı oluşur. p120ctn bir armadillonun alan, hücre-hücre adhezyonu ile ilgili olan klasik kaderinler, yüksek oranda korunan bir jukstamembran alanı bağlanan, ancak aynı zamanda transkripsiyonel represör Kaiso bağlanır. p120ctn N-terminal alanı, farklı kinaz, fosfataz, küçük RhoGTPases ve mikrotübüle bağlı p ile etkileşimeroteinler 3. İlginç bir şekilde, alternatif bağlantısının sonucu olarak, p120ctn izoformları dört alternatif bir başlangıç kodonu 4 elde edilebilir. başlatma kodonu de en çok 5' çevrilmiş ve tam uzunlukta, N-terminal segmenti ihtiva gibi p120ctn izoform 1A, en uzun. p120ctn 3 ve 4, bu N-terminal segmenti, kısmen ve tamamen sırasıyla silinir izoformları. farklı hücresel fonksiyonları protein (ya da protein izoformlarının) ve bunların bölgesinin tam rolünü anlamak bir sorun olmaya devam etmektedir.
mESCs gen hedefleme karşılık gelen genin genetik silerek bir proteinin fonksiyonunun çalışma sağlar ve yaygın olarak, gelişimsel olarak önemli ve hastalığa, ilgili genlerin ve yolların belirlenmesi katkıda bulunmuştur. Ters genetik Bu atılım nedeniyle homolog yeniden 5'e Mesc izolasyon ve gen hedefleme alanlarındaki gelişmelerin sonucuydu Yukarı. Homolog rekombinasyon, DNA fragmanları, çift sarmallı (ds) DNA kırılmalarının sonra, iki benzer veya özdeş nükleik yarımları arasında değiş tokuş edildiği bir süreçtir. dsDNA sonları seyrek olduğu için Normalde İK verimsizdir. Son zamanlarda, hedefleme homoloji yönlendirilmiş gen etkinliği site-spesifik nükleazlar 6, 7 kullanılarak arttırılabilir, ancak ne yazık ki bu hedef dışı etkiler 8 yatkındır. Daha güvenilir bir teknik Gen hedefleme sağlamak için Cre / loxP veya FLPe / FRT gibi site-spesifik rekombinasyon sistemleri dayanmaktadır RMCE vardır. LoxP ve Frt dizisi bakteriyofaj P1 bulunurlar ve Saccharomyces cerevisiae ve sırasıyla site yönünü belirleyen bir asimetrik 8 bp sekansı da dahil olmak üzere, 34 bp oluşur. Diğer yandan, oryantasyonu, örneğin, bir DNA bölümü içindeki iki loxP floxed DNA kesilmiş olur belirlemek veya i olacaktırKre-aracılı rekombinasyon 9 üzerine nversed. iki site farklı kromozom üzerinde bulunan Üstelik, eğer Kre da translokasyon neden olabilir. RMCE çapraz reaksiyona girmez ve bir genomik gömülü heterospesifik rekombinasyon yararlanır. Aynı heterospesifik bölgeleri tarafından takviye eden bir DNA fragmanı ihtiva eden bir Verici plazmit varlığında, rekombinaz için çift eş zamanlı translokasyon (Şekil 1) RMCE uyumlu genomik bu DNA fragmanı ekleyecektir. Burada, sadece doğru RMCE hedefli klonlar geri gelen vektör üzerinde bir promotere ilaç direnci sayesinde işleyebilen bir "tuzak" promotör az Neomisin direnç geni yerleştirme hücreleri R26 genomunda bulunan (NeoR) (Şekil 1) 10, 11. Bu <% 100 11 ile çok yakındır çok yüksek hedefleme verimliliği, sonuçlanır/ sup> 12. Sonuç olarak, RMCE bazlı bir hedefleme son derece verimlidir ve yapı-işlev çalışmaları için kullanılabilir; Bununla birlikte, bu, önceden tasarlanmış bir genomik lokus gerektirir.
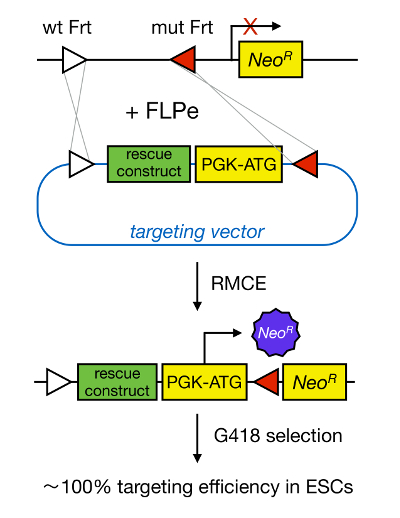
RMCE aracılı Hedefleme Şekil 1 şematik gösterimi. Her iki heterospesifik FRT bölgeleri (beyaz ve kırmızı üçgenlerle gösterilir) liman halinde RMCE eden tanımlı bir genomik lokus gelen bir hedefleme vektörü DNA segmentlerinin alışverişine izin verir. Buna ek olarak, işlenmiş genomik bölgenin bir promotörsüz ve tepe bölümü kesik neomisin direnci (NeoR) genini içerir. Gelen DNA fragmanı kodonu bir promotörü ve başlangıç olarak, yalnızca doğru rekombinasyon olayları, yüksek hedefleme verimi ile, neomisin direncini yeniden. T daha büyük bir versiyonunu görmek için buraya tıklayınOnun rakam.
mESCs içinde Genom mühendislik RMCE uyumlu farelerin üretilmesine imkan tanır. 1981 yılında, iki grup blastosist iç hücre kütlesinin (ICM) pluripotent hücreler yakalama ve kültür 13, 14 onları korumuştur. mESCs germ hücresi soyundan dahil embriyonik ve yetişkin hücrelerinin her türlü içine kendini yenileme ve farklılaşma yeteneğine sahiptir. Bu nedenle, mESCs içinde gen hedefleme konstitütif veya (Cre / LoxP sistemi kullanılarak) koşullu KO fareleri geliştirilmesi yoluyla ters genetik çalışmalar sağlar. Ancak, fare ES hücreleri izole etmek için klasik yol çok verimsizdir. Birkaç büyük gelişmeler büyük ölçüde SR ve fetal sığır serumu (FBS) 16 içeren Mesc ortam arasında değişen, 15 orta tanımlanmış serum yerine (SR) kullanımı da dahil olmak üzere, türetme Mesc hatları için başarı oranını artırmıştır ve İlaçlarla kullanımı adresBu tür pluripotin veya 2i 17 mantıksal bileşikler. Pluripotin, küçük sentetik bir molekül, lösemi inhibitör faktörü (LİF) ve fare embriyonik fibroblastlar (MEF'ler) 18 yokluğunda farklılaşmamış bir halde mESCs arasında yayılmasını sağlar. Son olarak, mESCs SR / FBS ortamı değiştirme kuralı, 20, LİF ve 19 pluripotin birleştirildiğinde (% 100'e yakın), çok yüksek bir verimle izole edilebileceği gösterilmiştir. Bu protokoller, daha sonra yapı-işlev çalışmaları için kullanılabilir RMCE uyumlu KO mESCs etkili izolasyonunu sağlar.
Bu çalışma, spesifik bir hücre süreçlerinden sorumludur bir protein içinde anahtar alanları ya da kalıntılarını tanımlamak üzere sağlayan bir yöntemi tarif etmektedir. Bu amaçla, verimli Mesc izolasyonunu sağlayan gelişmiş teknolojilerin, hedefleme vektörü montaj ve Mesc hedeflemenin bir boru hattı oluşturmak oldud. Protein izoform alan mutantlar ve devamındaki efektörlere böyle büyük paneller KO mESCs sokulabilir ve in vitro KO fenotipi kurtarmak için kabiliyetleri açısından değerlendirilebilir gibi.
Protokol
fareler üzerinde Tüm deneyler, kurumsal, ulusal ve Avrupa hayvan yönetmeliklere göre gerçekleştirilmiştir.
RMCE uyumlu KO mESCs 1. İzolasyonu
- Böyle ROSALUC fareler 10 veya ROSA26-iPSC fareler 21 olarak RMCE uyumlu farelere, heterozigot KO fareleri Breed. Her iki RMCE uyumlu farelere karışık 129 / C57BL6 / İsviçre arka plan üzerinde muhafaza edilmiştir.
NOT: heterozigot KO fareleri geçerek homozigot KO farelerde embriyonik öldürücülüğü aşmak için tavsiye edilir. - R26 odağına 12'de bir RMCE kasetini içeren heterozigot KO fareleri seçmek için PCR kullanın.
- heterozigot KO fareleri RMCE uyumlu, heterozigot KO fareleri Breed ve RMCE uyumlu, homozigot KO blastosistleri izole eder.
- Akşam zamanlı çiftleşmesi kurun ve çiftleşme ertesi sabah bujileri kontrol edin.
NOT: Fişler erkek pıhtılaştırma ve veziküler bezlerinden pıhtılaşmış salgılarının yapılır.Bu fişler dişi vajinayı doldurup 8 süre devam - ıslahının sonra 24 saat. Tıkalı dişiler 0.5 DPC (gün sonra coitum) embriyolar taşıyan olduğu kabul edilir.- , Fişler için kontrol onun kuyruk tabanı tarafından dişiyi kaldırıp bir beyazımsı kitle için onu vajinal açılış incelemek için. fiş görmek zordur hafifçe açılı bir prob ile vulva dudakları yayıldı. Onların erkek ayırın takılı kadın.
- 3.5 DPC'de blastokistlerle toplayın.
- Onaylanmış yöntemle (örneğin, servikal dislokasyon) tarafından hamile kadın öldürülür. Bir midventral kesi yapın ve rahim ve yumurtalık teşrih ince makas ve forseps kullanılarak (hala birbirlerine ekli).
- 45 ° açı ile bir 26-gauge iğne kır. Bu bükülmüş iğne M2 ortamı ile doldurulmuş bir 1 ml şırınga takın ve 10 cm'lik bir tabak kapağı içine rahim blastosistler temizlemek için kullanın.
- en yakın rahim ucuna iğne takınyumurta kanalı. ince forseps ile iğneyi yerinde tutarken pistonu iterek; rahim şişme başarılı kızarma gösterir.
- tüm embriyolar toplamak ve taze M2 ortamının bir damlası iki kez yıkayın - (200 um, 100 bir çapa sahip olan) bir ağız pipet kullanın. Hemen yıkamadan sonra, kültür plakalarına blastosistler aktarın (aşağıya bakınız).
NOT: laminer hava akımı yapılmalıdır blastosist diseksiyon ve taşıma.
- Akşam zamanlı çiftleşmesi kurun ve çiftleşme ertesi sabah bujileri kontrol edin.
- RMCE uyumlu KO mESCs izole edin
- Mitomisin-C ile tedavi edilen DR4 MEF'ler ile 12-çukurlu bir plaka (Malzemelerin Tablo) blastosist izole bir gün önce hazırlayın.
Not: Bu MEF'ler Dört ilaç seçilebilir genler içerir ve neomisin, puromisin, higromisin direnç kazandıran Tg (DR4) 1Jae / J farelerinden izole edilmiştir ve 22 6-tioguanin edildi.- Kaplama,% 0.1 jelatin ile tüm kültür plakası. % 0.1 jelatin eklemeKültür plakaları,% 5 CO2 içinde 37 ° C'de 5 dakika inkübe edilir, ve jelatin çözeltisi aspire. Tohum bir 12-çukurlu plaka içinde P2 MEF'ler bir şişe çeyrek ve MEF orta 2 mL büyümek (bakınız Tablo 1, Malzeme Tablo) bir konfluent tek tabaka 19.
- 3 saat, mitomisin-C (10 ug / mL) ile etkisiz hale getirilmesi ve fosfat tamponlu tuzlu su (PBS) 19 ile iki kez yıkayın.
- SR-ES hücre ortamı içinde mitomisin-C ile tedavi edilen MEF'ler ile, jelatinize 12 oyuklu plakalar üzerine blastosistlerine (1 de / embriyo) plaka, bir ağız pipet kullanılarak, (2 ml / çukur), ya 2 uM pluripotin veya 2i ile desteklenmiş (1 uM Erk inhibitörü PD0325901 ve 3 uM GSK3 inhibitörü CHIR99021). % 5 CO2 içinde 37 ° C'de inkübe edilir.
- 3 gün - her 2 (pluripotin veya 2i ile takviye edilmiş), SR-ES hücre ortamı yenileyin.
- Bir stereomicro altındaki her blastosist inceleyin4.0 x büyütme kapsamı ve MEF tabakaya yavru üretmesi ve bağlanması için kontrol edin.
NOT: blastokistlerin ambar, bunları kapsüller zona pellucidanm kaybettiğinde. bekâr blastositlerle Wells ağız pipetleme kullanılarak yenilenmesi gerekir. - tek kullanımlık uçları olan bir P10 pipet kullanarak kültür 12 gün - 10 sonra (Stereomikroskopta kullanarak) bireysel ICM çıkıntılar seçin. (Oda sıcaklığında) / göz PBS 30 uL ihtiva eden bir V-şekilli 96 oyuklu plakaya ortamın yaklaşık 10 uL aşırı büyümesini aktarın.
- Her bir çok kanallı bir pipet kullanılarak% 0.25 tripsin, 50 uL ilave edin ve% 5 CO2 içinde 37 ° C 'de 3 dakika süre ile inkübe edilir.
- Mesc ortamı FBS içeren 100 uL ilave et; 10-15 kez pipetleme suretiyle tek hücre halinde ICM çıkıntılar ayırmak; ve mitomisin-C ile tedavi edilen ayrışmış hücreleri transferi ICM koloniler toplanır bir gün önce hazırlandı 96 oyuklu MEF plakalar.
- Omi, itibaren bu adımda itibaren Mesc ortamından t pluripotin veya 2i. Sonraki gün, (oyuk başına 100 uL /) SR içeren Mesc ortamına FBS- gelen orta değiştirmek.
- 96- 24 oyuklu bir formatta 19 için kurulan Mesc hatları Expand.
- PBS 200 uL hücreleri yıkayın tripsin 50 uL ekleyin ve% 5 CO içinde 37 ° C'de 5 dakika süreyle inkübe FBS göre Mesc ortamın 100 uL ekleyin.; 10 pipetleme ayrışan - çok kanallı pipet kullanılarak 15 kez; ve ayrışmış hücreleri transferi 24 oyuklu, MEF plakaları mitomisin-C ile tedavi edilen.
- ertesi gün SR tabanlı orta değiştirin. De 24 ila 6-gözlü formata benzer bir şekilde mESCs genişletin. Konfluent 6 plaka 19 4 freezings - 3 olun.
- Boş p120ctn için PCR'ler ve floxed allel daha önce tarif edilmiştir, bu durumda, p120ctn burada R26 lokusu 23 ve seçim KO alel (PCR primerleri kullanılarak RMCE uyumlu, homozigot KO mESCs belirlenmesilass = "xref"> 12).
- Mitomisin-C ile tedavi edilen DR4 MEF'ler ile 12-çukurlu bir plaka (Malzemelerin Tablo) blastosist izole bir gün önce hazırlayın.

Tablo 1. Kültür Ortamı. Tüm ortam, 4 ° C'de saklandı ve kullanılmadan önce 37 ° C'de 30 dakika ısıtıldı.
Rekombinasyon Klonlama kullanarak bir RMCE uyumlu Hedefleme Vector 2. Nesil
- Tabanlı veya 24 klonlama teknikleri PCR bazlı kurtarma restriksiyon enzimi (RE) kullanılarak rekombinasyon uyumlu vektörleri içine inşa Clone. cDNA'lar bir stop kodonu içermediğinden emin olun.
- Tasarım primerleri 24 attB-etiketli. Bir GGGG germe, bir AttB1 sitesi, bir bağlayıcı, bir Kozak dizisi ve (kendi ATG ile başlayarak) kurtarma cDNA yaklaşık olarak 25 nükleotid: ileri primer, şu öğeleri içerir emin olun. Bir GGGG streç bir AttB2 sitesi, bir bağlayıcı, ve yaklaşık 25 Nük: Ters primer, benzer bir bileşime sahip olduğundan emin olunKurtarma cDNA (ters tamamlayıcı) arasında leotides.
- AttB-kuşatılmış cDNA elde etmek PCR ile kurtarma cDNA yükseltin.
- AttB-kuşatılmış cDNA, 100 ng ve kanamisine dirençli gen ihtiva eden rekombinasyon uyumlu verici vektör, 150 ng, 10 uL BP reaksiyonu gerçekleştirmek.
- Isı-şoku-kompetan Escherichia coli MC1061 (E. coli) (adım 2.3 de tarif edilenlere benzer) bakteri BP karışımlarının 5 uL dönüşümü.
- Doğru kurtarma cDNA içeren vektörler ihtiva eden koloniler belirlenmesi (aşama tarif edilenlere benzer 2.4)
- Kurtarma cDNA ihtiva eden 100 ng vektör kullanılarak bir 10-uL LR reaksiyonu gerçekleştirmek; Kre-kesilmiş pRMCE-DV1 vektörü 11 (8195 LMBP) 150 ng; ve bir faj kodlanmış integraz ve excisionase ve bakteriyel entegrasyon konak faktörü içeren rekombinaz karışımı, 2 uL. 25 ° C'de 2 saat süreyle inkübe edin.
NOT: Bir LR Reaksiyon bir rekombinasyon reaksiyona olduğuiyon olan attL siteleri ve attR bölgelerini içeren bir hedef vektör ihtiva eden bir giriş klon LR klonaz enzim karışımı ile yeniden birleştirilir. Bu ilgi genine komşu attB siteleri içeren bir ifade klon sonuçlanır. - Isı-şoku-kompetan MC1061, E. Coli bakterisi içinde LR karışımlarının 5 uL dönüşümü.
- Bir oluklu 5 uL LR karışımlarını ekleme, ısı-şok-yeterli E. coli bakterilerinin 40 uL, 2 mL'lik vidalı kapaklı bir tüp etekli ve buz üzerinde 20 dakika inkübe edilir. 37 ° C'de 5 dakika süreyle inkübe edilir.
- 1 ml Luria etsuyu (LB) ortamı ilave edin ve 37 ° C'de 1 saat inkübe edilir. Plaka ampisilin üzerinde 50 uL (Amp; 100 ug / mL) agar ihtiva eden ve 37 ° C 'de bir gece boyunca büyür.
- Doğru hedefleme vektörü ile koloniler tanımlayın.
- rasgele bir P200 ucu kullanılarak 5 koloniler. 2 ihtiva eden bir cam test tüpü ucu transfer - 5 ml LB ortamı içinde 37 ° C'de gece boyunca büyür.
- eskiticari olarak temin edilebilen kitler kullanılarak bakteriyel kültürlerden plazmid DNA sistemi.
- RE sindirir ve sıralama kullanarak bunları doğrulayın. 10 pL reaksiyon RE 0.2 uL kullanılarak plazmid (20 U / ml) ve karşılık gelen 10x tampon 1 uL 2 ug - 0.5 kesin. bir% 1 agaroz jeli üzerinde en az 1, 37 ° C de saat ve ayrı inkübe edin. DNA fragmanlarının tahmin edilen model ile koloniler için seçin.
- Sanger sıklıklaştırıcı kullanarak Tlox F (ATC ATG TCT GGA TCC CCA TC) ve IRES R (GGG GCG GAA TTC ATC GAT AAG) primerleri (5 pmol / uL) ile teyit vektörleri (50 ng / uL) analiz eder.
Rescue Hedefleme 3. RMCE aracılı Mesc R26 Locus'un oluşturur
- FBS merkezli Mesc ortamda MEFS üzerinde en az iki kez RMCE uyumlu KO mESCs ve geçit onları kültürünü başlatın. jelatin hale 6 plaka üzerinde mESCs bölün.
- Ertesi gün, 1.5 ile yaklaşık% 50 birbirine karıştığında, hücreleri yenilemekFBS tabanlı Mesc ortamı mL kurtarma cDNA içeren vektör hedefleyen bir Cre kesilmiş pRMCE-DV1 ile mESCs transfekte.
- DNA karışımını yapın. Saf DMEM ortamı 250 uL FLPe-sentezleme plasmidi 25 1 hedefleme vektörünün ug ve 1 ug ekleyin.
- Bir lipofeksiyon karışımını yapın. Lipofeksiyon bazlı transfeksiyon reaktifi (örneğin, Lipofectamine 2000), saf DMEM ortamı 250 uL ve oda sıcaklığında 5 dakika boyunca (RT) inkübe 7 uL ekleyin.
NOT: Benzer RMCE hedefleyen verimlilik diğer lipofeksiyon- tabanlı reaktif (örneğin Lipofektamin LTX'e ve Effectene) kullanılarak elde edilmiştir. - lipofeksiyon karışımı ile, DNA karışımı karıştırın ve oda sıcaklığında 20 dakika inkübe edilir. yenilenir mESCs üzerine transfeksiyon karışımı pipetle. yavaşça karıştırınız ve bir gece bekletin.
- Transfeksiyondan bir gün sonra, bir birleşik DR4 MEF'lerin tabaka ve 10 ml FBS tabanlı m 10 cm'lik bir kültür tabağına 6-çukurlu plaka tüm mESCs bölünmüşESC ortamı.
- Transfeksiyondan iki gün sonra, ortam 0,2 mg / ml G418 (100 x) eklenerek doğru FLPe aracılı kaset değişimi ile Mesc klonları seçmek.
NOT: Tüm mESCs öldürür G418 düşük konsantrasyon tespit etmek G418 her parti için bir öldürme eğrisini olun. - G418 içeren Mesc ortamı ile günlük mESCs yenileyin. Koloniler 7 sonra görünmelidir - 10 gün, yani almak ve adım 1.4 göre bunlar genişler.
- PCR 11 üzerinden doğru klonları teyit edin.
Embriyoit Oluşumu mESCs 4. Farklılaşma (EBS)
- FBS merkezli Mesc ortamda MEFS üzerinde en az iki kez R26 odaklı kurtarma yapılara ve geçit onları birlikte KO mESCs kültürünü başlatın. bir kez Jelatinize 6-yuvalı plakalar üzerinde Passage mESCs MEFS kurtulmak için.
- PBS ile yıkayın ve neredeyse birbirine karışan Mesc kültürleri trypsinize. Plaka, yapışmayan, bakteriyel dereceli hayvan üzerine farklı seyreltilerde mESCs (1/20 ve 1/40) ayrışmışfarklılaştırma ortamının ri-yemekler.
- EBS 30 gün boyunca bu yemekler oluşmaya izin verin. 50 mL'lik bir tüpe EB süspansiyonu transfer, EBS yerçekimiyle yerleşmek izin Süpernatantı taze ortam ekleyin ve bir bakteriyel dereceli geri EB süspansiyonu transfer: aşağıdaki prosedür kullanılarak 3 gün - her 2 orta Yenile tabak.
- Daha önce 12 tarif edilmiştir protokoller kullanılarak immünofloresans ve transmisyon elektron mikroskobi ile hedeflenen mESCs ve EBS analiz edin.
Sonuçlar
RMCE uyumlu KO Mesc hatları izole etmek için işlem, Şekil 2'de tasvir edilmiştir. İki ardışık breedings RMCE uyumlu KO blastokistlerle almaları gerekmektedir. İlk olarak, heterozigot KO fareleri RMCE uyumlu, heterozigot KO fareleri elde etmek RMCE uyumlu fare ile kesilmişlerdir. Bu fareler, daha sonra RMCE uyumlu 3,5-DPC, homozigot KO blastosistlerin elde etmek üzere başka heterozigot KO fareleri zamanlı eşleştirmesi için kullanılır. Mendel kalıt...
Tartışmalar
Bizim Mesc izolasyon yöntemi kullanıcı dostu ve böyle blastosistindeki mikrocerrahi gibi gelişmiş beceri ve gereçlerine gerektirmez. Böylece, bu teknoloji bilim dünyasında büyük bir oranda erişilebilir. Temel hücre kültürü tecrübesi olan herkes ICM çıkıntılar yaymak ve mESCs hatları kurabilir. Ancak, blastosistindeki yıkama ve taşıma biraz pratik gerektirir. Ağız pipet blastosistler aktarmak için kullanılan ve bir mikropipet, bir mikro tutucu, boru ve bir aspiratör ağız parçasının
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Biz onların mükemmel teknik destek için Jinke D'Hont, Frederique Van Rockeghem Natalie farla Kelly Lemeire ve Riet De Rycke teşekkür ederim. Biz de onların uzman yardımı için Enflamasyon Araştırma Merkezi Biyogörüntüleme Çekirdek Tesis Eef Parthoens, Evelien Van Hamme, ve Amanda Goncalves teşekkür ederim. Biz değerli tartışmalar için araştırma grubunun üyelerini kabul eder. Bu çalışma Belçikalı Bilim Politikası tarafından desteklenmiştir (Belspo Üniversitelerarası Atraksiyon Polonyalılar - Ödül IAP VII-07 DevRepair; https://devrepair.be) Kraliçe Elisabeth Tıp Vakfı, Belçika (GSKE 2008-2010 tarafından; http: // www )-gske.be .fmre ve Belçika Ghent Üniversitesi'nden (http://www.ugent.be/en/ghentuniv) ait Uyumlu Araştırma Eylemler (GOA 01G01908) tarafından. SG Flanders Araştırma Fonu (FWO-V) doktora sonrası araştırmacı olduğunu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ROSALUC Mice | made in house | frozen sperm available upon request | |
| R26-iPSC mice | made in house | frozen sperm available upon request | |
| Vessel probe | Fine Science Tools | 10160-13 | to check for copulation plugs |
| M2 medium | Sigma-Aldrich | M7167 | make aliquots and store at -20 °C |
| Fine forceps (Dumont #5 Standard tip Student forceps) | Fine Science Tools | 11251-10 | spray with 70% EtOH before use (do not autoclave) |
| 23 G needles | Fine-ject | 8697 | |
| 1-mL syringes | Soft-ject | 6680 | |
| 60-mm bacterial grade plates (for flushing) | Gosselin | BB60-01 | |
| Mouth pipette | made in house | see discussion | |
| Mouse embryonic fibroblasts (MEFs, TgN (DR4)1 Jae strain) | ATTC | SCRC-1045 | |
| TgN (DR4)1 Jae mice | The Jackson Laboratory | 3208 | |
| Mitomycin C | Sigma-Aldrich | M0503 | |
| Phosphate buffered saline (PBS) without calcium or magnesium | Gibco | 14190-094 | |
| Tg(DR4)1Jae/J mice | JAX | 3208 | mice that contain four drug-selectable genes and DR4 MEFS confers resistance to neomycin, puromycin, hygromycin and 6-thioguanine |
| 0.1% Gelatin | Sigma-Aldrich | G1393 | Dissolve 0.5 g in 500 mL distilled water, autoclave and store at 4 °C. |
| Trypsin (0.25%) | Gibco | 25200-056 | |
| 2 μM pluripotin | Cayman Chemical | 10009557 | |
| pRMCE-DV1 | BCCM/LMBP collection | LMBP 08870 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| cre-excised pRMCE-DV1 | BCCM/LMBP collection | LMBP 08195 | public available from the BCCM/LMBP collection (http://bccm.belspo.be) |
| pCAG-FlpE-IRES-Puro-pA | Addgene | 20733 | |
| heat-shock competent DH5α bacteria | made in house | ||
| Gateway pDONR221 vector | Thermo Fisher | 12536-017 | contains kanamycin-resistance gene |
| BP clonase II mix | Thermo Fisher | 11789-020 | |
| LR clonase II mix | Thermo Fisher | 11791-020 | |
| Luria Broth (LB) | |||
| Ampicillin | |||
| Applied Biosystems 3730XL DNA Analyzer | Thermo Fisher | 3730XL | |
| G418 | Thermo Fisher | 11811-023 | |
| Lipofectamine 2000 transfection reagent | Thermo Fisher | 11668027 | |
| Lipofectamine LTX transfection reagent | Thermo Fisher | 15338100 | |
| Effectene transfection reagent | Qiagen | 301425 | |
| GATEWAY pENTR 1A vector | Thermo Fisher | A10462 | recombination-compatible vector |
| mouse monoclonal anti-p120ctn antibody | BD Transduction Laboratories | 610134 | |
| mouse monoclonal anti-Ecadherin antibody | BD Transduction Laboratories | 610181 | |
| General equipment | |||
| Sterile dissection tools | fine scissors and forceps for dissecting the uterus | ||
| Sterile pipettes: 5 mL, 10 mL and 25 mL | |||
| 15-mL and 50-mL conical centrifuge tubes | |||
| 96-well culture plates V-shaped bottom and flat bottom) | |||
| Culture dishes: 24 wells, 12 wells and 6 wells | |||
| Multichannel pipettes (to pipette 30, 50, 100 and 200 μL) | |||
| Sterile multichannel reservoirs | |||
| Access to a laminar air flow | |||
| Access to an incubator at 37 °C with 5% CO2 | |||
| Access to an inverted microscope | |||
| Access to a bench-top centrifuge | |||
| Access to a stereo microscope with transmitted-light | |||
| Culture media | |||
| MEF Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 41965-062 | |
| 10% fetal bovine serum (FBS) | Sigma-Aldrich | F-7524 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| Sodium pyruvate (0.4 mM) | Gibco | 11360-039 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| SR-based mESC medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| DMEM/F12 | Gibco | 31330-038 | mixed in a 1:1 ratio |
| 15% knock-out serum replacement (SR) | Gibco | 10828–028 | |
| L-glutamine (2 mM) | Gibco | 25030-024 | |
| 0.1 mM non-essential amino acids | Gibco | 11140-050 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| β-mercaptoethanol (0.1 mM) | Sigma-Aldrich | M 3148 | |
| 2,000 U/mL recombinant mouse LIF | (IRC/VIB Protein Service facility) | ||
| FBS-based mESC medium (similar to SR-based mESC medium) | stored at 4°C; warm 30 min at 37°C before use | ||
| Knockout DMEM | Gibco | 10829-018 | |
| 15% FBS | Hyclone | SH30070.03E | |
| Differention Medium | stored at 4 °C; warm 30 min at 37 °C before use | ||
| Iscove's Modified Dulbecco's Medium (IMDM) | Gibco | 21980-032 | |
| 15% FBS | Hyclone | SH30070.03E | |
| 5% CD Hybridoma Medium(1x) liquid | Gibco | 11279-023 | |
| 2 mM L-glutamine | Gibco | 25030-024 | |
| 0.4 mM 1-thioglycerol | Sigma-Aldrich | M-6145 | |
| 50 μg/mL ascorbic acid | Sigma-Aldrich | A-4544 | |
| penicillin (100 U/mL) | Gibco | 15140-122 | |
| streptomycin (100 µg/mL) | Gibco | 15140-122 | |
| 2i | |||
| 1 μM Erk inhibitor PD0325901 | Axon Medchem | Axon 1408 | |
| 3 μM Gsk3 inhibitor CHIR99021 | Axon Medchem | Axon 1386 |
Referanslar
- Gul, I. S., Hulpiau, P., Saeys, Y., van Roy, F. Metazoan evolution of the armadillo repeat superfamily. Cell Mol Life Sci. , (2016).
- Valenta, T., Hausmann, G., Basler, K. The many faces and functions of beta-catenin. EMBO J. 31, 2714-2736 (2012).
- Pieters, T., van Hengel, J., van Roy, F. Functions of p120ctn in development and disease. Front Biosci. 17, 760-783 (2012).
- Keirsebilck, A., et al. Molecular cloning of the human p120ctn catenin gene (CTNND1): Expression of multiple alternatively spliced isoforms. Genomics. 50, 129-146 (1998).
- Capecchi, M. R. Gene targeting in mice: functional analysis of the mammalian genome for the twenty-first century. Nat Rev Genet. 6, 507-512 (2005).
- Wang, H., et al. One-step generation of mice carrying mutations in multiple genes by CRISPR/Cas-mediated genome engineering. Cell. 153, 910-918 (2013).
- Yang, H., et al. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 154, 1370-1379 (2013).
- Fu, Y., et al. High-frequency off-target mutagenesis induced by CRISPR-Cas nucleases in human cells. Nat Biotechnol. 31, 822-826 (2013).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6, 7-28 (2004).
- Sandhu, U., et al. Strict control of transgene expression in a mouse model for sensitive biological applications based on RMCE compatible ES cells. Nucleic Acids Res. 39, 1 (2010).
- Haenebalcke, L., et al. Efficient ROSA26-based conditional and/or inducible transgenesis using RMCE-compatible F1 hybrid mouse embryonic stem cells. Stem Cell Rev. 9, 774-785 (2013).
- Pieters, T., et al. p120 Catenin-Mediated Stabilization of E-Cadherin Is Essential for Primitive Endoderm Specification. PLoS Genet. 12, e1006243 (2016).
- Evans, M. J., Kaufman, M. H. Establishment in culture of pluripotential cells from mouse embryos. Nature. 292, 154-156 (1981).
- Martin, G. R. Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A. 78, 7634-7638 (1981).
- Cheng, J., Dutra, A., Takesono, A., Garrett-Beal, L., Schwartzberg, P. L. Improved generation of C57BL/6J mouse embryonic stem cells in a defined serum-free media. Genesis. 39, 100-104 (2004).
- Bryja, V., et al. An efficient method for the derivation of mouse embryonic stem cells. Stem Cells. 24, 844-849 (2006).
- Ying, Q. L., et al. The ground state of embryonic stem cell self-renewal. Nature. 453, 519-523 (2008).
- Chen, S., et al. Self-renewal of embryonic stem cells by a small molecule. Proc Natl Acad Sci U S A. 103, 17266-17271 (2006).
- Pieters, T., et al. Efficient and User-Friendly Pluripotin-based Derivation of Mouse Embryonic Stem Cells. Stem Cell Rev. 8, (2012).
- Yang, W., et al. Pluripotin combined with leukemia inhibitory factor greatly promotes the derivation of embryonic stem cell lines from refractory strains. Stem Cells. 27, 383-389 (2009).
- Haenebalcke, L., et al. The ROSA26-iPSC Mouse: A Conditional, Inducible, and Exchangeable Resource for Studying Cellular (De)Differentiation. Cell Rep. 3, (2013).
- Tucker, K. L., Wang, Y., Dausman, J., Jaenisch, R. A transgenic mouse strain expressing four drug-selectable marker genes. Nucleic Acids Res. 25, 3745-3746 (1997).
- Nyabi, O., et al. Efficient mouse transgenesis using Gateway-compatible ROSA26 locus targeting vectors and F1 hybrid ES cells. Nucleic Acids Res. 37, 55 (2009).
- Katzen, F. Gateway((R)) recombinational cloning: a biological operating system. Expert Opin Drug Discov. 2, 571-589 (2007).
- Schaft, J., Ashery-Padan, R., vander Hoeven, F., Gruss, P., Stewart, A. F. Efficient FLP recombination in mouse ES cells and oocytes. Genesis. 31, 6-10 (2001).
- Spencer, H. L., et al. E-cadherin inhibits cell surface localization of the pro-migratory 5T4 oncofetal antigen in mouse embryonic stem cells. Mol Biol Cell. 18, 2838-2851 (2007).
- Stryjewska, A., et al. Zeb2 Regulates Cell Fate at the Exit from Epiblast State in Mouse Embryonic Stem Cells. Stem Cells. , (2016).
- Nagy, A., Gertsenstein, M., Vintersten, K., Behringer, R. . Manipulating the mouse embryo: A laboratory manual. , (2003).
- van den Berghe, V., et al. Directed migration of cortical interneurons depends on the cell-autonomous action of Sip1. Neuron. 77, 70-82 (2013).
- Li, J., et al. The EMT transcription factor Zeb2 controls adult murine hematopoietic differentiation by regulating cytokine signaling. Blood. , (2016).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır