需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
通过小鼠肺切除术和假体植入测量内部肺表面积的标准方法
摘要
内肺表面积(ISA)是评估肺部疾病和损伤诱导肺泡再生的肺形态和生理学的关键标准。我们在这里描述了一种标准化方法,可以最大限度地减少肺肺切除术和假体植入小鼠模型中ISA的测量偏差。
摘要
Pulmonary morphology, physiology, and respiratory functions change in both physiological and pathological conditions. Internal lung surface area (ISA), representing the gas-exchange capacity of the lung, is a critical criterion to assess respiratory function. However, observer bias can significantly influence measured values for lung morphological parameters. The protocol that we describe here minimizes variations during measurements of two morphological parameters used for ISA calculation: internal lung volume (ILV) and mean linear intercept (MLI). Using ISA as a morphometric and functional parameter to determine the outcome of alveolar regeneration in both pneumonectomy (PNX) and prosthesis implantation mouse models, we found that the increased ISA following PNX treatment was significantly blocked by implantation of a prosthesis into the thoracic cavity1. The ability to accurately quantify ISA is not only expected to improve the reliability and reproducibility of lung function studies in injured-induced alveolar regeneration models, but also to promote mechanistic discoveries of multiple pulmonary diseases.
引言
肺的基本功能是血管和大气之间的氧气和二氧化碳的交换。肺部疾病,如支气管肺发育不良(BPD),慢性阻塞性肺病(COPD)和急性呼吸道感染,导致降低的ISA 2。研究人员在研究肺病已经开发出多种定量方法来评估肺形态变化,包括美林,ILV,3的气体交换单元的数量,ISA,和肺组织顺应性2。 Weibel 等人的开创性研究4和Duguid 等人 5一起确定了ISA可以作为人肺肺气交换能力的直接指标,可作为确定肺气肿严重程度的标准。过去五年发表的一些研究已经使用肺形态学参数( 例如, ISA和MLI)对发展6期间和从损伤PNX 1,7恢复期间评估在小鼠的肺中的形态和功能的变化。 ISA使用等式1 8,9计算:
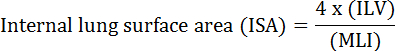
,其中ILV是内部肺容积,MLI是表示肺外周空间大小10的中间参数。
PNX,手术切除的一个或多个肺叶,已被广泛报道,以诱导在许多物种中肺泡再生,包括人类11,小鼠1,狗12,大鼠13,和兔14,15。一个螺柱PNX后14天的小鼠肺显示,既存在肺泡的扩张和肺泡从头形成有助于恢复其余肺组织中的ISA,ILV和肺泡数量1 。我们和其他人已经表明,在PNX( 即 ,假体植入)后,将诸如海绵,蜡或定制假体的材料插入空胸腔会损害肺泡再生。现在已牢固地确立机械力功能的发起肺泡再生1,16,17最重要的因素之一。这些研究强调了使用PNX处理和假体植入肺的ISA值作为定量评估肺泡再生的标准的有效性。
已知观察者偏倚显着影响测量值肺部形态学参数( 例如 ,MIL和ILV)。可以使用标准化协议来消除在确定ILV和MLI中的这种偏差,这是在ISA的计算中使用的两个参数。在这里,我们提供了高度详细的标准化方案来测量这些肺参数。重要的是,准确量化ISA的能力有望提高损伤诱导的肺泡再生模型中肺功能研究的可靠性和可重复性,并且有助于多种肺部疾病的机械发现。
研究方案
本议定书中使用的所有程序均按照北京国家生物科学研究所"实验动物护理和使用指南"中的建议进行。将8周龄的CD-1雄性小鼠饲养在特定的无病原体(SPF)设施中,直至进行实验。使用完全麻醉的小鼠进行手术( 即 ,没有任何趾夹紧反应)。手术后,将小鼠保持在温暖,潮湿的房间内,食物和淡水充足。使用过量腹膜内注射的麻醉剂处死小鼠。
小鼠PNX手术
- 通过腹膜内(IP)注射,用苯巴比妥钠(120mg / kg体重)和丁丙诺啡(0.1mg / kg体重)完全麻醉小鼠。当小鼠不再对脚趾捏住反应时,进行手术。
- 用化学物质除去老鼠左胸部的头发肛门治疗(〜3×3厘米2 )。
- 将每只鼠标固定在插管平台上,其腹侧朝向操作者( 图1A )。
- 拉出鼠标舌并用含有用于引导导管18 ( 图1A )的切口的小型动物喉镜照亮声带。
- 通过在呼吸过程中观察声带的运动来区分声带。轻轻地插入一个20 G静脉插管插管气管在前角19 。
- 将小鼠放置在右侧卧位,并将插管连接到机械呼吸机( 例如,压力控制;参见材料表 )。通过观察鼠标胸部的呼吸动作,检查插管插入气管( 图1B )。
- 设置吸气压力o将呼吸机调至12厘米H 2 O,并将呼吸频率设置为每分钟120次呼吸( 图1B )。
- 用betadine和70%乙醇去除外科手术区域的皮肤。
- 使2 -在第 5 次肋间空间,通过皮肤和肌肉与诺伊斯弹簧剪刀剪3厘米后外侧开胸切口(切削刃:14毫米;尖端直径:0.275毫米)( 图2B,C)。用于开胸手术的手术器械在使用前进行灭菌。
- 使在第 5肋间空间1.5厘米的切口,以暴露左肺( 图2D,E)。在手术中,使用高温烧灼器止血。
- 用钝头镊子从胸部抬起左肺叶三分之一( 图2F ),然后用棉签拉出整个左侧肺( 图2G )。
- 确定左肺叶肺动脉和支气管( 图2G )。
- 用丝线外科缝合线将支气管和门口的血管紧密连接,并从连接处切开4〜4mm的左肺叶( 图2H ,I )。
注意:小心不要切断左门槛上的缝合线,这可能导致气胸( 即胸腔腔内的空气或气体) 。 - 用1条缝合物关闭胸壁,然后依次缝合肌肉层和皮肤层,使用5 - 6个中断的缝合线。在每个缝合线之间留出3 - 4 mm的间隙( 图2M ,2N )。
注意:将手术缝合针远离心脏;无心的心脏穿刺会导致立即死亡。 - 用聚维酮碘消毒手术区域。
- AFTE在外科手术中,将鼠标放在38°C的热垫上,并将鼠标连接到呼吸机,直到自发呼吸运动开始( 图2O )。
假体植入
- 执行PNX程序的步骤1.1 - 1.13(即,直到鼠标的左肺叶被移除的时候)。
- 使用钝钳钳住硅胶假体的中心(客户制造,长度为12mm,厚度为3mm,宽度为7mm,椭圆形为0.2g)( 图2J )。插入硅胶假体前消毒。
- 用镊子用一只手握住肋骨露出胸腔,然后用另一只手将假体插入左侧空胸腔。
注意:在假体的正面和胸部表面之间的插入角度约为45度( 图2K ,L)。插入假体时要温柔。过度的力会导致胸膜破裂。 - 用钝钳调整假体的方向,以确保假体占据左空胸腔。
- 执行小鼠PNX程序的步骤1.14 - 1.16。
3.测量ILV
- 准备一个定制设备("充气管"),该设备由从一次性血清移液管(10 mL)中取出的柱塞,带有针头适配器的40 cm长柔性管,流量控制阀和18 G针组成。组装后,将吸管固定在带有磁带的电路板上( 图3A )。移液器顶部和实验台之间的距离必须至少为30厘米。
- 通过在55℃水浴中将20g PFA溶解在500mL预加热的1x磷酸盐缓冲盐水(PBS)中来准备新鲜的4%多聚甲醛(PFA)固定溶液,手动摇动每10分钟一次,直到溶液澄清。冷却至室温后,用0.45μm过滤器过滤溶液。
小心:处理PFA时,穿戴适当的个人防护装备(PPE)。 - 用过量注射麻醉剂(0.8%苯巴比妥钠,1000U / mL肝素)服用牺牲小鼠。
- 将每只小鼠固定在聚苯乙烯夹层板上,并用70%酒精喷雾。
- 小心打开小鼠胸部,用剪刀切开胸骨,彻底暴露肺叶。
- 使用剪刀去除多余的组织以暴露气管。确保将气管与食道分开。
- 切开腹主动脉,并将25号针插入心脏右心室;在插入前将针连接到20 mL注射器。慢慢地将1x PBS推入心脏去除血细胞,直到肺变白。通常需要5-10毫升的PBS来清除肺血管。
- 填充e定制的膨胀管,4%新鲜PFA,并从充气管中除去所有的气泡。
- 将充气管的18号针插入气管,并用气管夹夹住气管,以避免流体泄漏。
- 在25厘米的恒定跨肺压/ H 2 O 2,20膨胀用4%PFA肺部。在室温下孵育肺2小时以达到充分扩张的肺。这种"预先修复"步骤对于保持肺形态至关重要。
- 通过监测通胀管,记录初始4%PFA量的值,并记录最终量。内部肺容积等于最初的4%PFA体积减去最终4%的PFA体积。
- 用气管和剪刀,轻轻地从周围的结缔组织中清除肺部(保持完整的肺)。非常温柔,以免损伤肺部。
- INCU使用4%PFA填充的50mL锥形管中的肺将其在4℃下轻轻晃动振荡器(50rpm)。继续进行组织加工和染色(见第4部分)。
4.组织包埋,切片和苏木精与曙红(H&E)染色
- 固定后,使用Noyes弹簧剪刀剪除心脏和肺部过多的结缔组织。通过切断将肺叶连接到气管的支气管轻轻分开各肺叶。
- 在50 ml 1x PBS(30 min /次)中,在定位摇床上(50 rpm)将肺叶大面积清洗3-4次。
- 最终洗涤后,通过在4℃将它们浸入30%蔗糖溶液(1×PBS)中冷冻保护肺叶,直到组织沉入50mL锥形管的底部(约12小时)。
- 在对组织进行嵌入和冷冻切片之前,用镊子从管中取出肺叶样品,保留一下用于组织学分析的裂片,从辅助叶片样品的表面吸取剩余的蔗糖溶液,然后将样品彻底浸入含有最佳切割温度(OCT)化合物的培养皿中约30分钟。
- 使用低温枪将液氮中的OCT嵌入式附件叶片样品冷冻。将凸起的最大表面积与模具的底部平行。
- 在冷冻切片过程中,为每个样品准备三个10μm厚的切片,用于组织学分析。弃去前1毫米的组织,收集一个10微米厚的部分,丢弃0.5毫米的组织,收集另一部分,丢弃0.5毫米的组织,并收集第三(最后)部分。
- 在进行H&E染色之前,将切片空气干燥1 h。
- 进行H&E染色
- 洗涤3-4份自来水的切片,然后在新鲜的苏木精中染色切片2分钟;冲洗自来水下的部分;将该部分浸入1%HCl-70%乙醇溶液中以除去多余的苏木精。
- 在新鲜曙红中染色3分钟;在95%乙醇中连续30秒洗涤两次,并用100%乙醇洗涤两次30s洗涤部分。清除二甲苯中的切片30秒,在新鲜的二甲苯中重复清除步骤一次;使用玻璃盖玻片安装带有安装介质的滑块。
5.定量MLI
- 使用亮场显微镜获取H&E染色的辅助叶片部分的数字图像(20倍放大)。
- 为了量化MLI,从3个部分的合适区域(无动脉和静脉,主要气道和肺泡管)中随机选择总共15个非重叠视图(1,000μmx 1,000μm)。
- 放置一个具有10个均匀分布的垂直线和10个均匀分布的水平线的网格使用标尺工具在所选择的视野上的gth(1,000μm);因此每条线间隔100μm( 图4B )。
- 将一个截距的值定义为两个相邻肺泡上皮之间的线性长度。测量每个1000 m长度线上所有截距的值。
- 对于每个网格,量化10个水平1,000μm长度线和10个垂直1,000μm长度线中的所有截距的值。
注意:MLI是从为每个辅助波瓣准备的3个部分中分析的总共15个网格的截距长度的平均值。
6.计算ISA
- 使用公式1计算ISA(见导言 )。有关ILV的测量,请参阅第3节,并参考第5节MLI的量化。
结果
我们在这里进行了PNX治疗组和假体植入(假体植入)组的实验。这些分组与我们研究组14之前发表的研究中使用的分组相同。
小鼠PNX和假体植入程序如图2所示。 8周龄的CD-1雄性小鼠用于手术和量化。在PNX治疗组和假体植入组中,左肺叶切除( 图2A -
讨论
在本协议中,我们提供关于肺小鼠左肺PNX和假体植入后肺参数测量的详细描述。 ISA现在被认为是评估许多肺部疾病和损伤引起的肺泡再生中呼吸功能的关键指标。然而,虽然肺部研究界对ISA的实用性有一致意见,但迄今为止,几乎没有考虑用于计算ISA的两个参数ILV和MLI的测量标准化。显然,与任何测量一样,重要的是尝试获得无偏见的数据。本研究工作的核心目标是建立一个标准化的方案供小鼠...
披露声明
作者没有什么可以披露的。
致谢
作者要向北京国家生物科学研究所致谢。这项工作得到了北京市自然科学基金(Z17110200040000)的支持。
材料
| Name | Company | Catalog Number | Comments |
| Low cost cautery kit | Fine Science Tools | 18010-00 | |
| Noyes scissors | Fine Science Tools | 15012-12 | |
| Standard pattern forceps | Fine Science Tools | 11000-12 | |
| Castroviejo Micro Needle Holders | Fine Science Tools | 12060-01 | |
| Vessel clips | Fine Science Tools | 18374-44 | |
| I. V. Cannula-20 gauge | Jinhuan Medical Product Co., LTD. | 29P0601 | |
| Surgical suture | Jinhuan Medical Product Co., LTD. | F602 | |
| Mouse intubation platform | Penn-Century, Inc | Model MIP | |
| Small Animal Laryngoscope | Penn-Century, Inc | Model LS-2-M | |
| TOPO Small Animal Ventilator | Kent Scientific | RSP1006-05L | |
| Thermal pad | Stuart equipment | SBH130D | |
| Pentobarbital sodium salt | Sigma | P3761 | |
| Heparin sodium salt | Sigma | H3393 | |
| Hematoxylin Solution | Sigma | GHS132 | |
| Eosin Y solution, alcoholic | Sigma | HT110116 | |
| 10 mL Pipette | Thermo Scientific | 170356 | |
| Paraformaldehyde | Sigma | P6148 | |
| O.C.T Compound | Tissue-Tek | 4583 | |
| cryosection machine | Leica | CM1950 | |
| Disposable Base Molds | Fisher HealthCare | 22-363-553 | |
| 18 gauge needle | Becton Dickinson | 305199 | |
| Povidone iodine | Fisher Scientific | 19-027132 | |
| 70% ethanol | Fisher Scientific | BP82011 | |
| Infusion sets for single use | Weigao | SFDA 2012 3661704 | |
| Phosphate buffered saline | Gibco | 10010023 | |
| Tapes | 3M Scotch | 8915 | |
| Cotton pad | Vinda | Dr.P | |
| Silicone prosthesis | Custom made | ||
| Brightfield microscope | Olympus | VS120 | |
| Ruler tool | Adobe Photoshop |
参考文献
- Liu, Z., et al. MAPK-Mediated YAP Activation Controls Mechanical-Tension-Induced Pulmonary Alveolar Regeneration. Cell Rep. 16 (7), 1810-1819 (2016).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Knudsen, L., Weibel, E. R., Gundersen, H. J. G., Weinstein, F. V., Ochs, M. Assessment of air space size characteristics by intercept (chord) measurement: an accurate and efficient stereological approach. J Appl Physiol. 108 (2), 412-421 (2010).
- Weibel, E. R. . Morphometry of the Human Lung. , (1963).
- Duguid, J. B., Young, A., Cauna, D., Lambert, M. W. The internal surface area of the lung in emphysema. J Pathol Bacteriol. 88, 405-421 (1964).
- Branchfield, K., et al. Pulmonary neuroendocrine cells function as airway sensors to control lung immune response. Science. 351 (6274), 707-710 (2016).
- Ding, B. -. S., et al. Endothelial-derived angiocrine signals induce and sustain regenerative lung alveolarization. Cell. 147 (3), 539-553 (2011).
- Dunnill, M. S. Quantitative methods in the study of pulmonary pathology. Thorax. 17 (4), 320-328 (1962).
- Weibel, E. R., Gomez, M. Architecture of the human lung. Use of quantitative methods establishes fundamental relations between size and number of lung structures. Science. 137 (3530), 577-585 (1962).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. Am Rev Respir Dis. 95 (5), 765-773 (1967).
- Butler, J. P., et al. Evidence for adult lung growth in humans. N Engl J Med. 367 (16), 244-247 (2012).
- Hsia, C. C. W., Herazo, L. F., Fryder-Doffey, F., Weibel, E. R. Compensatory lung growth occurs in adult dogs after right pneumonectomy. J Clin Invest. 94 (1), 405-412 (1994).
- Thurlbeck, S. W. M. Pneumonectomy in Rats at Various Ages. Am Rev Respir Dis. 120 (5), 1125-1136 (1979).
- Cagle, P. T., Langston, C., Thurlbeck, W. M. The Effect of Age on Postpneumonectomy Growth in Rabbits. Pediatr Pulmonol. 5 (2), 92-95 (1988).
- Langston, C., et al. Alveolar multiplication in the contralateral lung after unilateral pneumonectomy in the rabbit. Am Rev Respir Dis. 115 (1), 7-13 (1977).
- Cohn, R. Factors Affecting The Postnatal Growth of The Lung. Anatomical Record. 75 (2), 195-205 (1939).
- Hsia, C. C., Wu, E. Y., Wagner, E., Weibel, E. R. Preventing mediastinal shift after pneumonectomy impairs regenerative alveolar tissue growth. Am J Physiol Lung Cell Mol Physiol. 281 (5), L1279-L1287 (2001).
- Das, S., MacDonald, K., Chang, H. -. Y. S., Mitzner, W. A simple method of mouse lung intubation. J Vis Exp. (73), e50318 (2013).
- Liu, S., Cimprich, J., Varisco, B. M. Mouse pneumonectomy model of compensatory lung growth. J Vis Exp. (94), (2014).
- Silva, M. F. R., Zin, W. A., Saldiva, P. H. N. Airspace configuration at different transpulmonary pressures in normal and paraquat-induced lung injury in rats. Am J Respir Crit Care Med. 158 (4), 1230-1234 (1998).
- Yilmaz, C., et al. Noninvasive quantification of heterogeneous lung growth following extensive lung resection by high-resolution computed tomography. J Appl Physiol. 107 (5), 1569-1578 (2009).
- Voswinckel, R., et al. Characterisation of post-pneumonectomy lung growth in adult mice. Eur Respir J. 24 (4), 524-532 (2004).
- Ravikumar, P., et al. Regional Lung Growth and Repair Regional lung growth following pneumonectomy assessed by computed tomography. J Appl Physiol. 97, 1567-1574 (2004).
- Gibney, B. C., et al. Detection of murine post-pneumonectomy lung regeneration by 18FDG PET imaging. EJNMMI Res. 2 (1), (2012).
- Muñoz-Barrutia, A., Ceresa, M., Artaechevarria, X., Montuenga, L. M., Ortiz-De-Solorzano, C. Quantification of lung damage in an elastase-induced mouse model of emphysema. Int J Biomed Imaging. 2012, (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。