このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
眼底イメージングを使用して認知症を研究するには
要約
網膜は脳と顕著な類似性を共有し、従って非侵襲的血管と脳の神経構造を研究するためのユニークなウィンドウを表します。このプロトコルでは、網膜のイメージング技術を用いた痴呆を調査する手法について説明します。このメソッドは、潜在的認知症の診断とリスク アセスメントを援助できます。
要約
網膜と中枢神経系 (CNS) の延長である発生学的起源は、解剖学的特徴の面で脳と顕著な類似性を共有して、脳で認知症の病態生理を研究するユニークな「窓」を提供しています、生理学的プロパティ。 網膜の血管や神経の構造は簡単に可視化し非侵襲的網膜イメージング技術、眼底写真と光干渉断層計 (OCT) などを含む、半自動的を用いて定量化できるようになりました計算機援用解析プログラム。網膜の血管や神経の変化と認知症の関係を勉強して改善できる認知症への理解と、潜在的に、診断とリスク評価に役立ちます。 このプロトコルは、定量化し、潜在的認知と関連付けられる網膜血管と神経構造分析の手法を目指しています。このプロトコルはまた認知症被験者の網膜の変化の例を提供し、技術的な問題および眼底イメージングの現在の制限事項について説明します。
概要
平均寿命に伴い重要な社会に貢献すること、主要な医療問題となっている認知症と経済の健康負担グローバル1,2,3,4,5。今日では、アメリカ合衆国の人は、アルツハイマー病 (AD)、66 秒6、認知症の最も一般的なフォームを開発しています。それは 2050 年までには、1 億 1500 万人が広告7影響を受けるが推定されています。
網膜は脳とそのような解剖学的および生理学的な特性のための認知症を勉強するユニークな「窓」を提供していますいます。血管、網膜細動脈、細静脈、直径 100 ~ 300 μ m の測定点で終わり細動脈吻合、バリア機能と自動規制8,なしなどの脳小血管と似たような機能を共有します。9. 神経構造の観点から網膜神経節細胞 (Rgc) は中枢神経系 (CNS) 10 のニューロンの典型的なプロパティを共有します。Rgc は、外側膝状核、上丘は網膜から視神経とプロジェクト視覚信号のフォームとして目立つように脳と接続されます。視神経、中枢神経系、神経繊維の多くと同様、オリゴデンドロ サイトによって有髄髄膜層で鞘です。特に、視神経への侮辱が結果することができますその他の中枢神経系の軸索にみられるような応答のように逆行と軸索、瘢痕形成、髄鞘破壊、二次変性、神経栄養因子の異常なレベルの前向性変性因子と神経伝達物質11,12,13,14。いくつかの AD 患者における視覚的症状の出現は、網膜と脳15,16の堅牢な関係によって説明されるかもしれない。その結果、網膜は脳で認知症の病態を反映可能性があり、認知症を勉強する眼底イメージングを使用ことができます示唆されています。
網膜血管と神経の構造は、非侵襲的網膜イメージング技術を使用して今視覚化できます。例えば、眼底カメラで眼底写真を取り込めるし、網膜血管 (例えば容器の口径、蛇行とフラクタル次元) の特徴は、コンピューターによる解析を用いて定量化します。プログラム。さらに、網膜の神経構造 (神経節細胞内網状層 [GC IPL] と [視神経] 網膜神経線維層の厚み) などのパラメーターの光コヒーレンストモグラフィ (OCT) を使用して測定することができます、組み込みを用いて定量化解析アルゴリズム。
認知症を勉強する眼底イメージングの重要性の観点からこのプロトコルはイメージングと網膜血管と神経構造体内の網膜イメージング技術を使用して分析する方法を説明を目指しています。このプロトコルはまた認知症被験者の網膜の変化の例を提供し、技術的な問題および眼底イメージングの現在の制限事項について説明します。
プロトコル
ここで説明したすべてのメソッドは、香港で地元の臨床研究倫理委員会によって承認されている
。注: 眼底イメージングとその後の分析の手順を説明するために簡単にするため、材料の表 に記載されている装置を使用します。網膜血管パラメーターの測定は、シンガポール I 容器評価プログラム (シヴァ) 17 (バージョン 4.0、位シンガポール国立大学) を使用して示されています。しかし、それは根底にある原理は同様のまま、機器の異なるセットを採用できることに注意する必要があります
。1。 網膜イメージングのための科目を準備
- 拡張対象 ’ mydriatic エージェントを使用しての生徒。十分な瞳孔拡張を確立する、少なくとも 15 分待機します 。
2。眼底写真は、計算機援用解析プログラムを使用してから網膜血管パラメーターを測定
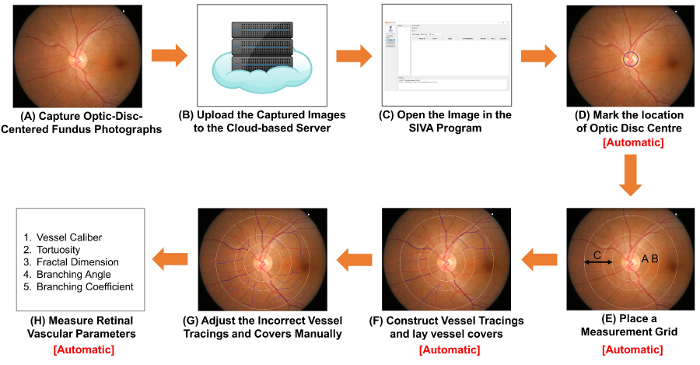
図 1。網膜血管のパラメーターを測定する手順を示す模式図。 眼底カメラを使用して (A) 取得光学ディスク中心の眼底写真。 図 1 a 図 2 a は、最適な品質と 2 つの眼底写真です。(B) は、眼底写真をクラウド ベースのサーバーにアップロードし、関連研究の詳細については、イメージ変換係数 (ICF) を含むを入力します。他のコンピューター支援型分析プログラムは、整理し、画像を保存するクラウド ベース メソッドを使用可能性があります。(C) オープン コンピューター援用解析プログラムの眼底写真。(D) マーク視神経乳頭部の場所と (E) プロンプトは自動的に視神経乳頭の縁を検出し、測定グリッドを配置するソフトウェア。(F) 構造容器トレース容器パスに基づいて、容器を置くは、血管の直径を推定するカバーしています。トレース不適切な容器と容器を手動でカバー (G) を調整します。容器口径、蛇行、フラクタル次元および分岐を含む網膜の血管パラメーターのスペクトルの (H) の測定。手順 (D) 手順 (F) と (H) の手順には、いくつかの計算機援用解析プログラムによって自動的に実行できます。 この図の拡大版を表示するのにはここをクリックしてください
- 眼底カメラを用いて眼底写真をキャプチャします。
コンピューター上のプログラムを
- 眼底カメラと起動イメージのキャプチャの
- ターン。ストラップの頭と額とあごに正しく被写体のあごを休ませます。被写体に正しく光のビームを配置するコントロール レバー ’ s 瞳孔 。
- は、両方がファインダーの両側に最小表示されるまで照明のポイントを合わせます。教科を指導する外固定ターゲットを移動 ’ s 目まで視神経乳頭がファインダーの中心、利益 (率 ROI) の領域が境界内に。焦点を網膜に焦点のノブを調整します 。
- 創外固定ターゲットを見てしっかりと主題を確保する件名を持つ ’ s の目は涙でいっぱいありません 。
- ( 図 1 a) 画像を撮影するシャッター ボタンを押します 。
- は、標準として 図 2 a を使用してキャプチャした眼底写真の品質をチェックします。イメージを破棄し、瞳孔が不十分な場合、イメージ取得プロセス (すなわち、ステップ 2.1.1 に 2.1.4) を繰り返します拡張 ( 図 2 b)、視神経乳頭が ( 図 2)、画像の中心ではないか、イメージが合って ( 図 2 D).
- な (すなわち、150 dpi 以上で約 3,000 ピクセル x 2,000 ピクセル) の解像度で TIFF 形式で画像を保存します
。 注: プロトコルがここで一時停止にすることができます 。
- 他の科目に眼底写真を取得するを繰り返します手順 2.1.1 に 2.1.6 。
- 画像の 10% サンプルをランダムに選択し、これらの画像 ( 図 3) で光ディスクの高さを測定します。画像変換係数 (ICF) 数式を使用して計算:
ICF = 1,800 μ m (サンプル画像の光ディスクのピクセルの高さを平均)/ 。
- 撮影した眼底写真をクラウド ベースのサーバーにアップロードし、イメージ変換係数 (ICF) ( 図 1 b) を含む、関連する研究の詳細を入力します
。 注: プロトコルはここで一時停止することができます。他のコンピューター支援型分析プログラム可能性があります画像を整理し、ICF を記録する他のクラウド ベースの方法を使用します 。
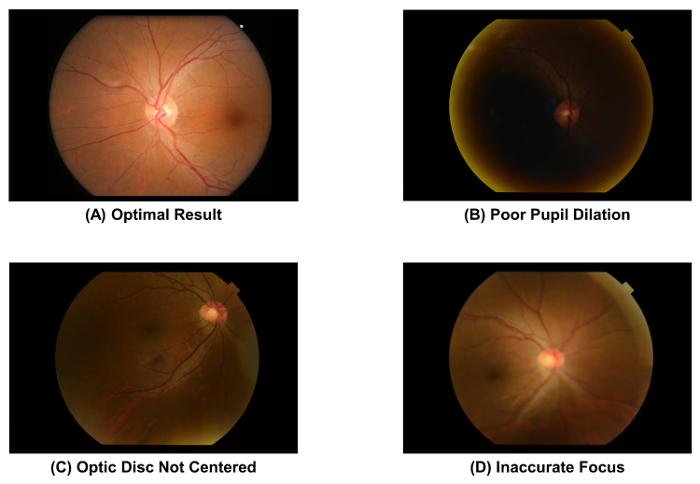
図 2: 最適と最適な品質の眼底写真。画質直接網膜血管パラメーターの後の測定に影響を与える、画像取得後すぐに眼底写真の画質をチェックする必要があります。これらの人工遺物の 1 つが発生した場合は、イメージを破棄しなければなりません。これらの画像は、50 ° 眼底カメラを使用してキャプチャされました。 この図の拡大版を表示するのにはここをクリックしてください
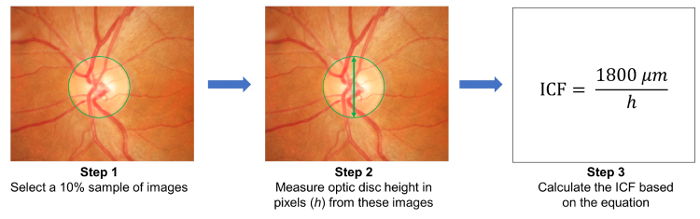
図 3: 画像変換係数 (ICF) の計算。ICF を計算するには、(ステップ 1) の研究から 10% サンプル画像がランダムに選択します。その後、画像からピクセル単位で光ディスクの高さ測定サンプリング (ステップ 2) です。計算式を使用して ICF: ICF = 1800 μ m/(サンプル画像の光ディスクのピクセルの高さを平均)、通常視神経乳頭 (ステップ 3) の高さの約 1800 μ m であります。倍率効果と画像の解像度が異なるカメラから、使用カメラごとに正確な ICF を計算する必要は。 この図の拡大版を表示するのにはここをクリックしてください
- 計算機援用解析プログラムで眼底写真を開きます。容器のトレースを構築し、網膜血管の容器カバーを置く
。 注: このセクションでシヴァ プログラムは手順を説明するために使用されます。しかし、シヴァのプログラムは他の利用できる計算機援用解析プログラムによって置き換えることができます。2.2.2 に 2.2.3 の手順を自動的に実行するさらに、いくつかのコンピューター支援型分析による眼底写真は、プログラムを開く (つまり ステップ 2.2.1)。- 計算機援用解析プログラム ( 図 1) で眼底写真を開く 。
- は、視神経乳頭の中心部 ( 図 1) の位置をマークします。
- をクリックして、“ OD センター ” left 関数パネルのボタン; マウス カーソルは緑の丸で置き換えられます 。
- 視神経乳頭 (OD) の中央に緑色の円を移動し、円を修正する] をクリックします 。
- プロンプト ソフトウェアを自動的に測定グリッドを配置し、容器のトレースと la を構築y 容器カバー ( 図 1E と 1F).
注: 容器カバー、血管の内部ルーメンのおおよその幅を推定する計測ラインです。- をクリックして、“ を見つける OD ” OD 縁を検出し、OD のセンターの位置に基づいて測定グリッドとして 4 つの同心円を配置するソフトウェアを要求するボタン 。
- をクリックして、“ プロセス ” ベッセル自動トレース処理を開始するボタンです 。
- 調整不適切な容器トレース手動で。12 から検査を始める o ’ クロックのすべての容器のトレースの確認に時計回りに位置します。
- 視神経乳頭が正確に検出され、測定グリッドが正しく挿入されていることを確認します。最も内側の円に正確に視神経乳頭縁 ( 図 4 a) アウトラインいない場合手動で手順 2.2.3 に 2.2.2 測定グリッドを調整します 。
- クリックして不適切な容器の種類 (細動脈と細静脈) が付いた容器 tracing(s) を選択し、クリック、します、“ 容器 (T) 型 ” 船舶の種類を変更します
。 注: 細動脈が赤で表示されているし、静脈は青で表示されています。細動脈は静脈の生理学的な相違点に基づくと区別できます。たとえば、静脈は、一般的に色でより暗く、細動脈よりも広い。容器タイプは通常、同じ血管が互いに交差できません 。
- 拡張の不完全な船のトレース手順 2.3.3.1 に 2.3.3.2 ( 図 4 b)。
不完全な船トレースの遠位端をクリックする
- カーソルを使用します。容器トレースを拡張する容器のパスに沿ったポイントを左クリックします 。
- は、容器の遠位端に達したときにトレース処理を停止します。外側の白い円でトレースを停止する測定グリッド外容器の遠位部に当たる場合 ( 図 4 b を参照してください).
- 容器パスはクロス オーバー サイト ( 図 4) で正しくトレースできない場合容器トレースを調整します。
- をクリックして、“ 選択 ” ボタンし、容器トレースの不正確なポイントでクリックします。クリックして、“ Brea(k) ワンセグ ”] ボタンをクリックすると、選択した時点で容器トレースを切断します。切断されたセグメントを選択しをクリックして、“ (Del) ワンセグ ”] ボタンをクリックすると、それを削除
- 容器の新しいトレース 2.3.3.1、2.3.3.2 の手順を使用してを再構築します 。
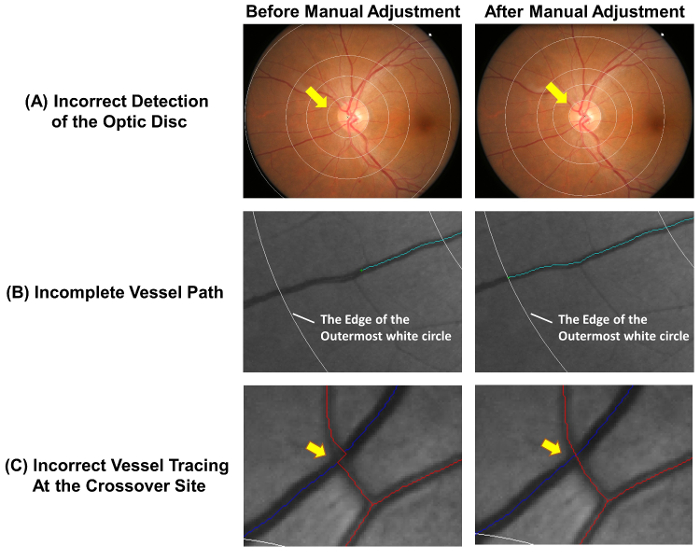
図 4: 一般的なエラーの自動トレース。ベッセル自動トレースが完全に正確ではないと、測定の精度を確保するために必要な手動での調整。この図自動トレースの一般的なエラーと手動調整後最適な結果を示します。視神経乳頭センター (A) が誤ってマーク以降の測定値に影響を与える可能性があります測定グリッドの偏差に、このリード。理想的には、測定グリッドの最も内側の円は、視神経乳頭縁を示す必要があります。(B) 容器の不完全なトレース フラクタル次元、蛇行、等 容器の端まで船のパスをトレースするかの誤った計測結果可能性があります。容器の遠位部測定グリッド外場合は、外側の白い円でトレースを停止できます。(C) 容器クロス オーバー サイトでトレース エラーの高い傾向の対象となり、このように特別な注意を必要とします。 この図の拡大版を表示するのにはここをクリックしてください
- 容器カバーを容器のすべてのセグメントに置き、不適切なカバーを手動で非アクティブ化します。
- をクリックして、“ カバーを見つける ” 容器のすべてのセグメントに自動的に容器カバーをレイアウトします 。
- すべての容器カバーが正しく配置されかどうかチェックしてください。左クリックしてドラッグ容器を非アクティブ化するカーソルをカバー、カバーがない場合 ( 図 5 a) 血管壁に垂直なを解雇され、船のパスが別の容器 ( 図 5 b) によって隠されるか、カバーを過大評価や血管内腔 ( 図 5) の幅を過小評価します 。
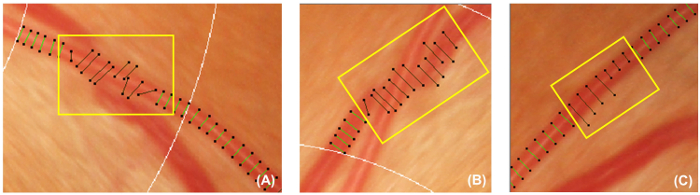
図 5: 不適切な容器をカバーします。この図では、非アクティブ化およびそれに続く測定から除外する必要があります不適切な容器カバーの例を示しています。容器カバーは、容器 (A) に垂直でない場合、非アクティブ化する必要があります。さらに、トレースされている容器が別の容器 (B) の下で隠されている場合、容器カバーを無効も必要があります。 または容器カバー容器 (C) のおおよその幅を表すことはできません。 この図の拡大版を表示するのにはここをクリックしてください
- の痕跡は容器と容器カバーで網膜血管パラメーターを測定
注: ステップ 2.5 は、コンピューターによる解析プログラムによって自動的に実行されます。 B は、ゾーンと C ゾーン 18 ( 図 6 a)、として視神経乳頭縁からエリア 0.5 2.0 ディスク直径として視神経乳頭縁から- ラベル面積 0.5 〜 1.0 ディスク径によると、動脈硬化の危険のコミュニティ (ARIC) の修正されたプロトコル研究 19.
- B ゾーンとゾーン、ARIC から変更は広く採用メソッドを使用して、C の両方から網膜血管径を測定研究 19 , 20 , 21 , 22, 23, 24, 25, 26 ( 図 6 b)。
- 6 最大細動脈と網膜血管の口径を推定する 6 最大細容器カバーの長さを測定します 。
- 要約眼底の網膜と網膜中心動脈と同等として水腫口径 (CRAE) と中央網膜静脈と同等 (CRVE) それぞれ 17、改訂された Knudtson を使用して – パー ハバード式 18, 19.
- と C ゾーンのあらゆる船舶を識別、幅 > 40 μ m 血管の痕跡に沿って合計二乗曲率積分から網膜細動脈と静脈が蛇行を計算し、合計の円弧の長さ、お辞儀、変曲点と値を正規化 27。 , 28 。
- 計算合計、細動脈、および水腫フラクタル次元ゾーン確立されたを使用して C から “ ボックス ・ カウンティング法 ” 29 , 30 , 31。
- 均等に大きさで分類された正方形のシリーズに画像を分割します 。
- 容器の痕跡のセクションを含むボックスの数をカウントします 。
- 異なるサイズの同じ大きさの正方形のシリーズを使用して、プロセスを繰り返します 。
- ; これはフラクタル次元船の痕跡は、ボックスのサイズの対数に対してを含むボックスの数の対数をプロットし、結果として得られる直線の傾きを計算します 。
- C ゾーンの最初の分岐で船舶を識別し、最初 2 つの娘の船 32 ( 図 6) の範囲を定めた角度 (θ) を計算します。分岐角度の平均値を取得する平均値を計算します 。
- 計算式を使用して C ゾーンから分岐係数:
(d 1 2 + d 2 2)/d 0 2、d 0 は平均トランク口径、d 1 と d 2 が平均分岐口径 ( 図 6).
- グレーディングの] ウィンドウを閉じます。クリックして “ を送信 ” [ポップアップ] ダイアログでクラウド ベースのサーバーに傾斜の画像をアップロードし、自動的に測定の網膜血管のパラメーターを記録 。
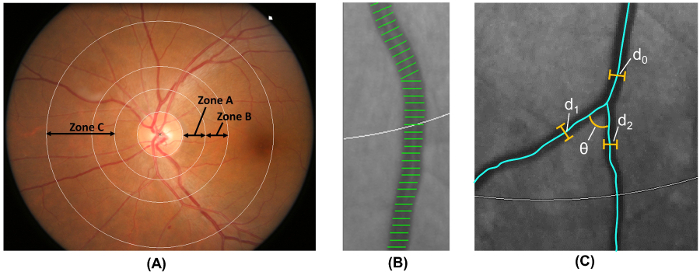
図 6: 網膜血管系の定量化。(A) ゾーン B (0.5 〜 1.0 として定義されているディスクのディスク余白から直径) コミュニティにおけるアテローム性動脈硬化のリスクによるとゾーン B の容器の口径を測定するために使用します。ゾーン C (0.5 2.0 として定義されているディスク ディスク余白から直径) ゾーン C の容器口径と網膜血管ネットワーク ・ パラメーター (蛇行、フラクタル、分岐など) のスペクトルを測定するために使用します。(B) 容器カバー、計測ラインの網膜血管の口径 (あるいは直径) を推定するために使用します。不適切な容器カバーは、測定から手動で除外する必要があります。(C) すべての血管内の最初の分岐を持つゾーン C プログラム自動的の最初の分岐の分岐角度 (θ) を測定します。さらに、分岐の係数も計算式を使用して: 分岐係数 = (d 1 2 + d 2 2)/d 0 2、d 0 はトランクの口径と d 1 と d2 分岐口径です。 この図の拡大版を表示するのにはここをクリックしてください
3 GC IPL と視神経の厚みを評価する
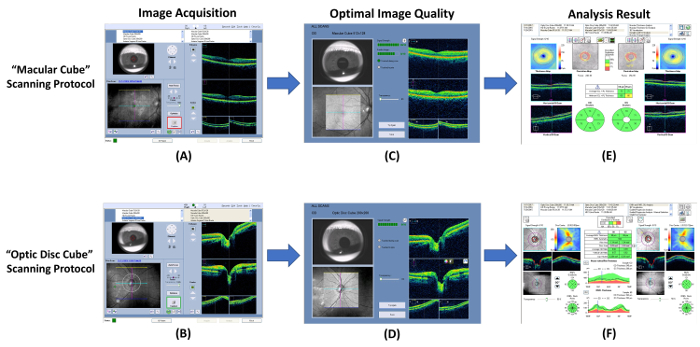
図 7: 視神経と GC IPL の厚さ測定の手順を示す図。光干渉断層計 (OCT) を使用して、神経節細胞内網状層 (GC IPL) と (視神経) 網膜神経線維層の厚みを測定できます。(A, B)組み込みを使用する GC IPL と視神経の厚みを測定 “ 黄斑キューブ ” と “ 光ディスク キューブ ” それぞれのプロトコルをスキャンします。(C, D)画像の取得の直後に画像の品質を確認します。画像を破棄し、信号の強さは、6 より小さいまたはモーションの遺物が検出された場合、スキャンを繰り返します。(E, F)その後、組み込み解析プログラムを自動的にスキャン結果を分析し、解釈するためのレポートを生成を促します。 この図の拡大版を表示するのにはここをクリックしてください
。- 光コヒーレンストモグラフィ (OCT) を使用して画像の取得を実行します。
- 10 月プログラムを開き、選択、“ 黄斑キューブ ” 新しい黄斑スキャン ( 図 7 a) を開始するためのプロトコルをスキャンします 。
- はアイリス ビューポートで、あごを調整することにより瞳孔を探します。瞳孔径が小さすぎる場合は、照明を下げる 。
- をクリックして、“ オート フォーカス ” ボタンし、“ 最適化 ”] ボタンをクリックすると、イメージ品質を向上させる 。
- すぐにスキャンを開始する前に、数回の点滅を主題に指示します 。
- をクリックして、“ キャプチャ ” ボタンを囲む境界線が緑になったときにスキャンを開始するボタン。動きの人工物を避けるために画像集録中に注視対象に集中する主題に指示します 。
- は、標準として 図 7 を使用してスキャンの品質を確認します。スキャン結果を破棄し、信号強度が小さくより 6 ( 図 8 a)、または (血管の不連続性によって示される) 運動の遺物が検出された場合、スキャンを繰り返します ( 図 8 b).
- スキャン結果を保存します 。
- 繰り返します手順別の目の 3.1.7 に 3.1.1 。
- と視神経の頭部スキャンを実行、“ 光ディスク キューブ ” 3.1.9 に 3.1.2 ( 図 7 b と 7 D) の手順次のプロトコルをスキャンします 。

図 8: 光コヒーレンストモグラフィのサブ最適な結果。光コヒーレンストモグラフィ (OCT) の共通のサブ最適な結果は、(A) 貧しい信号強度 (強度値 < 6)、および (B) 運動の工芸品。スキャン品質は、画像取得後すぐに見直されるべきし、スキャンをする必要がありますこれらの人工遺物が検出されたかどうかは繰り返されます。 この図の拡大版を表示するのにはここをクリックしてください
- 黄斑の GC IPL 厚さの解析出力を生成します。
- を選択、“ 黄斑キューブ ” 解析インタ フェースの両方の目のレコードをスキャンします 。
- をクリックして、“ 神経節細胞 OU 解析 ” スキャン ( 図 7 e) の GC IPL の厚さを評価する自動解析アルゴリズムを開始する
。 注: ステップ 3.2.2 は解析アルゴリズムによって自動的に完了します。- は、14.13 mm 2 黄斑部を中心とした楕円環状 0.6 mm と 2.4 mm、水平方向の内側と外側の半径をそれぞれ持つと 0.5 mm、2.0 mm、垂直方向の内側と外側の半径をそれぞれ生成します
。 注:サイズと楕円形の輪の形の黄斑の解剖学に密接に準拠して、Rgc は通常目 33 , 34 の厚い地域に相当します。アニュラスの内側のリング内の領域は測定されていないこの分野で GC IPL は非常に薄い 。
- 、視神経の外側の境界と内側の網状層 GC IPL ( 図 9) を検索する (IPL) の外側の境界をセグメントします 。
- 測定平均値、最小値、および六つのセクター (superotemporal、スーペリアー、superonasal、inferonasal、下、下側頭葉) 中心窩 cen 内黄斑 GC IPL の厚さドビック楕円環状 。
- デバイスに測定された GC IPL 厚さを比較 ’ s 標準年齢をマッチさせた内部データベースし、偏差マップと重要度マップ生成
- 分析プリント アウトの測定結果を報告します 。
- は、14.13 mm 2 黄斑部を中心とした楕円環状 0.6 mm と 2.4 mm、水平方向の内側と外側の半径をそれぞれ持つと 0.5 mm、2.0 mm、垂直方向の内側と外側の半径をそれぞれ生成します
- 解析印刷を .pdf 形式で保存します 。
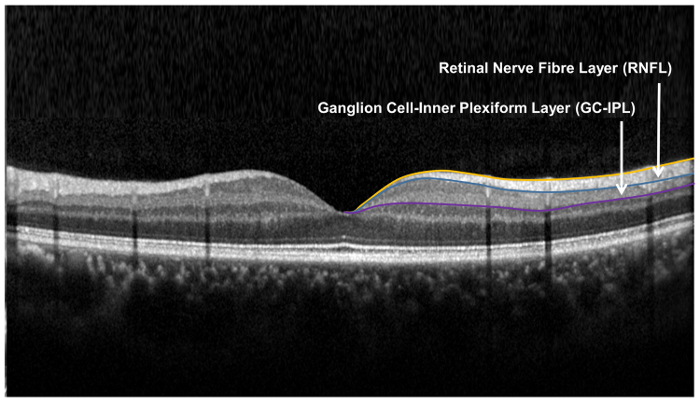
図 9: 網膜層用、網膜の神経細胞の構造の評価.網膜の神経繊維層 (視神経) は、神経節細胞内網状層、神経節細胞解析 (GCA) アルゴリズムを使用して測定中に視神経頭 (視神経) アルゴリズムを使用して測定されます。視神経のアルゴリズムは、視神経の厚さを測定する視神経の内側と外側の境界を分割します。GCA アルゴリズムは、網膜神経線維層 (視神経) と内側の網状層 (IPL) の神経節細胞層 (GCL) の合計厚さを生成するための外側の境界を検出し、IPL。GCL と IPL の境界は解剖学的に明瞭な一緒に、GCL と IPL の厚さを測定します。しかし、GCL と IPL (すなわち GC IPL) の合計の厚さはまだ Rgc の健康の指標 これの拡大版を表示するのにはここをクリックしてください図.
- 視神経の厚み ( 図 7 階) の解析出力を生成します。
- を選択、“ 光ディスク キューブ ” 解析インタ フェースの両方の目のレコードをスキャンします 。
- をクリックして、“ 視神経・視神経 OU 分析 ” スキャンの視神経の厚みを評価する自動解析アルゴリズムを開始します
。 注:3.3.2.1 に 3.3.2.6 の手順は、分析アルゴリズムによって自動的に完了できます。- 各スキャン ポイントで視神経の厚さを測りますそして視神経厚マップを生成します 。
- 特定サイズおよび形光ディスクの範囲と一致しているスキャンの中心に近いダーク スポットを検出することにより視神経乳頭
- 視神経厚マップ上視神経周り直径 3.46 mm 測定グリッドを配置します 。
- メジャー、グローバル、4-象限 (一時的な優れた、鼻、下) を計算と測定グリッドの 12 時間制の時計脈絡視神経厚さ 。
- デバイスに測定の視神経の厚みを比較 ’ s 標準年齢をマッチさせた内部データベースし、偏差マップと重要度マップを生成します 。
- 分析プリント アウトの測定結果を報告します 。
- 解析印刷を .pdf 形式で保存します 。
結果
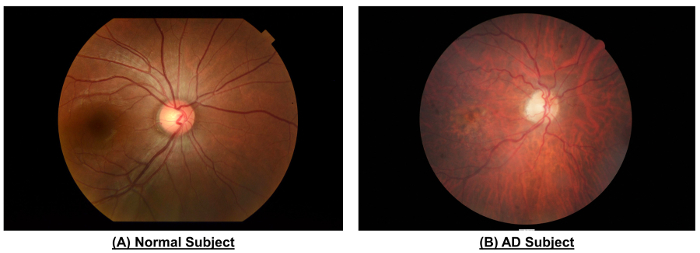
図 10:正常者と広告対象の網膜血管系の違いを示した例です。正常者と比較して、広告対象の眼底写真を示した狭い容器口径 (CRAE のゾーン B、μ m 116.4対156.4 μ m;ゾーン B、μ m 186.9対207.5 μ m; CRVECRAE ゾーン C μ m 138.5対165.8 μ m;ゾーン C, 232.2 μ m対
ディスカッション
このプロトコルでは、生体内で網膜の神経細胞および血管の変化の定量の手順について説明します。網膜は脳と同じような発生学的起源、解剖学的特徴と生理学的性質を共有しているこれらの眼底所見は血管および脳の神経の構造と同様の変更を反映可能性があります。
図 10 表 1に示すように、健常人と比較して減少した容器口...
開示事項
コンピューティングの学校、シンガポール国立大学のテクニカル サポートに感謝したいと思います。
謝辞
潜在的な金融関係に関する著者の Y. ウォンはこの記事で使用されるシンガポール I 容器評価 (シヴァ) プログラムの共同発明者です。
資料
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
参考文献
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved